En México, la producción de pollo ha mantenido una tendencia de crecimiento muy elevada, situación que ha sido influida principalmente por la creciente demanda de carnes blancas y en especial por sus precios, los cuales resultan altamente competitivos con respecto a otros cárnicos. Este elevado crecimiento de la producción, obedece a un fuerte nivel de tecnificación, similar al observado en países desarrollados, lo que se refleja en una alta eficiencia y en costos de producción bajos (1).
Durante los últimos 30 años, la selección avícola se centró en lograr aumentos en la velocidad de crecimiento de las líneas de carne; sin embargo, a consecuencia de esto se afectó negativamente el metabolismo del ave, su estructura muscular y la calidad de la carne (2). Además, se observó que las tasas elevadas de crecimiento pueden originar anormalidades morfológicas (2). Lo anterior, indica que las mejoras basadas en la selección genética tienen un límite que ya se está alcanzando, por ello los avicultores han optado por el uso de aditivos para mejorar la producción, tales como coccidiostatos, enzimas, saborizantes, antioxidantes, por mencionar algunos. Dentro de los antioxidantes se encuentra el ácido alfa lipoico (AAL), que es un ácido graso derivado del ácido octanóico que integra en su estructura dos átomos de azufre, los cuales le confieren varias de sus características particulares. El AAL participa como cofactor de dos complejos enzimáticos importantes en el ciclo de Krebs: la piruvato deshidrogenasa y la alfacetoglutarato deshidrogenasa (3).
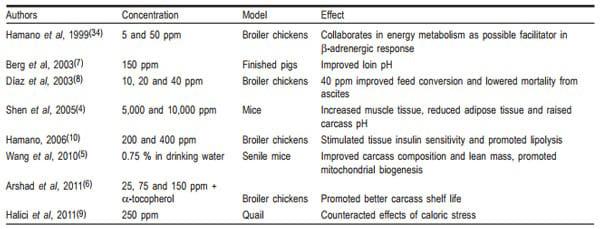
El AAL ha sido usado en animales, tanto de laboratorio (4,5) como de granja (pollo de engorda, codornices y cerdos), en los que se ha observado una mejora en la ganancia de peso y la disminución de problemas asociados con el estrés calórico y el síndrome ascítico, además del papel que ha desempeñado en la estimulación de la sensibilidad a la insulina (6- 10). El Cuadro 1 muestra algunos experimentos en los que el AAL ha sido evaluado empleando distinto modelo animal, cuyos resultados revelan efectos positivos de ese ácido sobre la ganancia de peso y en diferentes variables de calidad en la carne. Sin embargo, los modelos experimentales y las dosis utilizadas han sido muy amplias (de 10 a 10,000 ppm), lo que podría explicar parte de la variación que se observa en los resultados obtenidos.
Tomando como referencia las diversas dosis administradas (Cuadro 1), se optó por emplear como base el trabajo de Díaz (8), donde se usaron 10, 20 y 40 ppm, presentando el mejor resultado la dosis de 40 ppm. No obstante esto, se quería saber si con dosis más altas mejoraría la ganancia de peso y la calidad de la carne, por lo que se decidió usar además 80, 160 y 320 ppm de AAL.
Por lo anterior, el objetivo de este trabajo fue probar tales dosis de AAL (0, 40, 80, 160 y 320 ppm) incorporadas en la dieta de pollos de engorda para evaluar su efecto en las variables productivas y en la calidad de la carne.
La investigación se realizó en la granja experimental del Centro Nacional de Investigación Disciplinaria en Fisiología y Mejoramiento Animal (CENID-FyMA), del Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP), ubicado en Ajuchitlán, Querétaro. Las pruebas de calidad de carne se realizaron en el laboratorio de Bioquímica de la Facultad de Zootecnia y Ecología de la Universidad Autónoma de Chihuahua.
Cuadro 1. Experimentos en los cuales se usó el ácido lipoico sobre distinto modelo animal
Se empleó un total de 1,000 pollitos machos, recién eclosionados, de la línea Ross 308, usando 200 animales por tratamiento, los cuales se dividieron en ocho corrales para cada dosis probada, colocando 25 animales por corral, cada corral correspondió a una repetición. Los corrales se distribuyeron mediante un diseño de bloques al azar. Se probaron cinco niveles de AAL: 0, 40, 80, 160 y 320 ppm en el alimento, que fueron adicionados durante toda la engorda (49 días). Se evaluó la ganancia diaria de peso, el consumo de alimento, la conversión alimenticia y el peso final.
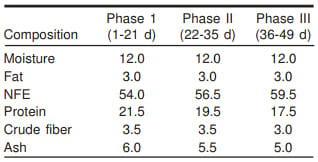
Los animales se alimentaron con un producto comercial (Pollo Sow de Nutri Sow®) en un esquema de tres fases, cada una con las características que se indican en el Cuadro 2. El alimento comercial se molió y fue colocado en una mezcladora donde se adicionaron las diferentes dosis de AAL; después el alimento mezclado se identificó y almacenó para proporcionárselo a las aves posteriormente.
Los animales se mantuvieron en un horario de 24 h de luz durante todo el experimento, a fin de promover un mayor consumo de alimento. No se aplicó ninguna vacuna ni se adicionó otro aditivo ajeno al alimento, ya que éste incluía vitaminas y minerales, además, en las fases II y III se incluían pigmentos amarillos.
Al terminar la Fase III todos los pollos se sacrificaron en la planta de procesamiento de aves Tipo Inspección Federal Pollo de Querétaro S. A. de C. V., localizada en el municipio de Colón, Querétaro. Previamente al sacrificio, los animales se ayunaron durante un periodo de 10 h, permitiéndoseles sólo el acceso al agua ad libitum. Al momento del sacrificio se seleccionaron, al azar, 20 canales por cada tratamiento (incluyendo todas las repeticiones), las cuales se enfriaron a 4 ºC durante 24 h. Posteriormente, se tomaron las muestras que serían usadas para las pruebas de calidad de la carne, obteniendo dos muestras de pechuga por cada canal, una sería usada para medición de la pérdida de agua por cocción y la otra sería empleada en el resto de las pruebas. Las pechugas se congelaron a -30 °C hasta su uso.
Cuadro 2. Composición proximal del alimento empleado en las fases de producción de pollo de engorda (%)
Para determinar la calidad de la carne se realizaron las siguientes pruebas:
Rendimiento de la pechuga. Después del sacrificio las canales se procesaron de forma convencional, almacenándose a 4 ºC durante 24 h. Pasado este periodo se tomaron los pesos de las canales en frío y, posteriormente, el peso de las pechugas deshuesadas, considerando tanto el músculo pectoral mayor como el menor, expresando el resultado como porcentaje del peso de la canal en frío.
Determinación del pH. El pH de las carne se midió durante dos ocasiones en el músculo pectoral o pechuga (Pectoralis major), con un potenciómetro portátil de la marca HANNA modelo HI 99163 (HANNA® instruments, USA). La primera medición del pH se tomó a los 15 min post mortem (11,12) (pH15) insertando el electrodo a 1 cm de profundidad, con calibraciones del equipo cada 30 a 50 mediciones con soluciones buffer de pH=4 y pH=7 (12,13). Las canales se enfriaron durante 24 h para alcanzar una temperatura interna de 4 ºC; posteriormente, se procedió a medir el pH final a las 24 h post mortem (pH24), justo en el mismo punto en donde se realizó la lectura anterior pH15 (12) .
Determinación del color.Se usó un colorímetro modelo CR-410 (Konica Minolta, USA) el cual tiene como referencia el sistema CIE L*a*b*(14) , determinando los valores de luminosidad (L*), índice de rojo (a*) e índice de amarillo (b*). El iluminante seleccionado fue D65, con un ángulo de medición de 2° y enfoque de 8 mm (12,15) . La medición del color se realizó a las 24 h post mortem, tomándose la lectura en la zona de la pechuga, tanto sobre la piel como sobre el músculo pectoral mayor. Para el caso del músculo, antes de la medición se retiró la piel y se midió el color sobre la superficie medial del lado de la fúrcula con el fin de evitar el brillo excesivo de la superficie del músculo de la pechuga (11,12,16) .
Posteriormente, las pechugas deshuesadas fueron envasadas al vacío y congeladas a -30 ºC hasta el momento de efectuar las demás mediciones. Para descongelar las pechugas, éstas se colocaron en refrigeración a 4 ºC durante toda la noche, en la mañana siguiente se retiraron del refrigerador y se mantuvieron a temperatura ambiente para finalizar el proceso de descongelación.
Capacidad de retención de agua. Se midió con la técnica de Grau y Hamm(17) modificada, en la cual se utilizó una muestra de 0.3 g que fue colocada entre dos hojas de papel filtro con porosidad de 0.5 µ, para después ser posicionada entre dos placas de plexiglass de 12 x 12 cm2 aplicando una fuerza con un peso de 10 kg durante 15 min(17,18). El porcentaje de agua perdida se expresó como agua libre y la capacidad de retención de agua se determinó restando el agua libre de 100.
Pérdida por goteo. Se determinó por el método gravimétrico a las 24 h post mortem, usando una porción del músculo pectoral de 3 g que fue suspendida dentro de un recipiente de plástico lo más hermético posible, a fin de evitar que la muestra se secara, manteniéndose a 3 ºC durante 48 h. El resultado se expresó como porcentaje de la masa muscular inicial, esto es [peso perdido por goteo/peso inicial de la carne] x 100 (12,16,19) .
Agua perdida por cocción. Para este análisis, la carne se empaquetó al vacío y se congeló a -30 ºC, posteriormente la carne (músculo Pectoralis major) se descongeló como se explicó previamente, para después pesarla y cocerla en agua a 85 ºC durante 15 min, hasta alcanzar una temperatura interna de 75 a 80 ºC, se enfrió y pesó nuevamente, obteniendo así el agua perdida por descongelación-cocción; el resultado obtenido se expresó como porcentaje del peso del músculo fresco (11).
Textura. La textura se evaluó midiendo la fuerza de corte (Warner-Bratzler) con el equipo LLOYD LS1 (USA), empleando cortes de carne después de cocinarse, por lo que se estandarizó el método de cocinado (velocidad de calentamiento y temperatura final en el centro térmico). La temperatura interna osciló entre 75 y 80 ºC. Siempre se tuvo en cuenta el tamaño de muestra, la localización dentro del músculo, la orientación de las fibras a la hoja de la cuchilla y la presencia de tejido conectivo (12). Las muestras se cortaron paralelas a la orientación longitudinal de las fibras musculares tomando siempre una muestra del mismo tamaño (1 cm de alto x 1.5 cm de ancho x 5 cm de largo), y se repitió tres veces para cada muestra de pechuga como mínimo. Las muestras se posicionaron de forma que la navaja cortara las fibras de manera perpendicular (12) .
Los datos de las variables productivas y los obtenidos de las pruebas para calidad de la carne se analizaron mediante un modelo completamente al azar, con el procedimiento de modelos lineales generales. Las diferencias entre medias se evaluaron usando el método de las diferencias mínimo cuadráticas. Se realizó una prueba de distribución para el caso del pH, y todos los valores que estaban expresados como porcentaje se transformaron a la raíz cuadrada del arco-seno para su análisis.
Cuadro 3. Efecto de diferentes niveles de ácido alfa lipoico (ALA) en la dietas sobre parámetros productivos de pollos de engorda
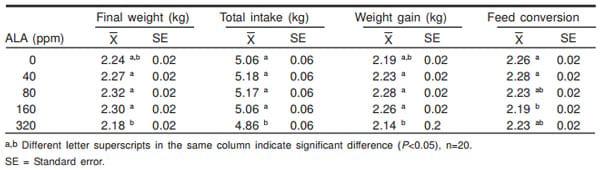
En el Cuadro 3 se observan las medias y el error estándar del peso final, ganancia de peso, consumo de alimento y conversión alimenticia en 49 días de evaluación. Respecto al peso final y la ganancia de peso, se puede observar que no existió diferencia entre los tratamientos 40, 80 y 160 ppm, sólo el nivel de 320 ppm de AAL mostró valores menores que el resto de las dosis, pero iguales al testigo (P>0.05). A su vez, el consumo de alimento fue menor (P<0.05) en los animales que recibían 320 ppm de AAL con respecto a todos los tratamientos incluyendo al testigo. En el caso de la conversión alimenticia se observaron algunas diferencias entre tratamientos, la dosis de 160 ppm presentó el menor valor, siendo diferente a los niveles de 0 y 40 ppm, pero igual al resto de los tratamientos (P<0.05). En los experimentos realizados por Berg et al (7) con cerdos, no se observaron efectos sobre el peso de la canal al adicionar ácido alfa lipoico en su dieta.
Como se puede ver en los resultados de consumo total de alimento, peso final y ganancia de peso del presente trabajo, la mayor dosis de AAL (320 ppm) ejerció un efecto negativo debido a que en estos parámetros se obtuvieron los valores más bajos, esto puede deberse a que dicha dosis disminuye la actividad de la AMPK hipotalámica, reduciendo de esta forma, el consumo voluntario, lo que trae como consecuencia menor ganancia de peso y por ende menor peso corporal, tal como se ha visto en trabajos previos (20).
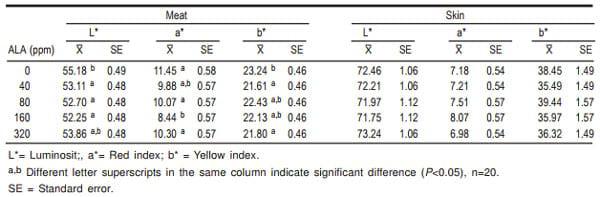
Cuadro 4. Efecto de diferentes niveles de ácido alfa lipoico (ALA) en la dietas sobre el color de la carne y piel de pollos de engorda
Los resultados obtenidos con la mayor dosis, 320 ppm, concuerdan con lo observado por otros autores (6,21), quienes administraron ácido alfa lipoico junto con alfa-tocoferol y observaron que el grupo con la mayor dosis (150 mg AAL + 200 mg ATA/kg de alimento) presentó el menor peso. En este sentido los resultados de Díaz et al (8) muestran que 40 ppm de AAL en la dieta, no tuvieron efecto sobre el consumo de alimento, pero sí mejoraron la ganancia diaria de peso y la conversión alimenticia. Sin embargo, otros autores (22) no encontraron diferencias entre sus tratamientos con diferentes dosis en los pollos de engorda.
En el Cuadro 4 se aprecia que en el caso del color de la carne, hubo una disminución de L* para todos los tratamientos que recibieron AAL excepto 320 ppm, un menor valor de a* para la dosis de 160 ppm y una disminución de b* para todos los niveles de AAL. En el caso del color de la piel, no hubo diferencias (P>0.05). Respecto a los valores de color de la carne, aun cuando no existen reportes en la literatura de mediciones directas sobre la pechuga, sí existen datos de otros autores (21) que evaluaron la carne cruda de la pechuga en presentación de nugget y hamburguesa, y muestran que para el caso de los nuggets el testigo fue similar al tratamiento con la menor dosis (25 mg AAL/ kg alimento); dicho tratamiento, a su vez, no presentó diferencia con el resto de los niveles de AAL. Mientras que para el caso de la hamburguesa el testigo también fue similar al tratamiento con la menor dosis, pero diferente de las demás concentraciones de AAL, todo esto tomando en cuenta únicamente los datos del día 0. Respecto a a* y b*, se puede observar que la carne presentó valores mayores para el índice de amarillo que para el de rojo, esto fue causado, en parte, por un pH final bajo, que reduce la absorción de la luz verde (valor negativo de a*) de la mioglobina, y resulta en una carne que parece menos roja y más amarilla (23) .
Cuadro 5. Efecto de diferentes niveles de ácido alfa lipoico (ALA) en la dieta sobre las características de la carne en pollos de engorda
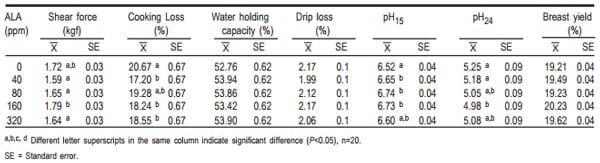
En el presente trabajo sólo se evaluó el color de la carne de la pechuga y se debe tomar en cuenta que ésta contiene una baja concentración de mioglobina, por lo que su color es más claro que otras piezas, como el muslo (24). En general, todas las concentraciones de AAL afectaron el color de la carne (P<0.05), los niveles de 40 y 160 ppm de AAL produjeron carne menos luminosa, y con menor intensidad de rojo y de amarillo en comparación con la carne del tratamiento testigo. El nivel de 80 ppm de AAL también mostró carne menos luminosa que el testigo, pero con igual intensidad de color rojo y amarillo que el mismo testigo; a su vez, el tratamiento de 320 ppm AAL solamente disminuyó la intensidad de color amarillo de la carne, pero mostró una luminosidad y una intensidad de color rojo igual que la carne del tratamiento testigo. Sin embargo, para el caso de piel no fue así, pues no se presentó ninguna diferencia atribuida a los tratamientos.
En el Cuadro 5 se observa que la dosis 160 ppm obtuvo el mayor valor en la fuerza de corte que el resto de los tratamientos (P>0.05), excepto que el tratamiento testigo. Los resultados de fuerza de corte presentan discrepancias con lo observado por otros autores (21), la adición de AAL disminuyó la dureza de la carne con excepción del nivel 160 ppm, el cual mostró una dureza igual que la carne del tratamiento testigo. Cabe mencionar que tales autores (21) evaluaron el efecto a través del tiempo 0, 30, 60 y 90 días, pero si se toma como referencia únicamente el día 0, entonces el testigo fue igual al resto de las dosis (200 mg de ATA + 75, 150 mg de AAL/kg de alimento), siendo sólo la menor dosis (200 mg de ATA + 25 mg de AAL/kg de alimento) la que fue diferente. Los resultados observados en la fuerza de corte para el tratamiento de 160 ppm pueden ser debidos a cambios en la arquitectura tisular (25).
El AAL disminuyó la pérdida por cocción sin afectar la capacidad de retención de agua y la pérdida por goteo. La pérdida por cocción fue menor en las canales de los animales tratados con AAL, excepto para los animales que recibieron 80 ppm. En las pruebas de capacidad de retención de agua, pérdida por goteo y rendimiento de la pechuga no se presentaron diferencias (P>0.05). Los valores de capacidad de retención de agua dan una idea de la integridad de las fibras musculares, pues si éstas conservan una mayor cantidad de agua, se debe a que han mantenido su integridad durante la conversión de músculo a carne y por ende presentarán un valor mayor para esta variable. Contrariamente, al perder demasiada agua el resultado obtenido irá disminuyendo, lo que significa que hay más líquidos intracelulares que han salido de las fibras musculares (7). Tampoco se presentaron diferencias para el caso de la prueba de pérdida por goteo, como otros autores mencionan (12); esta prueba se desarrolló inicialmente para evaluar carne de cerdo en donde las pérdidas de agua son abundantes; sin embargo, para el caso de la carne de pollo que tiende a perder menor cantidad de agua por goteo, sería preferible que la prueba aumentara el periodo de duración hasta tres días manteniéndose a 4 ºC como lo hicieron otros autores (19), lo que permitiría determinar si realmente se presenta un efecto por causa del tratamiento.
Cabe recordar que al suministrarse un antioxidante a los animales puede promoverse la integridad de la membrana celular de las fibras musculares, por lo cual éstas tendrán mayor capacidad de retener agua (26,27), como se mostró únicamente en la prueba de pérdida de agua por cocción (40, 160 y 320 ppm), un resultado similar era esperado para las pruebas de capacidad de retención de agua y pérdida por goteo, pero no fue así.
Los valores obtenidos de la medición del pH15 en los tratamientos 40, 80 y 160 ppm fueron diferentes al testigo (P<0.05), aunque la dosis de 320 ppm presentó un resultado similar al resto de las dosis, éste no fue diferente del testigo (P>0.05). Por otro lado, para el caso de la lectura de pH24 sólo el tratamiento de 160 ppm fue diferente del resto de las dosis (P<0.05). Se sabe que el pH pueden influenciar el color de la carne(28), pues se ha reportado que al disminuir el pH el valor de L* se incrementa (28,29,30); esto concuerda con los valores de pH inicial, donde el testigo y el tratamiento 320 ppm tuvieron los valores de pH más bajos y la luminosidad más alta, siendo los valores iguales en ambos, tanto de pH15 como de L*.
Dos de los factores que pueden ejercer efecto sobre el valor del pH son la cantidad de glucógeno contenido en el tejido muscular y el mecanismo que convierte el glucógeno en ácido láctico (31,32,33). Aun cuando en este trabajo no se midieron estas variables, una posible explicación podría ser que la dosis de 160 ppm pudo promover una mayor cantidad de glucógeno muscular por una conversión alimenticia más eficiente, pues obtuvo un valor de pH24 menor que el testigo, aunque no fue diferente de los tratamientos 80 y 320 ppm, pero se sabe que la cantidad de glucógeno disminuye por estrés previo al sacrificio.
En conclusión y a diferencia de trabajos previos, no se observó un efecto de AAL sobre los parámetros productivos; sin embargo, el AAL a dosis elevadas inhibió el consumo en los animales y por ende disminuyó el peso. Los niveles bajos de AAL (40 y 160 ppm) disminuyeron la luminosidad y el color rojo de la carne, pero ese efecto desapareció cuando el nivel de AAL subió a 320 ppm. El AAL no mostró efecto en el color de la piel de las aves. La adición de AAL disminuyó la dureza de la carne y la pérdida por cocción sin afectar la capacidad de retención de agua y la pérdida por goteo. El pH15 de la carne aumentó con el AAL, pero éste se estabilizó a las 24 h post mortem, cuando sólo el tratamiento 160 ppm AAL produjo carne ligeramente más ácida que la carne testigo. Estudios adicionales con un mayor número de aves por repetición serán necesarios para determinar cuál es la dosis idónea de AAL que permita obtener los resultados deseados, tanto en granja como en calidad de la carne.
AGRADECIMIENTOS
Este trabajo fue financiado por el Proyecto PAPIIT-UNAM IN200910. Sergio Sigler Galván agradece la beca otorgada por el CONACYT para la realización de sus estudios de Maestría en la Facultad de Estudios Superiores-Cuautitlán, UNAM, México.
LITERATURA CITADA
1. SAGARPA. Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación. Situación actual y perspectiva de la producción de carne de pollo en México. Coordinación General de Ganadería. México. 2009.
2. Dransfield E, Sosnicki AA. Relationship between muscle growth and poultry meat quality. Poult Sci 1999;78:743- 746.
3. Nesbitt NM, Cicchillo RM, Lee KH, Grove TL, Booker SJ. Lipoic acid biosynthesis. In: Lipoic acid, energy, production, antioxidant activity and health effects. Patel MS et al editors. First ed. Boca Raton, Florida, USA: CRC Press. Taylor & Francis Group; 2008:11-13.
4. Shen Q, Jones C, Kalchayanand M, Zhu M, Du M. Effect of dietary alpha-lipoic acid on growth, body composition, muscle pH, and AMP-activated protein kinase phosphorylation in mice. J Anim Sci 2005;83:2611-2617.
5. Wang Y, Li X, Guo Y, Chan L, Guan X. Alpha-lipoic acid increases energy expenditure by enhancing AMPK-PGC-1α signalling in the skeletal muscle of aged mice. Metabolism 2010;59:967-976.
6. Arshad MS, Anjum FM, Asghar A, Khan MI, Yasin M, Shahid M, El-Ghorab AH. Lipid stability and antioxidant profile of microsomal fraction of broiler meat enriched with α-lipoic acid and α-tocopherol acetate. J Agric Food Chem 2011;59:7346-7352.
7. Berg E, Maddock K, Linville M. Creatine monohydrate supplemented in swine finishing diets and fresh pork quality: III. Evaluating the cumulative effect of creatine monohydrate and alpha-lipoic acid. J Anim Sci 2003;81:2469-2474.
8. Díaz CA, Serret M, Ramírez G, Ávila E, Guinzberg R, Piña E. Prophylactic action of lipoic acid on oxidative stress and growth performance in broilers at risk of developing ascites syndrome. Avian Pathol 2003;32:645-653.
9. Halici M, Imik H, Koç M, Gümüs’ R. Effects of a-lipoic acid, vitamins E and C upon the heat stress in Japanese quails. J Anim Physiol Anim Nutr 2012;96:408-415.
10. Hamano Y. Effects of dietary lipoic acid on plasma lipid, in vivo insulin sensitivity, metabolic response to corticosterone and in vitro lipolysis in broiler chickens. Br J Nutr 2006; 95:1094-1101.
11. Le Bihan-Duval E, Debut M, Berri C, Sellier N, Santé- Lhoutellier V, Jégo Y, et al. Chicken meat quality: genetic variability and relationship with growth and muscle characteristics. BMC Genetics 2008;9:53.
12. Petracci M, Baéza E. Harmonization of methodology of assessment of poultry meat quality features. Working paper of WPSA Working Group 5. Poultry Meat. 2009.
13. Le Bihan-Duval E, Millet N, Remignon H. Broiler meat quality: Effect of selection for increased carcass quality and estimates of genetic parameters. Poult Sci 1999;78:822-826.
14. CIE. Commission Internationale de l’Eclairage. 18th session. Londres, Inglaterra. CIE Publication. 1976;36.
15. Alarcón A, Duarte J, Rodríguez F, Janacua H. Incidencia de carne pálida-suave-exudativa (PSE) y oscura-firma-seca (DFD) en cerdos sacrificados en la región del Bajío en México. Téc Pecu Méx 2005;43:335-346.
16. Alarcón A, Gamboa J, Alonso F, Grado J, Janacua H. Efecto de variables críticas del sacrificio sobre las propiedades físico químicas de la carne de cerdo. Téc Pecu Méx 2006;44:53-66.
17. Grau R, Hamm R. Eine einfache Methode zur bestimmung der wasserbindung im muskel. Die Naturwissenschaften 1953;40:29-30.
18. Boakye K, Mittal GS. Changes in pH and water holding properties of Longissimus dorsi during beef ageing. Meat Sci 1993;34:335-349.
19. Allen CD, Fletcher DL, Northcutt JK, Russell SM. The relationship of broiler breast color to meat quality and shelf – life. Poult Sci 1998;77:361-366.
20. Lee WJ, Song KH, Koh EH, Won JC, Kim HS, Park HS, et al. Alpha-lipoic acid increases insulin sensitivity by activating AMPK in skeletal muscle. Biochem Biophys Res Commun 2005;332:885-891.
21. Sohaib M, Anjum F, Khan M, Arshad M, Shahid M. Enhanced of lipid stability of broiler breast meat and meat products fed on alpha lipoic acid and alpha tocopherol acetate supplemented feed. Lipids Health Dis 2012;11:57.
22. Chen P, Ma Q, Ji C, Zhang J, Zhao L, Zhang Y, et al. Dietary lipoic acid influences antioxidant capability and oxidative status of broilers. Int J Mol Sci 2011;12:8476-8488.
23. Castellini C, Mugnai C, Dal Bosco A. Effect of organic production system on broiler carcass and meat quality. Meat Sci 2002;60:219-225.
24. Imik H, Ozlu H, Gumus R, Atasever MA, Urcar S, Atasever M. Effects of ascorbic acid and a-lipoic acid on performance and meat quality of broilers subjected to heat stress. Br Poult Sci 2012;53:800-888.
25. MacIntosh BR, Gardiner PF, McComas AJ. Muscle architecture and muscle fiber anatomy. In: Skeletal muscle: Form and function. MacIntosh BR et al editors. 2nd ed. Champaign, Illinois, USA: Human Kinetics; 2006;3-21.
26. Cai S, Wu C, Gong L, Song T, Wu H, Zhang L. Effects of nano-selenium on performance, meat quality, immune function, oxidation resistance, and tissue selenium content in broilers. Poult Sci 2012;91:2532-2539.
27. Hu C, Wang D, Pan H, Zheng W, Zuo A, Liu J. Effects of broccoli stem and leaf meal on broiler performance, skin pigmentation, antioxidant function, and meat quality. Poult Sci 2012;91:2229-2234.
28. Schilling M, Radhakrishnan V, Vizzier-Thaxton Y, Chritensen K, Joseph P, Williams J, Schmidt T. The effects of low atmosphere stunning and deboning time on broiler breast meat quality. Poult Sci 2012;91:3214-3222.
29. Pekel A, Demirel G, Midilli M, Yalcintan H, Ekiz B, Alp M. Comparison of broiler meat quality when fed diets supplemented with neutralized sunflower soapstock or soybean oil. Poult Sci 2012;91:2361-2369.
30. Samuel D, Trabelsi S. Influence of color on dielectric properties of marinated poultry breast meat. Poult Sci 2012;91:2011-2016.
31. McKee SR, Sams AR. The effect of seasonal heat stress on rigor development and the incidence of pale, exudative turkey meat. Poult Sci 1997;76:1616-1620.
32. Duclos MJ, Berri C, Le Bihan-Duval E. Muscle growth and meat quality. Poultry meat and egg quality symposium. J Appl Poult Res 2007;16:107-112.
33. Wang RR, Pan XJ, Peng ZQ. Effects of heat exposure on muscle oxidation and protein functionalities of pectoralis majors in broilers. Poult Sci 2009;88:1078-1084.
34. Hamano Y, Sugawara S, Kamota Y, Nagai E. Involvement of lipoic acid in plasma metabolites, hepatic oxygen consumption, and metabolic response to a b-agonist in broiler chickens. Br J Nutr 1999;82:497-503.