Presencia de micotoxinas de Fusarium en pastos nativos de los humedales de Chaco, Argentina destinados a la alimentación bovina
En Argentina, el uso de anabólicos como promotores de crecimiento en la producción bovina está prohibido. Sin embargo, la presencia de la toxina fúngica zearalenona (ZEA) en pastos destinados a consumo animal como contaminante natural, puede generar resultados falsos positivos en el control de anabólicos, por la aparición de zeranol en orina, el cual es un derivado del metabolismo de la toxina. Como objetivo del presente estudio se consideró de interés analizar la presencia natural de micotoxinas producidas por el género Fusarium, incluida la ZEA y sus derivados, mediante LC-MS/MS, en pastos naturales destinados a la alimentación bovina en dos establecimientos ganaderos del este de Chaco, donde SENASA había detectado zeranol en orina de ganado. El análisis reveló la presencia de ZEA en el 90% de las muestras analizadas (media: 84,5 µg/kg), también se detectó α y β-zearalenol. Además, se detectaron algunos metabolitos con probada toxicidad en rumiantes como son los tricotecenos tipo A, tales como toxina T-2 y toxina HT-2 los cuales estaban presentes en alta frecuencia (63 y 50% respectivamente) y en concentraciones superiores a 5000 µg/kg en algunas muestras. Se encontraron también otros metabolitos producidos por Fusarium en muy alta frecuencia como beauvericina, equisetina y aurofusarina. Como segundo objetivo se planteó estudiar la variación estacional de las micotoxinas presentes en pastos naturales destinados a la alimentación bovina, con el fin de verificar si la presencia de ZEA y de otros metabolitos en pastos naturales (no cultivados) es un evento frecuente o esporádico y dilucidar si existe variación temporal en las micotoxinas de Fusarium. Para ello, en el año 2014 se muestrearon un total de 67 plantas que pertenecían a 13 géneros diferentes dentro de la familia Poaceae en dos periodos diferentes del año: febrero y septiembre. La mayoría de las muestras (98%) presentaron contaminación con micotoxinas, siendo las más prevalentes ZEA, toxina T-2, beauvericina, toxina HT-2 y aurofusarina. También se encontraron con baja frecuencia otras micotoxinas producidas por Fusarium como: neosolaniol y diacetoxiscirpenol. A partir de los resultados obtenidos fue posible explicar los niveles de zeranol encontrados en la orina del ganado bovino.
Figura 1. Mapa indicando la localización de los establecimientos a partir de los cuales se obtuvieron las muestras de pasto. 1. Establecimiento La Adela 2. Establecimiento San Francisco.
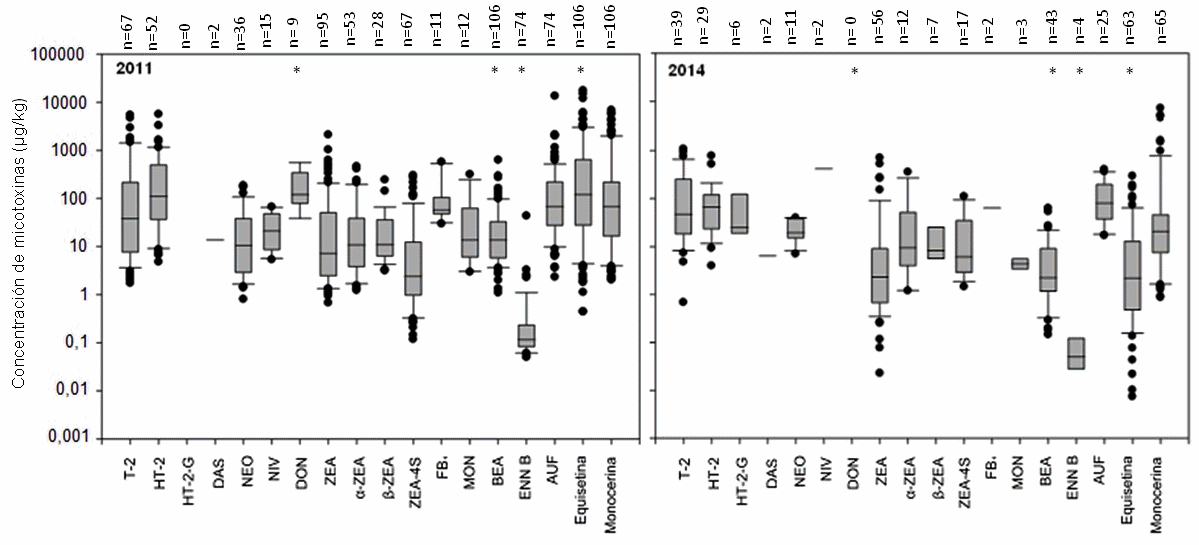
Figura 2. Box-plots de las concentraciones de las toxinas de Fusarium en muestras de pastos naturales en los años 2011 y 2014. *Significativo p < 0,01.
Articulo original ha sido publicado en Toxins 2015, 7, 3309-3329; doi:10.3390/toxins7083309
Este trabajo ha sido financiado por SECYT-UNRC, PIP-CONICET y SENASA (Segundo premio a la Investigación y Transferencia en Protección Vegetal 2014 de Equipos Consolidados). La Dra. Nichea es becaria de CONICET y las Dras. Torres y Ramírez son miembros de la Carrera de Investigador Científico de CONICET.
- Aráoz LF (2004) Trazabilidad de la carne bovina en la Argentina. Proyecto FAO–Países del MERCOSUR ampliado, “Apoyo a la Integración del Sector Agropecuario del Cono Sur para Contribuir a las Políticas de Seguridad Alimentaria” (TCP/RLA/2910).
- Arelovich HM, Bravo RD, Martínez MF (2011) Development, characteristics, and trends for beef cattle production in Argentina. Animal frontiers 1: 37-45.
- Bavera G, Boco O, Beguet H, Petryna A (2002) Promotores de crecimiento y modificadores del metabolismo. Cursos de Producción Bovina de Carne, FAV UNRC
- Changwa R, Abia W, Msagati T, Nyoni H, Ndleve K, Njobeh P (2018) Multi-mycotoxin occurrence in dairy cattle feeds from the Gauteng province of South Africa: A pilot study using UHPLC-QTOF-MS/MS. Toxins 10: 294.
- Di Rienzo J, Casanoves F, Balzarina M, Gonzalez L, Tablada M, Robledo C. (2018) Infostat versión 2018. Centro de Transferencia Infostat, FCA. Universidad Nacional de Córdoba. Argentina. http: //www.Infostat.com.ar.
- Eckard S, Wettstein FE, Forrer HRY, Vogelsang S (2011) Incidence of Fusarium species and mycotoxins in silage maize. Toxins 3: 949–967.
- EFSA (2011) European Food Safety Authority. Scientific opinion on the risks for animal and public health related to the presence of T-2 and HT-2 toxin in food and feed. EFSA J 9: 1–187.
- Erasmuson AF, Scahill BG, West DM (1994) Natural zeranol (α-zearalanol) in the urine of pasture-fed animals. J Agric Food Chem 42: 2721-2725.
- Hadley G, Wolf C, Harsh S (2006) Dairy cattle culling patterns, explanations, and implications. J Dairy Sci 89: 2286–2296.
- Kennedy DG, Hewitt SA, McEvoy JD, Currie JW, Cannavan A, Blanchflower WJ, Elliot CT (1998) Zeranol is formed from Fusarium spp. toxins in cattle in vivo. Food Addit Contam 15: 393-400.
- Kleinova M, Zöllner P, Kahlbacher H, Hochsteiner W, Lindner W (2002) Metabolic profiles of the mycotoxin zearalenone and of the growth promoter zeranol in urine, liver, and muscle of heifers. J Agric Food Chem 50: 4769–4776.
- Launay FM, Ribeiro L, Alves P, Vozikis V, Tsitsamis S, Alfredsson G, Sterk SS, Blokland M, Litia A, Lövgren T, Tuomola M, Kennedy G, Kennedy DG (2004) Prevalence of zeranol, taleranol and Fusarium spp. toxins in urine: implications for the control of zeranol abuse in the European Union. Food Addit Contam 21: 833-839.
- Malachova A, Sulyok M, Beltrán E, Berthiller F, Krska R (2014) Optimization and validation of a quantitative liquid chromatography-Tandem mass spectrometric method covering bacterial and fungal metabolites including all relevant mycotoxins in four model food matrices. J Chromatogr A 1362: 145–156.
- Miles CO, Erasmuson AF, Wilkins AL, Towers NR, Smith BL, Garthwaite I, Scahill BG, Hansen RP (1996) Ovine metabolism of zearalenone to α-zearalanol (zeranol). J Agric Food Chem 44: 3244–3250.
- Mostrom M, Jacobsen B (2011) Ruminant mycotoxicosis. Vet Clin Food Anim Pract 27: 315–344.
- Munkvold GP (2017) Fusarium species and their associated mycotoxins. En: Mycotoxigenic Fungi: Methods and Protocols, Methods in Molecular Biology. Moretti A, Susca A (Eds) Humana Press, New York, NY, pp 51-106.
- Reed KFM, Moore DD (2009) A preliminary survey of zearalenone and other mycotoxins in Australian silage and pasture. Anim Prod Sci 49: 696–703.
- Reyes Velasquez W (2011) Micotoxicosis en rumiantes. En: Micotoxinas y Micotoxicosis. Ramos Girona A (Ed.) Editorial A, Madrid Vicente, Ediciones, pp187-218.
- Salvat A, Moschini RC, Comerio RM, Balbuena O, Rosellio Brajovich JE, Cristos D, Rojas D, Ricca A, Salerno JC (2016) Zearalenone content in animal fodder samples in relation to weather conditions in Colonia Benitez, northeastern Argentina. Australasian Plant Pathol 45: 251-259.
- Schollenberger M, Müller HM, Rüfle M, Suchy S, Plank S, Drochner W (2006) Natural occurrence of 16 Fusarium toxins in grains and feedstuffs of plant origin from Germany. Mycopathologia 161: 43–52.
- SENASA (2007) Servicio Nacional de Sanidad y Calidad Agroalimentaria. Listado de ensayos analíticos acreditados bajo la norma ISO/IEC 17.025 ante el organismo argentino de acreditación.
- Shimshoni JA, Cuneah O, Sulyok M, Krska R, Galon N, Sharir B, Shlosberg A (2013) Mycotoxins in corn and wheat silage in Israel. Food Addit Contam Part A 30: 1614–1625.
- Smith JF (2006) Review of zearalenone studies with sheep in New Zealand. En: Proceedings of the New Zealand Society of Animal Production. New Zealand Society of Animal Production, pp 306-310.
- Streit E, Schatzmayr G, Tassis P, Tzika E, Marin D, Taranu I, Tabuc C, Nicolau A, Aprodu I, Puel O, Oswald I (2012) Current situation of mycotoxin contamination and co-occurrence in animal feed: Focus on Europe. Toxins 4: 788–809.
- Streit E, Schatzmayr G, Tassis P, Tzika E, Marin D, Taranu I, Tabuc C, Nicolau A, Aprodu I, Puel O, Oswald I (2012) Current situation of mycotoxin contamination and co-occurrence in animal feed: Focus on Europe. Toxins 4: 788–809.
- Sulyok M, Berthiller F, Kraska R, Shhuhmacher R (2006) Development and validation of a liquid chromatography/tandem mass spectrometric method for the determination of 39 mycotoxins in wheat and maize. Rapid Commun Mass Spectrom 20: 2649–2659.
- Sulyok M, Krska R, Schuhmacher R (2007) A liquid chromatography/tandem mass spectrometric multi-mycotoxin method for the quantification of 87 analytes and its application to semiquantitative screening of moldy food samples. Anal Bioanal Chem 389: 1505–1523.
- Van Asselt ED, Azambuja W, Moretti A, Kastelein P, De Rijk TC, Stratakou I, Van Der Fels-Klerx HJA (2012) Dutch field study on fungal infection and mycotoxin concentrations in maize. Food Addit Contam 29: 1556-1565.
- Wenz J, Jensen S, Lombard J, Wagner B, Dinsmore R (2007) Herd management practices and their association with bulk tank somatic cell count on United States dairy operations. J Dairy Sci 90: 3652–3659.
- Zain M (2011) Impact of mycotoxins on humans and animals. J Saudi Chem Soc 15: 129–144.
Interesante articulo con resultados muy agropertinentes y se derivan varias dudas y reflexiones, de las cuales describo a continuación:
1.Se encontró importante evidencia de que el efecto estacional no varió de manera drástica los resultados en niveles de micotoxinas con actividad estrogenoide (entre otras micotoxinas detectadas en la investigación), siendo las zearalenonas y sus metabolitos frecuentemente las micotoxinas enmascaradas o que no suelen detectarse fácilmente, a menos que se cuente con método analíticos de alta sensibilidad y apoyados con investigación veterinaria como la descrita en este foro.
2. El estudio también evidencia riesgos de interacciones negativas entre micotoxinas del genero Fusarium en rumiantes que no son frecuentemente reportadas. Estas interacciones enmascaradas pueden promover sinergismos toxicológicos. Pero!!! Adicionalmente la actividad estrogenoides de zearalenona y algunos de sus metabolitos causan inducción enzimática (incremento del metabolismo hepático), con las exposición crónica, es decir, aquellas interacciones entre este tipo de micotoxinas y un plaguicida o agroquímico, algunos medicamento (antibiótico u analgésico, desparasitante por ejemplo), pueden incrementar la toxicidad de los últimos o simplemente no encontrar el efecto terapéutico esperado en el rebaño.
3. Asimismo, permite reflexionar que en los últimos diez años aproximadamente, se ha incrementado la frecuencia o detección de micotoxinas del genero Fusarium, con respecto a las producidas por el Genero Aspergillus … sobre todo en Latinoamérica. Esto entre varias razones, puede deberse al cambio climático y/o al uso de materias primas vegetales transgénicas (más resistentes al género Aspergillus), hipotéticamente. Por lo que estudios como este son muy importantes en la búsqueda de respuestas o soluciones en la presencia, frecuencia de micotoxinas y su riesgo de exposición en las especies animales domesticas o silvestres.
Excelente trabajo de investigación, gracias por compartirlo…
Hola, como estan??
Repasando contenidos publicados años atrás recorde esta noticia "Argentina - Clausuras por supuesta aplicación de zeranol". Allí publicamos lo que sucedia en la provincia de Chaco junto a la opinión y el aporte bibliográfico del recordado Ing. Alberto Gimeno. Y en el foro de discusión técnica hacían su aporte, entre otros profesionales destacados Marta Scuteri y Patricia Knass.
Espero sea útil este aporte
Slds, Hugo












