Etiología de infecciones intramamarias en vacas de raza carora en sistemas de pastoreo y estabulación
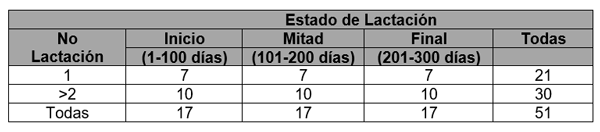
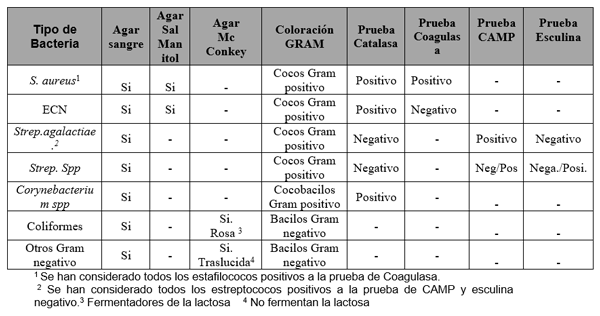
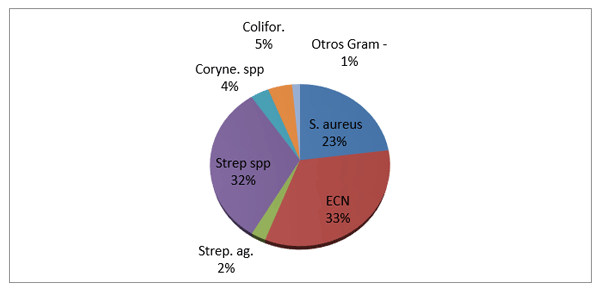
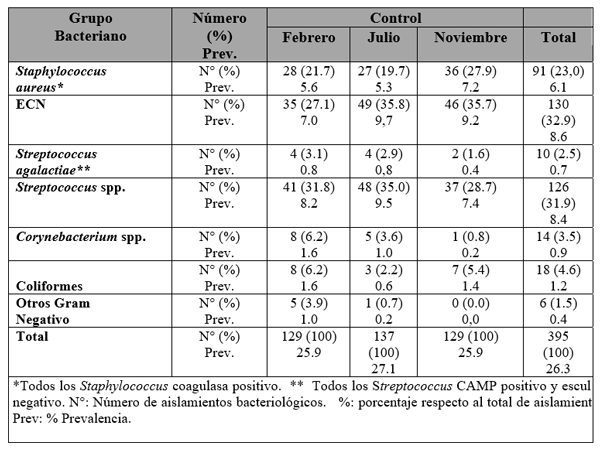
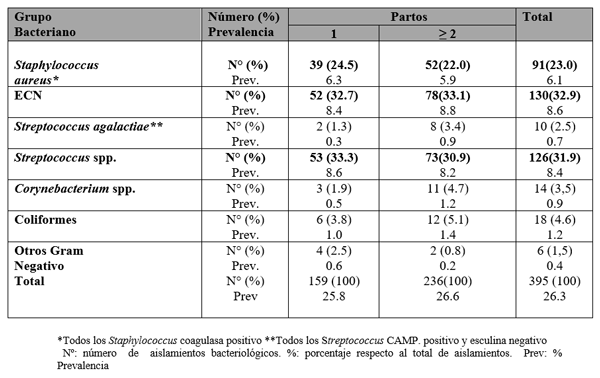
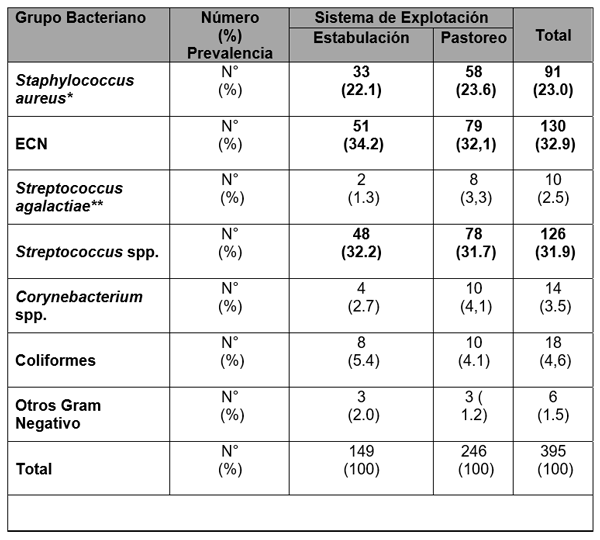
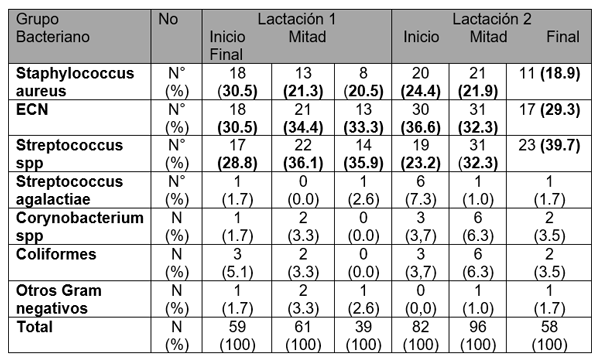
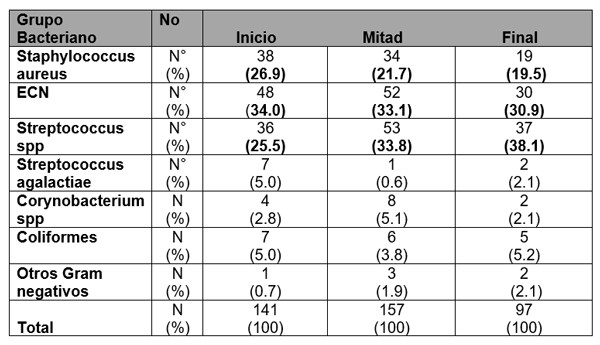
El experimento se llevó a cabo en 10 explotaciones pertenecientes a la Asociación Venezolana de Criadores de Ganado Carora [1]. En la mitad de ellas las vacas estaban estabuladas permanentemente, mientras que en la otra mitad los animales estaban en pastoreo. Todas las explotaciones elegidas tenían más de 80 vacas. El diseño experimental consistió en realizar tres controles (Febrero-Marzo, Junio-Julio, Noviembre) en cada explotación, de modo que en cada uno de ellos se tomaron 51 muestras de leche de ubre y una muestra de leche del tanque. Las 51 vacas muestreadas en cada control fueron elegidas según su número de lactación (primíparas y multíparas) y estado de lactación (Inicio: 7-100 d; Mitad: 101-200 d; Final>201 d) del siguiente modo: a) 21 vacas primíparas, de las cuales 7, 7 y 7 estaban al Inicio, Mitad y Final de la lactación, respectivamente; b) 30 vacas multíparas, de las cuales 10, 10 y 10 estaban al Inicio, Mitad y Final de la lactación, respectivamente. En el primer control los animales fueron elegidos al azar, de entre todos los que reunían las características de número y estados de lactación especificados anteriormente. En los siguientes dos controles fue necesario incorporar nuevos animales para mantener el plan de muestreo descrito. En total se tomaron 1530 muestras de leche individual procedentes de 958 vacas (406 primíparas y 552 multíparas). Para cada animal se registró la siguiente variable en cada control: bacteriológico en una muestra de leche, mezcla de los cuatro cuarterones. . La mayoría de las infecciones intramamarias fueron ocasionadas por ECN (32.9 % de los aislamientos), Streptococcus spp (31.9 %) y Staphylococcus aureus (23.0 %). El resto de gérmenes (S. agalactiae, Corynebacterium spp., coliformes y otros bacilos Gramnegativo) representaron, cada uno, menos del 5 % de las IIM.
Palabras Claves: Etiología, IIM, Estado de Lactación, Pastoreo, Estabulación, Raza Carora
[1] ASOCIACIÓN VENEZOLANA DE CRIADORES DE GANADO RAZA CARORA (ASOCRICA). Datos del registro computarizado de la Asociación Venezolana de criadores de ganado Carora. Carora Estado Lara. Venezuela. 2009.
[2] ACUÑA, C.N., CHERTCOFF, R.E.,MARTÍNEZ, M.B., NIMO, J.M.. Udder pathogens prevalence in dairy cows from Argentina. Proceedins of the National Mastitis Council 41 Annual Meeting, pp 177-178. 2001
[3] BRADLEY, A. J., GREEN, M. J. A study of the incidence and significance of intramammary enterobacterial infections acquired during the dry period. J.Dairy Sci. 83:1957-1965. 2000.
[4] BRADLEY, A.J. Bovine mastitis: an evolving disease. The Veterinary Journal, 164: 116-128. 2002.
[5] BRADLEY, A.J., LEACH, K.A., GREE N, L.E., GREEN, M.J. Survey of the incidence and aetiology of mastitis on dairy farms in England and Wales. The Veterinary Record, 160: 253-258. 2007.
[6] BLOWEY, R., EDMONDSON, P. Control de la Mastitis en granjas de vacuno de leche. Ed. Acribia S.A., Zaragoza. 208 pp. 1999.
[6] CHAVES, J., TIRANTE, L., POL, M., BAS, D.,VANDONI, R., OLIVIERI, R. Prevalence of intramammary infections in 74 dairy herds located in Argentina. Proceedins of the National Mastitis Council 41 Annual Meeting, pp 205-206. 2001.
[6] CREMONESI, P., CASTIGLIONI, B., MORONI. P., PISONI, G. Molecular testing, epidemiological aspects, prevalence and distributior of mastitis pathogens in Dairy bovine, caprine and ovine herds. Mastitis control-From science to practice. 2008.
[7] DÖPFER, D., BARKEMA, H.W., LAM, T.J.G.M., SCHUKKEN, Y.H., GAASTRA, W. Recurrent clinical mastitis caused by Escherichia coli in dairy cows.J. Dairy Sci., 82:80-85. 1999.
[8] FARIA-REYES, JF., VALERO, L.K., D´POOL, G., GARCIA, U.A., ALLARA, C.M., MORALES, D. Agentes bacterianos y contaje de células somáticas en leche de cuarto de bovino mestizos doble propósito ordeñados en forma manual o mecánica en cuatro fincas lecheras del estado Zulia, Venezuela. 2005a.
[9] FARIA-REYES, JF., GARCIA, U.A., D´POOL, G., VALERO, L.K., ALLARA, C.M., ANGELOSANTE, G. Detección de Mastitis subclínica en bovinos mestizos doble propósito ordeñados en forma manual o mecánica. Comparación de tres pruebas diagnósticas. Maracaibo-Venezuela. 2005b.
[10] HOGAN, J.S., SMITH, K.L. Environmental Streptococcal Mastitis: facts, fables and fallacies. Proceedins of the National Mastitis Council 42 Annual Meeting pp 162-170.
[11] JEMEL.JANOVS, A., KONOSONOVA, I.H., BLUZMANIS, J., IKAUNIECE, D. Chances of pathogen spectrum in dairy herds of Latvia. University of Agriculture Research Institute of Biotechnology and Veterinary Medicine Signa. 2008.
[11] LONDOÑO, D. Prevalencia de los principales microorganismos causantes de mastitis en vacas lecheras del centro del Valle del Cauca en los años 2003 a 2006. Trabajo de Grado. 2005.
[12] NMCA practical look at environmental mastitis. National Mastitis Council. Factsheet, pp 3. 1997.
[13] OSTERAS, O., SOLVEROD, L. REKSENT, O. Milk culture results norwegian Surrey-effects of seasons, parity, days in milk, resistence and clustering. Journal Dairy Sci. 89: 1010-1023. 2006.
[14] PIEPERS, S., DE MEULEMEESTER, L., DE KRUIF, A., OPSOMER, G. BARKEMA, H. W., VLIEGHER, S. D. Prevalence and distribution of mastitis pathogens in subclinically infected dairy cows in Flanders, Belgium.J. of Dairy Research, 74: 478-483. 2007.
[15] PINHO, J.F., CABRAL, C.R., LAMEIRA, R., MEIRELES, P., VAZ, F., CARVALHEIRA, J., THOMPSOM, G. Prevalence of mastitis pathogens in milk samples from Portuguese dairy cattle. Mastitis control - From science to practice. 2008.
[16] PHILPOT, W.N., NICKERSON, S.C. Ganando la lucha contra la Mastitis. WESTFALIA SURGE, INC. NAPERVILLE, IL, USA. P. 28-37. (2002).
[17] PITKALA, A., HAVERL, M., PYÖRÄLÄ, S., MYLLYS, V., HONKANEN-BUZALSKI, T. Bovine mastitis in finland 2001-Prevalence, distribution of bacteria, and Antimicrobial Resistance. J. Dairy Sci. 87:2433-2441. 2004.
[18] SAMPIMON, S. L., SNOEP, J. J. Factors associated with bacteriological curse during lactation offer therdpy for subclinical study of risk factors for clinical mastitis in post partum dairy lerfors. J. Dairy Sci. 84: 392-399. 2001.
[19] SAMPIMON, O. C., OLDE RIEKERINK, R.G.M., LAM, T.J.G.M. Prevalence of subclinical mastitis pathogens and adoption of udder health management practices on Dutch dairy farms: preliminary resultads. Mastitis control - From science to practice. 2008.
[20] SAMPIMON, O. C., BARKEMA, H. W., BERENDS, I.M.G.A., SOL, J., LAM,T.J.G.M., Prevalence and herd-level risk factors for intramammary infection with coagulase-negative staphylococci in dutch dairy herds. Veterinary Microbiology, 134: 37-44. 2009.
[21] SCARAMELLI, A.M., FERRARO, L., TROYA, H. Recuento Electrónico de Células Somáticas aplicado a la detección de mastitis subclínica bovina en fincas lecheras de los estados Aragua y Carabobo Venezuela. Universidad Central de Venezuela, Facultad de Ciencias Veterinarias. Maracay, Edo. Aragua. 1999.
[21] SCHUKKEN, Y.H., GONZÁLEZ, R.N., TIKOFSKY, L.L., SCHULTE, H.F., SANTISTEBAN, C.G., WELCOME, F.L., BENNETT, G.J., ZURAKOWSKI, M.J., ZADOKS, R.N. CNS mastitis: nothing to worry about?. Veterinary Microbiology, 134: 9-14. 2009.
[22] SMITH, K.L., HOGAN, J.S. (2001). The world of mastitis. Proc. 2nd Intern. Symp. Mastitis and Milk Quality, Vancouver, British Columbia, Canada: 1-12.
[23] TAPONEN, S., PYÖRÄLÄ, S. How important is coagulase-negative staph as a cause of mastitis?. Proceedins of the National Mastitis Council 46 AnnualMeeting, pp 81-91. 2007.
[24] TENHAGEN, A., KÖSTER, G., WALLMANN, J., HEUWIESER, W. Prevalence of mastitis pathogens and their resistance Against Antimicrobial Agents in Dairy Cows in Brandenburg, Germany. Mastitis control – From science to practice. 2006.
[25] TENHAGEN, A., HANSEN, I., REINECKE, A., HEUWIESER, W. Prevalence of pathogens in milk samples of dairy cows with clinical mastitis and in heifers at first. 2008.
[26] TODHUNTER, D.A, SMITH, K.L., HOGAN, J.S. Environmental streptococcal intramammary infections of the bovine mammary gland. J. Dairy Sci. 78: 2366-2374. 1995.
[27] VAN WERVEN, T. The role of leukocytes in bovine Escherichia coli mastitis. PhD Thesis. Utrecht. 1999.
[28] WATTS, J.L. Etiological agents of bovine mastitis. Veterinary Microbiology, 46: 41-46. 1988.
[29] WILSON, D.J., GONZALEZ, R.N., DAS, H.H. Bovine mastitis pathogens in new York and Pennsylvania: Prevalence and effects on Somatic Cell count and milk production. Quality Milk promotion services, Cornell University, Ithaca, NY 14850. 1997.
[30] ZADOKS, R.N., ALLORE, H.G., BARKEMA, H.W., SAMPIMON, O.C., GRÖHN, Y.T., SCHUKKEN, Y.H. Analysis of an outbreak of Streptococcus uberis mastitis. J. Dairy Sci., 84:590. 2001.
[31] ZADOKS, R.N., FITZPATRICK, J.L. Chnagin trends in mastitis. Irish Veterinary Journal, 62: 59-70. 2009.




Este foro se inicio hace algo mas de tres años y la tematica ha ido variando segun cambiaban los comentarios que se vertian, quisiera rescatar un punto tocado tangenciamente por algunos ponentes pero que creo que debemos analizar y profundisar con mas amplitud y criterio.
El problema de la salud Publica, en nuestra americalatina en las grandes urbes se consume leche procesada lo que garantiza su inocuidad por lo no hay problema que controlar. El gran problema que estamos observando es que cada dia es mayor el consumo de quesos artesanales sellados al vacio y se entregan al consumo con ingentes cantidaddes de patgenos y que causan un sin numero de infecciones ETA en todos nuestros centros poblados y no pasa nada.
La falta de regulaciones y de control de las autoridades municipales es evidente la disminucion en los mercados de quesos madurados con cascara es palpable con la invacion de los quesos frescos que demuestran tener una vida util de no mas de tres dias, despues no sirven para nada, se llenan de hongos y la carga bacteriana es fabulosa.
Pensemos un poco en nuestros poblados que estan algo alejados de las grandes urbes alli la gente sufre estas inclemencias y no se dice nada.
Otro gran problema es la venta aetesanal de Yoguth que segun los venedores los ofertan en la via publica sin refrigeracion por que carecen de animalitos (bacilos)
Actuamente en el Perú se esta comercializado un Manjarblanco (dulce de leche )
que no tiene una gota de leche pues es una mezcla de Maicena, agua y saborizantes y se vende 20 soles (5.40 dolares) por un balde de aceite de 20 lt de capacidad. y nuestras autoridades estan felices por el consumo de manjar.
Disculpen pero no podia soportar mas estan atrocidades.
Raul Santivañez Vivanco
Reg CMVP 444


Special Nutrients
Yo creo que este foro debe concluir con esta discusión y aquellos lecheros cuyo negocio no les reditúa lo suficiente para compensar la inversion económica, más el trabajo físico y mental que esta empresa conlleva, debería buscar otra profesión mas rentable.
No hay vergüenza en admitir derrota. En los Estados Unidos la industria a perdido más de la mitad de los lecheros comerciales durante los últimos 20 anos, como resultado la industria se ha fortalecido y los precios de la leche caliente son hoy en día más estables, la llamada "volatibilidad" ha desaparecido, al menos en 2024, situación que no he observado en anos.



Evonik Animal Nutrition
El problema en Latinoamerica es la leche cruda que es accesible a miles de comunidades de nuestro medio y generalmente a mas bajos precios que la leche comercial Pasteurizada. Por unos centavos menos, el consumidor arriesga su salud consumiendo esta leche, que podría muy bien causarle enfermedad. Algunos consumidores, al menos la hierven reduciendo así los problemas de gastroenteritis infantil, que incidentalmente, fue la razon principal que provoco a los organismos de salud pública en países industrializados, a que editaran leyes en donde se obligaba a los productores de leche a compañías procesadoras de leche.
A partir de ese momento, el finquero perdió su independencia en el mercado de la leche y es el procesador el que dicta los precios de la leche de tanque que se refleja muy bien en las grandes diferencias de precio que existen, entre el litro de leche pagado al productor en la finca sin pasteurizar, y el litro de leche pasteurizada que el consumidor paga en la tienda.
Es muy importante que hagamos la diferencia entre productores de leche profesionales de aquellos que simplemente no lo son.
Los primeros venden su leche a una compañía procesadora de leche que demanda ciertos requisitos al productor; los segundos, en general venden la leche al público en forma cruda o la utilizan para hacer queso, mantequilla, natilla, etc., y exponen un riesgo a la salud pública.
En cuanto a organizaciones como el DHIA norteamericano (que incluyen Mexico y Canada), hoy en día son solamente aquellos ranchos que aparte de la leche venden su genética los que siguen este programa; la gran mayoría de hatos comerciales han optado en abandonar el programa (total o parcialmente) y confiar en los sistemas de manejo computarizados que la industria ofrece, tales como:
DC-305, PC Dart, etc. La mayoría de estos pueden ser integrados con otros programas comerciales especializados en por ejemplo: la detección de mastitis por conductividad (Affi Milk), genomics, vacas en celo, laminitis, etc,.


Priya Chemicals
Amigos del Foro: Leer todas las opiniones expuestas en un tema tan importante como son las mastitis en el ganado lechero es algo siempre aleccionador solamente me agradaría hacer un comentario que creo no se ha considerado.
En mi opinión, el principal problema del control de las mastitis en nuestra querida Latinoamérica es que en la gran mayoría de las ganaderías lecheras el conocimiento, control y manejo de las mastitis no esta en manos de MEDICOS VETERINARIOS y estos son solicitados cuando el problema se le ha escapado de las manos al productor.
Es importante conocer como nos indica el Dr. Francesa las ventajas que tienen las ganaderías en EEUU pero lamentablemente en nuestros países no podemos contar con esas armas y tenemos que usar macho mas nuestras experiencias y conocimientos para lograr el control del principal y mas caro problema de la ganadería lechera.
Como ya he mencionado en varias oportunidades este es un tema donde cada quien tiene un punto de vista diferente en cuanto como proceder cuando un hato es declarado con este problema: mastitis crónico-contagiosa.
Yo creo que el ganadero es el que hace las decisiones finales y es por lo tanto el que más se beneficiaria de los comentarios expuestos en este forum.
En mi experiencia personal debo decirles que no conozco un solo rebaño infectado; ya sea, Staph o Mycoplasma que hallan triunfado en eliminar el problema. Conozco un rancho de vacas Jersey en el estado de Vermont donde la prevalencia de Staph aureus en las vacas de ordeno ha persistido por más de 20 anos. Conozco un rancho en el estado de Nueva York donde Mycoplasma es agente etiológico causal y persistido en ese medio por una cantidad de anos semejante. Ranchos grandes con 350 vacas el primero y 2000 vacas en ordeno el segundo.
El rancho con Mycoplasma decido vender en una ocasión todas las vacas infectadas que mantenían en un grupo separado de alrededor 175-200 animales; al año siguiente, tenían el mismo número de animales infectados.
Con estos ejemplos quiero decirle al ganadero que se toma la molestia de leer este comentario, de que una vez que Ud.: "le abrió la puerta y la dejo dormir por unos días en su casa, no la va a poder sacar de su casa."
Mantenga su hato lechero cerrado, no compre animales a menos que sean provenientes de hatos libres de la enfermedad y que lo puedan demostrar con registros de salud.


FIGAP - Exposición Internacional


Special Nutrients












