Hongos toxigénicos en maíz almacenado en bolsas de plástico herméticas
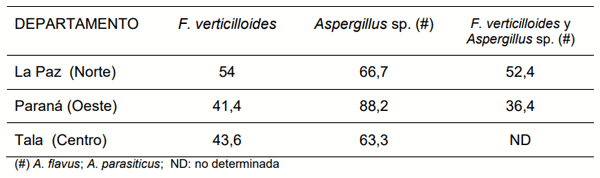
In Argentina, 35 million tonnes are stored in hermetic plastic bags. Inside the bags, the modified atmosphere has an effect on stored grains, insects and fungi. Fungal biota typically isolated from stored grains consists of species of the gender Aspergillus, Penicillium, Fusarium and xerophilic fungal, some of which are potential producers of mycotoxins. The province of Entre Rios, Argentina, is an important area of study because much of the production of maize stored in bags is demanded by the poultry industry. The objective of this study was to identify mycotoxigenic fungal species in corn stored in hermetic plastic bags, located in three Departments of Entre Rios province. A total of 176 samples of corn were analyzed, stored in 23 bags located in the Departments of Paraná (west region), La Paz (northern region) and Tala (central region). Two potential species producers of Aflatoxins (A. flavus and A. parasiticus) and a potential producer of Fumonisins (F. verticilloides) were identified in all the plastics bags evaluated. In La Paz Department, Aspergillus sp. was detected in 66,7% of samples analyzed and F. verticilloides in 54%. In Tala Department Aspergillus sp. were detected in 63,3% and F. verticilloides in 43,6%, while in Parana Aspergillus sp. was detected in 88,2% of the evaluated samples and F. verticilloides 41,4%. The results revealed that mycotoxigenic fungi, can develop in corn stored in hermetic plastic bags. This implies a potential risk of contamination with Aflatoxins and /or Fumonisins in the evaluated bags.
Key words: mycotoxigenic fungi, corn, silobag
2. METODOLOGÍA
2.2. Caracterización de la micobiota
3. RESULTADOS
4. DISCUSIÓN
- Cardoso, M.L, Bartosik, R, Rodriguez, J and Ochandio, D., 2008. Factors affecting carbon dioxide concentration of soybean stored in hermetic plastic bags (silo-bag). Proceedings of the 8th International Conference on Controlled atmosphere and fumigation in stored products. Chengdu.
- Christensen, C.M., 1987. Field and storage fungi. In: Beuchat LR, ed. Food and Beverage Mycology. New York, Van Nostrand Reinhold. Pp 211-232.
- Gerlach, W. and Nirenberg, H., 1982. The Genus Fusarium – a Pictorial Atlas. Berlin. 406 pp.
- Giorni, P., Battilani, P. and Magan, N., 2008. Effect of solute and matric potential on in vitro growth and sporulation of strains from a new population of Aspergillus flavus isolated in Italy. Fungal Ecology 1, 101-106.
- Hell, K., Cardwell, K.F., Setamou, M. and Poehling, H.M., 2000. The influence of storage practices on aflatoxin contamination in maize in four agroecological zones of Benin west Africa. Journal of Stored Products Research 36, 365-382.
- Lacey, J., 1989. Pre and post harvest ecology of fungi causing spoilage of foods and other stored products. J. of Apl. Bacteriol. Symposium Suplement, 11S25S.
- Lerda, D., Biaggi Bistoni, M., Peralta, N., Ychari, S., vazquez, M. and Bosio, G., 2005. Fumonisins in foods from Cordoba (Argentina), presence and genotoxicity. Food and Chemical Toxicology 43, 691-698.
- Lino, C.M., Silva, L.J., Pena, A., Fernández, M. and Mañes, J., 2007. Ocurrence of fumonisins B1 and B2 in broa, typical Portuguese maize bread. International Journal of Food Microbiology 118, 79-82.
- Logrieco A., Moretti, G., Perrone, G. and Mule, G., 2007. Biodiversity of complexes of mycotoxigenic fungal species associated with Fusarium ear rot of maize and Aspergillus rot of grape 119, 11-16.
- Moreno Cunha, E., Tironi García, G., Ono, M.A., Vizoni, E., Kawamura, O., Hirooka, E.Y., Sataque Ono, E.Y., 2009. Co-ocurrence of mycotoxins in corn samples from the Northern region of Paraná State, Brazil. Food Chemistry 116, 220-226.
- Pacin, A.M., Bovier, E.C., González, H.L., Whitechurch, E.M., Martínez, E.J. and Resnik, S., 2009. Fungal and fumonisins contamination in Argentine mayze (Zea mays L.) solo bags. Journal of Agricultural and Food Chemistry 57, 2778- 2781.
- Pitt, J. and Hocking,A.D., 1997. Fungi and food spoilage.London. UK: Blackie Academic & Professional.
- Rodriguez, J, Bartosik, R, Cardoso, ML and Croce, D., 2008. Factors affecting carbon dioxide concentration of weath stored in hermetic plastic bags (silo-bag). Proceedings of the 8th International Conference on Controlled atmosphere and fumigation in stored products. Chengdu.
- Samson, R.A., Hoekstra, E.S., Frisvad, J.C. and Filtenborg, O., 1995. Introduction to food-borne fungi. 4 ed. Centraalbureau voor Schimmelcultures. Baarn. Netherlands. 322 p.
- Voss, K.A., Smith, G.W. and Haschek, W.M., 2007. Fumonisins: Toxicokinetics, mechanism of action and toxicity. Animal feed Science and Technology 137, 299-325.
El trabajo sobre el relevamiento de los hongos toxigénicos en maíz en silo bolsa es bueno. Pero, creo que se debería haber relevado como estaba esa contaminación cuando los granos vinieron del campo y se depositaron en la bolsa. Cuál era la contaminación que ya tenían al entrar a la bolsa. Muchos de los hongos citados pueden contaminar a los granos de maíz en el campo. También me hubiese gustado saber el tiempo de almacenamiento y las condiciones ambientales en ese período de almacenamiento. Después, haber hecho énfasis en que las condiciones del maíz no eran las aconsejadas para este tipo de almacenamiento (granos con altos contenidos de humedad) y por último, el tipo y calidad física del maíz (impurezas, daños mecánicos y climáticos). No se tuvieron en cuenta muchos factores que pudieron afectar el desarrollo de los hongos, que eran independientes del tipo de almacenamiento. Haber aclarado que estos resultados, con esa calidad del maíz, hubiesen sido igual o peores en cualquier otro sistema de almacenamiento. Estas observaciones las hago, con todo respeto, en vista que este trabajo fue presentado en un congreso internacional en el extranjero y lleva a tener una visión poco favorable de esta tecnología en otros países.









