Uso de levadura (Pichia kudriavzevii) sola y en combinación con micotoxina y coccidiostático sobre el comportamiento productivo de pollos parrilleros
El objetivo de este trabajo fue evaluar la eficiencia in vivo de una cepa autóctona del medio ambiente aviar, Pichia kudriavzevii, para prevenir los efectos tóxicos de la aflatoxina B1 (AFB1) sola y en combinación con monensina (MON), sobre parámetros productivos en pollos parrilleros. Se utilizaron 120 pollos, 8 tratamientos, 3 réplicas, con 5 pollos por réplica (de un día de edad, Cobb). Las aves fueron alimentadas con una dieta iniciadora hasta el día 33 de edad. A partir de la dieta iniciadora se prepararon las diferentes dietas experimentales: tratamiento 1 (T1): dieta basal (DB); T2: dieta basal + monensina (50 mg/kg); T3: dieta basal + levadura (0,1%); T4: dieta basal + AFB1 (100 μg/kg); T5: dieta basal + monensina (50 mg/kg) + levadura (0,1%); T6: dieta basal + AFB1 (100 μg/ kg) + levadura (0,1%); T7: dieta basal + AFB1 (100 μg/kg) + monensina (50 mg/ kg) + levadura (0,1%); T8: dieta basal + AFB1 (100 μg/kg) + monensina (50 mg/ kg). Los resultados obtenidos de los parámetros productivos evaluados (ganancia media diaria (GMD), consumo medio diario (CMD) e índice de conversión (IC)) demostraron que la adición de la levadura mejoró significativamente la GMD y CMD, mientras que el IC no mostró diferencias significativas (p<0,05). Además, no se observaron diferencias significativas entre los tratamientos (p<0,05) para el peso de carcasa, pata muslo, pechuga, órganos inmunológicos y parámetros bioquímicos. Este estudio permitió concluir que Pichia kudriavzevii no presentó un efecto tóxico en las aves, demostrando además que su eficiencia para adsorber aflatoxina B1 no fue afectada por la presencia de monensina.
Palabras clave: bioadsorbente, aflatoxina B1, monensina, pollos parrilleros, parámetros productivos
MATERIALES Y MÉTODOS
RESULTADOS
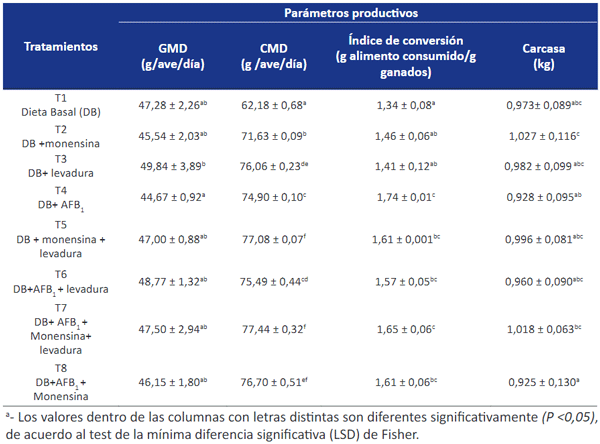
DISCUSIÓN
CONCLUSIÓN
1- Departamento de Producción Animal, Facultad de Agronomía y Veterinaria Universidad Nacional de Río Cuarto, Córdoba, Argentina.
2- Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET), Argentina.
3- Departamento de Microbiología e Inmunología, Facultad de Ciencias Exactas Físico Química y Naturales Universidad Nacional de Río Cuarto, Córdoba, Argentina.
4- Departamento de Química, Facultad de Ciencias Exactas Físico Química y Naturales Universidad Nacional de Río Cuarto, Córdoba, Argentina.
- Afzal, M. y Saleem, Z. 2004. Effects of addition of a mycotoxin detoxifier in poultry feed containing different levels of aflatoxins on the performance of broilers. Asian-Australian Journal of Animal Science 17: 990–994.
- Balzarini, M.G.; González, L.; Tablada, M.; Casanoves, F.; Di Renzo, J.A.; Robledo, C.W. 2008. Manual del usuario, editorial Brujas, Córdoba, Argentina, InfoStat 2008.
- Bhat, R.; Rai, R.V.; Karim, A. 2010. Mycotoxins in food and feed: present status and future concerns. Comprehensive Reviews in Food Science and Food Safety 9: 57–8.
- CAST (Council for Agricultural Science and Technology). 2003. Mycotoxins: Risks in plant, animal, and human systems. Task Force Report No. 139:13-85. Ames, Iowa. pp. 199.
- Celik, K.; Denli, M.; Erturk, M.; Ozturkcan, O.; Doran, F. 2001. Evaluation of dry yeast (SCE) in the feed to reduce AFB1 residues and toxicity to japonica quails. Journal Applied Animal Research 20: 245-250.
- Chiacchiera, S.M.; Magnoli, C.E.; Astorga, P.; Miazzo, R.; Combina, M.; Dalcero, A.M.; Kikot, E.; Basaldella, E. 2000. Use of synthetic zeolites to adsorb different mycotoxins, prevention of mycotoxicoses. Actualidad Fisicoquímica Organica 12: 218–236.
- Dusi, G. y Gamba, V. 1999. Liquid chromatography with ultraviolet detection of lasalocid, monensin, salinomycin and narasin in poultry feeds using pre-column derivation. J. Chromatogr. A 835: 243–246.
- Elliott, C.T.; Kenned, D.G.; McCaughey, W.J. 1998. Methods for the detection of polyether ionophore residues in poultry. Analyst 123: 45R–56R.
- Fraga, M.E.; Curvello, F.; Gatti, M.J.; Cavaglieri, L.R.; Dalcero, A.M.; Da Rocha Rosa, C.A. 2007.
- Potential aflatoxin and ochratoxin A production by Aspergillus species in poultry feed processing. Veterinary Research Communications 31: 343– 353.
- Gray, S.J.; Ward, T.L.; Southern, L.L.; Ingram, D.R. 1998. Interactive effects of sodium bentonite and coccidiosis with monensin or salinomycin in chicks. Poultry Science 77:600–604.
- Gutleba, A.C.; Caloni, F.; Girauda, F.; Cortinovis, C.; Pizzo, F.; Hoffmanna, L.; Bohna, T.; Pasquali, M. 2015. Detection of multiple mycotoxin occurrences in soy animal feed by traditional mycological identification combined with molecular species identification. Toxicology Reports 2: 275–279.
- Hashmi, I.; Pahsa, T.N.; Jabbar, M.A.; Arkam, M.; Hashmi, A.S. 2006. Study of adsorption potential of yeast sludge against AF in broiler chicks. Journal of Animal and Plant Sciences 16: 12–14.
- Juan-juan, L.; De-cheng, S.; Xiao-ou, S. 2010. Binding capacity for AFB1 by different adsorbents. Agricultural Sciences China 9: 449–456.
- Lamelas, K.; Mair, G.; Beczkowski, G. 2010. Evolución del sector Avícola año 2009, perspectiva 2010. Boletín avícola 58:1–26 Ministerio de Agricultura, Ganadería, Pesca y Alimentación. Acceso Marz. http://www.minagri.gob.ar.
- Magnoli, A.P.; Monge, M.P.; Miazzo, R.D.; Cavaglieri, L.R.; Magnoli, C.E.; Merkis, C.I.; Cristofolini, A.L.; Dalcero, A.M.; Chiacchiera, S.M. 2011a. Effect of low levels of aflatoxin B1 on performance, biochemical parameters, and aflatoxin B1 in broiler liver tissues in the presence of monensin and sodium bentonite. Poultry Science 90: 48–58.
- Magnoli, A.P.; Texeira, M.; Rosa, C.A.R.; Miazzo, R.D.; Cavaglieri, L.R.; Magnoli, C.E. 2011b. Sodium bentonite and monensin under chronic aflatoxicosis in broiler chickens. Poultry Science 90: 352–357.
- Magnoli, A.P.; Rodriguez, M.C.; Poloni, V.L.; Rojo, M.C.; Combina, M.; Chiacchiera, S.M.; Dalcero, A.M.; Cavaglieri, L.R. 2016. Novel yeast isolated from broilers’ feedstuff, gut and faeces as aflatoxin B1 adsorbents. Journal Applied Microbiology Volume 121 (6): 1766-1776.
- Magnoli, A.P.; Rodriguez, M.C.; González Pereyra, M.L.; Poloni, V.L.; Peralta, M.F. Nilson, A.J.; Miazzo, R.D.; Bagnis, G.; Chiacchiera, S.M.; Cavaglieri, L.R. 2017. Use of yeast (Pichia kudriavzevii) as a novel feed additive to ameliorate the effects of aflatoxin B1 on broiler chicken performance. Mycotoxin Research 33 (4): 273-283.
- Manafi, M.; Hedayati, M.; Yari, M. 2014. Aflatoxicosis and herbal detoxification: the effectiveness of thyme essence on performance parameters and antibody titers of commercial broilers fed aflatoxin B1. Research Zoological 4 (2): 43–50.
- Miazzo, R.D.; Rosa, R.C.A.; Carvalho, E.C.Q.; Magnoli, C.E.; Chiacchiera, S.M.; Palacio, G.; Saenz, M.; Kikot, A.; Basaldella, E.; Dalcero, A. 2000. Efficacy of synthetic zeolite to reduce the toxicity of aflatoxin in broiler chicks. Poultry Science 79: 1–6.
- Miazzo, R.D.; Peralta, M.F.; Magnoli, C.E.; Salvano, M.; Ferrero, S.; Chiacchiera, S.M.; Carvalho, E.C.Q.; Rosa, C.A.; Dalcero, A. 2005. Efficacy of sodium bentonite as a detoxifier of broiler feed contaminated with aflatoxin and fumonisin. Poultry Science 84: 1–8.
- Monge, M.P.; Dalcero, A.M.; Magnoli, C.E.; Chiacchiera, S.M. 2013. Natural co-occurrence of fungi and mycotoxins in poultry feeds from Entre Ríos, Argentina. Food Additives and Contaminants Part B: Surveillance 6: 168–174.
- Motawe, H.F.A.; Abdel Salam, A.F.; El Meleigy, K.H.M. 2014. Reducing the toxicity of aflatoxin in broiler chickens’ diet by using probiotic and yeast. International Journal Poultry Science 13 (7): 397–407.
- Nacional Research Council, (NRC) 1994 Nutrient requirements of chickens. En: Nutrient requirements of poultry. 8th rev. ed. National Academy Press, Washington DC 11–15.
- Nemati, Z.; Janmohammadi, H.; Taghizadeh, A.; Maleki, H.; Nejad Mogaddam, G.H.; Arzanlou, M. 2014a. Occurrence of aflatoxins in poultry feed and feed ingredients from north western Iran. European Journal of Zoological Research 3: 56– 60.
- Nemati, Z.; Janmohammadi, H.; Taghizadeh, A.; Moghaddam, G.H.; Maleki Nejad, H. 2014b. Effect of bentonite supplementation to the contaminated diets with aflatoxin B1 on broiler performance. presented at the 6th Iranian congress on animal science, Tabriz.
- Nemati, Z.; Karimi, A.; Besharati, M. 2015. Impact of aflatoxin contaminnated feed and yeast cell wall suplementation on immune system in broiler chickens Intl Conf. International Conference on Innovations in Chemical and Agricultural Engineering (ICICAE’2015) Feb. 8–9, 2015 Kuala Lumpur.
- Oğuz, H.; Kececi, T.; Birdane, Y.O.; Onder, F.; Kurtoglu, V. 2000a. Effect of clinoptilolite on serum biochemical and haematological characters of broiler chickens during experimental aflatoxicosis. Research in Veterinary Science 69: 89–93.
- Oğuz, H.; Kurtoglu, V.; Coskun, B. 2000b. Preventive efficacy of clinoptilolite in broiler during chronic aflatoxin (50 and 100 ppb) exposure. Research in Veterinary Science 69: 197–201.
- Oliveira, G.R.; Ribeiro, J.M.; Fraga, M.E.; Cavaglieri, L.R.; Direito, G.M.; Keller, K.M.; Dalcero, A.M.; Rosa, C.A. 2006. Mycobiota in poultry feeds and natural occurrence of aflatoxins, fumonisins and zearalenone in the Rio de Janeiro State, Brazil. Mycopathologia 162: 355–362.
- Schwarz, S.; Kehrenberg, C.; Walsh, T.R. 2001. Use of antimicrobial agents in veterinary medicine and food animal production. International Journal of Antimicrobial. Agents 17: 431–437.
- Sur, E. y Celik, I. 2003. Effects of aflatoxin B1 on the development of the bursa of Fabricius and blood lymphocyte acid phosphatase of the chicken. British Poultry Science 44: 558–566.
- Trucksess, M.W.; Stack, M.E.; Nesheim, S.; Albert, R.; Romer, T. 1994. Multifunctional column coupled with liquid chromatography for determination of aflatoxins B1, B2, G1 and G2 in corn, almonds. Brazil nuts, peanuts, and pistachio nuts: collaborative study. Journal AOAC Int 77: 1512–1521.
- Yiannikouris, A.; Poughon, L.; Cameleyre, X.; Dussap, C.G.; Francüois, J.; Bertin, G.; Jouany, J.P. 2003. A novel technique to evaluate interactions between Saccharomyces cerevisiae cell wall and mycotoxins: application to zearalenone. Biotechnology Letters 25: 783–789.
- Yiannikouris, A.; François, J.; Poughon, L.; Dussap, C.G.; Bertin, G.; Jeminet, G.; Jouany, J.P. 2004. Alkali-extraction of b-D-glucans from Saccharomyces cerevisiae cell wall and study of their adsorptive properties toward zearalenone. Journal of Agricultural and Food Chemistry 52: 3666–3673.
- Zain, M.E. 2011. Impact of mycotoxins on humans and animals. Journal of Saudi Chemical Society 15: 129–144.



Estados Unidos de América

Estados Unidos de América




