Enzima ß-mananasa en dietas de vacas
Suplementación con ß-mananasa en dietas de vacas Jersey en una lechería de altura en Costa Rica
Se evaluó el efecto de la inclusión de β -mananasa en alimentos balanceados para vacas lecheras en lactación temprana en una finca comercial en la zona de Oreamuno de Cartago, Costa Rica. Se utilizaron 27 vacas Jersey en pastoreo, distribuidas con base en producción de leche, días en lactación y número de lactancia en 3 grupos experimentales: 0%, 0,1% y 0,2% de inclusión de la enzima β-mananasa en el alimento balanceado. Las variables analizadas fueron: producción de leche (kg/día), leche corregida a 4% de grasa, porcentaje de sólidos totales (grasa, proteína, lactosa, minerales), contenido de células somáticas (cs/ml), calcio (Ca), fósforo (P), magnesio (Mg) y nitrógeno ureico en leche (NUL). Se realizó un análisis de medidas repetidas con un modelo linear mixto analizado con el software estadístico SAS y una prueba de Tukey para determinar la significancia (p<0.05) de los posibles efectos del uso de la enzima β-mananasa. No se encontraron diferencias significativas para ninguna de las variables evaluadas (p˃0.05), esto asociado al bajo contenido de manano-oligosacáridos de la dieta experimental (21,12-29,46 g/animal/día). Por lo tanto, se concluye que, bajo las condiciones de este experimento, no se observó ningún efecto de la inclusión de la enzima β-mananasa en la dieta de vacas Jersey en lactancia temprana.
Palabras clave: enzimas, manano-oligosacáridos, producción, calidad de leche, minerales.
INTRODUCCIÓN
MATERIALES Y MÉTODOS
Ubicación del experimento
Diseño del experimento, animales y dietas
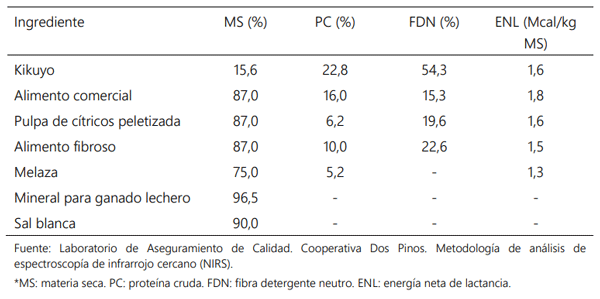
Variables evaluadas
Análisis de la información
RESULTADOS Y DISCUSIÓN
Producción y calidad de leche
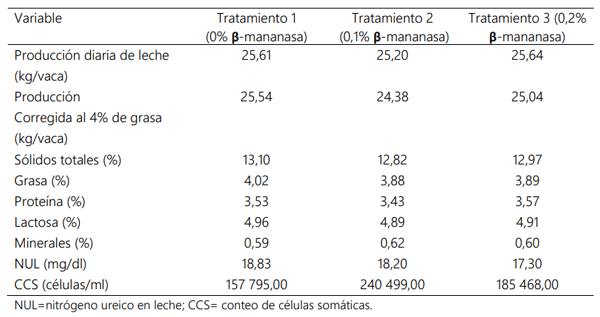
Contenido mineral de la leche

CONSIDERACIONES FINALES
AGRADECIMIENTOS
Arriola, K. G., S. Kim, C. Staples, y A. Adesogan. 2011. Effect of fibrolytic enzymes application to low-and high-concentrate diet in the performance of lactating dairy cattle. Journal of Dairy Science, 94: 832-841. doi: 10.3168/jds.2010-3424.
Arriola, K. G., A. Oliveira, X. Ma, I. Lean, M. Giurcanu, y A. Adesogan. 2017. A meta-analysis on the effect of dietary application of exogenous fibrolytic enzymes on the performance of dairy cows. Journal of Dairy Science, 100: 4513-4527. doi: https://doi.org/10.3168/jds.2016-12103.
Beauchemin, K., S. Jones, L. Rode, y V. Sewalt. 1997. Effects of fibrolytic enzyme in corn or barley diets on performance and carcass characteristics of feedlot cattle. Canadian Journal of Animal Science, 77:645-653. ISSN: 0008-3984.
Beauchemin, K. A., y L. Holtshausen. 2010. Developments in enzyme usage in ruminants. 2nd ed. CAB Int., Wallingford, UK. doi: 10.1079/9781845936747.0206.
Bedford, M., y G. Partridge. 2011. Enzymes in farm animal nutrition. 2nd Edition. CAB International. United Kingdom. 330 pp. ISBN: 1845936744.
Castillo, M., S.M. Martín-Orúe, J.A. Taylor-Pickard, J.F. Pérez y J. Gasa. 2008. Use of mannanoligosaccharides and zinc chelate as growth promoters and diarrhea preventative in weaning pigs: Effects on microbiota and gut function. Journal of Animal Science, 86(1):94-101. doi: 10.2527/jas.2005-686.
Cho J., y I. Kim. 2013. Effect of beta-mannanase supplementation in combination with low and high energy dense diets for growing and finishing broilers. Livestock Science, 154:137-143. doi: 10.1016/j.livsci.2013.03.004.
Durr, J. W., R. Cue, H. Monardes, J. Moro-Mendez, y K. Wade. 2008. Milk losses associated with somatic cell counts per breed, parity and stage of lactation in Canadian dairy cattle. Livestock Science, 117 (2-3): 225-232. doi: 10.1016/j.livsci.2007.12.004.
Gaines, W.L. 1928. The energy basis for measuring milk yield in dairy cows. Illinois Agricultural Experimental Station Bulletin 308. University of Illinois Agricultural Experiment Station, Urbana. 40 p.
Gonzáles, J. 2014. Relación del valor de urea en leche con parámetros reproductivos y productivos en animales Holstein, Jersey y sus cruces en diferentes proporciones en Costa Rica. Tesis presentada para optar por el título en el grado académico de Licenciatura en Ingeniería Agronómica con énfasis en Zootecnia. Universidad de Costa Rica. San José. Costa Rica. 39 pp.
Gutiérrez, L. 2015. Análisis de la competitividad del sector lácteo costarricense: Visión de la cámara nacional de productores de leche. Memorias Congreso Nacional Lechero 2015. Costa Rica.
Hristov, A., T. Mcallister, y K. Cheng. 1998. Effect of dietary or abomasal supplementation of exogenous polysaccharide-degrading enzymes on rumen fermentation and nutrient digestibility. Journal of Animal Science, 76:3146-3156. doi: 10.2527/1998.76123146x.
Huang, J., C. Chen, C. Huang, T. Huang, T. Wu, Y. Cheng, T. Ko, C. Lin, J. Liu, y R. Guo. 2014. Improving the specific activity of β-mannanase from Aspergillus niger BK01 by estucture-based rational design. Biochimica et Biophysica Acta (BBA), 1844: 663-669. doi: 10.1016/j.bbapap.2014.01.011.
Ishler, V. 2008. Interpretation of milk urea nitrogen values. Pennstate University. Cooperative Extention. Disponible en: http://extension.psu.edu/animals/dairy/nutrientmanagement/certifieddairy/tools/interpret-mun-values-08134.pdf
Kim, J., S. Ingale, S. Lee, K. Kim, J. Kim, J. Lee, y B. Chae. 2013. Effects of energy levels of diet and β–mannanase supplementation on growth performance, apparent total tract digestibility and blood metabolites in growing pigs. Animal Feed Science and Technology, 186: 64-70. doi: 10.1016/j.anifeedsci.2013.08.008.
Kogan, G. y A. Kocher. 2007. Role of yeast cell wall polysaccharides in pig nutrition and health protection. Livestock Science, 109: 161–165. doi: 10.1016/j.livsci.2007.01.134.
Kong, C., J. Lee, y O. Adeola. 2011. Supplementation of β-mannanase to starter and grower diets for broilers. Canadian Journal of Animal Science, 91 (3): 389- 397. doi: 10.4141/CJAS10066.
Lee, J., J. Seo, J. Jung, J. Lee, J. Lee, y S. Seo. 2014. Effects of β–mannanase supplementation on growth performance, nutrient digestibility, and nitrogen utilization of Korean native goat (Capra hircus coreanae). Livestock Science,169: 83-87. doi: 10.1016/j.livsci.2014.08.018
Li, Y., X. Chen, Y. Chen, Z. Li, y Y. Cao. 2010. Effects of β-mannanase expressed by Pichia pastoris in corn-soybean meal diets on broiler performance, nutrient digestibility, energy utilization and immunoglobulin levels. Animal Feed Science Technology, 159: 59-67. doi: 10.1016/j.anifeedsci.2010.05.001.
Martínez, M., C. Bostvironnois, V. Naranjo, y K. Pulsen. 2013. El uso de la beta-mananasa para controlar el impacto de respuesta inmunitaria inducida por alimentos y sus implicaciones en la avicultura comercial. 50 Congreso Científico de Avicultura. Simposio WPSA-AECA. España. 5 pp.
Morgavi, D., K. Beauchemin, V. Nsereko, L. Rode, T. Mcallister, A. Iwaasa, Y. Wang, y W. Yang. 2001. Resistance of feed enzymes to protealytic inactivavation by rumen microorganismos and gastointestinal proteases. Journal of Animal Science, 79 (6): 1621-1630. doi: 10.2527/2001.7961621x.
Nabté, L. 2009. Effect of β-mannanase enzyme addition to soy-containing milk replacers on growth and health of neonatal dairy calves. Thesis presented for the Degree of Master of Science. Cornell University. USA. 105 pp.
Navarrete, C. 2008. Implementación y modificaciones del método para determinar la fibra soluble en detergente neutro. Tesis presentada para optar por el grado de Master en Producción Animal. Universidad Politécnica de Valencia. Valencia, España. 45 pp.
Nochta, L., V. Halas, J. Tossenberger, y L. Babinszky. 2010. Effect of different levels of mannanoligosaccharide supplementation on the apparent ileal digestibility of nutrients, Nbalance and growth performance of weaned piglets. Journal of Animal Physiology and Animal Nutrition, 94 (6): 747-56. doi: 10.1111/j.1439-0396.2009.00957.x.
Peters, A., U. Meyer, y S. Dänicke. 2015. Effect of exogenous fibrolytic enzymes on performance and blood profile in early and mid-lactation Holstein cows. Animal Nutrition, 1 (3): 229-238. doi: 10.1016/j.aninu.2015.09.001.
Roque, B. M., G. Reyes, T. Tewoldebrhan, J. Apphuamy, J. Lee, S. Seo, y E. Kebreab. 2019. Exogenous β-mannanase supplementation improved immunological and metabolic responses in lactating dairy cows. Journal of Dairy Science, 102: 4198-4204. doi: 10.3168/jds.2018-15568.
SAS Institute. 2004. SAS Institute. SAS User's Guide: Statistics. Version 8 ed. SAS Institute, Inc, Cary, NC. USA.
Tewoldebrhan, T. A., J. Appuhamy, J. Lee, M. Niu, S. Seo, S. Jeong, y E. Kebreab. 2017. Exogenous beta-mannanase improves feed conversion efficiency and reduces somatic cell count in dairy cattle. Journal of Dairy Science, 100 (1): 244-252. doi: 10.3168/jds.2016-11017.
Tirado-González, D. N., L. Miranda-Romero, A. Ruíz-Flores, S. Medina-Cuéllar, R. RamírezValverde, y G. Tirado-Estrada. 2018. Meta-analysis: Effects of exogenous fibrolytic enzymes in ruminant diets. Journal Apply of Animal Research, 46: 771-783. doi: 10.1080/09712119.2017.1399135.
Vargas, O. 2014. Efecto de dos niveles de proteína cruda y suplementación con hidroxianálogo de metionina en el desempeño productivo de vacas lecheras. Tesis presentada para optar por el título en el grado académico de Licenciatura en Ingeniería Agronómica con énfasis en Zootecnia. Universidad de Costa Rica. San José. Costa Rica. 37 pp.
Wallace, R., S. Wallace, N. Mckain, V. Nsereko, y F. Hartnell. 2001. Influence of supplementary fibrolytic enzymes on the fermentation of corn and grass silages by mixed ruminal microorganismos in vitro. Journal of Animal Science, 79 (7): 1905-1916. doi: 10.2527/2001.7971905x.
Wu, G., M. Bryant, R. Voitle, y D. Roland. 2005. Effects of β-mannanase in corn-soy diets on commercial leghorns in second-cycle hens. Poultry Science, 84 (6): 894-897. doi: 10.1093/ps/84.6.894.
Yang, W., K. Beauchemin, y L. Rode. 2000. A comparison of methods of adding fibrolytic enzymes to lactating cows diets. Journal of Dairy Science, 83: 2512-2520. doi: 10.3168/jds.S0022-0302(00)75143-5.
Zyl, W., S. Rose, K. Trollope, y J. Gorgens. 2010. Fungal -mannanases: Mannan hydrolysis, heterologous production and biotechnological applications. Process Biochemistry Journal, 45: 1203-1213. doi: 10.1016/j.procbio.2010.05.011.



Pensando en voz alta:
Por otro lado las fuentes de manasa son diferentes especies de bacterias cultivadas. ¿Hay diferencia de acción entre especies?
LOS FORRAJES PASTURAS ¿Cuánto MANANO contienen para que la enzima Manasa actúe?
El tema de las enzimas en nutrición de vacas lecheras y su acción en los diferentes substratos que componen una dieta, es ampliamente discutido en la literatura, y no ha tenido el impacto que si lo ha tenido en otras especies no rumiantes.
Seria interesante ver su eficacia en la preparación de henos, desde que pH's bajos eliminaría la posibilidad de emplearlo en la producción de ensilajes.











