Recuento de celulas somaticas en leche de tanque y ubres en vacas de raza carora en sistemas de pastoreo y estabulación
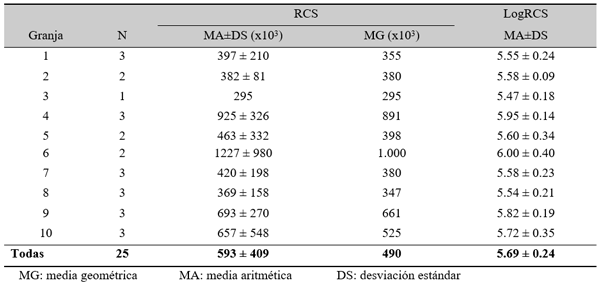
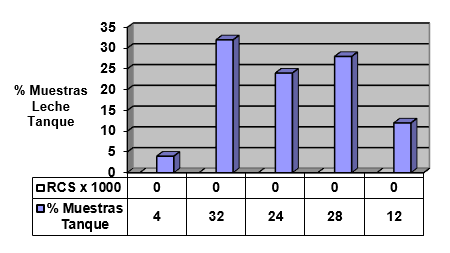
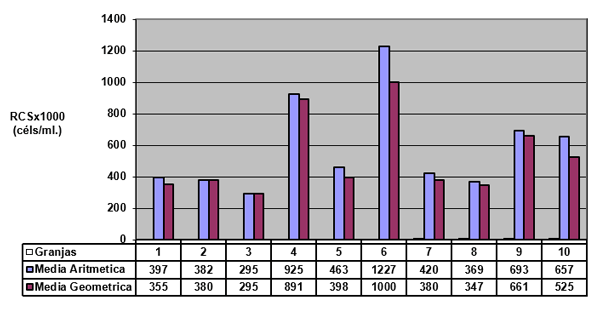
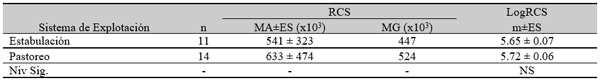
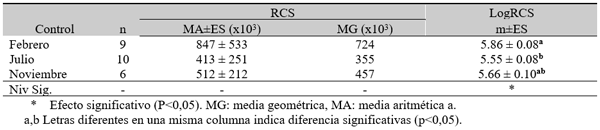
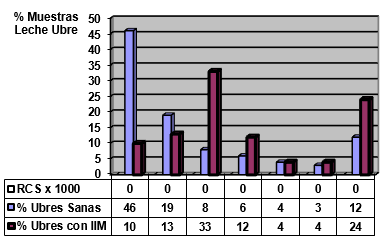
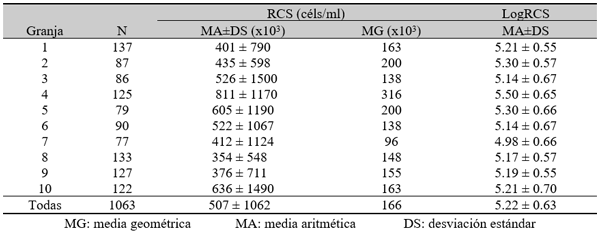
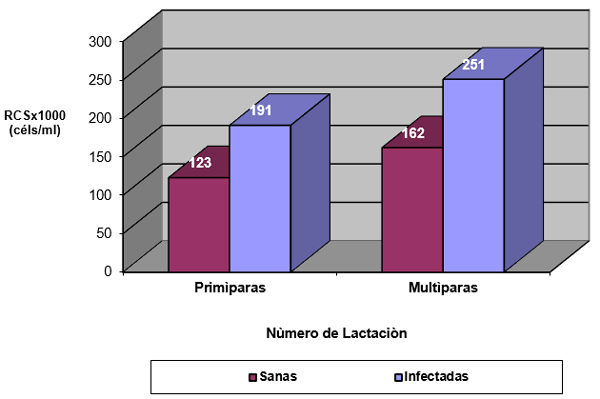
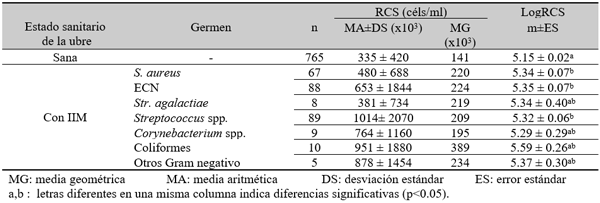
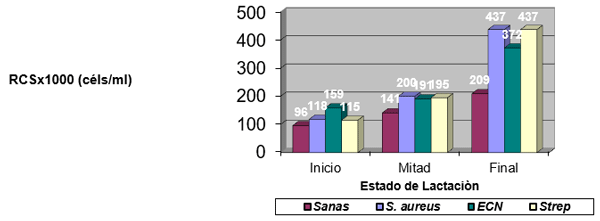
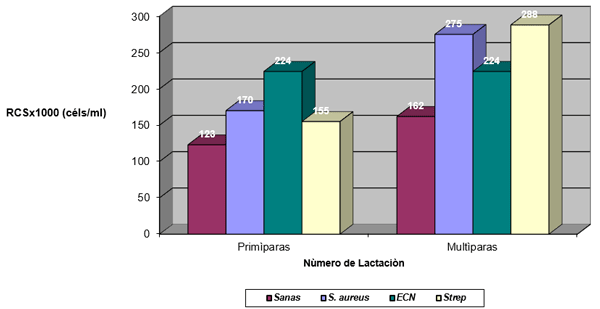
El experimento se llevó a cabo en 10 explotaciones pertenecientes a la Asociación Venezolana de Criadores de Ganado Carora (ASOCRICA). En la mitad de ellas las vacas estaban estabuladas permanentemente, mientras que en la otra mitad los animales estaban en pastoreo. Todas las explotaciones elegidas tenían más de 80 vacas. El diseño experimental consistió en realizar tres controles (Febrero-Marzo, Junio-Julio, Noviembre) en cada explotación, de modo que en cada uno de ellos se tomaron 51 muestras de leche de ubre y una muestra de leche del tanque. Las 51 vacas muestreadas en cada control fueron elegidas según su número de lactación (primíparas y multíparas) y estado de lactación (Inicio: 7-100 d; Mitad: 101-200 d; Final >201 d) del siguiente modo: a) 21 vacas primíparas, de las cuales 7, 7 y 7 estaban al Inicio, Mitad y Final de la lactación, respectivamente; b) 30 vacas multíparas, de las cuales 10, 10 y 10 estaban al Inicio, Mitad y Final de la lactación, respectivamente. En el primer control los animales fueron elegidos al azar, de entre todos los que reunían las características de número y estado de lactación especificados anteriormente. En los siguientes dos controles fue necesario incorporar nuevos animales para mantener el plan de muestreo descrito. En total se tomaron 1530 muestras de leche individual procedentes de 958 vacas (406 primíparas y 552 multíparas). Para cada animal se registró la siguiente variable en cada control: Las medias aritméticas y geométricas del RCS en la leche de tanque fueron de 593.000 y 490.000 céls/ml, respectivamente. Tan solo el 36 % de las muestras analizadas tuvieron recuentos inferiores a 400.000 céls/ml, y solamente en 6 explotaciones, de las 10 muestreadas, la media geométrica de los recuentos fueron inferiores a 400.000 céls/ml. El factor control o época del año afectó significativamente al RCS en la leche de tanque, obteniéndose valores más elevados en el control de Febrero (847.000 céls/ml) respecto a los controles de Julio (413.000 céls/ml) y Noviembre (512.000 céls/ml). El Sistema de Explotación (Pastoreo vs. Estabulación permanente) no llegó a afectar significativamente al RCS en la leche de tanque. El principal factor que influyó sobre el RCS en leche de ubre fue el Estado de Lactación, de modo que, tanto en las ubres sanas como en las infectadas, los recuentos aumentaron significativamente al avanzar la lactación (Inicio, Mitad y Final). En las ubres sanas los recuentos fueron significativamente inferiores en las vacas primíparas respecto a las multíparas, y en el control de Julio respecto a los otros dos controles (Febrero y Noviembre); en las ubres infectadas se observaron las mismas tendencias, pero ambos factores (Número de Lactación y Control) no llegaron a tener un efecto significativo. El Sistema de Explotación y la interacción Estado de Lactación x Número de Lactación no afectaron significativamente a los recuentos. La presencia de infección intramamaria (IIM) elevó significativamente el RCS en leche ubre. En las ubres sanas las medias aritméticas y geométricas del RCS fueron de 335.000 y 141.000 céls/ml, mientras que los valores respectivos en las ubres infectadas fueron de 737.000 y 219.000 céls/ml. Las interacciones del Estado Sanitario de la ubre con el Estado de Lactación y con el Número de Lactación no resultaron significativas. Cada uno de los grupos de gérmenes aislados ocasionó una respuesta inflamatoria muy variable, de modo que los recuentos no llegaron a diferir significativamente entre estos grupos. Solamente en aquellos gérmenes que fueron aislados con mayor frecuencia (S. aureus, ECN y Streptococcus spp) el RCS a nivel de ubre llegó a diferir significativamente respecto a las ubres sanas.
Palabras Claves: RCS, RCST, RCSU IIM, Mastitis subclínica, estado de lactación, pastoreo, estabulación, Raza Carora.
Introducción
Materiales y métodos

Número de vacas muestreadas en cada recuento de células somáticas
Variables registradas
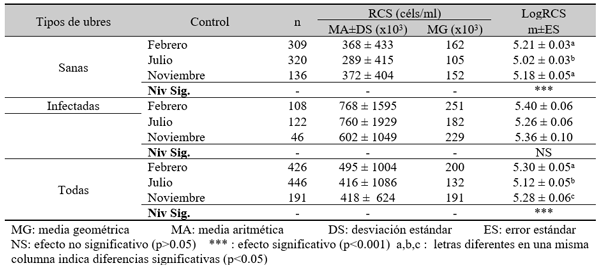
RCS en leche de tanque
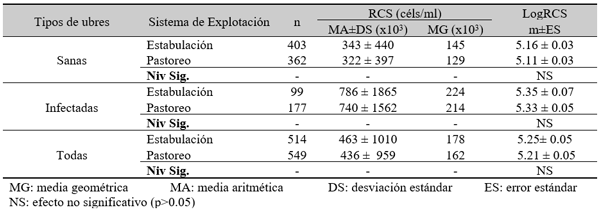
RCS en leche de ubre
Factores no infecciosos
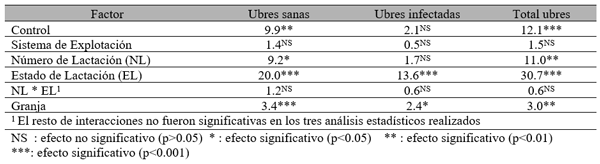
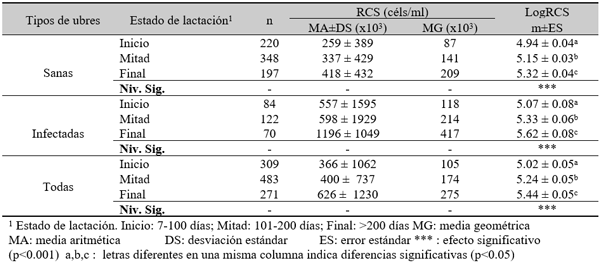
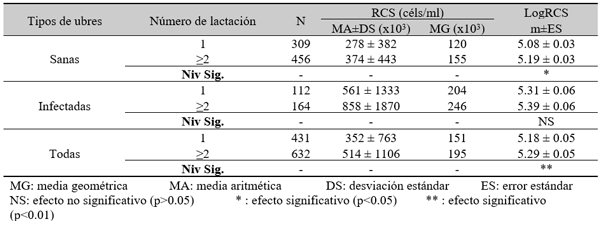
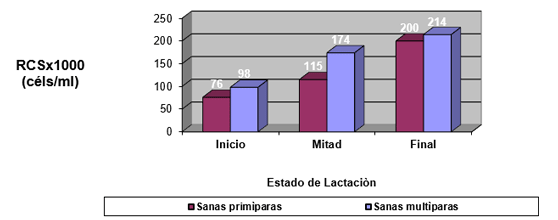
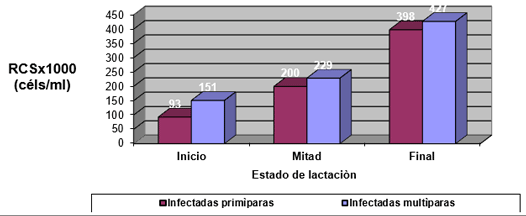
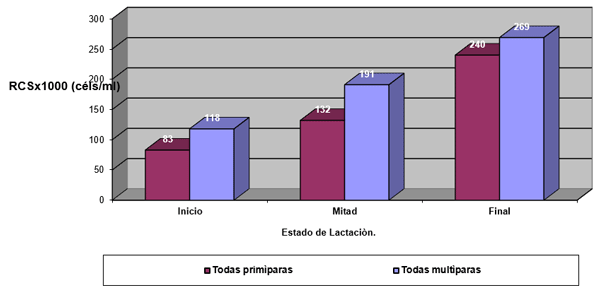
Efecto de la infección intramamaria.

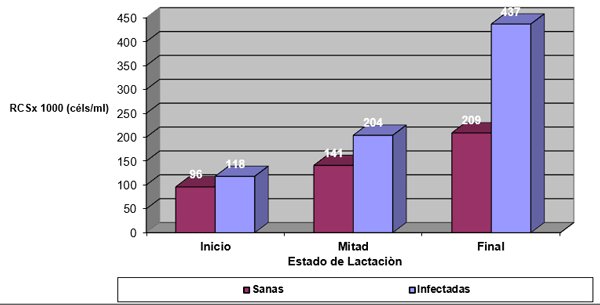
DISCUSIÓN
RCS en leche de tanque
RCS en muestras de leche individual
AGRADECIMIENTOS:
[1] BARKEMA, H.W., OLDE RIEKERINK, R. G. M., STRYHN, H., SCHUKKEN, Y. H.The effect of season of bulk milk somatic cell count and incidence rate of clinical mastitis . Mastitis in dairy production. Pp 941. 2005.
[2] BERRY, D. P., O’BRIEN, B., O’CALLAGHAN, E. J., SULLIVAN, K. O., W. J. MEANEY, W. J. Temporal Trends in Bulk Tank Somatic Cell Count and Total Bacterial Count in Irish Dairy Herds During the Past Decade. J. Dairy Sci. 89:4083-4093. 2006.
[3] BOUMAN, M., BIANCO, R., GIANNEECHINI, E., HIRIGOYEN, D., DE TORRES, E. Mastitis control in Uruguay: Strengths and weaknesses. Mastitis in dairy production. Pp 703-708. 2005b.
[4] CURBELO, R. J. Relación entre el Recuento de Células Somáticas y prácticas de manejo de patógenos causantes de mastitis en hatos lecheros de Puerto Rico. (Tesis Maestro en Ciencias Industrias Pecuarias). Universidad de Puerto Rico de Mayaguez. 2007.
[5] DJABRI, B., BAREILLE, N., BEAUDEAU, F., SEEGERS, H. Quarter milk somatic cell count in infected dairy cows: a meta-analysis. Vet. Res. 33: 335–357. 2002
[6] GREEN, M.J., BRADLEY, A.J., NEWTON, H., BROWNE, W.J. Seasonal variation of bulk milk somatic cell counts in UK dairy herds: Investigations of the summer rise. Preventive Veterinary Medicine 74: 293–308. 2006.
[7] HARMON, R.J. ¿Physiology of mastitis and factors affecting somatic cell counts?. J. Dairy Sci. 77:2103-2112. 1994.
[8] HOGAN, J.S., SMITH, K.L., HOBLET, K.H., SCHOENBERGER, P.S., TODHUNTER, D.A., HUESTON, W.D., PRITCHARD, D.E., BOWMAN, G.L., HEIDER, L.E., BROCKETT, B.L., CONRAD, H.R.. Field survey of mastitis in low somatic cell count herds. J. Dairy Sci. 72: 1547-1556. 1989.
[9] JAYARAO, B.M., PILLAI, S.R., SAWANT, A.A., WOLFGANG, D.R., HEGDE, N.V. Guidelines for monitoring bulk tank milk somatic cell count and bacterial counts. J. Dairy Sci. 87:3561-3573. 2004.
[10] KRUZE, J. Milk production and mastitis control in emerging dairy countries: the experience in Chile. Mastitis in dairy production. Pp 123-128. 2005.
[11] LAEVENS, H., DELUKER, H., SCHUKKEN, Y.H., DE MEULEMEESTER, L., VANDERMEERSCH, R., DE MUELENAERE, E., DE KRUIF, A. Influence of parity and stage of lactation on the somatic cell count in bacteriologically negative dairy cows. J. Dairy Sci. 80, 3219–3226. 1997
[12] LAM, T.J.G.M., OLDE RIEKERINK, R.G.M., SAMPIMON, O.C., SMITH, H. Mastitis diagnostics and performance monitoring: a practical approach. Irish Veterinary Journal. Volume 62 Supplement 34-39. 2009.
[13] LUKAS, J. M., RENEAU, J.K., KINSEL, M.L. Predicting Somatic Cell Count Standard Violations Based on Herd’s Bulk Tank Somatic Cells Count. Part. 1: Analizing variation. J. Dairy Sci. 91: 427-432. 2008
[14] MAKOVEC, J.A., RUEGG, P.L. Results of Milk Samples Submitted for Microbiological Examination in Wisconsin from 1994 to 2001. American Dairy Science Association J. Dairy Sci. 86:3466–3472. 2003.
[15] MORE. S.J. Global trends in milk quality: Implications for the Irish dairy industry. Irish Veterinary Journal, April 2009. Volume 62 Supplement 5-14. 2009.
[16] NIGHTINGALE, C., SCHUKKEN, Y. The importance of a low SCC premium policy in the reduction of population wide SCC levels. Mastitis in dairy production. Pp 558-563. 2005.
[17] NORMAN, H.D., MILLER, R.H., WRIGHT, J.R., WIGGANS, G.R. Herd and state means for somatic cell counts from dairy herd improvement. J. Dairy Sci., 83(12):2782-2788. 2000.
[18] OLDE-RIEKERINK, R.G.M., BARKEMA, H.W., STRYHN, H. The Effect of Season on Somatic Cell Count and the Incidence of Clinical Mastitis J. Dairy Sci. 90:1704-1715. 2007.
[19] OSTENSSON, K. Variations during lactation in total and differential leukocyte counts, N-acetyl-beta-Dglucosaminidase, antitrypsin and serum albumin in foremilk and residual milk from noninfected quarters in the bovine. Acta Vet Scand; 34(1):83-93. 1993.
[20] OSTERAS, O., SOLVEROD, L. Mastitis control Systems: The Norwegian experience. Mastitis in dairy production. Pp 91-100. 2005.
[21] PAAPE, M.J., SCHULTZE, W.D., MILLER, R.H., SMITH, J.W. Thermal stress and circulating erythrocytes, leucocytes, and milk somatic cells. J. Dairy Sci. 56:84. 1973.
[22] PAAPE, M.J., WIGGANS, G.R., BANNERMAN, D.D., THOMAS, D.L., SANDERS, A.H., CONTRERAS, A., MORONI, P., MILLER, R.H. Monitoring goat and sheep milk somatic cell counts. Small Ruminant Research. 68 1-2:114-125. 2007.
[23] PHILPOT, W.N., NICKERSON, S.C. Ganando la lucha contra la Mastitis. WESTFALIA SURGE, INC. NAPERVILLE, IL, USA. P. 28-37. 2002.
[24] PITKALA, A., HAVERL, M., PYÖRÄLÄ, S., MYLLYS, V., HONKANEN-BUZALSKI, T. Bovine mastitis in finland 2001-Prevalence, distribution of bacteria, and Antimicrobial Resistance. J. Dairy Sci. 87:2433-2441. 2004.
[25] POUTREL, B. La sensibilité aux mammites: revue des facteurs liés à la vache. Ann. Rech. Vet., 14, 89-104. 1983.
[26] RENEAU, J.K. Journal of Dairy Science. 69:1708 Effective use of dairy herd improvement somatic cells counts in mastitis control. J. Dairy Sci. 69: 1708-1720. 1986.
[27] RUPP, R., BEAUDEAU, D., BOICHARD. Relationship between milk somatic cell count in the first lactation and clinical mastitis occurrence in the second lactation of French Holstein cow. Prev. Vet. Med. 46: 99-111. 2000.
[28] SAMPIMON, O., SOL, J., KOCK, P. Changes in bulk milk somatic cell count and in mastitis pathogens over the past 50 years in the Netherlands. Mastitis in dairy production. Pp 963. 2005.
[29] SAMPIMON, O.C., BARKEMA, H.W., BERENDS, I.M.G.A., SOL, J., LAM, T.J.G.M., Prevalence and herd-level risk factors for intramammary infection with coagulase-negative staphylococci in dutch dairy herds. Veterinary Microbiology, 134: 37-44. 2009.
[30] SARGEANT, J.M., SCHUKKEN, Y.H., KENNETH, E.L. Ontario Bulk Milk Somatic Cell Count Reducing Program: Progress and Outlook. J. Dairy Sci. 81: 1545-1554. 1998.
[31] SCARAMELLI, A.M., FERRARO, L., TROYA, H. Recuento Electrónico de Células Somáticas aplicado a la detección de mastitis subclínica bovina en fincas lecheras de los estados Aragua y Carabobo Venezuela. Universidad Central de Venezuela, Facultad de Ciencias Veterinarias. Maracay, Edo. Aragua. 1999.
[32] SHELDRAKE, R.F., MCGREGOR, G.D., HOARE, R.J.T. Lactation stage, parity, and infection affecting somatic cells, electrical conductivity, and serum albumin in milk. J. Dairy Sci. 66: 542-547. 1983.
[33] SCHEPERS, A.J., LAM, T.J.G.M., SCHUKKEN, Y.H., WILMINK, J.B.M., HANEKAMP, W.J.A. Estimation of variance components for somatic cell counts to determine thresholds for uninfected quarters. Journal of Dairy Science. 80:1833-1840. 1997.
[34] SCHULTZ, L.H. Somatic cell counting of milk in production testing programs as a mastitis control technique. J.A.V.M.A. 170 (10), Part. 2: 1244-1246. 1977.
[35] SCHUKKEN, YNTE H., WILSON, D.J., WELCOME, F., GARRISON-TIKOFSKY, L., GONZALEZ, R.N. Monitoring udder health and milk quality using somatic cell counts. Vet. Res. 34 (2003) 579–596. 2003.
[36] SERIEYS, F. Interpretation des concentrations cellulaires du lait individual de vache pour le diagnostic de I´état d´infection mammaire. Annales de Recherches Véterinaires. 16(3):363-369. 1985.
[37] SERIEYS, F. Concentration cellulaire du lait individuel de vache: influence de l’état d’infection mammaire, du numéro, du stade de lactation et de la production laitiere. Ann Rech Vét 16(3):255-261. 1985.
[38] TENHAGEN, A., HANSEN, I., REINECKE, A., HEUWIESER, W. Prevalence of pathogens in milk samples of dairy cows with clinical mastitis and in heifers at first. 2008.
[39] VAN DER ZWAAG, H.G., VAN SCHAIK, G., LAM, J.G.M. Mastitis control program in the Netherlands: Goal, Tools and conditions. Mastitis in dairy production. Pp 599. 2005.
[40] VAN SCHAIK, G., LOTEM, M., SCHUKKEN, H. Trends in Somatic Cell Counts, Bacterial Counts, and Antibiotic Residue Violations in New York State During 1999-2000. J. Dairy Sci. 85: 782-789. 2002.
[41] WILSON, D.J., GONZALEZ, R.N., DAS, H.H. Bovine mastitis pathogens in new York and Pennsylvania: Prevalence and effects on Somatic Cell count and milk production. Quality Milk promotion services, cornell University, Ithaca, NY 14850. 1997
Saludos






.jpg&w=3840&q=75)