Introducción
Las dietas de los rumiantes con elevado contenido de proteína cruda rápidamente degradable en el rumen eleva la producción de amonio ruminal, el cual se absorbe y posteriormente metabolizado por el hígado en urea. La ureagénesis está conectada al ciclo de Krebs y a la gluconeogénesis hepática por medio de metabolitos como aspartato, oxalacetato, cetoglutarato y glutamato. Las elevadas concentraciones de amonio en el rumen generan una sobrecarga en la ureagénesis por la excesiva demanda de intermediarios del ciclo de la urea, los cuales provienen de precursores que son compartidos con el ciclo de Krebs y vía gluconeogénica. Así, el aumento en la producción de amonio ruminal compromete la capacidad hepática ureagénica, interfiriendo negativamente sobre la gluconeogénesis hepática y balance energético del animal.
Degradabilidad proteínica en rumiantes
El nitrógeno (N) presente en los alimentos que componen la dieta de los rumiantes se presenta en forma de proteínas, aminoácidos y compuestos nitrogenados no proteínicos (NNP). Entre estos últimos destacan la urea, sales de amonio, nitratos y ácidos nucleicos de origen vegetal o animal.1,2 En el rumen, gran parte de las proteínas rápidamente degradables (PRD) presentes en los alimentos son transformadas por amonificación a NNP, principalmente amonio (NH4+), resultante del proceso fermentativo bacteriano, sirviendo como principal fuente de N en la síntesis de proteína microbiana. El NH4+ es el principal producto de origen nitrogenado resultante del proceso fermentativo bacteriano y utilizado como la principal fuente de N para la síntesis de proteína microbiana.3
Cuando existe un desequilibrio entre la ingesta de energía y PRD, producto de un aporte limitado en energía o elevado de PRD, la concentración de NH4+ ruminal se incrementa ya que se excede la capacidad de la microbiota ruminal para utilizarlo; su acumulación alcaliniza el pH ruminal e incrementa la formación del amoníaco (NH3, [NH4+ + OH– <–> NH3 + H2O]).4,5 Por otro lado, el pH ruminal interfiere en la absorción del NH3 producido en el rumen; cuanto más alcalino el pH ruminal (superior a 7.5) mayor es la velocidad de absorción, debido a la mayor conversión de NH4+ en NH3, que es liposoluble y fácilmente absorbido por la pared ruminal.1,6 Valores de pH inferiores a 6.7, como sucede en animales alimentados con dietas de moderado a alto contenido de carbohidratos no estructurales, incrementan la formación de NH4+, el cual es hidrosoluble y, consecuentemente, presenta una lenta absorción ruminal.1,7 Es así que, en condiciones que favorezcan la alcalinización ruminal como ayuno, dietas con elevado contenido de fibra, o con bajo contenido de carbohidratos solubles, o la ingesta de NNP, predisponen al incremento de la absorción del NH3.8
Metabolismo del amonio
La concentración de NH4+ en el plasma se eleva rápidamente después de la ingestión del alimento, alcanzando un máximo a las 2 o 3 horas después de la alimentación, tiempo que varía según el tipo de alimento.9,10 Los rumiantes suplementados con NNP, como urea, presentan un pico en la producción de NH4+ ruminal en la primera hora posterior a la ración.11 El efecto tóxico del NH4 + en los mamíferos es controlado mediante un mecanismo de conversión por el hígado, a productos no tóxicos y de excreción.6,7,12 Después de la absorción, el NH4+ llega al hígado vía vena porta, donde gran parte se convierte en urea, compuesto 40 veces menos tóxico.1 El NH4+ restante, no metabolizado a urea, es incorporado a glutamina, que por contener dos grupos aminos sirve como transportador no tóxico del NH4+, favoreciendo su excreción en la orina.13
El hígado, por su heterogeneidad en morfología y características bioquímicas, presenta algunas particularidades en relación con el metabolismo del NH
4+. Los hepatocitos periportales, que primeramente reciben la sangre de la vena porta aferente, contienen las cinco enzimas ureagénicas, y la glutaminasa mitocondrial (glutamina
glutamato); además, son los responsables de la gluconeogénesis. Los hepatocitos perivenosos, que se distribuyen en torno a la vena eferente hepática, no presentan las enzimas ureagénicas ni la glutaminasa mitocondrial. Sin embargo, ellos poseen la enzima glutamina sintetasa citosólica (GS), que convierte glutamato en glutamina, y el transportador X
ag para el ingreso a la célula del glutamato y aspartato.
14–16Esta organización secuencial permite una eficiente metabolización y remoción del NH4+ circulante, ya que el NH4+ no metabolizado en los hepatocitos peri–portales llega a los hepatocitos perivenosos, donde es incorporado a glutamina. En términos funcionales, la ureagénesis y la síntesis de glutamina presentan diferencias; la ureagénesis es un sistema de baja afinidad y con alta capacidad desintoxidante para NH4+, mientras que la síntesis de glutamina presenta alta afinidad, pero baja capacidad para desintoxicar el NH4+. En concentraciones fisiológicas de NH4+ (200–300 µM/l), cerca de 2/3 del NH4+ es convertido en urea y 1/3 en glutamina.16 Estudios con la adición de NH4+ en hepatocitos ovinos demuestran una liberación semejante de N vía urea o glutamina.15
En rumiantes, la efectividad de la remoción del NH4+ como urea o como glutamina, asegura que aproximadamente 98% del NH4+ presente en la vena porta sea removido durante su paso por el hígado. De modo que esos sistemas son considerados vitales para la manutención de una baja amonemia en la sangre periférica.15
Ureagénesis
En los rumiantes de pastoreo, la ureagénesis es de particular importancia, ya que más del 60% de la urea plasmática puede ser originada del NH4+ ruminal, y hasta 98% del N dietético puede ser transformado en NH4+ en el rumen.17,18
La síntesis de la urea involucra una secuencia de reacciones bioquímicas, controladas por las enzimas ureagénicas. En mamíferos, el hígado es el único órgano que posee todas las enzimas necesarias para la ureagénesis, utilizando distintas fuentes de N para la formación de la urea por medio de condensación, deaminación y transaminación.12,17,19
La síntesis de 1 mol de urea requiere 1 mol de NH4+ y 1 N α–amino proveniente del aspartato; su costo energético varía dependiendo del origen del N, del balance de ATP y de nicotinamina adenina dinucleótido (NADH) producido durante la regeneración de oxalacetato a partir del malato citosólico generado del fumarato liberado por el ciclo de la urea.2,20,21
La síntesis de urea es un proceso cíclico donde la ornitina es consumida en la 2ª reacción y regenerada en la 5ª, propiciando que no ocurra pérdida neta o ganancia de citrulina, arginosuccinato o arginina. Entretanto, el NH4+, CO2 y aspartato son consumidos (Figura 1).12,19
Figura 1. Interacciones metabólicas entre ciclo de la urea, ciclo de Krebs y vía gluconeogénica en rumiantes. Adaptado de Visek 1979. PEP = fosfoenolpiruvato; PEPCK = fosfoenolpiruvato carboxiquinasa, EC = 4.1.1.32; FBPasa = Fructosa- 1,6 bisfosfatasa, EC: 3.1.3.11.
El primer paso para la síntesis de urea es la condensación de CO2, NH4+ y ATP para formar carbamoil fosfato (CbP), en la que un ATP sirve como fuente de energía. Esa reacción es catalizada por la CPS–I. La acción coordinada de la enzima auxiliar de la ureagénesis, glutamato deshidrogenasa (GD; EC: 1.4.1.2) junto con la CPS–I, transfiere el N para formar CbP producto intermediario, con elevado potencial de transferencia del NH4+ para el ciclo de la urea.12,19 Cuando la fuente del N (primer N) para la ureagénesis proviene del NH4+ ruminal sin formación de glutamato el costo energético es de 1 ATP, a su vez cuando proviene del glutamato el balance es positivo, de 2 ATP.
El próximo paso del ciclo es la catálisis del CbP, el cual se adiciona a la ornitina, por la enzima L–ornitina transcarbamoilasa (OTC; EC: 2.1.3.3), para formar citrulina. Esa reacción ocurre en la matriz mitocondrial, de donde emigra la citrulina al citosol. La citrulina se une al aspartato, vía el grupo amino, para formar arginosuccinato, reacción catalizada por la arginosuccinato sintetasa (AAS; EC: 6.3.4.5). En esa reacción, el aspartato dona el segundo N para la síntesis de urea, reacción que requiere un ATP.12,19 Por otro lado, el costo para la formación del aspartato es de 3 ATP cuando proviene de alanina (2 alanina + CO2 + 3ATP — 2 piruvato + urea + 2 ADP + 2Pi + AMP + PPi) o glutamina (glutamina + CO2 + NADH + 3 ATP — oxoglutarato + urea + NAD + 2 ADP + 2Pi + AMP + PPi).20
La reacción subsiguiente es un quiebre reversible, catalizado por la arginino succinasa, la cual retiene el N del arginosuccinato y libera el esqueleto del aspartato formando fumarato y arginina. La reacción final del ciclo de la urea es la división hidrolítica de la arginina catalizada por la arginasa (EC: 3.5.3.1) hepática, y la consecuente liberación de urea.19,22 El fumarato liberado queda disponible para formar oxalacetato en el ciclo de Krebs (Figura 1), ruta que forma 3 ATP.
Cuando ocurren desbalances en la disponibilidad de intermediarios del ciclo de la urea, disminuye la remoción del NH4+ y éste se acumula en los tejidos.7,12,23 Existen mecanismos específicos para reducir el riesgo de acumulación de NH4+, por ejemplo, en los hepatocitos periportales, la Keq de la GD mitocondrial favorece fuertemente la síntesis de glutamato a partir de NH4+ y de oxoglutarato. En la ureagénesis vía NH4+, el N amoniacal puede ingresar al ciclo de la urea tanto a través del N del CbP como del aspartato.21 Esta última vía de ingreso depende de la síntesis de glutamato a partir de NH4+, oxoglutarato, cetoglutarato y NADH. El glutamato probablemente es el principal donador del N–intermediario para aspartato.24 Esa acción de la GD, cuando se acopla al aspartato, vía AST (aspartato aminotransferasa; EC: 2.6.1.1), transfiere el NH4+ al aspartato mitocondrial, ruta importante cuando la extracción de éste excede al catabolismo aminoacídico. Lo anterior probablemente ocurre en circunstancias fisiológicas de rumiantes alimentados con forrajes frescos y ensilajes de elevado contenido de N amoniacal.15,25,26
En estudios donde se utilizaron hepatocitos ovinos incubados con 15NH3 se demostró la posibilidad de producción de 15N–urea, determinando que el 15NH3 puede ser transferido al aspartato.24,27 Durante una sobrecarga por NH4+ 32% del aspartato puede ser derivado del NH4+;28 otros estudios con hepatocitos incubados con 15NH3 indican que el glutamato y el aspartato se enriquecen similarmente con 15NH3, confirmando que las enzimas auxiliares de la ureagénesis, GD y AST, están involucradas en la desintoxificación del NH4+ en los rumiantes.15
Como se sabe, los aspectos que diferencian a los rumiantes de los monogástricos es la actividad enzimática más elevada de la OTC, arginasa y GD, sugiriendo que tienen una mayor capacidad de desintoxicar NH4+ vía el ciclo de la urea.29
Todavía no está completamente esclarecido si la ureagénesis es activa o pasivamente controlada, y cuáles son todos los factores involucrados. Se sabe que las concentraciones y actividades de las enzimas del ciclo de la urea pueden controlar la ureagénesis, por ejemplo el aumento de la actividad de la AAS después de un corto tiempo con alimentación elevada en proteína, aparentemente disminuye la toxicidad por urea, y que la acidosis metabólica reduce la ureagénesis.15
El glucagón conduce a una disminución de la retención de N y consecuente síntesis de urea. A su vez, la insulina desvía los aminoácidos en dirección al anabolismo de tejidos periféricos, no obstante, las acciones de la insulina sobre el ciclo de la urea no están esclarecidos in vivo.7,15
Hiperamonemia subclínica
La hiperamonemia ocurre cuando el flujo portal de NH4+ excede la capacidad de captación hepática. Como consecuencia de una elevada ingesta de proteínas, se produce una rápida acumulación de NH4+ en el rumen, aumentando su absorción. Cuando los animales no están previamente adaptados a dietas con alto contenido de proteínas o cuando los aminoácidos del ciclo de la urea son limitados, se sobrepasa la capacidad hepática de metabolización a urea, por lo que se produce una hiperamonemia con acumulación de NH4+ en los tejidos, donde ejerce toxicidad, ya que las concentraciones tisulares de éste son unas 50 veces superiores a las sanguíneas.7
La hiperamonemia está caracterizada por una elevación de las concentraciones de NH4+ sanguíneas e hiperglucemia.30,31 Se ha demostrado que la hiperglucemia debido a la hiperamonemia en rumiantes está asociada con una glucogenólisis hepática, reducción de la utilización periférica de glucosa, y disminuida secreción pancreática de insulina.30,32 La intoxicación subclínica por NH4+ reduce la concentración plasmática de insulina en ovinos30 y novillos,33 probablemente por inhibición de la secreción de insulina.31,34
Los límites fisiológicos de las concentraciones plasmáticas de NH4+ en bovinos están entre 7 y 95 u M/l33,35 y de 76 a 164 µM/l en sangre periférica de ovinos.36 Se considera una intoxicación subclínica por NH4+ en bovinos, cuando las concentraciones de NH4+ arterial son superiores a 190 µM/l.32
La máxima capacidad hepática de la vaca lechera en lactancia para metabolizar NH4+ está poco estudiada in vivo. Aparentemente, la máxima capacidad de extracción de NH4+ es aproximadamente 1.84 mM de NH3/min/kg de hígado,37 cantidad equivalente a la ingesta de 29 g de N/d para un ovino de 40 kg (1.05 g N/kg0.9) y de 435 g de N/día, para un bovino de 600 kg (1.37 g N/kg0.9).25,38
La capacidad hepática para metabolizar el NH4+ a urea puede ser sobrepasada en animales alimentados con alto suministro de PRD, en los que se producen fluctuaciones diarias en la producción de NH4+, o bien por excesiva absorción de los aminoácidos.26 El organismo requiere de una semana para realizar sus ajustes metabólicos enzimáticos que permitan que el aumento del NH4+ se traduzcan en aumento de las concentraciones de urea en sangre.35
Gluconeogénesis en el rumiante
Gluconeogénesis es el término que incluye todos los mecanismos y vías responsables de la conversión de sustancias no originarias de carbohidratos a glucosa o glucógeno. El hígado y los riñones son los dos tejidos capaces de realizar gluconeogénesis, pues contienen todas las enzimas gluconeogénicas.39
La importancia de la gluconeogénesis en rumiantes de pastoreo alimentados principalmente con forrajes ricos en fibra, se debe a que su organismo absorbe cantidades insignificantes de glucosa por el tracto digestivo y su capacidad de almacenamiento de glucógeno en el hígado es limitada.40 Cuando se compara la necesidad de glucosa en rumiantes para el sistema nervioso central, gestación y lactación, con la de los monogástricos, se comprueba que no es inferior, sino incluso mayor, como en el caso de vacas de elevada producción. Aproximadamente 60% de la glucosa del rumiante en lactancia es utilizada para la síntesis de la lactosa.3,40,41Como ejemplo, para sintetizar 30 litros de leche se necesitan 2200 g de glucosa,42 de ello se deduce que a medida que se eleva la productividad, la gluconeogénesis adquiere mayor importancia.
Cuantitativamente, la mayor fuente de energía absorbible en rumiantes son los ácidos grasos volátiles acetato y butirato, no gluconeogénicos, y propionato, principal precursor gluconeogénico. A su vez, el glicerol, el lactato y el valeriato, también son gluconeogénicos, pero su producción es insuficiente para cubrir los requerimientos gluconeogénicos.40,41 Sin embargo, en periodos de carencia alimentaria, el glicerol y los aminoácidos glucogénicos son los principales precursores de glucosa.40,43
El lactato, proveniente de la glucólisis anaeróbica y del propionato metabolizado en el epitelio ruminal, origina glucosa vía ciclo de Cori, entrando al ciclo de Krebs como piruvato, que es carboxilado a oxalacetato.40,44 Por otro lado, el propionato entra al ciclo de Krebs vía succinil–CoA. El glicerol procedente de la movilización lipídica origina glucosa tanto en el hígado como en los riñones. En periodos de ayuno o de elevado requerimiento, donde aumenta la degradación de las reservas lipídicas, aumenta la gluconeogénesis vía glicerol. Esta cantidad ascendería de 5% en ovinos alimentados con una dieta balanceada45 a 23% en ayuno.40
El papel de los aminoácidos en la gluconeogénesis en vacas y ovinos puede representar entre 5 y 30% de la producción total de glucosa.40,46–48 La conversión de aminoácidos a glucosa ocurre en el hígado del rumiante, y en menor extensión, en el riñón. La mayoría de los aminoácidos derivados del músculo esquelético no son transportados directamente al hígado como tal, sino que inicialmente son convertidos a aminoácidos de transporte como alanina y glutamina en el músculo. La glutamina y la alanina son los dos aminoácidos mayormente responsables por la producción de glucosa en los ovinos, y en las vacas se suma el aspartato.40,49
El costo energético medio de la gluconeogénesis es próximo al de la ureagénesis (4–5 moles de ATP por mol de glucosa formado, partiendo de una proporción de 70% de propionato, 10% de lactato y 20% de aminoácidos como sustratos gluconeogénicos).20
Relaciones entre ureagénesis y gluconeogénesis hepática
Los hepatocitos periportales son responsables de la ureagénesis, gluconeogénesis y glucogenólisis, y los perivenosos lo son de la glucólisis, lipogénesis y síntesis de glutamina.16 Las enzimas gluconeogénicas fosfoenolpiruvato carboxiquinasa (PEPCK, EC: 4.1.1.32), glucosa–6–fosfatasa (EC:3.1.3.9), 1,6 fructosa bifosfatasa (FBPasa, EC: 3.1.3.11) y glucoquinasa (EC:2.7.1.2) se localizan predominantemente en la zona periportal hepática.14,50–52
La ureagénesis hepática está controlada por las enzimas ureagénicas, los intermediarios del ciclo de la urea, y por la disponibilidad de aspartato. Los procesos de gluconeogénesis y ureagénesis en los hepatocitos periportales,14,16 se integran, vía ciclo de Krebs, por medio de aminoácidos específicos (aspartato, glutamato, alanina) y oxalacetato (Figura 1).2 Lo anterior hace suponer que una mayor demanda ureagénica puede alterar la eficiencia gluconeogénica.
El exceso de NH4+ puede afectar la gluconeogénesis aminoacídica, así como del propionato.27 Ensayos in vitro con hepatocitos ovinos tratados con florizina, sustancia que provoca glucosuria aumentando la demanda de glucosa, demuestran que el cloruro de amonio (NH4Cl) disminuye la velocidad máxima de conversión de propionato a glucosa, afectando la capacidad de los hepatocitos para utilizar propionato en la oxidación y gluconeogénesis.48 La conversión de propionato a glucosa in vitro disminuye 30% en hepatocitos ovinos tratados con NH4 (0.25–0.5 mM).53 Otro estudio indica que la síntesis de urea, estimulada por NH4+, puede reducir la gluconeogénesis hepática 25 por ciento.21
El NH4Cl inhibe la conversión de alanina a glucosa en hepatocitos aislados de ovinos, pero el mecanismo involucrado en esa inhibición no se conoce. En hepatocitos de ratas el efecto primario de NH4Cl es la conversión del oxalacetato mitocondrial a malato y de éste a aspartato, con la finalidad de contribuir con un átomo de N para la ureagénesis,54 disminuyendo consecuentemente el oxalacetato mitocondrial y su flujo para PEPCK y, por lo tanto, la gluconeogénesis.
La hiperamonemia disminuye la producción y liberación de glucosa hepática en ovejas55 y vacas.32 Los análisis de los flujos netos hepáticos de NH4+ y urea para un rango amplio de consumo y dietas, indican que el cociente de síntesis N ureico por NH4+ se aproxima a 2, sugiriendo que la síntesis de urea requiere una contribución adicional de N aminoacídico, el que es entregado por aspartato. Este aporte, si bien permite equilibrar el ingreso de NH4+ al ciclo de la urea como CbP,56 reduciría la disponibilidad de aminoácidos para la gluconeogénesis.
A su vez corderos suplementados con alto contenido de NNP en la dieta57 o vacas en pastoreo de praderas con alto contenido de proteínas y suplementadas con NNP58 presentan un incremento en la capacidad gluconeogénica vía propionato,59 una mayor actividad de la PEPCK y un balance energético más positivo.57
Por otro lado, ensayos in vitro con hepatocitos de corderos demostraron que el propionato inhibe la ureagénesis. La adición de propionato (1.25 mM) a hepatocitos en presencia de NH4Cl y alanina, disminuye la producción de urea.27 El hallazgo de un marcado aumento en las concentraciones de NH4+ en sangre periférica de vacas lecheras, sugiere que el propionato reduce la capacidad hepática para desintoxicar NH4+.33Aparentemente, el sitio de la inhibición de la ureagénesis por propionato ocurre en un punto entre la fijación del NH4+ y la formación de la citrulina. El propionato en concentraciones de 0.5 mM reduce 80% la síntesis de citrulina por la mitocondria de hepatocitos. Otro factor metabólico que reduce la ureagénesis es la lipidosis hepática, producto de la excesiva movilización lipídica al inicio de lactancia.
El NH4 puede alterar el metabolismo energético, además de llevar a la depleción de cetoglutarato y de ATP.60Los ovinos alimentados con urea poseen 36% menos cetoglutarato, 14% de piruvato y 32% de glucosa 6–P, respectivamente, que los alimentados con proteína de soya.60
Por otro lado, el costo de la desintoxicación de la urea y, probablemente otros gastos energéticos de mantenimiento hepático asociados, son mayores con el incremento de la ingesta de N.61 Sin embargo, algunos ATP pueden ser recuperados de las células cuando los cetoácidos formados durante la deaminación aminoacídica se oxidan a través del ciclo de Krebs.62 No obstante, cualquier requisito para la ureagénesis provocada por una baja eficiencia de utilización de N, no sólo representa una pérdida de N sino también potencialmente de energía útil.
Además, se describe una disminución en la actividad de la isocitrato deshidrogenasa (isocitrato
cetoglutarato), en presencia de NH
4+. Las mayores actividades enzimáticas ureagénicas en ovinos suplementados con urea se traducen en un mayor potencial de conversión y de consumo de cetoglutarato con la finalidad de conservar ornitina. El glutamato ocupa un papel central en el metabolismo N y su síntesis aparentemente es un prerrequisito para la máxima formación de urea.
60 Del glutamato procede aproximadamente 8% de la glucosa corporal,
40 de modo que ambos, glutamina y glutamato, son sustratos que comparten la ureagénesis y gluconeogénesis.
63Los antecedentes presentados señalan que tanto la ureagénesis como la síntesis de glutamina operan efectivamente, ejerciendo importantes implicaciones para la productividad del rumiante. A su vez, ambas rutas pueden ser excedidas en condiciones de hiperamonemia periférica y el catabolismo aminoacídico puede ser estimulado para suplir la necesidad adicional de N–aspartato, produciendo un desequilibrio con el ciclo de Krebs. De esa información se supone que la manutención de una adecuada biotransformación de NH4+ depende de la disponibilidad de aspartato y glutamato, generados vía oxalacetato y cetoglutarato.
Como el metabolismo proteínico en rumiantes está íntimamente relacionado con el metabolismo energético, un desequilibrio metabólico proteínico o energético puede conducir a un menor desempeño productivo. Todavía no se ha contabilizado la magnitud de los efectos del exceso de amonio sobre el metabolismo energético; sin embargo, su exceso parece interferir en la máxima expresión productiva, resultando en un desempeño menor al esperado, situación de importancia en vacas de elevada producción láctea a pastoreo o suplementadas con PRD, las cuales requieren de una plena capacidad gluconeogénica, o en animales en crecimiento que necesitan de un gran aporte aminoacídico. De la relación entre la ureagénesis y gluconeogénesis, se sugiere que el aumento de PRD o NNP podrían afectar negativamente la gluconeogénesis, lo que sería crítico durante periodos de elevados requerimientos.
Referencias
- HUNTINGTON GB, ARCHIBEQUE SL. Practical aspects of urea and ammonia metabolism in ruminants. J Anim Sci. 2000; 78: 742:749.
- REYNOLDS CK. Metabolism of nitrogenous compounds by ruminant liver. J Nutr 1992; 122: 850–854.
- BERGMAN EN, HOGUE DE. Glucose turnover and oxidation rates in lactating sheep. Am J Physiol 1967; 213: 1378–1384.
- SINCLAIR KD, SINCLAIR LA, ROBINSON JJ. Nitrogen metabolism and fertility in cattle: I. Adaptative changes in intake and metabolism to diets differing in their rate of energy and nitrogen release in the rumen. J Anim Sci 2000; 78: 2659–2669.
- MOORE DA, VARGA G. BUN and MUN: Urea nitrogen testing in dairy cattle. Compendium 1996; 18: 712–720.
- HALIBURTON JC, MORGAN SE. Nonprotein nitrogen–induced ammonia toxicosis and ammoniated feed toxicity syndrome. Vet Clin North Am: Food Anim Pract 1989; 5: 237–249.
- VISEK WJ. Ammonia: Its effects on biological systems, metabolic hormones, and reproduction. J Dairy Sci 1984; 67: 481–498.
- ANTONELLI AC, TORRES GAS, MORI CS, SOARES PC, MARUTA CA, ORTOLANI EL. Intoxicação por amônia em bovinos que receberam uréia extrusada ou granulada: alterações em alguns componentes bioquímicos do sangue. Braz J Vet Res Anim Sci 2009; 46: 69–76.
- GUSTAFFSON AH, PALMQUIST DL. Diurnal variation of rumen ammonia, serum urea, and milk urea in dairy cows at high and low yields. J Anim Sci 1993; 76: 475–484.
- MACKLE TR, PARR CR, BRYANT AM. Nitrogen fertilizer effects on milk yield and composition, pasture intake, nitrogen and energy partitioning, and rumen fermentation parameters of dairy cows in early lactation. New Zel J Agric Res 1996; 39: 341–356.
- HENNING PH, STEYN DG, MEISSNER HH. Effect of synchronization of energy and nitrogen supply on ruminal characteristics and microbial growth. J Anim Sci 1993; 71: 2516–2528.
- VISEK WJ. Ammonia metabolism, urea cycle capacity and their biochemical assessment. Nutr Rev 1979; 37: 273–282.
- MAZZAFERRO E, HACKETT T, WINGFIELD W, OGILVIE G, FETTMAN M. Role of glutamine in health and disease. Compendium 2000; 22: 1094–1103.
- KATZ NR. Metabolic Heterogeneity of hepatocytes across the liver acinus. J Nutr 1992; 122: 843–849.
- LOBLEY GE, MILANO GD, VAN DER WALT JG. The liver: Integrator of nitrogen metabolism. In: CRONJE P B, editor. Ruminant Physiology: Digestion, Metabolism, Growth and Reproduction. Pretoria, South Africa:CABI, 2000: 149–168.
- HÄUSSINGER D. Nitrogen metabolism in liver: structural and functional organization and physiological relevance. Biochem J 1990; 267: 281–290.
- BAREJ W. On extent of ureagenesis and gluconeogenesis in ruminants with regards to the diet. Arch Anim Nutr 1986; 40: 154–163.
- NOLAN JV, NORTON BW, LENG RA. Further studies of the dynamics of nitrogen metabolism in sheep. Br J Nutr 1976; 35: 127–147.
- RODWELL VW. Catabolism of proteins and of amino acid nitrogen. In: MURRAY RK, GRANNER DK, MAYES PA, RODWELL VW, editors. Harper's Biochemistry. 25th ed. New York, USA: MacGraw–Hill, 2000: 313–322.
- MADSEN A. The molecular basis of animal production: Metabolism in liver cells. In: RIIS PM, editor. Dynamic Biochemistry of Animal Production. New York, USA: Elsevier, 1983: 53–74.
- LUO QJ, MALTBY SA, LOBLEY GE, CALDER AG, LOMAX MA. The effect of amino acids on the metabolic fate of 15NH4Cl in isolated sheep hepatocytes. Eur J Biochem 1995; 228: 912–917.
- HARTWELL JR, CECAVA MJ, DONKIN SS. Rumen undegradable protein, rumen–protected choline and mRNA expression for enzymes in gluconeogenesis and ureagenesis in periparturient dairy cows. J Dairy Sci 2001; 84: 490–497.
- VISEK WJ. Some aspects of ammonia toxicity in animal cells. J Dairy Sci 1968; 51: 286–295.
- LOBLEY GE, CONNELL A, LOMAX MA, BROWN DS, MILNE E, CALDER AG et al. Hepatic detoxification of ammonia in the ovine liver: possible consequences for amino acid catabolism. Br J Nutr 1995; 73: 667–685.
- LOBLEY GE, BREMNER DM, NIETO R, OBITSU T, MOORE AH, BROWN DS. Transfers of N metabolites across the ovine liver in response to short–term infusions of an amino acid mixture into the mesenteric vein. Br J Nutr 1998; 80: 371–379.
- WHITT J, HUNTINGTON G, ZETINA E, CASSE E, TANIGUCHI K, POTTS W. Plasma flow and net nutrient flux across gut and liver of cattle fed twice daily. J Anim Sci 1996; 74: 2450–2461.
- MUTSVANGWA T, BUCHANAN–SMITH JG, MCBRIDE BW. Effects of ruminally degradable nitrogen intake and in vitro addition of ammonia and propionate on the metabolic fate of L–[1–14C Alanine and L–[15N Alanine in isolated sheep hepatocytes. J Anim Sci 1997; 75: 1149–1159.
- LOBLEY GE, BREMNER DM, BROWN DS. Response in hepatic removal of amino acids by the sheep to short–term infusions of varied amounts of an amino acid mixture into the mesenteric vein. Br J Nutr 2001; 85: 689–698.
- FICO ME, MOTYL T, MILNERJA. Species comparison of the influence of ammonia on orotic acid and urea biosynthesis in liver. J Nutr 1984; 114: 613–621.
- FERNANDEZ JM, CROOM JR WJ, JOHNSON AD, JAQUETTE RD, EDENS FW. Subclinical ammonia toxicity in steers: effects on blood metabolite and regulatory hormone concentrations. J Anim Sci 1988; 66: 3259–3266.
- KAYE MM, FERNANDEZ JM, WILLIAMS CC, WHITE TW, WALKER RL. Differential responses to an oral urea load test in small ruminants: species and breed effects. Small Rum Res 2001; 42: 211–217.
- FERNANDEZ JM, CROOM WJJ, TATE LP, JOHNSON AD. Subclinical ammonia toxicity in steers: effects on hepatic and portal–drained visceral flux of metabolites and regulatory hormones. J Anim Sci 1990; 68: 1726–1742.
- CHOUNG JJ, CHAMBERLAIN DG. Effects of intraruminal infusion of propionate on the concentrations of ammonia and insulin in peripheral blood of cows receiving an intraruminal infusion of urea. J Dairy Res 1995; 62: 549–557.
- FERNANDEZ J, SAHLU T, HART S, POTCHOIBA M, EL SHAER H, JACQUEMET N et al. Experimentally–induced subclinical hyperammonemia in dairy goats. Small Rum Res 2001; 42: 5–20.
- BRITO AL. Avaliação do uso intensivo de cama de frango na alimentação de bovinos: Alguns aspectos toxicológicos e do metabolismo do nitrogênio (tese doutorado). São Paulo, Brasil: Universidade de São Paulo–USP, 1999.
- ROLLER MH, RIEDEMANN GS, ROMKEMA GE, SWANSON RN. Ovine blood chemistry values measured during ammonia toxicosis. Am J Vet Res 1982; 43: 1068–1071.
- SYMONDS HW, MATHER DL, COLLIS KA. The maximum capacity of the liver of the adult dairy cow to metabolize ammonia. Br J Nutr 1981; 46: 481–486.
- GRAHAM NM. Units of metabolic body size for comparisons amongst adult sheep and cattle. Proceedings of Australian Society of Animal Production, Ninth Biennial Conference. 1972 Feb 1319; Canberra, Australia: Ramsay Were Publishing Pty Ltd. 1972; 9: 352–355.
- MAYES P. Gluconeogenesis and control of the blood glucose. In: MURRAY RK, GRANNER DK, MAYES PA, RODWELL VW, editors. 25th ed. New York, USA: MacGraw–Hill, 2000: 208–218.
- HERDT TH. Fuel homeostasis in the ruminant. Vet Clin North Am: Food Anim Pract 1988; 4: 213–231.
- HERDT TH. Ruminant adaptation to negative energy balance. Influences on the etiology of ketosis and fatty liver. Vet Clin North Am Food Anim Pract 2000; 16: 215–230.
- KOLB E. Fisiología Veterinaria. Vol. II. Zaragoza, España: Acribia, 1991.
- TELENI E, ANNISON EF. Release of gluconeogenic amino acids from hind–limb muscles of fed and starved sheep. In: BAKER SK, GAWTHORNE JM, MACKINTOSH JB, PURSER DB, editors. Ruminant physiology: concepts and consequences: a tribute to R. J. Moir. Perth, Australia: University of Western Australia, 1984.
- GONZÁLEZ FD, SILVA SC. Introdução à bioquímica clínica veterinária, 2ª Ed. Porto Alegre RS–Brasil, Universidade Federal do Rio Grande do Sul, 2006.
- BERGMAN EN, STARR DJ, REULEIN SSJ. Glycerol metabolism and gluconeogenesis in the normal and hypoglycemic ketonic sheep. Am J Physiol 1968; 215: 874–880.
- CHALUPA W, SNIFFEN CJ. Protein and amino acid nutrition of lactating dairy cattle. Vet Clin North Am: Food An Prac 1991; 7: 353–372.
- FORD EJ, REILLY PE. The utilization of plasma free amino acid and glucose carbon by sheep. Res Vet Sci 1969; 10: 409–418.
- OVERTON TR, DRACKLEY JK, OTTEMANN–ABBAMONTE CJ, BEAUIEU AD, EMMERT LSC. Substrate utilization for hepatic gluconeogenesis is altered by increased glucose demand in ruminats. J Anim Sci 1999; 77: 1940–1951.
- MILLS SE, BEITZ DC,YOUNG JW. Evidence for impaired metabolism in liver during induced lactation ketosis of dairy cows. J Dairy Sci 1986; 69: 362–370.
- YANEZ AJ, BERTINAT R, CONCHA, II, SLEBE JC. Nuclear localization of liver FBPase isoenzyme in kidney and liver. FEBS Lett 2003; 550: 35–40.
- SAEZ DE, FIGUEROA CD, CONCHA II, SLEBE JC. Localization of the fructose 1,6–bisphosphatase at the nuclear periphery. J Cell Biochem 1996; 63: 453–462.
- YANEZ AJ, GARCIA–ROCHA M, BERTINAT R, DROPPELMANN C, CONCHA II, GUINOVART JJ et al. Subcellular localization of liver FBPase is modulated by metabolic conditions. FEBS Lett 2004; 577: 154–158.
- DEMIGNÉ C, YACOUB C, RÉMÉSY C, FAFOURNOUX P. Propionate and butyrate in rat or sheep hepatocytes. Bioch Bioph Acta 1986; 875: 535–542.
- MEIJER AJ, GIMPEL JA, DELEEUW G, TISCHLER ME, TAGER JM , WILLIAMSON JR. Interrelatioships between gluconeogenesis and ureogenesis in isolated hepatocytes. J Biol Chem 1978; 253: 2308–2320.
- ORZECHOWSKI A, PIERZYNOWSKI S, MOTYL T, BAREJ W. Net hepatic metabolism of ammonia, propionate and lactate in sheep in relation to gluconeogenesis and ureagenesis. J Anim Physiol Anim Nutr 1988; 59: 113–122.
- PARKER D, LOMAX M, SEAL C, WILTON J. Metabolic implications of ammonia production in the ruminant. Proc Nutr Soc 1995; 54: 549–563.
- NORO M. Gluconeogénesis hepática en ovinos (Ovis aries) alimentados con una dieta alta en nitrógeno no proteico (tesis doctoral). Valdivia, Chile: Universidad Austral de Chile, 2006.
- NORO M, BARBOZA CS, BENITEZ O, PULIDO R, WITTWER F. Capacidad gluconeogénica vía propionato en vacas lecheras pastoreando alta o moderada oferta de pradera y suplementadas con dos fuentes de nitrógeno, XXXV Reunión Anual SOCHIPA; 2010 octubre 27–29; Coyhaique, Chile, Coyhaique, INIA Tamel Aike, 2010: 137–138.
- NORO M, WITTWER P, SCANDOLO D, GONZALEZ C, HARO F, SANDOVAL A. Effect of non–protein nitrogen supplementation on glucose and urea syntheses after a propionate loading test in sheep. Vet Clin Path 2005; 34: 305.
- CHALUPA W, CLARK J, OPLIGER P, LAVKER R. Detoxication of ammonia in sheep fed soy protein or urea. J Nutr 1970; 100: 170–176.
- MARINI JC, KLEIN JD, SANDS JM, VAN AMBURGH ME. Effect of nitrogen intake on nitrogen recycling and urea transporter abundance in lambs. J Anim Sci 2004; 82: 1157–1164.
- NEWSHOLME E, LEECH A. Biochemistry for the Medical Sciences. Chichester, UK: John Wiley & Sans Inc, 1983.
- NEWSHOLME P, LIMA MM, PROCOPIO J, PITHONCURI TC, DOI SQ, BAZOTTE RB et al. Glutamine and glutamate as vital metabolites. Braz J Med Biol Res 2003; 36: 153–163.
 glutamato); además, son los responsables de la gluconeogénesis. Los hepatocitos perivenosos, que se distribuyen en torno a la vena eferente hepática, no presentan las enzimas ureagénicas ni la glutaminasa mitocondrial. Sin embargo, ellos poseen la enzima glutamina sintetasa citosólica (GS), que convierte glutamato en glutamina, y el transportador Xag para el ingreso a la célula del glutamato y aspartato.14–16
glutamato); además, son los responsables de la gluconeogénesis. Los hepatocitos perivenosos, que se distribuyen en torno a la vena eferente hepática, no presentan las enzimas ureagénicas ni la glutaminasa mitocondrial. Sin embargo, ellos poseen la enzima glutamina sintetasa citosólica (GS), que convierte glutamato en glutamina, y el transportador Xag para el ingreso a la célula del glutamato y aspartato.14–16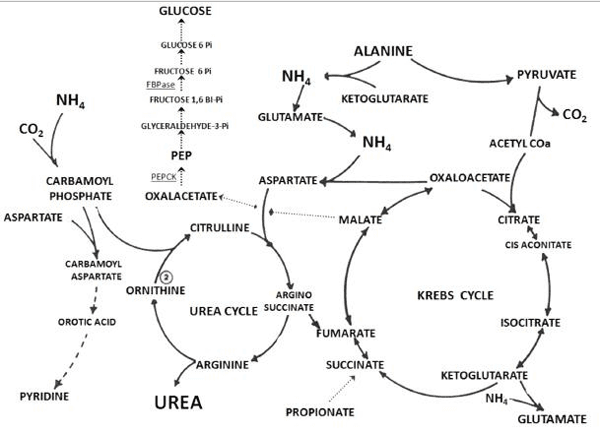
 cetoglutarato), en presencia de NH4+. Las mayores actividades enzimáticas ureagénicas en ovinos suplementados con urea se traducen en un mayor potencial de conversión y de consumo de cetoglutarato con la finalidad de conservar ornitina. El glutamato ocupa un papel central en el metabolismo N y su síntesis aparentemente es un prerrequisito para la máxima formación de urea.60 Del glutamato procede aproximadamente 8% de la glucosa corporal,40 de modo que ambos, glutamina y glutamato, son sustratos que comparten la ureagénesis y gluconeogénesis.63
cetoglutarato), en presencia de NH4+. Las mayores actividades enzimáticas ureagénicas en ovinos suplementados con urea se traducen en un mayor potencial de conversión y de consumo de cetoglutarato con la finalidad de conservar ornitina. El glutamato ocupa un papel central en el metabolismo N y su síntesis aparentemente es un prerrequisito para la máxima formación de urea.60 Del glutamato procede aproximadamente 8% de la glucosa corporal,40 de modo que ambos, glutamina y glutamato, son sustratos que comparten la ureagénesis y gluconeogénesis.63