Trastornos metabólicos en rodeos de cría
Publicado: 21 de julio de 2021
Por: Ernesto Odriozola, MV, Ms Phil.Ex-Investigador INTA Balcarce.
INTRODUCCIÓN
Los minerales y las vitaminas representan una proporción muy pequeña de la ingesta diaria de materia seca en las dietas del ganado de carne y a veces, son subestimadas dentro de un programa nutricional. Aunque representen un porcentaje muy pequeño de nutrientes dentro de la dieta, muchas veces son de importancia vital y su carencia puede traducirse en fallas de desarrollo, productivas, reproductivas, alterando la función del sistema nervioso, la respuesta inmune y pueden llevar a la muerte de nuestros animales. Todas estas funciones pueden verse comprometidas si no se implementa el uso un buen programa de minerales.
Macrominerales y microminerales
El ganado de carne requiere un número importante de diferentes minerales en sus dietas, los cuales se clasifican como macrominerales o microminerales, según las cantidades requeridas en las dietas. Los macrominerales se requieren en cantidades mayores (gramos por día) que los microminerales (miligramos o microgramos por día). Los macrominerales requeridos por el ganado de carne incluyen calcio, magnesio, fósforo, potasio, sodio, cloro y azufre. Los microminerales requeridos incluyen cromo, cobalto, cobre, yodo, hierro, manganeso, molibdeno, níquel, selenio y zinc.
Los requerimientos de nutrientes de los elementos minerales específicos varían, de-pendiendo de la edad del animal, el peso, la etapa de producción, el estado de la lactancia, la raza, el estrés y la biodisponibilidad de los minerales (el grado en que un mineral está disponible para el tejido objetivo después de la administración) de la dieta. Los requerimientos de macromineral general-mente se expresan como un porcentaje (%) de la dieta total, mientras que los requerimien-tos de micromineral generalmente se expresan como miligramos por kilogramo (mg / kg), que es el equivalente a partes por millón (ppm).
HIPOMAGNESEMIA
La hipomagnesemia es un desorden metabólico de los rumiantes provocado por un aporte insuficiente de magnesio (Mg) al organismo (deficiencia primaria), por una incorrecta digestibilidad o por factores metabólicos que impiden su normal utilización (deficiencia secundaria).
La Hipomagnesemia es la causa más impor-tante de muerte de vacas adultas en el área de cría de la Provincia de Buenos Aires donde se concentra la mayor población de vacas del país Aproximadamente del 65 al 70 por ciento del magnesio en el cuerpo se encuentra en el hueso, el 15 por ciento en el músculo, el 15 por ciento en otros tejidos blandos y el 1 por ciento en el fluido extracelular. El magnesio es importante para la activación de enzimas, la degradación de la glucosa, la transmisión de códigos genéticos, el transporte de mem-brana, la transmisión de impulsos nerviosos y el desarrollo del esqueleto.
El animal joven puede movilizar el magnesio del hueso, pero el adulto, pierde esa capacidad y depende exclusivamente del Mg aportado por la dieta.
La presentación de la enfermedad depende de múltiples factores, que abarcan ubicación geográfica, clima, alimentación y factores inherentes al animal.
El análisis de la información generada por el Servicio de Diagnóstico del INTA Balcarce durante el período 1998-2013 donde se registraron 173 casos de Hipomagnesemia, permite obtener las siguientes conclusiones.
Ubicación geográfica: el 96,5% de los casos se registraron en la Provincia de Buenos Aires, el 87,5% ocurrieron en campos ubicados en partidos del sur de la Pcia y 9,2% en campos del norte de la Pcia de Buenos Aires
Categoría: Sobre una población expuesta de 44508 animales, el promedio de mortalidad fue del 3.0%, total de1357 bovinos muertos. El 86.7% de los casos se registraron en la cate-goría vacas.
Condición corporal: el 94,8 % de los muertos estaban en muy buena o buena condición corporal. La susceptibilidad a la Hipomagnesemia varía con la edad, el puntaje de condición corporal y la raza de las vacas, así como el rendimiento de leche. Más del 80% de las vacas de carne afectadas son mayores de seis años. Las vacas gordas tienen menos magnesio disponible en los fluidos corporales, y si paren en otoño y pierden peso corpo-ral mientras están amamantando en pastos cortos y dominantes de pasto en invierno, el riesgo de Hipomagnesemia es alto. Las vacas menores de seis años se ven afectadas cuan-do intervienen factores distintos a la alimentación o la ingesta de magnesio. Es probable que esté involucrado un alto consumo de potasio o una nutrición baja en sodio o fósforo. Las razas Bos taurus (británicas y europeas) son más susceptibles a la Hipomagnesemia que las razas Bos indicus (Brahman, Santa Gertrudis)
Gestación: El 72.6% de los animales estaban lactando, mientras que en el 25.0% estaban gestando y el 2.4% eran no gestantes.
Las vacas lactantes son muy sensibles a los cambios en el balance de entrada-salida de magnesio en sus cuerpos porque no tienen una reserva de magnesio fácilmente disponi-ble. Esto se ve agravado por la baja y variable proporción de magnesio en la dieta que se ab-sorbe desde el rumen (entre 5% y 30%). Para que una vaca de 600 kg cumpla con un requisito de mantenimiento de 1,8 g de magnesio / día y un requerimiento de lactancia de 0,85 g de magnesio / día (5 litros de leche contienen 170 mg de magnesio / litro), la ingesta requerida de magnesio es de entre 9 y 53 g /día. Los pastos consumidos entre abril y septiembre pueden no proporcionar este requisito.
Alimentación: La ingesta de magnesio depende del nivel de magnesio en el alimento y la cantidad de alimento consumido. Las vacas están en riesgo cuando el forraje con-tiene menos de 0.2% de magnesio (base de materia seca) o cuando la disponibilidad de pasto es menor a 1000 kg de materia seca / hectárea. La Hipomagnesemia puede ocurrir cuando la disponibilidad del pasto es baja, aunque la concentración de magnesio en el pasto esté dentro de los límites normales. En general, los pastos jóvenes y los cereales exuberantes tienen niveles de magnesio más bajos que los cultivos de pasto y cereales más antiguos. Los pastos y los cultivos de cereales tienen niveles más bajos de magnesio que las leguminosas, por ejemplo, los tréboles y la alfalfa. La absorción de magnesio se reduce por un alto consumo de potasio (más del 3.5% de materia seca). La baja absorción de magnesio también puede ocurrir cuando los niveles de potasio en el rumen aumentan debido a la deficiencia de sal (sodio), el ayuno o los cambios repentinos en la ingesta de alimento seco a pastos exuberantes. El efecto de los altos niveles de potasio en el rumen sobre la absorción de magnesio aumenta por la defi-ciencia de fósforo, y se agrega a las altas concentraciones de iones de amonio en el rumen causadas por los altos niveles de nitrógeno o proteína en las plantas.
En el estudio de los casos los alimentos que consumían las vacas eran: pasturas (46.9%), campo natural (26.9%), verdeos (9.2%) y otros (17.7%) (rastrojos de diferentes cultivos, maíces o sorgos diferidos, henos y ensilados). Estas pasturas estaban compuestas por diferen-tes especies, muchas veces consociadas, entre las que se describen pasto ovillo (Dactylis glomerata) (18.3%), agropiro (Thinopyrum ponticum) (15.6%), raigrás (Lolium multiflo-rum) (13.8%) y festuca (Festuca arundinacea)(12.8%) entre otras especies (39.4%).
Clima:Los peores meses para Hipomagnesemia son de junio hasta agosto. Durante estos meses muchas vacas están en estado de lactancia media y perdiendo condición. La pastura es a menudo corta, la hierba es do-minante y tiene una composición química desfavorable para la absorción de magnesio y calcio. El estrés climático (frío intenso, lluvia fuerte o viento fuerte) puede ser alto. En los años donde se registraron más de 20 epi-sodios (2001, 2010 y 2012), las precipitaciones fueron 28.1% más altas que el resto de los años.
La radiación solar media fue 5.3% más baja
Cuadro clínico
Se pueden distinguir claramente dos formas de presentación, la primera señal puede ser que las vacas se encuentran muertas en el potrero. Por lo general, sale espuma por la boca y la nariz, y en el suelo pueden verse signos de pedaleo. Otras vacas pueden mostrar signos nervio-sos. Inicialmente, la vaca puede caminar rígidamente, con hipermetría, puede reaccionar agresivamente antes de caer y no poder levantarse. Puede tener una respuesta exagerada a estímulos visuales, sonoros o al tacto, presentando convulsiones, con espasmos musculares (tetania), pedaleo, nistagmus, opistotomos, movimientos descontro-lados de los pabellones auriculares, babeo. La muerte puede ocurrir en media hora.
Hallazgos de necropsia
Los hallazgos de necropsia son prácticamente nulos, solo suele encontrarse pequeñas hemorragias en epicardio y endocardio, tampoco se observan cambios al estudio histopatológico
Tratamiento
El tratamiento inyectable queda restringido para aquellos animales que presentan signología clínica, no tiene efecto preventivo más que por algunas horas. El exceso de Mg es eliminado por la orina
Lo ideal es el uso de sales de Mg en bateas, como agregado a un alimento concentrado (óxido de Mg) o espolvoreado sobre rollos de pastura a razón de 50 gr de óxido de Mg por ración diaria, también se puede emplear el agua de bebida (sulfato de Mg) como vehícu-lo a razón de 3gr/l.. Por lo general, es un método poco confiable porque el consumo de agua por parte de las vacas es generalmente bajo cuando están consumiendo pastos exuberantes y se complica en épocas de tiempo lluvioso Uso de bloques con sales de magnesio son útiles, pero no brindan una protección del 100% porque algunas vacas no los consumen. La mayoría de los bloques de magnesio comerciales contienen hasta un 80% de melaza porque las sales de magnesio no son muy palatables. Los bloques se colocan cerca de las bebidas. Ninguno de los tratamientos mencio-nados tiene alta eficacia, pero reduce el nú-mero de muertes
POLIOENCEFALOMALACIA
El término Polioencefalomalacia (PEM) se refiere a una condición neuropatológica que cursa con una compleja carencia de vitamina B1 afectando prioritariamente a rumiantes jóvenes en engorde intensivo, pero sólo rara vez a vacunos adultos. El nombre PEM significa reblandecimiento o necrosis (malacia) de regiones de la sustancia gris (polio). La mayoría de los alimentos destinados a bovinos contiene una buena cantidad de tiamina en su composición, la que junto a la sintetizada por los microbios pre estomacales cubre sus requerimientos normales. Si bien algunos microorganismos pre estomacales producen tiaminasas que provocan la destrucción de la tiamina, aún resta suficiente cantidad de la misma para su absorción intestinal. Algunas situaciones que trastornan los procesos de fermentación intraruminal pueden desviar el equilibrio entre los factores de formación y destrucción de tiamina a favor de estos últi-mos, de manera que se produce una hipovitaminosis B.
Los factores que modifican el equilibrio entre síntesis y destrucción pueden ser: Insuficiencia primaria de la síntesis microbia-na:La síntesis de vitaminas B en el rumendepende de la flora ruminal que a su vez se ve influenciada por la fibra vegetal para desarrollarse y poder mantener niveles óptimos de dicha vitamina. El hecho de que los animales sean alimentados en feedlot con dietas ricas en concentrados y pobre en fibra, provoca un ambiente hostil para las bacterias productoras de vitamina B1, a la vez que disminuye el sustrato para su desarrollo, dándole por lo tanto menor posibilidad de competir en el medio al que es expuesto, disminuyendo su número y afectando de este modo la producción vitamínica.
Destrucción por tiaminasas ruminales: La destrucción de la tiamina puede ser producida por tiaminasas (enzimas específicas que degradan selectivamente a la tiamina hasta thiazole y pirimidina). Las principales enzimas de este grupo son la tiaminasa I y la tia-minasa II, siendo la de mayor importancia la primera. La velocidad de degradación depende mucho de la concentración de tiaminasas en rumen, y la presencia o no de co-sustratos que aceleren en gran proporción la velocidad de degradación. Se han identificado muchos co-sustratos de la tiaminasa de tipo I entre ellos muchos metabolitos ruminales, y anti-parasitarios como clorhidrato de levamisol y thiobendasole. Estas enzimas pueden ser producidas en rumen por bacterias ruminales (como Bacillus thiaminolyticus y Clostridium esporogenes para la de tipo I; Bacillus aneu-rinolyticus para la de tipo II) o ser ingerida como tal en el alimento (por ejemplo, en plantas de helecho (Pteridium aquilinum).
Intoxicación con amprolium: análogo de la tiamina.
Altos niveles de sulfato en agua y/o alimento. los excesos de sulfato pueden provocar signos clínicos de PEM disminuyendo los niveles de tiamina, a través de su acción directa sobre las células, o ambos. Esto se puede deber a que el sulfito que es producido durante la reducción del sulfato a sulfhídrico puede tener un efecto sobre el tejido cerebral. Algunos autores sugirieron que los sulfitos pueden rom-per los puentes de metileno de la tiamina (ac-ción indirecta). Otros, que el SO3 puede ser un gran contribuidor, porque el SO3 producido en rumen una vez absorbido, inhibe funciones enzimáticas afectando adversamente el me-tabolismo oxidativo y la producción de ATP. Especialmente, el S2 bloquea la citocromo C-oxidasa, la cual tiene la función de transporte de electrones en la producción de ATP. El incremento del S2-ruminal, después de la absorción, puede causar una disminución en la producción de ATP neuronal y con esto necrosis de la materia gris (acción directa).
Cuadro clínico
Los animales clínicamente afectados en un principio se muestran deprimidos, pierden el apetito y no tratan de beber agua. La temperatura corporal y la frecuencia respiratoria se hallan usualmente normales, pero la frecuencia cardiaca tiende a disminuir. En las etapas iniciales, los signos son intermitentes, pero luego se hacen constantes con opistótonos y nistagmo persistente. Generalmente se presenta en forma brusca y en casos individua-les, afectando principalmente animales entre 3 y 9 meses (aunque se puede presentar en animales de hasta 24 meses). La severidad de la enfermedad es algo menor en los animales a campo que en los bovinos y ovinos alimentados a corral o estabulados. Los animales presentan ceguera (lo que demuestran generalmente con una clásica marcha en círculos), pueden caer al suelo donde toman posición de opistótono, presentando convulsiones tónico-clónicas intermitentes. Sus miembros permanecen rígidos y extendidos, temblores musculares (especialmente en la cabeza), por lo que denotan una clara incoordinación al marchar. Debido al aumento de la presión intracraneana, los animales presionan su cabeza contra paredes, postes u otro objeto duro. Otros sig-nos son nistagmos, estrabismo dorsal, bruxismo y salivación espumosa.
Hallazgos de necropsia
Generalmente no existen. Las lesiones de PEM en los tejidos cerebrales afectados autofluorecen bajo luz UV debido a que los macrófagos fagocitan el tejido lesionado en las zonas de malacia, concentrando en sus lisosomas lipo-fucsina (sustancia fotoactiva).
Hallazgos histopatológicos
Al análisis histopatológico pueden observarse áreas de necrosis cortical, presencia de células mononucleares fagocíticas (células de Gitter), focos de gliosis, manguitos perivasculares (con predominio de macrófagos), y en muchos casos hemorragia perivascular. Estas lesiones en SNC se deben a que la tiamina es un necesario cofactor en el ciclo del ácido tricarboxílico y del shunt con el ciclo de las pentosas, por lo tanto, las lesiones se presentan en los tejidos en los cuales estos procesos son vitales para la supervivencia de las células, en particular, los tejidos del cerebro y corazón.
Tratamiento
Los tratamientos recomendados para animales clínicamente afectados, son cinco dosis de 10-20 mg clorhidrato de tiamina /Kg. de peso vivo con un intervalo no mayor a 3 horas. Se recomienda que la primera dosis sea por vía intravenosa, ya que esto elevaría rápidamente los niveles de tiamina en sangre y permitiría una mayor velocidad de llegada al cerebro acelerando la recuperación. Para mejorar los resultados de los tratamientos se recomienda utilizar 2 mg de dexametasona /5kg de peso vivo, esto ayudaría a disminuir el edema cerebral y provocaría una recuperación clínica más rápida. Por último, se recomienda asegurar el consumo de alimentos fibrosos y reducir los concentrados por una semana para restablecer la flora ruminal
VITAMINA A
La vitamina A es una de las vitaminas menos estables y es altamente lábil a la luz y la oxidación. Químicamente, el retinol consiste en un anillo de ciclohexeno sustituido con una cadena lateral alifática marcada por una serie de dobles enlaces conjugados. Esta estructura única permite que el retinol y sus derivados funcionen como un pigmento visual y un regulador del crecimiento y la diferenciación celular.
La vitamina A (retinol) no se produce per se en las plantas, pero sus precursores, los ca-rotenos, se presentan en varias formas. Los carotenos son pigmentos de color amarillo anaranjado que aparecen en las hojas verdes y en menor medida, en el grano de maíz. Cuatro de estos compuestos, alfa-caroteno, beta-caroteno, gamma-caroteno y criptoxantina (el carotenoide principal del maíz), son de par-ticular importancia debido a su actividad de provitamina A.
La vitamina A y los precursores, los carotenoides, son destruidos rápidamente por el oxígeno, el calor, la luz y los ácidos. La presencia de humedad y minerales traza reduce la ac-tividad de la vitamina A en los alimentos. La vitamina A es una de las vitaminas menos estables y es altamente lábil a la luz y la oxidación
Las variables que influyen en la digestibilidad del caroteno incluyen el mes de cosecha de forraje; tipo de forraje (heno, ensilaje, gre-enchop o pasto); especies de plantas; conte-nido de materia seca vegetal; y condiciones de cosecha y almacenamiento. En general, la digestibilidad del caroteno estuvo por encima del promedio durante los meses más cálidos y por debajo del promedio durante el invierno.
HIPOVITAMINOSIS A
Etiología
La deficiencia de vitamina A puede ocurrir como una enfermedad primaria debido al aporte insuficiente de vitamina A en la dieta (o su precursor, el caroteno), o como una en-fermedad secundaria debido a una absorción deficiente de la misma por parte del aparato digestivo, siendo su aporte correcto en la dieta.
Epidemiologia
Los animales que son alimentados con dietas a base de forraje reciben un aporte suficiente de vitamina A en la dieta, salvo durante las sequias prolongadas, donde se alimentan con pastos secos, pero la deficiencia clínica no siempre tiene lugar en esta situación ya que las reservas hepáticas suelen ser adecuadas y los periodos de privación no son lo suficientemente largos como para que las reservas dis-minuyan a niveles críticos. Pero en aquellos animales que se crían de manera confinada y son alimentados con raciones preparadas puede observarse deficiencia grave si no se realiza la suplementación adecuada.
Los bovinos soportan dietas deficitarias de hasta 5-18 meses antes de la aparición de los signos clínicos.
La enfermedad es más frecuente en machos que en hembras cuando ambos sexos reciben la misma alimentación, esto puede estar dado por la producción de vitamina A por parte del cuerpo lúteo de las hembras.
La deficiencia materna de vitamina A puede dar lugar a brotes de hipovitaminosis congé-nitas en los terneros.
Patogenia
La vitamina A es esencial para la regeneración de la rodopsina, necesaria a su vez para la visión con luz escasa, para el crecimiento normal de los huesos y para la conservación de los tejidos epiteliales normales. Es por tal motivo que cuando se produce una deficiencia se manifieste clínicamente con varias presentaciones.
Visión Nocturna:
La deficiencia de vitamina A no permite la regeneración de la rodopsina, es por esto que el animal pierde la visión con falta de luz.
Presión Intracraneal:
Una de las primeras alteraciones que se produce en la hipovitaminosis A en los terneros es la hipertensión intracraneal. Esta altera-ción se debe a un aumento de la presión del líquido cefalorraquídeo (LCR), la cual aumen-ta debido a una alteración en la absorción del mismo provocada por el descenso de la per-meabilidad tisular de las vellosidades arac-noideas y por el engrosamiento de la matriz de tejido conectivo de la duramadre cerebral. Esta alteración causa síncope y convulsiones, que aparecen en los terneros durante los pri-meros estadios de la deficiencia de vitamina A.
Crecimiento óseo:
La vitamina A es necesaria para el funciona-miento de los osteoblastos y osteoclastos. Durante la deficiencia se produce una alteración del desarrollo óseo, sobre todo en los huesos más finos como los del cráneo, es por esto que se pueden producir lesiones graves del siste-ma nervioso.
Se produce un aumento de la presión de líquido cefalorraquídeo hasta 4 ó 6 veces más de lo normal, observando herniación de cerebelo y ocupación total de la cavidad craneal con deformación, esto genera los signos nerviosos característicos de la deficiencia de vitamina A que son edema de la pupila, incoordinación y sincope. Por otra parte, causan debilidad y ataxia, la compresión, la torsión y el alargamiento de los nervios craneales y la hernia del cerebelo a través del orificio occipital, y de la medula espinal en los orificios vertebrales, lo que origina lesión de las raíces nervio-sas y signos de localización referidos a ner-vios periféricos determinados (parálisis facial y ceguera debido a la compresión del nervio óptico).
Tejidos epiteliales:
La deficiencia de vitamina A produce atrofia de todas las células epiteliales, pero las más afectadas son las células epiteliales con función secretora y de revestimiento. Estas células secretoras comienzan a ser remplazadas por células epiteliales queratinizadas estratificadas características de los tejidos epiteliales no secretorios. Esta situación se observa principalmente en glándulas salivales, aparato urogenital, glándulas paraoculares y los dientes.
Desarrollo embriológico:
La vitamina A es esencial para la formación de los órganos durante el crecimiento del feto. La deficiencia congénita en el ternero se caracteriza por ceguera con midriasis, nistagmo, debilidad y falta de coordinación. La constricción del canal óptico por el engrosamiento de la duramadre da lugar a necrosis isquémica del nervio óptico con papiledema y ceguera. También se puede observar displasia retiniana. También se produce engrosamiento de los huesos occipital y esfenoidal, y abombamiento de los huesos frontales y parietales con compresión cerebral.
Mecanismos inmunitarios:
Se sabe que la vitamina A y el beta caroteno tienen efectos importantes sobre el sistema inmunitario, pero los mecanismos por los cuales ejercen su efecto, no están bien aclarados aún. Una de las teorías más aceptadas es que la vitamina A incrementa la función de los neutrófilos.
Signos clínicos
Debido a que esta patología afecta muchas partes del organismo, se observan diferentes signos clínicos, los cuales se clasifican a continuación:
Ceguera nocturna: La incapacidad de los afectados para percibir obstáculos a media luz, durante la noche y bajo la luz de la luna constituye un signo diagnostico importante, y de etapas temprana de la enfermedad.
Xeroftalmia (engrosamiento y opacificación de la córnea).
Alteraciones cutáneas: Se observan grandes depósitos de escamas cutáneas.
Capacidad reproductora: Esta es una de las causas de pérdidas más importantes en los animales con esta patología. Se afectan machos y hembras en igual proporción.
En el macho se produce una degeneración del epitelio germinativo de los túbulos seminíferos, lo que provoca la disminución del número de espermatozoides normales móviles producidos.
En la hembra se produce la degeneración de la placenta generando abortos o expulsión de fetos muertos o débiles. Es frecuente la retención placentaria.
Sistema nervioso: Entre los signos relacionados con la lesión del sistema nervioso central están:
Parálisis de los músculos esqueléticos debida a lesión de las raíces nerviosas periféricas, encefalopatía debido a un aumento de la presión intracraneal, y ceguera debido a la constricción del nervio óptico en su canal.
Parálisis: Se manifiesta por trastornos de la marcha debidos a debilidad e incoordinación, comenzando por las extremidades del tren posterior y luego las del tren anterior.
Convulsiones: Se dan a causa del aumento de la presión de líquido cefalorraquídeo y se manifiesta por crisis convulsivas frecuentes en los animales de cría intensiva de 6-8 meses d edad. Los afectados presentan síncope espontáneamente o después de ejercicio o manejo, y durante el tiempo que estén echados puede sobrevenir una convulsión tónico-clónica que dura de 10 a 30 segundos. Durante la convulsión el animal puede morir o sobrevivir y permanecer quieto durante varios minutos como si estuviera paralizado, antes de que sobrevenga otra convulsión. Durante la crisis convulsiva el animal se encuentra en ventroflexión de la cabeza y el cuello, opistótonos, cierre tetánico de los parpados y una retracción de los globos oculares. La mortandad de estos animales puede llegar hasta el 25%. Si se los trata el pronóstico es excelente curándose el animal en 48 horas.
Ceguera: Esta forma afecta principalmente a bovinos de entre 12 y 18 meses de edad pero también puede afectar a los de 2 a 3 años. El primer signo de la forma ocular es una amaurosis bilateral durante el día, las pupilas se encuentran muy dilatadas y fijas y no res-ponden a los estímulos luminosos. En el disco óptico se observa edema prominente y perdida del color, habitualmente brillante, del tapetum. Pueden aparecer también grados variables de desprendimiento retiniano peripapilar, hemorragias papilares y peripapilares, y rotu-ra del epitelio pigmentario de la retina. Están presentes los reflejos palpebrales y corneal. Estos animales pueden sufrir convulsiones si se los fuerza a caminar o si se los carga para transporte. El pronóstico para esta presentación es desfavorable y el tratamiento no es eficaz, debido a la degeneración que sufren los nervios ópticos
Malformaciones congénitas: En terneros la malformación congénita se manifiesta con ceguera por compresión del nervio óptico y encefalopatía.
Hallazgos de necropsia
La deficiencia de vitamina A no presenta cambios macroscópicos en la necropsia, pue-de en los terneritos observarse abombamien-to de los huesos frontales y parietales con compresión cerebral.
La disección cuidadosa puede mostrar una disminución del tamaño del cráneo y las vértebras.
Cambios microscópicos
La metaplasia escamosa de los conductos in-terlobulillares de la glándula parótida (foto 1a) es muy sugestiva de la deficiencia de vi-tamina A en terneros. Esta alteración es más manifiesta y ocurre en primer lugar en el extremo bucal del conducto principal de la glán-dula parotídea.
Foto 1a) Metaplasia de conductos interlobulillares parotídeos.
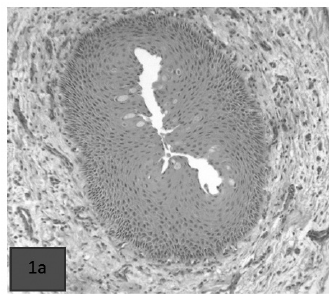
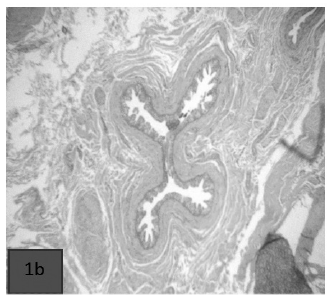
Foto 1b) Conductos interlobulillares parotídeos normales.
Diagnóstico
El diagnóstico se realiza midiendo los niveles plasmáticos de vitamina A, (cuyo rango normal es de 25 a 60 microgramos/decilitros, apareciendo los signos clínicos con niveles inferiores a 5 microgramos/decilitros), determinando la concentración de vitamina A en tejido hepático, (rango normal es de 4 microgramos/decilitro, apareciendo la signología clínica con niveles inferiores a 2 micro-gramos/decilitro). Los hallazgos microscópicos en los tejidos anteriormente mencionados confirman el diagnóstico.
Tratamiento
Los animales que muestran una deficiencia aguda deben ser tratados de inmediato a una dosis de 10 a 20 veces los requerimientos diarios.
En términos generales se utiliza una dosis de 440 UI/kg de peso corporal, de una formulación acuosa y no oleosa por vía intramuscular. La respuesta al tratamiento en casos de deficiencia aguda grave es generalmente rápida y completa, pero en casos crónicos es irre-versible. Como ejemplo de esto último son los animales que sufren la forma ocular de la deficiencia, no responden al tratamiento y deben ser sacrificados, de lo contrario son los terneros que sufren la forma convulsiva por aumento de la presión del líquido cefalorraquídeo, estos recuperan su estado normal a las 48 horas de realizado el tratamiento.
Prevención y Control
La vitamina A puede ser administrada por vía oral diariamente o en casos de que esto no sea posible existen suplementos proteicos, los cuales contienen concentraciones altas de vitamina A (10 a 15 veces las necesida-des diarias), estos se administran una vez a la semana y permiten la formación de reservas hepáticas de la misma.
Cuando la suplementación oral no es posible, existe la alternativa de la administración parenteral, mediante la aplicación intramuscular de vitamina A en una dosis de 3000 a 6000 UI/kg, con un intervalo de 50 a 60 días entre dosis. La formación de reservas hepáticas de vitamina A por esta vía se mantiene durante 50 a 60 días. En animales gestantes es fundamental que la última aplicación sea administrada 30 días antes del parto, de esta manera aseguramos la formación de reservas hepáticas de vitamina A en el ternero, y que existan concentraciones suficientes en el calostro.
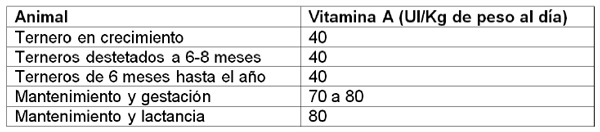
Requerimientos diarios de vitamina A por animal.
MIOPATÍA NUTRICIONAL CON DESPLAZAMIENTO DORSAL BILATERAL DE LA ESCAPULA EN BOVINOS
La miopatía nutricional es una patología asociada a la deficiencia de selenio (Se) y/o vitamina E (Vit. E) que se encuentra ampliamente descripta en la bibliografía veterinaria bajo la denominación de “enfermedad del músculo blanco”. En bovinos se caracteriza por afectar la musculatura esquelética o cardíaca, produciéndose cuadros que, dependiendo del sitio de lesión, pueden incluir claudicación, dificul-tad respiratoria, intolerancia al movimiento, decúbito y muerte. En general se afectan con mayor frecuencia animales menores a seis meses de vida, pudiendo inclusive adquirir esta afección un comportamiento endémico.
En animales de mayor edad, la afección clínica es mucho menos frecuente, observándo-se en algunos casos una mayor afección de la musculatura subescapular, principalmente el músculo serrato ventral, que es una de las principales estructuras anatómicas encarga-da de fijar la escápula al tórax del animal. La rotura de esta fijación muscular provoca la dislocación hacia dorsal de las escápulas y el consecuente desplazamiento hacia ventral del tórax del animal, lo que ha sido denomi-nada vulgarmente como “escápula voladora.
Es importante considerar igualmente, que la asociación de este tipo de cuadros con la de-ficiencia de Se o Vit E. no es del todo clara, ya que si bien se han reportado cuadros en los que se constató la deficiencia conjunta de ambos compuestos, solo de Se o solo de Vit. E., también se han registrado casos en los que los valores de ambos compuestos eran nor-males.
El selenio es un nutriente esencial para los animales porque forma parte de enzimas las cuales llevan a cabo la función de protección de membranas celulares evitando reacciones oxidativas a partir de radicales derivados del oxígeno, los cuales en exceso producen daños oxidativos tisulares.
Esta patología se presenta comúnmente en terneros de 2 a 4 meses de edad, con crecimiento rápido y bien alimentados, poco después de un ejercicio excesivo produciéndose generalmente la presentación de la enfer-medad en músculo esquelético y cardíaco.
También se presenta en animales mayores a un año, principalmente alimentados con grano y asociado a factores de estrés, en forma subaguda donde se ve afectada la musculatura esquelética.
Signos clínicos
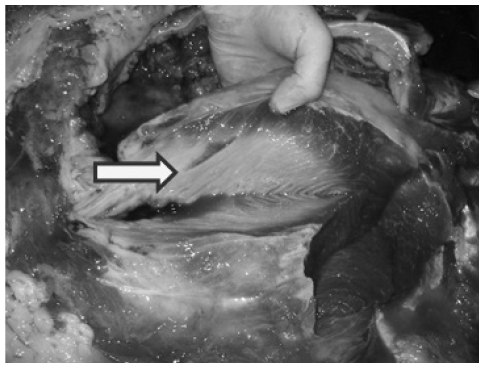
Se observan en el transcurso de una semana e incluyen rigidez, decúbito, mioglobinu-ria, taquipnea y disnea, puede haber fiebre transitoria debido a efectos pirógenos de la mioglobinemia y el dolor. En los casos más graves se presenta la dislocación bilateral dorsal de las escápulas.
Foto 1. Desplazamiento escapular

Foto 2. Músculo con aspecto de carne de pescado
Necropsia
El aspecto y lesiones del músculo son constantes, simétricas. Los músculos afectados, principalmente en el músculo serrato, se evidencian zonas grisáceas o blancas de degeneración con aspecto de carne de pes-cado (Foto2), adoptando a veces disposición en bandas o estrías que abarca un grupo de fibras musculares y discurren a lo largo de un musculo de centro aparentemente normal.
En el diafragma, la distribución de las bandas distróficas da al órgano un aspecto es-triado radialmente. El músculo afectado es de aspecto friable y edematoso, y en ocasio-nes se presentan focos de calcificación. En casos con afección del miocardio se apre-cian áreas blancas de degeneración, principalmente sub endocárdicas del ventrículo izquierdo.
Cambios microscópicos
Las lesiones musculares no son inflamatorias; hay degeneración hialina y subsecuente necrosis coagulativa, caracterizada por una lesión de tipo polifásica con áreas de mine-ralización.
Tratamiento
Se basa en la aplicación de selenio inyectable. La formulación varía, se puede inyectar selenato o selenito de sodio a dosis de 0,1 mg/kg de peso vivo que permiten mantener concentraciones adecuadas por 6 meses. Otro tratamiento es la aplicación de selenato de bario el cual es más seguro debido a su lenta liberación desde el lugar de inyección. La do-sis recomendada es de 1 mg/kg de peso vivo subcutáneo el cual se mantiene por 5 meses en concentraciones adecuadas. La respuesta al tratamiento se hace notable 30 días posteriores al tratamiento debido a que el organis-mo tiene que resintetizar la enzima Glutation peroxidasa que se encuentra dentro de los eritrocitos para lo cual debe sintetizar nuevamente eritrocitos.
La suplementación oral es una alternativa para su prevención. En ganado de engorde la dosis recomendada es de 0,1 mg/kg MS, esta dosis se puede incrementar si hay déficit de Vitamina E o exceso de sulfatos en la dieta.
- Agriculture Victoria, Grass tetany (Hypo-magnesemia) in beef cattle, Note Number: AG0579, Revised by David Champness, Ha-milton Updated: June 2007.
- Cantón G, Odriozola E, Cseh S. Análisis de casos de hipomagnesemia en bovinos de pro-ducción de carne diagnosticados en Inta EEA Balcarce (1998-2013). Ergomix. Publicado el: 11/6/2014.
- Contreras, P. Congreso de la Sociedad Es-pañola de Medicina Interna Veterinaria. León, España. Pp: 20-29. 2002.
- Gould DH. Polioencephalomalacia. J Anim Sci 76: 309-314. 1998.
- Hill BD, Holroyd RG and Sullivan M. Clini-cal and pathological finding associated with congenital hypovitaminosis A in extensive-ly grazed beef cattle. Australian Veterinary Journal Volume 87, No 3, March 2009.
- İssi M, Gül Y. Case reports: hypovitaminosis A coupled to epilepsy in four calves, Revue Méd. Vét, 161, 8-9, 387-390, 2010.
- Jensen R, Griner LA, Adams OR. Polioen-cephalomalacia of cattle and sheep. J Am Vet Med Assoc 129: 311-321. 1956.
- Mc Coy MA, Goodall EA., Kennedy DG. Vete-rinary Record. 138:41-43. 1996
- Mc Coy MA. Magnesium Research. 17(2):137-145. 2004.
- McAllister MM, Gould DH, Raisbeck MF, Cummings BA, Loneragan GH. Evaluation of ruminal sulfide concentrations and seasonal outbreaks of polioencephalomalacia in beef cattle in a feedlot. J Am Vet Med Assoc 211: 1275-1279, 1997.
- Niles GA, Morgan SE, Edwards WC. Case re-port - sulfur-induced polioencephalomalacia in beef steers consuming high sulfate water. Bov Pract 36: 101–104, 2002.
- Olson, JA. Vitamin A. In “Handbook of Vi-tamins,” (Machlin LJ, ed.). Marcel Dekker, Inc., New York, 1984.
- Parker EM, Gardiner CP, Kessell AE and Parker AJ. Hypovitaminosis A in extensive-ly grazed beef cattle. Australian Veterinary Journal Volume 95, No 3, March 2017.
- Van Der Lugt. JJ. & Prozesky. L. Thepatholo-gy of blindness in new-born calves caused by hypovitaminosis A. Onderstepoor Journal of Veterinary Research. 56, 99-109,1989.
- Van Donkersgoed J and Clark EG. Blindness Caused by Hypovitaminosis A in Feed lot Cattle. Can Vet J Volume 29, November 1988.
- Buergelt, CD, Sisk D, Chenoweth PJ, Gamboa J y Nagus R. Nutritional myodegeneration as-sociated with dorsal scapular displacement in beef heifers. J.Comp. Path. 114(4): 445-450, (1996).
- Gunnings RF and Walters RJ. “Flying scapu-las”, a post turnout myopathy in cattle. Vet. Rec. 135(18): 433-434, (1994).
- Hannam, D.A.R.; Holden, L.R.; Jeffrey, M. y Twiddy, N. Flying scapula of cattle. Vet. Rec. 134(14): 356, (1994).
- Mearns, R. y Lewis, H. “Flying scapula” in cattle. Vet. Rec. 161(3): 107-108, (2007).
- Osweiler, G.D.; Carr, T.F.; Sanderson, T.P.; Carson, T.L.; Kinker, J.A Water deprivation-sodium ion toxicosis in cattle. J. Vet. Diagn. Invest. 7(4): 583-585, (1995).
- Radostis, O.M.; Gay, C.C.; Hinchcliff, K.W. y Constable, P.D. Chapter 30: Diseases associ-ated with nutritional deficiencies. En: Veteri-nary Medicine. A textbook of the diseases of cattle, horses, sheep, pigs and goats 10th Ed. Saunders Ltd., Elsevier, España, pp. 1691-1783, (2007).
- Rucker, R.B.; Fascetti, A.J. y Keen, C.L. Chap-ter 22. Trace minerals. En: Kaneko, J.J.; Harvey, J.W. y Bruss, M.L. (eds.). Clinical biochemistry of domestic animals. 6th ed. Academic Press, San Diego (EEUU), pp. 663-693, (2008).
- Van Vleet, J.F. y Valentine, B.A. Chapter 2. Muscle and tendón. En: Grant Maxie, M. (ed.). Jubb, Kennedy and Palmer’s. Pathology of do-mestic animals, 5th.Ed. Vol.1. Saunders Elsevi-er, Philadelphia (EEUU), pp. 185-280, (2007).
Contenido del evento:
Temas relacionados:
Autores:

Referentes que Recomendaron :
Oscar PerusiaRecomendar
Comentar
Compartir
Agropecuaria Tayanga
28 de abril de 2024
Retomando el tema de las vacas aladas. Quisiera realizar algunos comentarios que me agradaria conocer sus opiniones.
En nuestra región diferenciamos bien dos tipos de vas lecheras :
Las vacas frágiles de osamenta delgada y fina muy perfiladas con la característica que dan mucha leche (hablamos de campañas sobre los 9000 kilos año), pero que lamentablemente no duran en el establo y en tres o máximo cuatro partos tenemos que descartarlas para camal, con problemas de las ubres o por que simplemente no preñan
Las vacas fuertes o con mucha fortalez son vacas que no superan campañas de 6000 kilos año pero que nos dan una cria casi todos los años y que viven en nuestros establos hasta 8 en algunos casos.
En los catálogos de USA ellos identifican muy bien la forma lechera con la amplitud de pecho de las vacas, siempre pense que ello permite una mejor oxigenación y por lo tanto una mayor producción lechera.
Mi observación refiere a que gran cantidad de vacas frágiles y de muy buenas producciones son de la característica de vacas aladas.
Gracias por sus opiniones.
Raul
En nuestra región diferenciamos bien dos tipos de vas lecheras :
Las vacas frágiles de osamenta delgada y fina muy perfiladas con la característica que dan mucha leche (hablamos de campañas sobre los 9000 kilos año), pero que lamentablemente no duran en el establo y en tres o máximo cuatro partos tenemos que descartarlas para camal, con problemas de las ubres o por que simplemente no preñan
Las vacas fuertes o con mucha fortalez son vacas que no superan campañas de 6000 kilos año pero que nos dan una cria casi todos los años y que viven en nuestros establos hasta 8 en algunos casos.
En los catálogos de USA ellos identifican muy bien la forma lechera con la amplitud de pecho de las vacas, siempre pense que ello permite una mejor oxigenación y por lo tanto una mayor producción lechera.
Mi observación refiere a que gran cantidad de vacas frágiles y de muy buenas producciones son de la característica de vacas aladas.
Gracias por sus opiniones.
Raul
Recomendar
Responder

31 de agosto de 2022
Hola Ernesto, mis saludos y felicitaciones por tan interesante artículo.Coincido en un todo con lo que describes y además tengo material fotográfico que respalda todo lo que dices en el artículo.
Recomendar
Responder
Agropecuaria Tayanga
29 de junio de 2022
En una ganaderia ubicada a 3200 msnm he observado una vaca sumamente alada , cuando se recuesta y aun cuando esta parada se nota que las paletas se encuentran abiertas a parte de ello solo muestra las heces bastante sueltas con relacion al resto del ganado a pesar de consumir un aprox de 55 kg de forraje (ray gras y 4 kg de concentrado.
Me gustaría conocer su opinion.
saludos desde el norte del Peru Raul
Recomendar
Responder


FIGAP - Exposición Internacional
FIGAP es la Exposición Mexicana de caracter Internacional vinculada a la industria de alimentos balanceados, salud, nutrición y genética en producción anima
Enlace recomendado
Recomendar
Responder
30 de julio de 2022
Estimado Dr. Odriozola:
Excelente artículo.
Muchas gracias por compartir sus conocimientos.
Soy médico veterinario y asesoro varios planteles crianceros en el sur de Chile.
Recomendar
Responder

¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.
Usuarios destacados en Ganadería

Eduardo Martellotto  Instituto Nacional de Tecnología Agropecuaria - INTA
Instituto Nacional de Tecnología Agropecuaria - INTA

Ing. Agr. Investigador INTA
Estados Unidos de América
Estados Unidos de América





