Listeria monocytogenes: persistencia o resistencia
Publicado: 8 de marzo de 2023
Por: Verónica Yepes Medina, BSC, MSC (E).
Introducción
Listeria monocytogenes (Lm) es el agente causal de la listeriosis, una enfermedad esporádica en humanos y animales pero con altos casos de hospitalización y alta tasa de fatalidad, considerado como una de las más serias enfermedades transmitidas por alimentos. Un estimado de 1600 casos de listeriosis son reportados cada año y se asocian hasta 200 muertes. [1]–[6]. Es un anaerobio facultativo, no formador de esporas que se adapta fácilmente a los cambios de las condiciones ambientales. La habilidad de crecer en un amplio de rango de temperaturas(0-45ºC), actividad de agua (aw= 0.92), pH (4,3- 9,6) y salinidad (10% NaCl) determina la presencia en agua, suelo, vegetales en descomposición y alimentos para animales y humanos.[6]–[8].
El primer caso de listeriosis fue reportado en 1926 durante un brote que afectó conejos y cerdos; en 1935 Burn mostró que causaba infecciones neonatales. En 1970 fue reconocido como el agente etiológico de una enfermedad humana y en 1980 fue identificado como patógeno transmitido por alimentos. El primer brote ligado directamente con consumo de alimentos contaminados fue reportado en 1983 y asociado con repollo usado en una ensalada. Desde ese momento han sido numerosos los brotes relacionados con una amplia variedad de alimentos, resultando en extensos y costosos retiros de alimentos del mercado.
La contaminación de los alimentos puede ocurrir en diferentes puntos de la cadena de producción, empaque y distribución. La dosis infectiva depende de la condición inmune del hospedero, un alimento contaminado con hasta 109 bacterias consumido por una persona inmunocompetente sólo experimentan una severa gastroenteritis, pero en el caso de niños, adultos mayores, mujeres embarazadas e individuos inmunocomprometidos solo se requiere de 102-104 bacterias para producir sepsis bacteriana y meningitis y/o infección del feto, resultando en aborto o complicaciones en el embarazo.[1], [4], [9], [10]. Lm tiene una alta tasa de mortalidad entre los microorganismos transmitidos por alimentos, correspondiente al 25-50%. La bacteria tiene la habilidad de colonizar e infectar la placenta causando infecciones fetales o abortos. [8], [10], [11].
Este saprófito es un patógeno intracelular facultativo que es capaz de causar enfermedades severas invasivas en poblaciones susceptibles (niños, mujeres embarazadas, adultos mayores)[5], [10]. Las infecciones de Lm son más comúnmente asociadas con enfermedades transmitidas por alimentos que involucran lácteos, cárnicos, alimentos refrigerados, de mar y vegetales.[5], [12]. Adicionalmente, puede proliferar en superficies en contacto directo con el alimento, mientras resiste a elevadas concentraciones de antimicrobianos y productos antisépticos. La tolerancia al stress y la virulencia pueden ser considerados como parte de la biología de la bacteria, las respuestas de tolerancia al stress adaptativo son. La fuerza impulsora detrás de la capacidad de supervivencia de Lm en diferentes ambientes, dentro de los alimentos y, en última instancia, la capacidad de causas infecciones humanas. Aunque las respuestas adaptativas al stress bacteriano son principalmente una necesidad para la supervivencia en los alimentos y el medio ambiente, algunos aspectos de las respuestas al stress ácido y osmótico pueden proteger al patógeno contra stress similar en el trato gastrointestinal (GIT) y, por lo tanto, ayudar directamente a su potencial de virulencia. Esta transición está controlada por dos redes transcripcionales superpuestas e interconectadas para la respuesta al stress general (regulada por el factor Sigma B (SigB) y la virulencia (regulada por el factor positivo A (PrfA)).[4], [5], [8], [10] [13].
Filogenia Listeria
El género Listeria actualmente incluye 21 especies de bacilos Gram-Positivos encontrados en diferentes ambientes, sin embargo, fue inicialmente clasificada en 13 serotipos, basado en la aglutinación del antígeno somático (O) y el antígeno flagelar (H), con solamente tres (1/2a, 1/2b y 4b) causando más del 90% de las infecciones humanas invasivas. Después de la caracterización y diferenciación a través de métodos moleculares como la electroforesis de campo pulsado (PFGE) y la secuenciación multilocus (MLST) se mostró que 1.Lm forma una población estructurada consistente en 4 linajes divergentes (I-IV) y 2. Los aislados forman dos grupos de cepas genéticamente similares, llamados complejos clonales (CCs). Cada linaje incluye serotipos específicos: linaje I corresponde a los serotipos 1/2b, 3b, 4b, 4e y 7; linaje II, serotipos 1/2a, 1/2c, 3a y 3c; linaje III, serotipos 4b, 1/2a, 4a, 4c y linaje IV, serotipos 4a y 4c. Las cepas con mayor relevancia clínica se encuentran en los linajes I y II, las principales epidemias son asociadas con aislados del linaje I y más específicamente con el serotipo 4b, representando el 95% de los casos humanos [2], [3], [5], [6], [9], [12], [14].
Dos especies de Listeria, Lm y Listeria ivanovii han sido consideradas históricamente patógenos. Lm infecta animales y humanos y es en su género la especie zoonótica de mayor importancia en la salud pública y economía global. Listeria ivanovii ha sido considerada como patógeno de rumiantes principalmente, los casos humanos son raros, involucrando pacientes inmunocomprometidos debilitados. Las dos explicaciones que soportan la baja ocurrencia en L.ivanovii en humanos son: 1. Estás especies podrían tener baja patogenicidad para los humanos o 2. La ocurrencia esporádica y limitada distribución en la naturaleza (incluyendo alimento) de L. ivanovii podría limitar la exposición de los humanos a esta bacteria [3]. Por su parte L.innocua fue inicialmente considerada una especie no-hemolítica y no-patogénica, sin embargo, los aislados de L.innocua poseen una isla de patogenicidad funcional (LIPI-1) y una internalina A (inLA), los cuales codifican para factores de virulencia importantes para la etapa de infección intestinal, la entrada a las células hospederas y la adaptación a la vida intracelular. L. innocua atípicas pueden atravesar la barrera intestinal e invadir órganos como el hígado y el bazo.[3]
Biología celular del proceso de infección
La capacidad de Lm para sobrevivir y multiplicarse dentro del tracto gastrointestinal para la infección inicial, la persistencia y la transmisión se da porque la bacteria está bien adaptada a este entorno y produce múltiples factores para competir con la microbiota y contrarrestar los pépticos antimicrobianos, la acidez, la hiperosmolaridad, la hipoxia, la bilis y la privación de hierro[14].
La patogenicidad de Lm está determinada por un grupo de genes de virulencia que están agrupados en las islas de patogenicidad 3 y 4 (LIPI-3, LIPI-4) que son asociadas con severas infecciones en humanos. Los factores de virulencia incluyen 5 etapas cruciales: adhesión, invasión, reproducción motilidad y diseminación intercelular dentro del hospedero y juegan un papel clave en la virulencia y resistencia contra la inmunidad. Los principales determinantes de virulencia incluyen internalinas codificadas por los genes inlA, inlC y inlj, listeriolisina codificada por hlyA, actina codificada por actA y las proteínas asociadas con la invasión codificados por el gen iap. [12]
Después de la ingestión de un alimento contaminado por el hospedero Lm encuentra y atraviesa el epitelio intestinal hasta la lámina propia y se disemina vía linfática y sangre a través de órganos diana como el hígado y el bazo (Gráfica 1). Esta bacteria puede atravesar la barrera hemato-encefálica en individuos inmunocomprometidos o la barrera fetoplacentaria en mujeres embarazadas y causar meningitis, sepsis, partos prematuros o abortos, esto se debe a la E-cadherina, una proteína de unión epitelial que se encuentra en abundancia en la barrera hematoencefálica, así como en la barrera placentaria-fetal, lo que puede explicar por qué la bacteria puede infectar a los recién nacidos y causar meningitis. Lm puede ser internalizada en células fagocíticas y no fagocíticas. A diferencia de la entrada en las células fagocíticas, que es mediada por el fagocito, la entrada en las células no fagocíticas es iniciada por las bacterias que co-optan la maquinaria de endocitosis mediada por el receptor celular. En las células caliciformes, pueden transitar a través de la célula dentro de una vacuola y en algunos macrófagos, puede replicarse en fagosomas espaciosos que contienen Listeria (SLAPs). Al escapar de la vacuola, Lm polimeriza posteriormente la actina y puede propagarse de célula a célula. De hecho, uno de los rasgos distintivos de la infección por Lm es la notable capacidad de la bacteria para entrar en células no fagocíticas. La internalina A (InIA) y la InIB, dos miembros de una familia de 25 proteínas denominadas internalinas, se unen a los receptores de la membrana de las células eucariotas, E-cadherina y la primera etapa requiere nucleación de la actina y polimerización lo que dirige la reorganización del citoesqueleto. En la mayoría de los casos, la bacteria escapa de la vacuola por disrupción física de la membrana vacuolar a través de la actividad de factores potentes de virulencia como la listeriolisina O(LLO), la fosfolipasa A (PlcA) y la fosfolipasa B (PlcB). Lm puede sobrevivir y dividirse en el citosol de las células del hospedero y alterar funciones celulares de este. La LLO también provoca cambios en la modificación de las histonas, la fisión mitocondrial, el estrés del retículo endoplásmico (RE) y la permeabilización lisosomal, todo lo que puede ocurrir por la actividad formadora de poros de la LLO extracelular (Gráfica 2).[9], [12], [14].
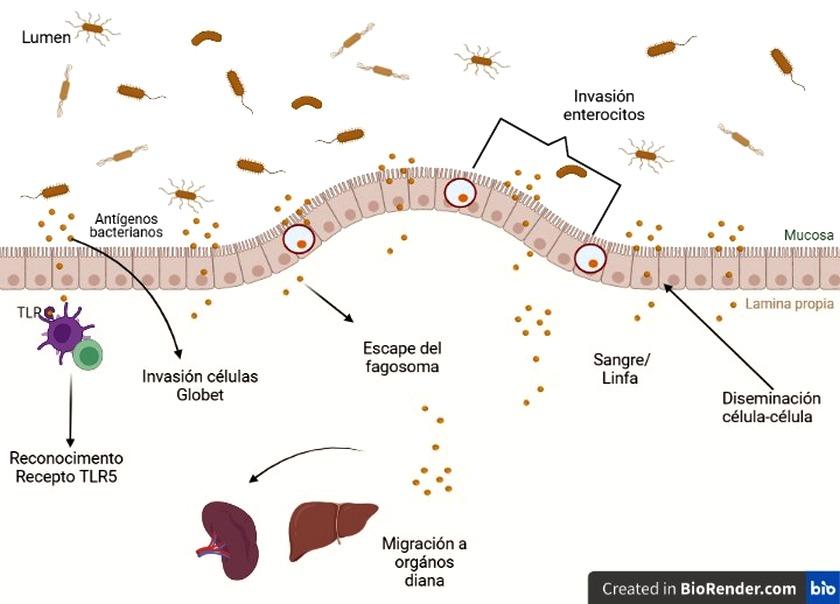
Gráfica 1: representación esquemática de infección de Listeria monocytogenes
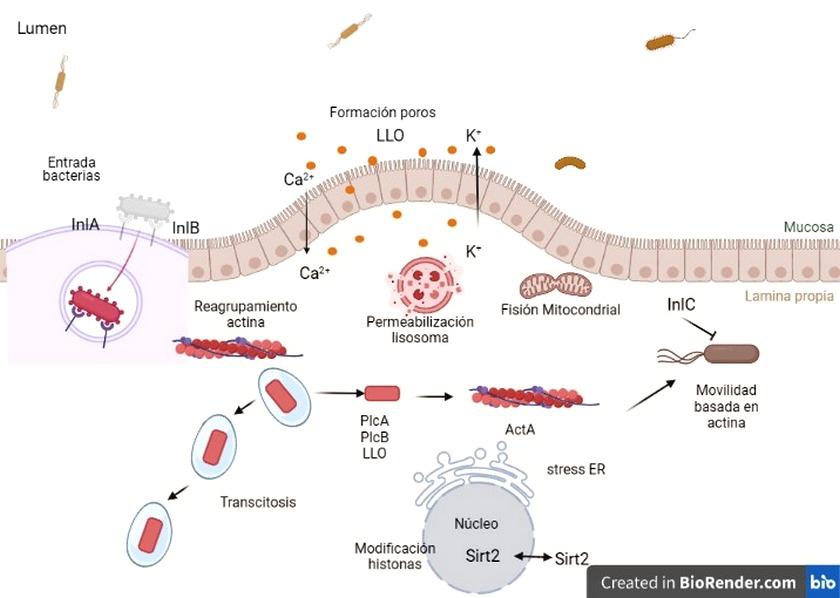
Gráfica 2: Representación esquemática de factores de virulencia de Listeria monocytogenes
Tras la infección, Lm puede manipular la transcripción de las células del huésped e inducir modificaciones epigenéticas. Trabajos recientes han puesto de relieve una nueva clase de factores de virulencia bacteriana que pueden modular directa o indirectamente la expresión génica para ajustar la respuesta inmunitaria innata a los patógenos invasores. Estos factores, denominados nucleomodulinas, son secretadas por la bacteria en el citoplasma de la célula y desde allí pueden llegar al núcleo y ejercer sus funciones específicas. La primera nucleomodulina de Lm que se ha identificado se denomina proteína A dirigida al núcleo de Listeria (LntA). La LntA interactúa con la proteína que reprime la cromatina, la proteína que contiene el dominio de homología adyacente 1 (BAHD1), para despresionar ISGs específicas de forma dependiente del interferón tipo III, lo que paradójicamente beneficia al patógeno. La interacción LntA-BAHD1 es directa, la abrogación de esta interacción inhibe el efecto de LntA sobre los ISG y su colonización con BAHD1 en el núcleo. La Lm también secreta di-AMP cíclico y libera otros patrones moleculares asociados a patógenos (PAMP) durante la infección, los cuales activan la respuesta inmunitaria celular.[9].
Listeriosis
Hay dos tipos principales de listeriosis: una forma no invasiva y una forma invasiva (Gráfica 3). La listeriosis no invasiva (gastroenteritis febril por Listeria) es una forma leve de la enfermedad que afecta principalmente a personas sanas. Los síntomas incluyen diarrea, dolor de cabeza y mialgia (dolor muscular). El período de incubación es corto (unos pocos días). Los brotes de esta enfermedad generalmente han implicado la ingestión de alimentos que contienen altas dosis de Lm.[15]
La listeriosis invasiva es una forma más grave de la enfermedad y afecta a determinados grupos de población de alto riesgo. Estos incluyen mujeres embarazadas, pacientes en tratamiento por cáncer, SIDA y trasplantes de órganos, ancianos y niños. Esta forma de enfermedad se caracteriza por síntomas graves y una alta tasa de mortalidad (20%-30%). Los síntomas incluyen fiebre, mialgia, septicemia, meningitis. El período de incubación suele ser de una a dos semanas, pero puede variar entre unos pocos días y hasta 90 días. [16]
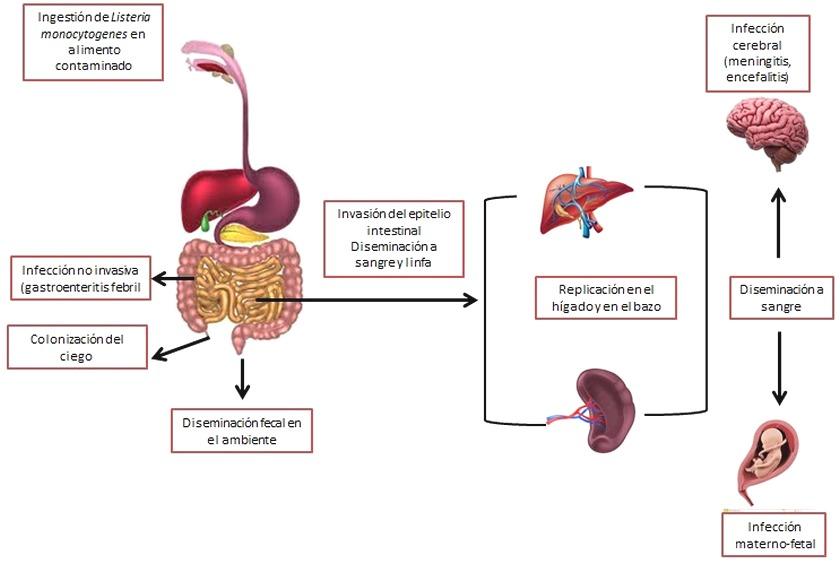
Gráfica 3: Representación esquemática de la enfermedad listeriosis.
Las mujeres embarazadas tienen una probabilidad 20 veces mayor de contraer listeriosis que otros adultos sanos. Puede resultar en un aborto espontáneo o muerte fetal. El recién nacido también puede tener bajo peso al nacer, septicemia y meningitis. Las personas con VIH/SIDA tienen al menos 300 veces más probabilidad de enfermarse que aquellas con un sistema inmunitario que funciona normalmente. [15]–[17]
Respuesta inmune
La eliminación de Lm se basa principalmente en la capacidad del hospedero para iniciar una respuesta celular eficiente a la infección. En particular el destinado de la infección depende del nivel de activación de los macrófagos y de la capacidad de Listeria para contrarrestar los mecanismos bactericidas de las células hospederas[14]. La infección es una interacción compleja entre el huésped y el patógeno. El modelo de listeriosis murina permite una disección cuidadosa de factores tanto del huésped como bacterianos que son importantes para la infección y la inmunidad. El resultado de la infección depende de la eficacia de la respuesta inmunitaria del huésped contra un patógeno en particular. En el caso de Lm, tanto la inmunidad innata como la adaptativa son fundamentales para controlar la infección de la bacteria intracelular. La infección es reconocida primero por el sistema inmunitario innato, lo que conduce a la rápida producción de factores antimicrobianos, así como de quimiocinas y citocinas que ayudan en el inicio de la respuesta inmunitaria adaptativa. El antígeno de Lm presentado por las CD impulsa fuertes respuestas de células T CD4 y CD8 que dan como resultado una población estable de Lm: células T de memoria específicas. Esto ha convertido a la infección por Lm en un modelo útil para estudios recientes relacionados con vacunas en la generación, el mantenimiento y las respuestas de desafío de las células T de memoria. Además, como patógeno intracelular citosólico, Lm es un modelo ideal para el floreciente campo del reconocimiento intracelular.[18], [19]
Tratamiento
La naturaleza intracelular de Listeria hace difícil su tratamiento. Muchos antibióticos han demostrado su actividad in vitro contra la bacteria pero la mayoría de ellos han demostrado ser solamente bacteriostáticos en el ambiente intracelular, por lo que se ha incluido el uso de plantas medicinales y sus metabolitos secundarios por sus efectos antimicrobianos para Lm. Los fitoquímicos bioactivos, los antioxidantes y los monoterpenos, los sesquiterpenos, la cumarina, los flavonoides, los taninos, las saponinas, los alcaloides y los terpenoides son los principales ingredientes de las plantas medicinales contra la listeriosis. La derivación de estos compuestos y los estudios farmacológicos complementarios pueden demostrar su uso como fármacos contra Lm y otras bacterias patógenas.[20]
Prevención y Control
Lm está muy extendida y contamina una amplia gama de alimentos y productos de origen animal y vegetales, debido a las malas condiciones higiénicas. Lm puede multiplicarse a niveles muy peligrosos, incluso a temperaturas de refrigeración durante su distribución y almacenamiento. Por lo tanto existe una necesidad urgente de controlar Lm en todas las etapas de las cadenas alimentarias y gestionar su infección en los animales [21]. Debido a los importantes riesgos para la seguridad, el control de Lm se ha convertido en un requisito reglamentario al que deben adherirse los operadores de empresas alimentarias. La limpieza, desinfección y sanitización periódicas de las superficies en contacto con los alimentos y las que no están en contacto con los alimentos son necesarias como parte de un plan de saneamiento que también incorpora mantenimiento de los equipos y los edificios, el control de plagas y la higiene general. Además de la implementación de buenas prácticas de fabricación y un plan eficaz de análisis de peligros y puntos críticos de control ayuda a reducir el riesgo de enfermedades transmitidas por los alimentos [22].
Otra crisis en las infecciones por Lm es la amplia propagación de la resistencia a los antimicrobianos. La resistencia adquirida a los fármacos antimicrobianos se correlaciona más con los aislados de alimentos a cuatro clases de antibióticos: penicilinas, quinolonas, aminoglucósidos y macrólidos. Este es un gran problema para la salud pública, ya que puede representar un desafío en el tratamiento de la listeriosis. La resistencia antimicrobiana en Lm puede atribuirse a la adquisición de genes de resistencia a los antibióticos de otros patógenos. Además, la adquisición de transposones conjugativos, genes asociados al eflujo activo y mutaciones ribosómicas y cromosómicas son los principales mecanismos de resistencia de Lm[21]
Se han desarrollado y aplicado varias estrategias para la eliminación de Lm de la cadena alimentaria. Una de ellas es la tecnología de procesamiento por irradiación con rayos gamma. El enfoque ha demostrado ser seguro y es un método probado que se utiliza en todo el mundo para la conservación de productos alimenticios. Otro método de eliminación de patógenos y de los entornos de producción de alimentos, es la aplicación de ozono, método ecológico que está clasificado como seguro (GRAS). Y un nuevo método biológico alternativo de control de Lm a lo largo de la cadena alimentaria es el uso de fagos, estos se consideran una herramienta eficaz contra los patógenos bacterianos, ya que sólo se dirigen a su organismo específico y no interfieren con otros microorganismos [23].
Referencias
- [1] A. Stoller, M. J. A. Stevens, R. Stephan, and C. Guldimann, “Characteristics of listeria monocytogenes strains persisting in a meat processing facility over a 4-year period,” Pathogens, vol. 8, no. 1, Mar. 2019, doi: 10.3390/pathogens8010032.
- [2] P. M. K. Njage et al., “Quantitative microbial risk assessment based on whole genome sequencing data: Case of listeria monocytogenes,” Microorganisms, vol. 8, no. 11, pp. 1–24, Nov. 2020, doi: 10.3390/microorganisms8111772.
- [3] J. J. Quereda et al., “Pathogenicity and virulence of Listeria monocytogenes: A trip from environmental to medical microbiology,” Virulence, vol. 12, no. 1. Taylor and Francis Ltd., pp. 2509–2545, 2021. doi: 10.1080/21505594.2021.1975526.
- [4] M. I. Hossain et al., “Listeria monocytogenes biofilm inhibition on food contact surfaces by application of postbiotics from Lactobacillus curvatus B.67 and Lactobacillus plantarum M.2,” Food Research International, vol. 148, Oct. 2021, doi: 10.1016/j.foodres.2021.110595.
- [5] G. Centorotola et al., “Intensive environmental surveillance plan for listeria monocytogenes in food producing plants and retail stores of central italy: Prevalence and genetic diversity,” Foods, vol. 10, no. 8, Aug. 2021, doi: 10.3390/foods10081944.
- [6] B. Félix et al., “A European-wide dataset to uncover adaptive traits of Listeria monocytogenes to diverse ecological niches,” Sci Data, vol. 9, no. 1, Dec. 2022, doi: 10.1038/s41597-022-01278-6.
- [7] S. Zamuz, P. E. S. Munekata, C. K. O. Dzuvor, W. Zhang, A. S. Sant’Ana, and J. M. Lorenzo, “The role of phenolic compounds against Listeria monocytogenes in food. A review,” Trends in Food Science and Technology, vol. 110. Elsevier Ltd, pp. 385–392, Apr. 01, 2021. doi: 10.1016/j.tifs.2021.01.068.
- [8] N. Wiktorczyk-Kapischke, K. Skowron, K. Grudlewska-Buda, E. Wałecka-Zacharska, J. Korkus, and E. Gospodarek-Komkowska, “Adaptive Response of Listeria monocytogenes to the Stress Factors in the Food Processing Environment,” Frontiers in Microbiology, vol. 12. Frontiers Media S.A., Aug. 19, 2021. doi: 10.3389/fmicb.2021.710085.
- [9] L. Radoshevich and P. Cossart, “Listeria monocytogenes: Towards a complete picture of its physiology and pathogenesis,” Nature Reviews Microbiology, vol. 16, no. 1. Nature Publishing Group, pp. 32–46, 2018. doi: 10.1038/nrmicro.2017.126.
- [10] N. F. D. Silva, M. M. P. S. Neves, J. M. C. S. Magalhães, C. Freire, and C. Delerue-Matos, “Emerging electrochemical biosensing approaches for detection of Listeria monocytogenes in food samples: An overview,” Trends in Food Science and Technology, vol. 99. Elsevier Ltd, pp. 621–633, May 01, 2020. doi: 10.1016/j.tifs.2020.03.031.
- [11] P. D. McMullen and N. E. Freitag, “Listeria monocytogenes,” in Molecular Medical Microbiology, Elsevier, 2014, pp. 1345–1361. doi: 10.1016/B978-0-12-397169-2.00074-3.
- [12] E. E. Abdeen et al., “Prevalence, antibiogram and genetic characterization of listeria monocytogenes from food products in Egypt,” Foods, vol. 10, no. 6, Jun. 2021, doi: 10.3390/foods10061381.
- [13] T. Sibanda and E. M. Buys, “Listeria monocytogenes Pathogenesis: The Role of Stress Adaptation,” Microorganisms, vol. 10, no. 8. MDPI, Aug. 01, 2022. doi: 10.3390/microorganisms10081522.
- [14] O. Dussurget, H. Bierne, and P. Cossart, “The bacterial pathogen Listeria monocytogenes and the interferon family: Type I, type II and type III interferons,” Frontiers in Cellular and Infection Microbiology, vol. 4, no. APR. Frontiers Media S.A., 2014. doi: 10.3389/fcimb.2014.00050.
- [15] D. Rogalla and P. A. Bomar, “Listeria monocytogenes,” National Library of Medicine. National Center for Biotechnology Information, Jul. 04, 2022.
- [16] World Health Organization, “Listeriosis,” World Health Organization, Feb. 20, 2018.
- [17] U.S.FOOD & DRUG ADMINISTRATION, “Listeria (listeriosis),” FDA U.S FOOD & DRUG ADMINISTRATION, Jul. 20, 2022.
- [18] L. A. Zenewicz and H. Shen, “Innate and adaptive immune responses to Listeria monocytogenes: A short overview.”
- [19] S. E. F. D’orazio, “Innate and Adaptive Immune Responses during Listeria monocytogenes Infection,” 2019, doi: 10.1128/microbiolspec.
- [20] M. Rafieian-Kopaei, K. Saki, M. Bahmani, S. Ghafourian, N. Sadeghifard, and M. Taherikalani, “Listeriosis Phytotherapy: A Review Study on the Effectiveness of Iranian Medicinal Plants in Treatment of Listeriosis,” J Evid Based Complementary Altern Med, vol. 22, no. 2, pp. 278–283, Apr. 2017, doi: 10.1177/2156587215621460.
- [21] M. E. Elsayed et al., “New Insights into Listeria monocytogenes Antimicrobial Resistance, Virulence Attributes and Their Prospective Correlation,” Antibiotics, vol. 11, no. 10, Oct. 2022, doi: 10.3390/antibiotics11101447.
- [22] J. A. Gray, P. S. Chandry, M. Kaur, C. Kocharunchitt, J. P. Bowman, and E. M. Fox, “Novel biocontrol methods for Listeria monocytogenes biofilms in food production facilities,” Frontiers in Microbiology, vol. 9, no. APR. Frontiers Media S.A., Apr. 03, 2018. doi: 10.3389/fmicb.2018.00605.
- [23] J. Osek, B. Lachtara, and K. Wieczorek, “Listeria monocytogenes – How This Pathogen Survives in Food-Production Environments?,” Frontiers in Microbiology, vol. 13. Frontiers Media S.A., Apr. 26, 2022. doi: 10.3389/fmicb.2022.866462.
Temas relacionados:
Autores:
Recomendar
Comentar
Compartir

¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.





.jpg&w=3840&q=75)