INTRODUCCIÓN
La producción de ganado es una fuente importante de proteínas animales en todo el mundo ya que cubren las necesidades nutricionales con forrajes, lo que las coloca en un lugar privilegiado al no competir directamente con los alimentos destinados al ser humano (Adjei-Fremah et al., 2015).
El uso de antibióticos promotores del crecimiento (APC) en la alimentación animal fue prohibido en Europa debido a los riesgos potenciales de propagación de genes de resistencia a los antibióticos, además de la contaminación de la leche o la carne con residuos de antibióticos junto con el auge de la agricultura orgánica (Hong et al., 2005). Los productores de ganado han explorado estrategias alternativas para mejorar el rendimiento y la salud de los animales. La estrategia principal para modificar la fermentación ruminal es la combinación de los ingredientes del pienso, su composición y proporción relativa en la dieta. Por otro lado, también se desarrollaron alternativas naturales o biológicas para optimizar la eficiencia productiva modificando la fermentación ruminal; algunos de ellos fueron evaluados para reemplazar el uso de APG (Adjei-Fremah et al., 2015; Carro y Ungerfeld, 2015; Retta 2016; Bąkowski y Kiczorowska 2021).
Los probióticos se definen como “microorganismos vivos que, cuando se administran en cantidades adecuadas, confieren un beneficio para la salud del huésped” (FAO / OMS 2001). Son ampliamente reconocidos como microorganismos no patógenos con beneficios para la salud. En los rumiantes los probióticos tienen un efecto positivo sobre la fermentación del rumen, especialmente sobre la digestibilidad y degradabilidad del alimento y la microbiota del rumen. Bacterias del ácido láctico como Lactobacillus, Bifidobacterium, Bacillus, y Enterococcus sp. además de levaduras como Saccharomyces sp.se utilizan comúnmente como probióticos en piensos (Reta et al., 2016; Bąkowski y Kiczorowska, 2021). Las bacterias se utilizan en animales jóvenes (prerumiantes hasta los seis meses de edad) y las levaduras se utilizan principalmente en animales con rumen funcional (ganado vacuno en crecimiento y engorde y vacas lactantes) (Diao et al., 2019). Los beneficios de la administración oral de probióticos en rumiantes incluyen la regulación y equilibrio de la microbiota intestinal, la promoción del crecimiento de los animales y la mejora de la resistencia del huésped a las enfermedades (Adjei-Fremah et al., 2015; Xu et al., 2017).
Alimentar a los terneros con probióticos al destete facilita el desarrollo de comunidades bacterianas en el rumen colaborando en la transición de alimento líquido a alimento seco y forraje. Los productos de fermentación de S. cerevisiae han mostrado una influencia positiva sobre la microbiota ruminal y la mejora de la morfología del rumen (Diao et al., 2019). Los probióticos en rumiantes adultos mejoraron la digestión de la fibra por los microorganismos ruminales, afectando positivamente los parámetros productivos, mejorando los procesos digestivos (especialmente la celulolisis) y la síntesis de proteínas microbianas (Uyeno et al., 2015).
Existen escasos datos en la literatura acerca del uso de S. boulardii en terneros después del destete. Por tanto, el objetivo de este estudio fue evaluar la inclusión en el pienso del probiótico S. cerevisiae var. boulardii RC009 sobre la adaptación y el rendimiento de los terneros después del destete.
Materiales y métodos
Ética animal
Todos los procedimientos experimentales con animales fueron aprobados por el Comité de Ética de la Universidad Nacional de Río Cuarto, en cumplimiento de la reglamentación del Subcomité de Bioética Animal dependiente del Comité de Ética de la Investigación Científica, según lo establecido en la Resolución 253/10 del Consejo Superior de la Universidad Nacional de Rio Cuarto. Se hicieron esfuerzos para minimizar el sufrimiento de los animales.
Formulación de aditivo probiótico
Saccharomyces cerevisiae var. boulardii RC009 (S. boulardii) fue aislado del ecosistema animal (Armando et al., 2011). Esta cepa fue depositada en la Colección de Microbiología Industrial, Biotecnología Aplicada a la producción de aditivos alimentarios del grupo (BIOAPLA) de la Universidad Nacional de Río Cuarto dirigido por la Dra. Lilia Cavaglieri. La biomasa liofilizada de S. boulardii considerada el aditivo probiótico fue producida por BIOFEED TECH SAS. La concentración de S. boulardii RC009 en el aditivo probiótico fue de 1x1010 UFC/g. El aditivo probiótico (50 g) se mezcló con la dieta correspondiente por cada tonelada de alimento (5 x 1011 UFC/T).
Diseño experimental
Los corrales utilizados para los tenían 50 m de ancho y 70 m de largo, con comederos sobre soportes de hormigón de 3 m de largo y un cable de acero que impedía la entrada de los animales al comedero. El piso estaba bien compactado, con áreas de descanso y pendiente para sedimentar sólidos y líquidos. Cada corral tenía un punto de bebida único que proporcionaba suficiente agua limpia y fresca.
Se realizó el ensayo con cien (100) terneros destetados (Aberdeen Angus - Hereford-F1) de 7-8 meses (machos y hembras), con pesos entre 130 Kg y 146 Kg. Los animales se pesaron y se separaron por similitud de peso en dos grupos, cincuenta (50) animales cada uno. El alimento consistió en un alimento iniciador texturizado para terneros que fue considerado como dieta basal (BD). Los tratamientos se aplicaron durante 35 días desde el destete; T1- control (BD sin aditivo probiótico); T2- Probiótico (BD con 5 x 1011 UFC / T S. boulardii).
Las dietas se formularon para satisfacer los requisitos de nutrientes de acuerdo con NRC (2001). Durante los primeros 7 días después del destete los terneros fueron alimentados con 4,16 Kg de alimento iniciador texturizado para terneros (con o sin aditivo probiótico) por animal, dos veces al día (9:00 a.m. y 5:00 p.m.). Desde el día 8 del ensayo, se añadió a la dieta 1 Kg de grano de maíz y rollo de alfalfa (ad libitum). Desde el día 18 del ensayo y hasta el final del experimento (35 días de ensayo) los terneros fueron alimentados con 4,16 kg de alimento texturizado para cría (con o sin aditivo probiótico) además, 1 kg de grano de maíz por animal dos veces al día y rollo de alfalfa (ad libitum). Los ingredientes de la dieta y la composición de nutrientes se muestran en las Tablas 1 y 2.
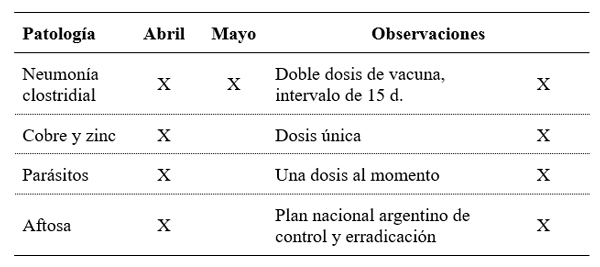
El plan sanitario que recibieron los animales puede observarse en la Tabla 2.
Tabla 1. Composición nutricional e ingredientes de la dieta.
Tabla 2. Plan sanitario realizado en la granja.
Determinaciones de parámetros productivos
La ingesta diaria de materia seca (IDMS) se estimó por corral a partir del suministro diario de alimento. Luego, la ingesta diaria del grupo se dividió por el número de animales presentes en el corral. La ganancia de peso (GP) se calculó como la diferencia entre el peso final y el peso inicial de cada animal. La ganancia de peso diaria (GPD) se calculó como la GP de cada animal dividida por el período en días; se estimó individualmente. El índice de conversión alimenticia (ICA) se calculó dividiendo la cantidad de IDMS (kg) por la GPD.
Análisis estadístico
Los parámetros productivos GP, GPD y el ICA se determinaron utilizando cada animal como unidad experimental. Los datos fueron analizados por modelo general lineal y mixto (GLMM) utilizando el software Sistema de análisis estadístico (InfoStat 2012, Universidad de Córdoba, Argentina). Las medias y la desviación estándar se compararon mediante la prueba de la mínima diferencia significativa de Fisher (LSD) (p < 0,001).
Resultados
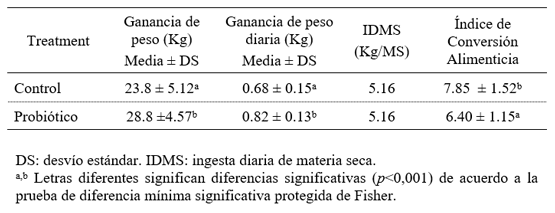
En la Tabla 3 se muestran las medias de los parámetros productivos de los terneros destetados durante el período experimental (35 d). La ganancia de peso mostró diferencias significativas entre los tratamientos control y probiótico (p≤0,001). Los valores de GP fueron significativamente mayores en los animales que recibieron el probiótico, mostrando una GP significativamente mayor en comparación con los controles. Un comportamiento similar mostró la GPD que fue mayor en los animales suplementados con el aditivo probiótico. El ICA fue menor en los animales suplementados con el aditivo probiótico mostrando la mejor eficiencia en la conversión alimenticia (35 d).
Tabla 3. Parámetros productivos de los terneros destetados durante el período experimental
Discusión
En pre-rumiantes jóvenes, los probióticos se dirigen a la porción inferior del intestino y representan una estrategia interesante para estabilizar la microbiota intestinal y disminuir el riesgo de colonización de patógenos (Uyeno et al., 2015). El presente estudio mostró una mejora de la CGP en terneros destetados que recibieron S. boulardii RC009 durante el período experimental de 35 días. Estos resultados están de acuerdo con Penha et al. (2011), quienes informaron que bovinos machos de 18 meses alimentados con probióticos y enzimas (amilasa, celulasa, proteasa, lipasa, pectinasa) durante 75 días mostraron una mayor GP en comparación con el ganado que no recibió probióticos. Además, Kelsey et al. (2018) demostraron una mejora de los parámetros productivos en terneros destetados alimentados con probióticos durante tres semanas. Considerando la inclusión de levaduras, nuestros resultados concuerdan con Lesmeister et al. (2004) quienes demostraron que S. cerevisiae incluida al 2% en el alimento de terneros Holstein destetados mejoró la GPD un 15,6%, en comparación con el tratamiento sin probióticos. Los efectos más consistentes luego de la adición de cultivos de levadura a la dieta mejoraron la productividad en animales lactantes.
El modo de acción de los probióticos involucra cambios en las tasas y patrones de fermentación del rumen. Ciertas cepas de levaduras secas activas son particularmente efectivas para elevar y estabilizar el pH ruminal al estimular ciertas poblaciones de protozoos ciliados, que consumen rápidamente el almidón y, por lo tanto, compiten efectivamente con las bacterias productoras de lactato. Se demostró también que la presencia de S. cerevisiae beneficia el crecimiento y las actividades de degradación de la fibra de los microorganismos celulolíticos (Dogi et al., 2011). Las células de levadura proporcionan factores de crecimiento para los microorganismos del rumen, incluidos ácidos orgánicos y oligosacáridos, vitaminas B y aminoácidos, que estimulan el crecimiento microbiano en el rumen, estabilizando indirectamente el pH ruminal (Uyeno et al., 2015). En este contexto, la levadura en sí funciona no solo como probiótico, sino que también ayuda a otros miembros de la microbiota del rumen a desarrollarse, actuando como prebiótico.
En conclusión, el probiótico S. boulardii RC009 fue efectivo para mejorar los parámetros productivos en terneros sometidos a estrés por destete. El uso de este producto generará un impacto positivo en la reducción de costos relacionados con la alimentación de los animales ya que un aumento en la GP se correlacionó con una mejora en el ICA.
Agradecimientos
Los autores agradecemos la colaboración de Jorge Ancía, ingeniero agrónomo a cargo del Fideicomiso Corancor y Marcos Gerasimchuk del rancho El Cuatro (Espinillo, Córdoba, Argentina) donde se ubicaron los animales objeto de este estudio. Los autores agradecen a BIOFEED TECH SAS por la producción a escala industrial del probiótico ensayado, comercialmente denominado PROBIO.SACH).










.jpg&w=3840&q=75)