Susceptibilidad a antibióticos de Staphylococcus aureus aislados de mastitis bovina en lecherías de la cuenca central de Argentina
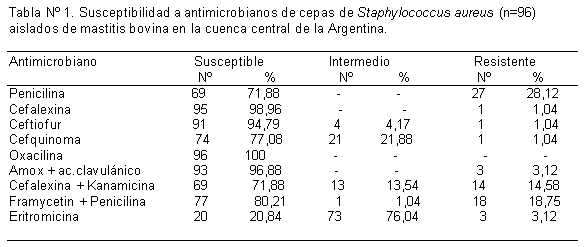
La mastitis bovina causa cuantiosas pérdidas económicas al productor lechero y la industria láctea a nivel mundial. Staphylococcus aureus es uno de los principales patógenos mayores causantes de infecciones intramamarias, siendo la terapia antibiótica uno de los pilares para el control de esta enfermedad. El objetivo de este estudio fue evaluar la susceptibilidad de 96 cepas de Staphylococcus aureus frente a antimicrobianos utilizados frecuentemente en la terapia de mastitis bovina. Los aislamientos provinieron de 40 establecimientos lecheros de la cuenca central de la Argentina. Se utilizó el método de difusión en agar, evaluándose los siguientes antimicrobianos: penicilina G, eritromicina, amoxicilina + ac clavulánico, ceftiofur, cefalexina + kanamicina, cefquinoma, cefalexina, framicetina + penicilina G. Se encontraron los mayores niveles de resistencia frente a penicilina (28%), cefalexina + kanamicina (14%) y framicetina + penicilina (18%). El 7% de las cepas presentaron resistencia a más de un antibiótico; el 3% a eritromicina y penicilina y el 2% a amoxicilina+ ac clavulánico y penicilina. No se observaron cepas resistentes a oxacilina y la mayoría de los aislados fueron sensibles a las cefalosporinas evaluadas: cefalexina, ceftiofur y cefquinoma. Este estudio brinda información de utilidad para la selección de antibióticos y el monitoreo de la evolución de la resistencia a este organismo patógeno.
Palabras claves: Staphylococcus aureus, mastitis bovina, antibióticos

Aarestrup FM, Jensen NE. Development of penicillin resistance among Staphylococcus aureus isolated from bovine mastitis in Denmark and other countries. Microbial Drug Res. 1998; 4 247–256
Barkema HW, Schukken YH, Zadoks RN. The role of cow, pathogen, and treatment regimen in the therapeutic success of bovine Staphylococcus aureus mastitis. J. Dairy Sci. 2006; 89:1877–1895.
Calvinho LF, Toselli FG, Weimann WR, Canavesio VR, Neder VE, Iguzquiza IA. Susceptibilidad en estafilococos coagulasa positivos. Rev. Argent. Microbiol. 2002; 34:171-175.
CLSI (Clinical and Laboratory Standards Institute). Performance standards for antimicrobial disk and dilution susceptibility tests for bacteria isolated from animals. Clinical Laboratory Standards Institute, Wayne, PA, USA.2013; Vol. 28, No. 8. 4th ed. Approved standard, VET01-A4.
Errecalde, JO. Uso de antibióticos en animales de consumo. Incidencia del desarrollo de resistencias en salud pública. FAO Producción y Sanidad Animal. 2004;162. Pg. 61. Viale delle Terme di Caracalla. Roma. Italia.
Erskine RJ, Walker R, Bolin C, Bartlett P, White D. Trends in antibacterial susceptibility of mastitis pathogens during a seven-year period. J. Dairy Sci. 2002; 85:1111–1118
Gentilini E, Denamiel G, Llorente P, Godaly S, Rebuelto M, DeGregorio O. Antimicrobial susceptibility of Staphylococcus aureus isolated from bovine mastitis in Argentina. J. Dairy Sci. 2000; 83:1224–1227.
Gooraninejod S, Ghorbanpoor M and Parviz Salati A. Antibiotic susceptibility of Staphylococci Isolated from bovine subclinical mastitis. Pakistan J. Biol. Sci. 2007; 10:2781-2783.
Güler L, Gündüz K, Gülcü Y, Hadimli HH. Antimicrobial susceptibility and coagulase gene typing of Staphylococcus aureus isolated from bovine clinical mastitis cases in Turkey. J Dairy Sci.2005; 88:3149-3154.
Idriss, SH.E., Foltys, V., Tancin, V., Kirchnerová, K., Tancinová, D., Zaujec, K. Mastitis pathogens and their resistance against antimicrobial agents in dairy cows in Nitra, Slovakia. Slovak J. Anim. Sci.2014; 47: 33-38
Kirkan S, GoKsoy E, Kaya O. Identification and Antimicrobial Susceptibility of Staphylococcus aureus and Coagulase Negative Staphylococci from Bovine Mastitis in the Ayd›n Region of Turkey. Turk J Vet Anim Sci. 2005; 29:791-796.
Lucas, MF, Vaca R, Errecalde JO, Mestorino N .Susceptibilidad antimicrobiana de cepas de S. aureus aisladas de bovinos portadores de mastitis subclínica en las Cuencas Mar y Sierras, y Abasto de la Prov. Bs As. XI Jornadas Latinoamericanas de Fármaco-Toxicología Veterinaria. Facultad de Agronomía y Veterinaria. Universidad Nacional de Río Cuarto. 2005.
Malinowski E, Klossowska A, Kaczmarowski M, Lassa Henryka, Kuzma Krystyna. Antimicrobial susceptibility of Staphylococci isolated from affected with mastitis cows. Bull. Vet. Inst. Pulawy. 2002; 46, 289-294.
Moroni P, Pisoni G, Antonini M, Villa R, Boettcher P, Carli S. Antimicrobial drug susceptibility of Staphylococcus aureus from subclinical bovine mastitis in Italy. J. Dairy Sci. 2006; 89:2973–2976.
Mosaferi, S., Jalili, T., Ostadi, Z., Khakpour, M., Bodaghi, H. Sensitivity of Staphylococcus aureus isolated from subclinical bovine mastitis to Co-amoxiclav in Tabriz dairy herd in 2010. Res. J. Biol. Sci.2012; 7:165-169.
Oliver SP, Gonzalez RN, Hogan JS, Jayarao BM & Owens WE. Microbiological Procedures for the Diagnosis of Bovine Udder Infection and Determination of Milk Quality; 4th edition; National Mastitis Council, Verona, WI, USA.2004
Oliver, S.P. Murinda, S.E. Antimicrobial resistance of mastitis pathogens. Vet. Clin. Food Anim. 2012; 28:165-185.
Pellegrino M, Frola I, Odierno L, Bogni C. Mastitis bovina: Resistencia a antibióticos de cepas de Staphylococcus aureus aisladas de leche. REDVET- Rev. electrón vet. 2011; Vol. 12 Nº7:1-14. http://www.veterinaria.org/revistas/redvet/n070711.html
Pengov A., Ceru S. Antimicrobial Drug Susceptibility of Staphylococcus aureus Strains Isolated from Bovine and Ovine Mammary Glands. Journal of Dairy Sci. 2003; 86:3157–3163.
Persson Y, Nyman A, Grönlund-Andersson U. Etiology and antimicrobial susceptibility of udder pathogens from cases of subclinical mastitis in dairy cows in Sweden. Acta Vet. Scan. 2011; 53 36 – 43
Pillar CM, Stoneburner A, Shinabarger DL, Abbeloos E, Goby L. In vitro susceptibility of bovine mastitis pathogens to a combination of penicillin and framycetin: Development of interpretive criteria for testing by broth microdilution and disk diffusion. J Dairy Sci.2014; 97:6594-6607.
Pillar, C.M., Goby, L. Draghi , D., Grover, P. and Thornsberry, C. Evaluating the in vitro susceptibility of bovine mastitis pathogens to a combination of kanamycin and cefalexin: recommendations for a disk diffusion test. J. Dairy Sci.2009; 92:6217-6227.
Pÿoraälä, S. Treatment of mastitis during lactation. Ir. Vet. J. 2009; 62 (Suppl. 4):S40-S44.
Roberson JR, Fox LK, Hancock DD & Besser TE. Evaluation of methods for differentiation of coagulase-positive Staphylococci. J. Clin. Microbiol. 1992; 30 3217–3219
Rose, M, and Swinkels, J. Cefquinome disk susceptibility test and interpretative criteria for cefquinome in vitro activity testing against veterinary pathogens. XXV World Buatrics Congress, Budapest, Hungary.2008; Pg. 177.
Russi, NB; Bantar C., Calvinho LF. Antimicrobial susceptibility of Staphylococcus aureus causing bovine mastitis in Argentine dairy herds. Rev. Arg. Microbiol. 2008; 40:116-119.
Russi, NB, Maito J., Dieser SA., Renna MS, Signorini ML, Camussone C, Neder VE, Pol M, Tirante L, Odierno LM., Calvinho LF. Comparison of phenotypic tests for detecting penicillin G resistance with presence of blaZ gene in Staphylococcus aureus isolated from bovine intramammary infections. J. Dairy Res. 2015; 82:317-321.
Sader, HS, Jones RN. The fourth-generation cephalosporins: antimicrobial activity and spectrum definitions using cefpirome as an example. Antimicrob. Newslett. 1993; 9:9.
Saini V, Olde Riekerink RGM, McClure JT, Barkema HW. Diagnostic accuracy assessment of sensititre and agar disk diffusion for determining antimicrobial resistance profiles of bovine clinical mastitis pathogens. J. Clin. Microbiol. 2011 49:1568-1577.
Zecconi A, Calvinho L, Fox L. Staphylococcus aureus intramammary infections. Bulletin of the International Dairy Federation.2006; 408/2006. Pp 39. FIL-IDF.
Ziv, G. Treatment of peracute and acute mastitis. Vet. Clin. North Am.: Food Anim. Pract. 1992; 8:1-15.


Amigos del foro :
Siempre tenemos algo mas que aprender y por alli va la cosa APRENDER. Los resultados cada vez mas graves de la resistencia bacteriana a los antibioticos tiene en una de sus principales causas al ABUSO DE LOS ANTIBIÓTICOS Y SU EMPLEO FUERA DE RECETA.
y es alli donde debemos trabajar todos los profesionales de la salud.
Señores del foro lo que necesitamos es profesionales cada vez mas capacitados para solucionar las enfermedades de nuestros animales ; primero buenas practicas de manejo y ordeño, Higiene en general (en la actualidad no se estudia Higiene veterinaria como en mi época), conocimiento de los fármacos que debemos restringir para la medicina de los humanos para evitarlos lo mas posible. y mantener correctamente los periodos de retiro tanto en leche como en carne en todos los animales de abasto.
Saludos.
Raúl


FIGAP - Exposición Internacional




Priya Chemicals


Special Nutrients



Evonik Animal Nutrition














