Introducción
El rumen alberga poblaciones microbianas diversas que particionan la energía digestible de los alimentos para sintetizar biomasa microbiana (BM), ácidos grasos volátiles (AGV) y gases de desecho (CH4, CO2, H2; McDonald et al., 2010). Esta partición puede ser evaluada in vitro gracias a la relación estequiométrica entre los perfiles de AGV y el gas producido a partir de la materia orgánica realmente digerida (Blümmel et al., 1997b), que permite estimar la producción de BM (Blümmel and Lebzien, 2001); generando así una caracterización más completa (comparando con la química húmeda y digestibilidad comúnmente utilizadas) de los alimentos para rumiantes.
La mayor producción de CH4 (PCH4) ruminal, es producto de la fermentación de carbohidratos fibrosos, por parte de archaeas metanogénicas, donde el aceptor final de los electrones de H+ es el C.
Si bien es lógico pensar que la eliminación de H+ y el redireccionamiento de los C hacia CH4 provocarían una disminución en el pH, esto ocurre en dietas ricas en almidón (Martin et al., 2010), pero no así en dietas fibrosas, donde la alta actividad metanogénica, si bien no está asociada a un descenso en el pH, generaría una ineficiencia en aprovechamiento de la fibra, con la consecuente reducción de la producción de BM, pudiendo representar una pérdida del 2 al 12% de la EB del alimento (Knapp et al., 2014).
Pero la PCH4 no solo es importante como indicador de la ineficiencia con que son utilizados los alimentos, sino que también es un potente gas con efecto invernadero (GEI), siendo la producción animal, responsable de un 12 y 18% del total de las emisiones antropogénicas (FAOSTAT, 2014). Debido al creciente interés de la opinión pública de diversos países por la sustentabilidad del medio ambiente, existen en la actualidad, numerosos grupos de investigación comprometidos con la mitigación de GEI. Muchos de los cuales estudian factores nutricionales que mejoren las condiciones ambientales derivadas de la producción (e.g. mejoramiento de forrajes, uso de aditivos o componentes anti-nutricionales; Beauchemin et al., 2008).
Los taninos condensados (TC) son compuestos antinutricionales que sintetizan numerosas plantas como defensa contra la herbivoría (Lasa et al., 2010) y se utilizan en la industria del cuero, adhesivos y resinas, pero además presentan un potencial efecto mitigador de GEI, llegando a reducir hasta 26 % la PCH4 (Grainger et al., 2009; Pathak et al., 2017). Esto se puede atribuir directamente, por un efecto sobre la actividad de las archaeas metanogénicas o indirectamente, reduciendo la producción de H+ (Ortiz et al., 2014; Tavendale et al., 2005). Sin embargo, altas dosis, tanto como el tipo o naturaleza del extracto, podrían afectar la digestibilidad o síntesis de BM (Makkar, 2003).
En este trabajo se hipotetizó que la adición de TC afectará los patrones de fermentación de raigrás, utilizado como sustrato, generando una disminución en la PCH4, con el consecuente aumento en la producción de AGV (o al menos con perfiles diferenciados) y/o BM. Para poner a prueba esta hipótesis, se planteó como objetivo determinar el efecto que produce la adición de diferentes dosis de TC sobre la digestibilidad y los parámetros fermentativos de raigrás (Lolium perenne) mediante la técnica de producción de gas in vitro.
Materiales y Métodos
Caracterización del experimento
El experimento se realizó en el Centro de Investigación y Servicios en Nutrición Animal (CISNA - FAUBA), donde se evaluó la fermentación de raigrás (Lolium perenne) sin aditivos (Ctrl) y con la adición de tres dosis de TC comercial de Quebracho (Schinopsis balansae, 1,5, 3,0 y 4,5 mg TC cada 100 mg de sustrato; TC1, TC2 y TC3 respectivamente), a través de la técnica de producción de gas in vitro (Theodorou et al., 1994). Todos los tratamientos fueron evaluados en presencia o ausencia de polietilenglicol (i.e. adicionando 1 ml de PEG o de agua destilada, P y N, respectivamente). El PEG se utilizó para evaluar el efecto particular de los TC, ya que tiene alta afinidad por los mismos (Makkar, 2000) sin generar efectos en la fermentación ni en la metanogénesis (Tavendale et al., 2005). El PEG se adicionó a razón de 20 mg por botella, asegurando 2 mg de PEG por mg de TC incluidos en cada botella.
Se evaluó la digestibilidad in vitro de la materia seca (ivDMS, % MS), de la materia orgánica (ivDMO, % de MO) y de la fibra (DFDN como % de la FDN, y la FDN digestible en % MS, FDNd). Se midió la producción de gas acumulada neta (PGAN; ml/gr MS incubada) corregida por la producción de botellas blanco (i.e. sin sustrato), las tasas de producción de gas horarias (ml/h) y la PCH4. Además, se evaluó el ambiente ruminal a partir del perfil de AGV, pH y la concentración de nitrógeno amoniacal (N-NH3). Por último, se analizó la cantidad de sustrato degradado utilizado para producir BM, estimado por el factor de partición (FP), que refleja la eficiencia de síntesis de BM (Blümmel et al., 1997a).
Análisis producto de la fermentación in vitro
Se utilizó licor ruminal de 2 ovejas fistuladas, con una dieta de mantenimiento (heno de alfalfa y de grano de maíz, relación 70: 30) como inóculo. Se utilizó como sustrato láminas de raigrás cosechadas en estado vegetativo molido en fresco. En breve, se colocaron las láminas en capas dentro de una caja de telgopor interponiendo pequeños trozos hielo seco (CO2 presurizado), durante 3-5 minutos, hasta congelación. Luego fueron molidas con un molino industrial de acero inoxidable (Foss Tecator 2096 Homogeneizer) adicionando pequeños trozos de hielo seco dentro del molino, para mantener las propiedades quebradizas del forraje. El material molido (c.a. tamaño de partícula de c.a. 1 mm) se incubó (c.a. 0,200 g de MS) en botellas de vidrio color caramelo de 100 ml por duplicado en un baño termostatizado (i.e. 39°C en anaerobiosis durante 24 h). A cada botella se le agregó 38 ml de medio de incubación y 4 ml de licor ruminal (relación medio: licor, 10: 1). Se midió la presión (con un transductor de presión) y el volumen del gas de fermentación en 7 tiempos (i.e. 1, 2, 4, 8, 12, 16 y 24 h), con una jeringa calibrada, acumulando cada toma en viales de 20 ml saturados con N a presión atmosférica, para determinar la concentración de CH4 en un cromatógrafo de gases HP 4890 series (Hewlett Packard® Labs, Palo Alto, CA, EE.UU.) equipado con una columna de acero inoxidable de 2 m de largo con N Porapak (malla de 80-100) y un detector FID (N como carrier, temperaturas: horno= 90°C, inyector= 110°C y FID= 250°C). Una vez obtenida la concentración de gases, la PCH4 fue estimada de acuerdo con Lopez and Newbold (2007). En breve, se calculó el volumen de CH4 según la siguiente fórmula:
CH4 (ml) = PGA + HS × Conc
Donde PGA es el volumen (ml) del gas total producido; HS es el volumen (ml) del headspace en la botella y Conc es la proporción de CH4 en la muestra.
Una vez conocido el volumen, la cantidad de CH4 (en mMol) se puede calcular aplicando la fórmula de la ley de los gases ideales:
P × V = n × R × T ≈ (n = P × V R × T)
Donde n es la cantidad de CH4 (en mMol), P es la presión atmosférica (en atmósferas), V el volumen del gas (en ml), R es la constante de los gases (0,082 litros × atm / [mol × °K]) y T es la temperatura a la que se midió el gas (en °K). Teniendo en cuenta que P es 1 Atmósfera y T es 312°K (39°C + 273), entonces un mol de cualquier gas (inclusive el CH4) ocupa 22,415 litros. Luego se convierte el CH4 en g (CH4, 1 mol= 16 g), y se lo afecta por kg de MS incubada (CH4-MSi), por kg de MS desaparecida (CH4- MSD), por kg de MO desaparecida (CH4-MOD). También se analizó la CH4 de las botellas blanco para corregir el CH4 no proveniente de la fermentación del sustrato analizado.
Pasadas las 24 h se interrumpió la fermentación con dos o tres gotas de timol saturado, se midió el pH (Hanna instruments HI 9025) y se tomaron alícuotas, preservadas con ácido ortofosfórico al 25% (i.e. relación ácido: muestra, 1: 5) para la determinación de AGV en un cromatógrafo Konik (modelo HRGC 5000b) equipado con un detector FID y una columna capilar Nukol (30 mt × 0,32 mm × 0,25 μm de espesor de capa, Perkin Elmer - Elite FFAP; Part. N°931-635-4). Se utilizó hidrógeno como gas carrier (2,4 ml H2/min). Para la determinación de N-NH3 se estabilizaron alícuotas de licor con ácido sulfúrico 0,02 N (i.e. relación ácido: muestra, 1: 1) y se utilizó un kit de uremia comercial (Wiener® lab).
Finalmente, el residuo de las botellas se filtró en vacío directamente dentro de bolsitas ANKOM® (ANKOM® Technology #F57 filter bags), para analizar ivDMS, ivDMO, DFDN e FDNd. El raigrás fue caracterizado por contenido de MS (105°C por 4 h) y MO (ignición a 600°C, AOAC, 1997). El contenido de proteína bruta (PB= N total × 6,25) fue determinado por Kjeldahl (AOAC, 1997); la fibra insoluble en detergente neutro con alfa-amilasa (aFDNMO, Goering and Van Soest, 1970), fibra insoluble en detergente ácido (FDAMO) y contenido de lignina (LDAMO, Van Soest et al., 1991) fueron reportados libres de cenizas y determinados con equipo ANKOM®. El cociente entre el sustrato verdaderamente digerido in vitro (mg) y el volumen del gas producido in vitro (ml) fue expresado como el FP (que refleja la eficiencia de producción de proteína microbiana) y se estimó la BM según Blümmel et al. (1997a).
Diseño experimental
El diseño experimental que se utilizó fue en bloques completos aleatorizados (DBCA) con un arreglo factorial (i.e. 2 factores; Factor A= tratamientos; Ctrl, TC1, TC2 y TC3; Factor B= presencia y ausencia de PEG; P y N). Se llevaron a cabo 3 períodos (i.e. Período = Bloque), separados en el tiempo y utilizando licor ruminal de dos ovejas diferentes en cada período, con los cuales se obtuvieron 3 repeticiones para cada tratamiento. El modelo estadístico utilizado fue el siguiente:
Yijkl = αi + βj +γk + (α×γ)ik +εijkl
Donde, Yijkl= variable en estudio; αi= tratamientos, i.e. dosis de TC (i= 4); βj= bloque (j= 3); γk= Ausencia o presencia de PEG (k= 2); (α × γ)ik= interacción entre tratamientos y PEG; εijkl = error experimental (l=3).
Las variables fueron analizadas usando el Proc GLM de SAS (2002). Se realizaron comparaciones múltiples usando el Test de Tukey (para la interacción tratamientos × PEG, y el efecto de la inclusión o no de PEG) o Dunnett (para los tratamientos, Ctrl vs TC1, TC2 y TC3) con un nivel de significancia p?0,05. Cuando la interacción no fue significativa se realizaron contrastes (i.e. Control vs Dosis; Dosis máxima vs Dosis mínima).
Resultados
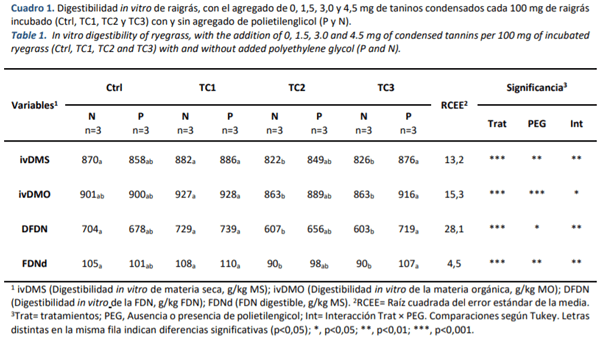
Se encontró en las variables asociadas a la digestibilidad del raigrás en estudio (MS= 172 g/kg MH, MO= 819 g/kg MS, PB= 184 g/kg MS, aFDNMO= 345 g/kg MS, FDAMO= 164 g/kg MS, y LDAMO= 14 g/kg MS) una interacción entre la adición de TC en el sustrato y el agregado o no de PEG, (p?0,05, Cuadro 1). Se observó un efecto inhibitorio del PEG en el accionar de los TC solo en la más elevada de las dosis estudiadas (TC3), ya que en las botellas con PEG las digestibilidades fueron mayores en comparación con aquellas botellas con igual dosis de TC pero sin PEG (Cuadro 1. TC3, N vs P, p<0,05). En las dosis menores de TC al igual que en el Ctrl, el PEG no tuvo efecto (p<0,05). Por otro lado, en ausencia de PEG, el TC2 y TC3 produjeron una disminución en la ivDMS, DFDN y FDNd al compararlo con el Ctrl (p<0,05).
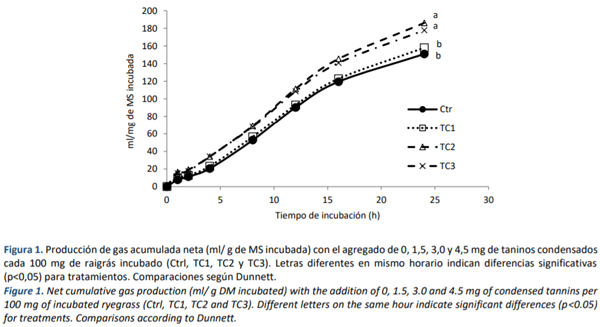
La evaluación de la PGAN en los diferentes horarios analizados, no detectó diferencias entre el Ctrl y el agregado de TC (p>0,05, Figura 1), sin embargo al final de la fermentación (i.e. 24 h), el TC1 se comportó igual al Ctrl, y ambos produjeron menos gas que TC2 y TC3 (p<0,05).
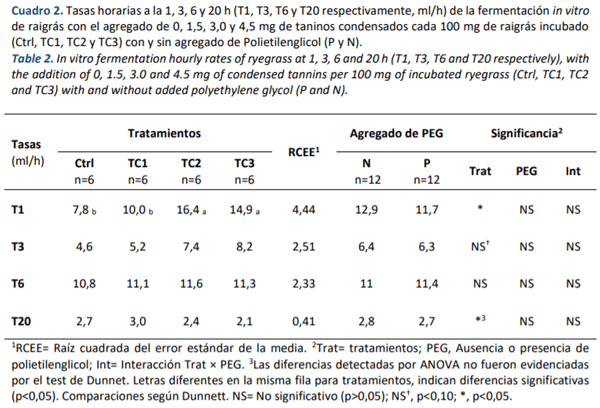
Al analizar la cinética de producción de gas, solo al comienzo de la fermentación (T1), las dosis TC2 y TC3 presentaron mayores tasas (p<0,05; Cuadro 2). En T20 el ANOVA detectó diferencias entre tratamientos, sin embargo, estas no fueron reflejadas por Dunnett. Para las tasas T3 y T6, el agregado de TC no produjo diferencias (p>0,05). En ninguna de las tasas la presencia de PEG generó diferencias (p>0,05).
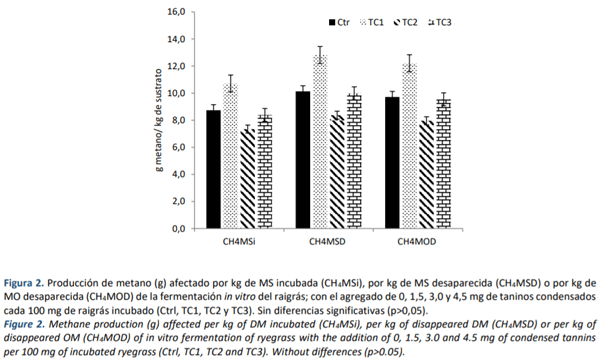
No se encontraron diferencias significativas al evaluarse la producción de CH4 afectado por MS incubada, desaparecida y MO desaparecida (media general; CH4-MSi=8,8 g/kg MS incubada; EEM= 1,94; CH4-MSD=10,3 g/kg MS desaparecida; EEM=2,26; CH4-MOD= 9,9 g/kg MO desaparecida; EEM= 2,16; p?0,05; Figura 2). Tampoco el agregado el PEG tuvo incidencia en los datos observados (p?0,05).
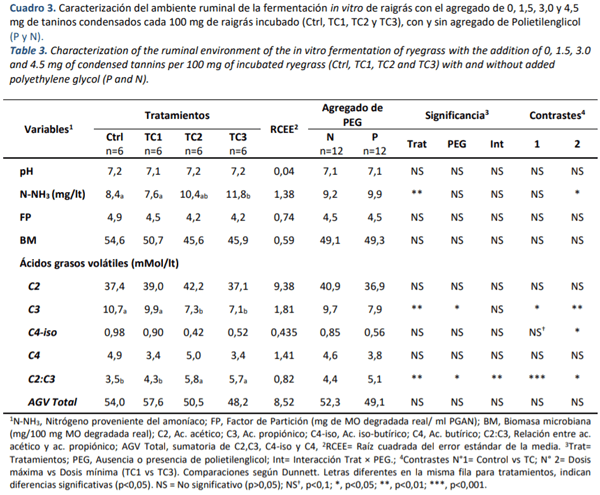
En cuanto la caracterización del ambiente ruminal se obtuvieron diferentes respuestas en las variables analizadas. El pH no se vio afectado (media general= 7,15; p>0,05, Cuadro 3) por la utilización de diferentes dosis de TC. El agregado de TC3 aumentó la concentración de N-NH3 (p<0,01), sin embargo dosis menores no produjeron cambios con respecto al Ctrl (p>0,05). Por otro lado, el agregado de TC no generó diferencias en la estimación de la producción o eficiencia de síntesis de proteína microbiana, observado en el FP y la BM (p>0,05). En ninguna de estas variables el agregado de PEG produjo diferencias (p>0,05).
Evaluando el perfil de AGV, se observó que únicamente el ácido propiónico presentó diferencias con el agregado de TC. La concentración del mismo disminuyó un 29 % con el agregado de TC2 y TC3 con respecto al Ctrl (p<0,01, Cuadro 3), mientras que TC1 fue igual al Ctrl. Además el agregado de PEG a las botellas determinó una disminución en la concentración de este AGV (p<0,05). Analizando los contrastes, se observó una diferencia generada por el agregado de TC y también entre dosis máxima y mínima (i.e. TC1 vs TC3, p<0,05). En los demás AGV analizados (i.e. acético, butírico e iso-butírico) y en la concentración total de AGV, la adición de TC no provocó cambios en la producción (p>0,05). Para iso-butírico si bien el ANOVA no detecto diferencias, en los contrastes se observó unas diferencias entre las dosis máxima y mínima (p<0,05).
Discusión
Las dosis de TC que se evaluaron fueron elegidas teniendo en cuenta lo expuesto por Waghorn et al. (1997) quienes determinaron que dosis menores de 10 g de TC /100 g de MS en la dieta, el consumo de MS no se ve afectado y existen potenciales beneficios en el aprovechamiento y la distribución de energía. Por otro lado, dosis mayores a 2 mg de TC de Quebracho/ 100 mg de sustrato podrían disminuir las emisiones de CH4, aunque habría que tener en cuenta el potencial efecto negativo en el metabolismo proteico (Beauchemin et al., 2007).
Por estos motivos se propuso como dosis mínima 1,5 mg de TC/ 100 mg de sustrato y se duplicó esa concentración dos veces (3 y 4,5 mg de TC %) para observar el efecto del extracto sobre la digestibilidad in vitro, la PCH4 y la distribución de la energía disponible del raigrás utilizado como sustrato.
Efecto de los TC sobre la digestibilidad del raigrás
El raigrás (Lolium perenne) utilizado como sustrato en este ensayo es una de las gramíneas forrajeras más difundidas y utilizadas como alimento de rumiantes, en regiones de climas templado-húmedos y suelos ricos. Principal forraje para pastoreo y heno en Europa occidental y muy difundido en Australia y Nueva Zelanda, y por supuesto, en Argentina. Su principal área de cultivo en Argentina es el Centro y Sudeste de la Provincia de Buenos Aires, pero también puede verse formando parte de valles y mallines de la Patagonia. Los resultados muestran que las distintas dosis de TC afectaron diferencialmente la ivDMS, ivDMO, DFDN y la FDNd del raigrás en estudio (cuadro 1). Solo con la aplicación de la dosis más alta de TC (4,5 mg TC/ 100 mg MS) la disminución en la digestibilidad (p?0,01) se debió a un efecto específico de los TC, observado por la diferencia entre P y N.
Esta respuesta coincide con otros estudios que analizaron el comportamiento de TC de Quebracho, en sustratos como heno de alfalfa (Al-Dobaib, 2009) o silaje de cebada (Beauchemin et al., 2007), donde no se observaron diferencias (p>0,05) en la digestibilidad agregando hasta 1,5 o 2 mg TC/ 100 mg de sustrato, lo cual se correspondería con los valores hallados en el presente trabajo para el tratamiento TC1 (1,5mg TC/ 100mg sustrato). Sin embargo Al-Dobaib (2009) si observó una reducción con valores de 2,25 mg/ 100 mg de sustrato, coincidiendo con Carulla et al., (2005), quienes encontraron reducciones en las digestibilidades in vivo de FDN y FDA con 4,1 mg TC/ 100 mg MS de la dieta, aunque utilizando un extracto de Acacia mearnsii. Sin embargo existe evidencia que los efectos sobre digestibilidad, así como los efectos en protección de la proteína dietaria o el rol mitigador de metano y otros GEIs de los TC, no sólo dependen de la dosis y los sustratos sobre los cuales son utilizados como aditivos. Los comportamientos disímiles observados con la adición de TC en fermentaciones de forrajes depende en mayor medida de la fuente donde fue obtenido el TC (Carreño et al. 2015, Huang et al., 2010), el procedimiento de extracción y purificación (Barahona Rosales, 1999,) así como también en las diferencias en el peso molecular o la composición monomérica de los TC (Barahona, 1999; Barahona et al., 2006).
Esta menor degradación de la celulosa debido al efecto de los TC, podría deberse a una inhibición de la acción específica de enzimas celulolíticas, implicadas en la degradación de la fibra (McSweeney et al., 2001) o también por un efecto indirecto donde los taninos que forman un complejo ligno-celulósico evitando, de esta forma, el ataque enzimático (Patra and Saxena, 2011), demostrado por las reducciones en el aprovechamiento de estos forrajes al agregar dosis altas de TC.
Gases de fermentación afectados por la presencia de TC
Existen varios trabajos realizados los últimos años, tanto in vivo (Carulla et al., 2005; Pathak et al., 2017; Piñeiro-Vázquez et al., 2018) como in vitro (Min et al., 2005; Supapong et al., 2017) en el cual el uso de los TC como mitigador del CH4 fue probado. Estos efectos en la disminución de la PCH4 pueden estar relacionados directamente con una disminución en la degradabilidad de la fibra (Tavendale et al., 2005). Sin embargo, en este trabajo no hubo diferencias en la PCH4, aun afectando dicha producción por la DFDN (Figura 2), por lo cual, la falta de efecto pudo ser consecuencia de una falla en la supresión de microorganismos metanógenicos (Bueno et al., 2015) o de una menor efectividad de los TC a formar complejos con los carbohidratos debido a la especificidad por peso molecular, que poseen los TC para formar la unión (Bodas et al., 2012; Patra and Saxena, 2011). Sin embargo, este último factor sería descartado ya que al aumentar la concentración de TC en las botellas, disminuyó la digestibilidad in vitro.
El accionar de los TC depende de la concentración (Patra and Saxena, 2011) y de sus características químicas (concentración de ácidos fenólicos y grupo hidroxilos, Goel and Makkar, 2012). Teniendo en cuenta esta premisa, es probable que el extracto comercial utilizado no fuese efectivo a las dosis estudiadas, coincidiendo con Goel y Makkar (2012), quienes, con dosis similares a las del presente experimento, utilizando extractos de Quebracho (Schinopsis sp.) o mimosa (Mimosa caesalpineaefolia) no encontraron evidencias de un efecto mitigador. Sin embargo, otras fuentes de TC, tal como Acacia mearnesii o sulla (Hedysarum coronarium) (Grainger et al., 2009; Woodward et al., 2002) o madera de castaño (Castanea sativa, Moscoso M. et al., 2017) produjeron resultados satisfactorios en estudios in vivo.
Por otro lado, la PGAN a las 24 h aumentó al incluir las dosis más altas de TC (3,0 y 4,5 mg/100 mg MS) lo que podría indicar efectos de los TC en el perfil gaseoso; en consonancia con Medjekal et al. (2017) que encontraron aumentos en la PG in vitro a las 24 h con la adición de raíces de Zingiber officinale como fuente de TC. Si bien el test de Dunnett no pudo encontrar diferencias entre los tratamientos en las primeras horas de fermentación, la PGAN tiende a aumentar con la presencia de TC (Figura 5). Estos resultados se contraponen a lo reportado por Jayanegara et al., (2015), quienes encontraron que distintas fuentes de TC (incluyendo Quebracho) generaban una disminución en la PGAN.
De todas formas, los cambios encontrados en la digestibilidad solo se atribuyeron a las dosis más elevadas (efecto específico de los TC en TC3), que relacionado con una mayor PGAN, nos refleja una ineficiente distribución de la energía (Blümmel et al., 1997b) no sólo teniendo en cuenta el aprovechamiento de la MS, sino también al evaluar los patrones de fermentación, aunque esto no se vea reflejado estadísticamente en el FP o la BM. Estos patrones ineficientes de TC3 están originados fundamentalmente durante las primeras horas de fermentación.
Ambiente ruminal y productos de fermentación
El pH no varió significativamente manteniéndose en un promedio de 7,2 (Cuadro 3). Teniendo en cuenta que la tasa de PCH4 se vería afectada por el pH obteniéndose los máximos valores a pH altos (≥7, Van Kessel and Russell, 1996), al no existir diferencias en la PCH4 entre los tratamientos, es coincidente con el mantenimiento del pH en el medio de incubación.
Por otro lado, se especulaba que la protección de las proteínas a la degradación ruminal producto de la formación de complejos tanino-proteína, genere una disminución en los valores de N-NH3, el cual refleja el N subutilizado por la población bacteriana ruminal, en los tratamientos con TC (Goel and Makkar, 2012). Sin embargo, si bien no hubo diferencias con las dosis menores, el aumento de N-NH3 en TC3, refleja una degradación proteica sustancial, que podría deberse a la pobre formación de los complejos antes mencionados(Beauchemin et al., 2007) o a una reducción de los efectos inhibitorios sobre la actividad proteolítica en algunas bacterias, los cuales pueden ser producidos por interacciones de los TC con enzimas extracelulares bacterianas, acción directa sobre la morfología celular o indirecta, al dificultar la captación de nutrientes por parte de estos microorganismos (Patra and Saxena, 2011).
En cuanto al perfil de AGV, se especulaba que, relacionado con el efecto mitigador de CH4 de los TC, la relación acético: propiónico debería ser menor en los tratamientos con agregado de estos compuestos (Medjekal et al., 2017), ya que el acetato y el butirato promueven la PCH4, mientras que la formación de propionato puede ser considerada como una forma competitiva en el uso del H+ en el rumen (Moss et al., 2000). En adición, Supapong et al. (2017) encontraron un descenso en la PCH4 asociado a un aumento en la producción de ácido propiónico en dietas mixtas (relación forraje: concentrado, 70:30), con el agregado de 11,7 mg MS de harina de semillas de Delonix regia, que contienen taninos, comparando la misma dieta sin semillas.
Sin embargo, en el presente trabajo, la relación acético: propiónico aumentó con las dosis más alta de TC. Este efecto de TC2 y TC3 es consecuencia de la menor producción de propiónico, ya que el acético se mantuvo constante entre tratamientos, sin diferencias entre Ctrl y TC. Si asociamos este perfil fermentativo a falta de diferencia de las PCH4 reportadas, podemos observar una relación directa con las producciones de acético similares para los cuatro tratamientos, que liberarían equivalentes cantidades de H+ al medio (Moss et al., 2000).
En contraposición, Beauchemin et al. (2007), observaron que las concentraciones de acético disminuían linealmente con el aumento de TC, mientras que el propiónico se mantenía constante, generando así una disminución lineal en la relación acético: propiónico. Sin embargo, al evaluar en este trabajo la proporción relativa del acético en la concentración de AGV total, se encontró una diferencia de ocho puntos porcentuales entre Ctrl y TC2 y TC3 (i.e.; Ctrl= 69,2%, TC1= 77,2%, TC3= 76,8%). Esta diferencia en la importancia relativa podría explicar estequiometricamente la mayor PG (Wolin, 1960), generada por TC2 y TC3. Esta mayor producción relativa de acético estaría relacionada, además, con una menor producción de BM, ya que la eficiencia de proteína microbiana esta inversamente relacionada con la PG (Blümmel et al., 1997a). Aunque no se encontraron diferencias entre la producción de BM entre los tratamientos, TC2 y TC3 produjeron un 16 % menos comparados con el Ctrl, que no fue detectado por el ANOVA, presuntamente por la variabilidad de los datos analizados. Esta misma respuesta se ve reflejada en la similitud encontrada en los FP de los tratamientos evaluados.
Conclusiones
Los patrones de fermentación del raigrás evaluados en el sistema in vitro se vieron afectados por la inclusión de TC, fundamentalmente en las dosis más elevadas. La dosis de 4,5 mg de TC/100 g MS (TC3) produjo una disminución de la digestibilidad del alimento por acción específica de los TC, afectando además la eficiencia de utilización del alimento, sin embargo, la PCH4 in vitro no se vio afectada por la inclusión de TC. Por otro lado, la relación acético: propiónico aumentó en TC2 y TC3, debido a una disminución del propiónico y aunque el aumento relativo de acético en términos porcentuales explica la disminución de CH4, estas dosis presentaron las mayores PGAN. Se concluye que a las dosis estudiadas, la fuente de TC generó patrones fermentativos diferenciados pero no fue efectiva para disminuir el potencial metanogénico del raigrás.