Digestión ruminal e intestinal del maíz (Zea maíz) y Sorgo (Sorghum bicolor L. Moench) utilizando diferentes técnicas de digestibilidad (in vivo, in vitro e in sacco)
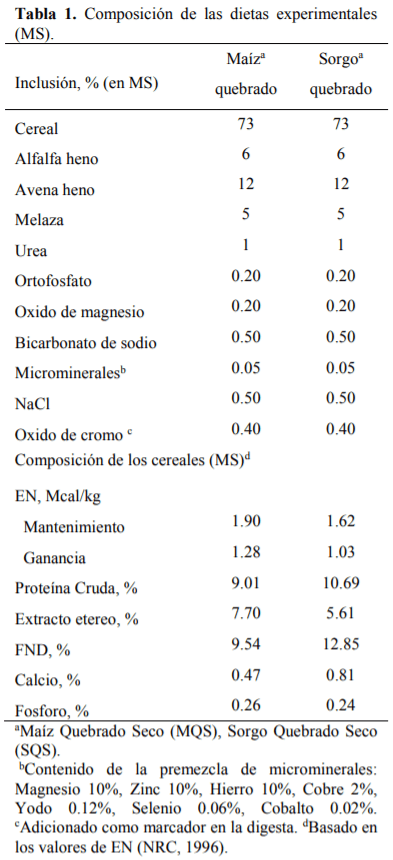
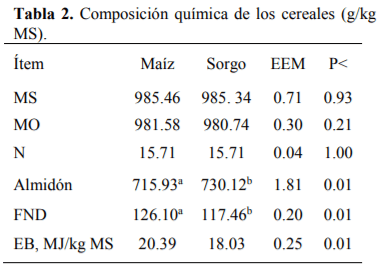
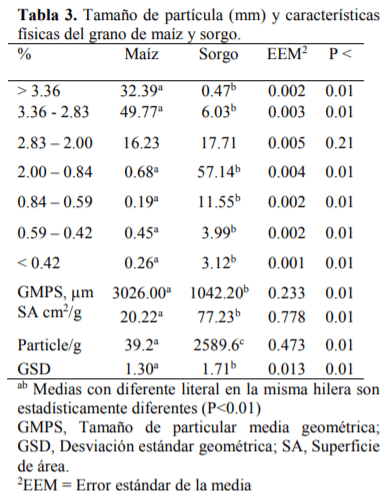
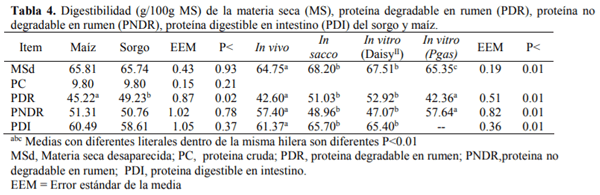
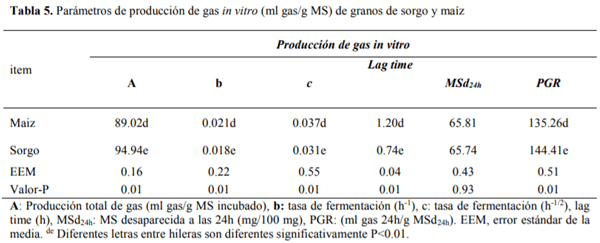
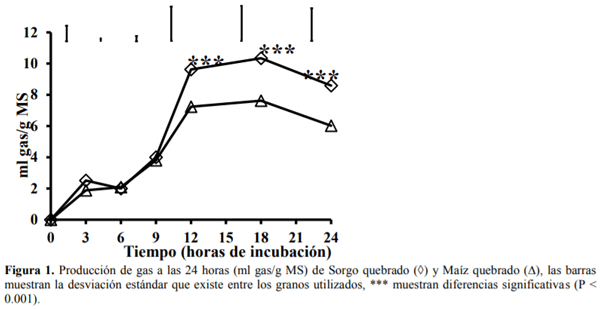
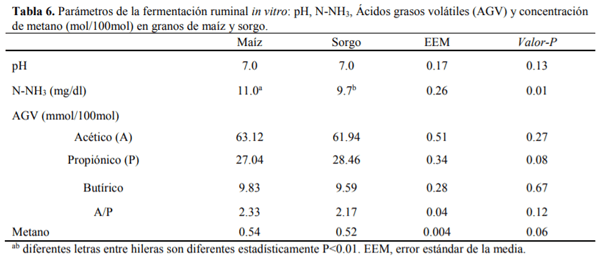
El conocimiento de la digestibilidad de los alimentos es básico para establecer su valor nutritivo y biodisponibilidad de los nutrientes para ello se han utilizado numerosos análisis de laboratorio para estimar la digestión ruminal e intestinal del alimento como son in vitro (Produccion de gas y Daisy) e in sacco, para ser comparadas con el método in vivo. El sorgo presenta el mayor (P<0.01) contenido de almidón, mientras que la FND fue mayor (P<0.01) para el maíz, la MSd fue similar (P=0.93) para ambos cereales, la digestión de la PC fue mayor (P<0.01) para el sorgo con respecto al maíz, mientras que para la proteína no degradable en rumen (PNDR) y la proteína degradable en intestino (PDI) no se encontraron diferencias (P>0.05) entre cereales. Con lo que respecta a los métodos de digestibilidad, la MSd fue menor (P<0.01) para el in vivo con respecto al resto de los métodos, la digestión de la PC tanto en rumen como en intestino fue mayor (P>0.01) para los métodos in sacco e in vitro (Daisy). La producción de AGV´S fue similar para ambos cereales. Las técnicas in situ e in vitro (DaisyII®) permiten determinar la digestibilidad de forma rápida y sencilla comparado con los métodos convencionales. El molido del sorgo mejora su valor alimenticio aumentando su digestibilidad, lo que representa una alternativa ante el maíz para la alimentación de terneros en engorda.
Palabras clave: in vivo, in sacco, proteína degradable en rumen, proteína digestible en intestino, Producción de gas in vitro.
Adesogan A.T., Krueger N.K., Kim S.C. 2005. A novel, wireless, automated system for measuring fermentation gas production kinetics of feeds and its application to feed characterization. Animal Feed Science and Technology 123:211–223.
Al Rabadi J.G., Torley J.P., Williams A.B., Bryden L.W., Gidley J.M. 2001. Effect of extrusion temperature and pre-extrusion particle size on starch digestion kinetics in barley and sorghum grain extrudates. Animal Feed Science and Technology. 168:267-279.
Altamirano D.J., Castro N.S., Mendoza M.G.D., Cobos P.M.A., Ricalde V.R, Plata P.F.X. 2004. Degradabilidad ruminal in vitro de almidón de 21 variedades de sorgo (sorghum bicolor. L Moench) con diferente genotipo de resistencia a sequía. Interciencia. 29:329- 333.
Álvarez, JH., Santini, JF., Rearte, HD., Elizalde, CJ. 2001. Milk production and ruminal digestion in lactating dairy cows grazing temperate pastures and supplement with dry cracked corn or high moisture corn. Animal Feed Science and Technology. 91:183–195.
Ankom Technology 2008 Procedures for fiber and in vitro analysis URL: http://www.ankom.com/09_procedures/Dais y%20method.pdf
AOAC, 1991. Official methods of analysis. 14th ed. Assoc. Offic. Anal. Chem. Arlington, VA
Arce P.C., Arbaiza F.T., Carcelén C.F., Lucas A.O. 2003. Estudio comparativo de la digestibilidad de forrajes mediante dos métodos de laboratorio. Revista de Investigaciones Veterinarias del Perú. 14:7- 12.
Arzola-Álvarez C., Bocanegra-Viezca J.A.,Murphy M.R., Salinas-Chavira J., Corral-Luna A., Romanos A, Ruíz-Barrera O., RodríguezMuela C. 2010. Particle size distribution and chemical composition of total mixed rations for dairy cattle: Water addition and feed sampling effects. Journal of Dairy Science. 93:4180–4188.
Atasoglu, C. Yurtman, Y.I. 2006. In vitro fermentation of different starches by mixed micro-organisms from the sheep rumen. Journal Animal Physiology and Animal Nutrition. 91:419–425.
Balogun O.R., Bird H.S. and Rowe B. J. 2006. Germination temperature and time affect in vitro Fermentability of sorghum grain. Animal Feed Science and Technology. 127:125–132.
Beauchemin, K.A., Yang W.Z., Rode L.M. 2001. Effects of barley grain processing on the site and extent of digestion of beef feedlot finishing diets. Journal of Animal Science 79:1925-1936.
Blaxter, K.L., Wainman, W. F. 1964. Utilization of food by sheep and cattle. Journal of Agricultural Science. 57:419–422
Bochi-Brum, O., Carro D.M., Valdés C., González S.J., López S. 1999. In vitro digestibility of forages and concentrates: effect of the diet of donor animals. Archivos de Zootecnia. 48:51-61.
Calsamiglia, S., Ferret, A. 2002. Fisiología ruminal relacionada con la patología digestiva: Acidosis y Meteorismo. XVIII Curso de especialización FEDNA. Barcelona, 4 y 5 de Noviembre de 2002. pp. 97-115.
Calsamiglia, S., Stern, D.M. 1995. A three-step in vitro procedure for estimating intestinal digestion of protein in ruminants. Journal of Animal Science. 73:1459–1465.
Chaney A. L., Marbach E. P. 1962. Modified reagents for determination of urea and ammonia. Clinical Chemistry 8:130–132.
Cone J.W., Rodrigues M.A.M., Guedes C.M., Blokc M.C. 2009. Comparison of protein fermentation characteristics in rumen fluid determined with the gas production technique and the nylon bag technique. Animal Feed Science and Technology. 153:28-38.
Corona, L., Owens, N.F., Zinn, A.R. 2006. Impact of corn vitreousness and processing on site and extent of digestion by feedlot cattle. Journal of Animal Science. 84:3020-3031.
Danesh Mesgaran, M., Stern, D.M. 2005. Ruminal and post-ruminal protein disappearance of various feeds originating from Iranian plant varieties determined by the in situ mobile bag technique and alternative methods. Animal Feed Science and Technology. 118:31–46.
Delagarde R., Pérez-Ramírez E. Peyrauda J.L. 2010. Yentterbium oxide has the same accuracy as chromic oxide for estimating variations of faecal dry matter output in dairy cows fed a total mixed ration at two feeding levels. Animal Feed Science and Technology. 161:121–131.
DePeters, J.E., Getachew, G., Fadel, G. J., Zinn, A. R., Taylor, J.S., Pareas, W. J., Hinders, G. R., Aseltine, S. M. 2003. In vitro gas production as a method to compare fermentation characteristics of steam-flaked corn. Animal Feed Science and Technology. 105:109–122.
Dijkstra, J., Kebreab, E., Bannink, A., France, J., López, S. 2005. Application of the gas production technique to feed evaluation systems for ruminants. Animal Feed Science and Technology. 123:561–578.
Ensor, H.H. 1970. A report: Committee on classification of particle size in feedstuffs. Journal of Dairy Science. 53:689–670.
Faichney, G.J. 1975. The use of markers to partition digestion within the gastro-intestinal tract of ruminants. In: I. W. McDonald and A. C. I. Warner (Ed.). Digestion and Metabolism in the Ruminant. Univ. of New England Publ. Unit. Armidale, Australia.
France, J., Dhanoa, S.M., Theodorou, K.M., Lister, J.S. Davies, R.D., Isac, D. 1993. A model to interpreted gas accumulation profiles associates whit in vitro degradation of ruminants feeds. Journal of Theorical Biology. 163:99–11.
Galyean M.L., Wagner D.G., Owens F.N. 1981. Dry matter and starch disappearance of corn and sorghum as influenced by particle size and processing. Journal of Dairy Science 64:1804-1812.
Gargallo, S., Calsamiglia, S., Ferret, A. 2006. Technical note: A modified three-step in vitro procedure to determine intestinal digestion of proteins. Journal of Animal Science. 84:2163-2167.
Getachew, G., Blummel, M., Makkar, S.P.H., Becker, K. 1998. In vitro gas measuring techniques for assessment of nutritional quality of feeds: a review. Animal Feed Science and Technology. 72:261-281.
Giraldo A.L., Gutiérrez A.L., Rúa C., 2007. Comparison between in vitro and in situ protocols for estimating true digestibility of several tropical forages. Revista Colombiana de Ciencias Pecuarias. 20:269-279.
Goering, H.K. and P.I. Van Soest. 1970. Forage fiber analysts (apparatus, reagents, procedures, and some applications). Agriculture Handbook 379. ARS, ASDA. Washington, DC.
González Ronquillo, M., Fondevila, M., Barrios, U.A., Newman, Y. 1998. In vitro gas production from buffel grass (Cenchrus ciliaris L.) fermentation in relation to the cutting interval, the level of nitrogen fertilization and the season of growth. Animal Feed Science and Technology. 72:19-35.
Hale, W.H. 1973. Influence of processing on the utilization of grains (starch) by ruminants. Journal of Animal Science. 37:1075–1080.
Hibberd, C.A., Wagner, D.G., Schemm, R.L., Mitchel, E. D. Jr., Weibel, D. E., Hintz, R. L. 1982. Digestibility characteristics of isolated starch from sorghum and corn grain. Journal of Animal Science. 55:1490–1497.
Hill, F.N., Anderson, D.L. 1958. Comparison of metabolizable energy and productive determinations with growing chicks. The Journal of Nutrition. 64:587-603.
Hristov, A.N., S. Ahvenjarvi, T.A. McAllister, and P. Huhtanen. 2003. Composition and digestive tract retention time of ruminal particles with functional specific gravity greater or less than 1.02. Journal of Animal Science. 81:2639–2648.
Jouany, J.P. 1982. Volatile fatty acid and alcohol determination in digestive contents, silage juices, bacterial cultures and anaerobic fermentor contents. Journal of Food Science. 2:131-144.
Kotarski, S.F., Waniska, R.D., Thurn, K.K. 1992. Starch hydrolysis by the ruminal microflora. Journal of Nutrition. 122:178–190
Lowman S.R., Theodorou K.M., Cuddeford D. 2002. The effect of sample processing on gas production profiles obtained using the pressure transducer technique. Animal Feed Science and Technology. 97:221-237.
Mahasukhonthacha, K., Sopade, A. P., Gidley, J. M. 2010. Kinetics of starch digestion in sorghum as affected by particle size. Journal of Food Engineering 96:18–28.
Mauricio, R.M., Mould, F.L., Dhanoa, M.S., Owen, E., Channa, K.S., Theodorou, M.K. 1999. Semi-automated in vitro gas production technique for ruminant feedstuff evaluation. Animal Feed Science and Technology. 79:321–330.
Menke, K.H., Raab, L., Salewski, A., Steingass, H., Fritz, D., Schneider, W. 1979. The estimation of the digestibility and metabolizable energy content of ruminant feedingstuffs from the gas production when they incubated with rumen liquor in vitro. Journal of Agricultural Science. 93:217–222.
National Research Council. 1996. Nutrient requirement of dairy cattle. 6th rev. ed. National Academy Press, Washington, D.C.
Navarro C.A., Díaz J.C., Roa M.L., Cuellar E. 2011. Comparison of digestibility technical in vitro with in situ of ten fodder in cattle “ruminofistulados” in: the “Piedemonte Llanero of Meta”. Revista de Sistemas de Producción Agroecológicas. 2:2-24.
Olivera, P.M.R. 2001. Estimación del valor nutritivo de los alimentos para ruminates con énfasis en las técnicas in sacco y la producción de gas in vitro. Revista de Producción Animal. 13:45–51.
Ørskov, E.R., McDonald, I. 1979. The estimation of protein degradability in the rumen from incubation measurements weighted according to rate of passage Journal of Agricultural Science Cambridge. 92:499- 503.
Owens, N.F., Secrist, S.D., Hill, J.W., Gill, R.D. 1998. Acidosis in cattle: A review. Journal of Animal Science. 76:275–286.
Pell, N.A., Schofield, P. 1993. Computerized monitoring of gas production to measure forage digestion in vitro. Journal of Dairy Science. 76:1063-1073.
Ramos, O.M.B., Champion, M., Poncet, C., Mizubuti, Y.I., Nozière, P. 2009. Effects of vitreousness and particle size of maize grain on ruminal and intestinal in sacco degradation of dry matter, starch and nitrogen. Animal Feed Science and Technology. 148:253–266.
SAS Inc. 2002–2003. SAS system for windows, release 9.0 (TS1M3). Cary (NC): SAS Institute Inc.
Siddons, R. C., Nolan, J. V., Beever, D., MacRae, J. C. 1985. Nitrogen digestion and metabolism in sheep consuming diets containing contrasting forms and levels of nitrogen. British Journal of Nutrition. 54:175-187.
Steel, R.G.D., Torrie, J.H. 1997. Principles and procedures of statistics. 39, McGraw Hill, New York.
Streeter, N.M., Hill, M.G., Wagner, G.D., Hibberd, A.C., Owens, N.F. 1993. Chemical and physical properties and in vitro dry matter and starch digestion of eight sorghum grain hybrids and maize. Animal Feed Science and Technology. 44:45–58.
System Analyses Statistics (SAS) for windows. 2002. SAS Institute, Statistical analysis systems user’s guide. SAS Cary, NC.
Theodorou, K.M., Williams, B.A., Dhanoa, M.S., McAllan, A. B., France, J. A. 1994. A simple gas production method using a pressure transducer to determine the fermentation kinetics of ruminant feed. Animal Feed Science and Technology. 48:185–197.
Tilley, J.M.A., Terry, R.A. 1963. A two-stage technique for the in vitro digestion of forage crops. Journal British Grassland Society. 18:104-11.
Trei, J.E., Hale, J.W., Theurer, B. 1966. Influence of grain processing factors on in vitro fermentation rate. Journal of Animal Science. 25: 910 (Abstract)
Wadhwa, M., Dharam Paul., Kataria, P., M.P.S. Bakshi, S. P. M. 1998. Effect of particle size of corn grains on the release of nutrients and in sacco degradability. Animal Feed Science Technology. 72:11–17.
Weatherburn, W.M. 1967. Phenol-Hypochloite reaction for determination of ammonia. Analitical Chemistry. 39:971–975.
Weston, R.H., Hogan, P.J. 1968. The digestion of pasture plants by sheep. I. Ruminal production of volatile fatty acids by sheep offered diets of rye grass and forage oats. Australian Journal Agricultural Research. 19:419–432.
Wolin, M.J. 1960. A theoretical rumen fermentation balance. Journal of Dairy Science. 43:1452- 1459.
Wong, H.J., Lau, T., Cai, N., Singh, J., Pedersen, F.J., Vensel, H.W., Hurkman, J.W., Wilson, D.J., Lemaux, G.P., Buchanan B.B. 2009. Digestibility of protein and starch from sorghum (Sorghum bicolor) is linked to biochemical and structural features of grain endosperm. Journal of Cereal Science. 49:73-82.
Yang, J.H., Tamminga, S. Barbara, A.W., Dijkstra, J., Boer, H. 2005. In vitro gas and volatile fatty acids production profiles of barley and maize and their soluble and washout fractions after feed processing. Animal Feed Science and Technology. 120:125–140.
Zinn R.A. 1990. Influence of flake density on the comparative feeding value of steam-flaked corn for feedlot cattle. Journal of Animal Science. 68:767-775.







