Uso de una 6-fitasa bacteriana termoestable en la alimentación de pollos
Publicado: 28 de octubre de 2015
Por: Bernardo F. Iglesias; Ing Jorge Azcona; Viviana Charriere (Instituto Nacional de Tecnologia Agropecuaria INTA-EEA Pergamino); Julián Melo (Fac.Cs.Agrarias, Universidad Catolica Argentina - UCA)
Introducción
La mayoría de los alimentos utilizados en la alimentación de las aves posee una considerable proporción de fósforo de origen vegetal (50-70 %) que está presente en forma de fitato (Reddy et al., 1982; Kratzer y Vohra, 1986). Los fitatos son una mezcla de sales del ácido mioinositol hexafosfórico o ácido fítico. La capacidad de utilización de este P por parte de los animales es muy baja (Ravindran et al., 1995; Kornegay et al., 1996), debido a la carencia de la enzima fitasa necesaria para hidrolizar y liberar el fósforo (Adeola et al., 2004).
Las fitasas (fosfohidrolasas de hexafosfato de mioinositol) son fosfatasas específicas que hidrolizan los fitatos a inositol y ortofosfato (Wyss et al., 1999). La IUPAC-IUB (1984) reconoce dos tipos de actividad fitásica, 3 y 6-fitasas. Su diferencia radica en que la primera inicia su hidrólisis en el grupo fosfato que está en la posición 3 y la 6-fitasa en el que está en la 6. Estas últimas han demostrado mejores resultados que las 3-fitasa, lo cual se debe a sus diferencias en propiedades bioquímicas y biofísicas (Rodriguez et al., 1999; Wodzinski y Ullah, 1996).
El origen de la fitasa también puede modificar las propiedades de la misma, modificándose el pH óptimo de acción o la capacidad de resistencia a las enzimas digestivas, lo cual modifica la eficiencia y consistencia de su actividad (Onyango et al., 2005). El uso de las fitasas microbianas como aditivo en las raciones de las aves fue inicialmente estudiado por Nelson (1976), aunque la evolución de su investigación ha permitido que la eficacia de las fitasas comerciales logren una mejora en la digestibilidad del P fítico en las aves desde 35 hasta alrededor del 60 % (Shoner et al., 1993; Ravindran et al., 1995; Kornegay et al., 1996),con la consiguiente reducción en la concentración de P en las excretas (Simons et al.,1990) y, por tanto, una mejora en la mineralización de los huesos (Qian et al., 1996).
Otros trabajos también han demostrado el efecto beneficioso de su administración al mejorar la retención de Ca, Zn, Mg, Fe y Cu (Sebastián et al., 1996; Mohanna y Nys, 1999;Ravindran et al., 2000) y la digestibilidad de los aminoácidos (Ravindran et al., 1999; Selle et al., 2000). La suma de beneficios lleva a la obtención de dietas de menor costo (Rutherfurd et al., 2004; Francesch et al., 2005).
Las fitasas (fosfohidrolasas de hexafosfato de mioinositol) son fosfatasas específicas que hidrolizan los fitatos a inositol y ortofosfato (Wyss et al., 1999). La IUPAC-IUB (1984) reconoce dos tipos de actividad fitásica, 3 y 6-fitasas. Su diferencia radica en que la primera inicia su hidrólisis en el grupo fosfato que está en la posición 3 y la 6-fitasa en el que está en la 6. Estas últimas han demostrado mejores resultados que las 3-fitasa, lo cual se debe a sus diferencias en propiedades bioquímicas y biofísicas (Rodriguez et al., 1999; Wodzinski y Ullah, 1996).
El origen de la fitasa también puede modificar las propiedades de la misma, modificándose el pH óptimo de acción o la capacidad de resistencia a las enzimas digestivas, lo cual modifica la eficiencia y consistencia de su actividad (Onyango et al., 2005). El uso de las fitasas microbianas como aditivo en las raciones de las aves fue inicialmente estudiado por Nelson (1976), aunque la evolución de su investigación ha permitido que la eficacia de las fitasas comerciales logren una mejora en la digestibilidad del P fítico en las aves desde 35 hasta alrededor del 60 % (Shoner et al., 1993; Ravindran et al., 1995; Kornegay et al., 1996),con la consiguiente reducción en la concentración de P en las excretas (Simons et al.,1990) y, por tanto, una mejora en la mineralización de los huesos (Qian et al., 1996).
Otros trabajos también han demostrado el efecto beneficioso de su administración al mejorar la retención de Ca, Zn, Mg, Fe y Cu (Sebastián et al., 1996; Mohanna y Nys, 1999;Ravindran et al., 2000) y la digestibilidad de los aminoácidos (Ravindran et al., 1999; Selle et al., 2000). La suma de beneficios lleva a la obtención de dietas de menor costo (Rutherfurd et al., 2004; Francesch et al., 2005).
Objetivos
El objetivo del presente trabajo fue la evaluación de una 6-fitasa bacteriana termoestable sobre el desempeño zootécnico y mineralización ósea de pollos.
Materiales y Métodos
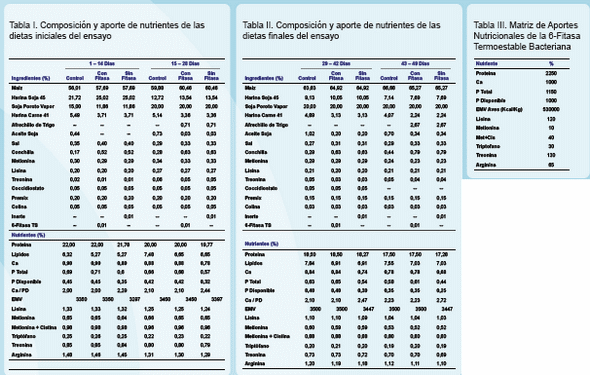
En una unidad experimental de la EEA-Pergamino del INTA se alojaron 432 machos Cobb de un día de edad, distribuidos en un diseño en bloques al azar en 3 tratamientos con 8 repeticiones de 18 aves cada una. Los tratamientos fueron 1- CONTROL, 2- CON FITASA (dietas isonutritivas) y 3- SIN FITASA (ídem T2 sin fitasa). En las Tablas I y II se especifican los ingredientes utilizados y los aportes de nutrientes formulados para cada una de las dietas. Se utilizaron cuatro dietas a base de maíz-soja formuladas para cubrir los requerimientos de la estirpe genética y peletizadas a 84°C. El alimento se elaboró en forma de pellet en INTA para 4 etapas: Iniciador (1 – 14 días), Crecimiento (15 – 28 días), Terminador (29 – 42 días) y Última Semana (43 – 49 días).Se consideró que la 6-FITASA BACTERIANA TERMOESTABLE aporta 0,10% de Pd y Ca, 53 Kcal/Kg y 0,225% de PC (dosis: 100 ppm o 500 FTU/kg), siendo la matriz de aportes nutricionales presentada en la Tabla III.
La fitasa utilizada es el resultado de la expresión de un gen modificado de Escherichia coli por parte de una levadura Pichia pastoris (Precizion Fit TS, Smizyme-TS). Semanalmente se registró peso vivo y consumo de alimento, calculándose conversión alimenticia y relación peso/conversión. Al concluir el ensayo se faenaron 20 aves por tratamiento para determinar cenizas en tibia. Los datos fueron sometidos a análisis de varianza y prueba de Duncan para la separación de medias, utilizando el software InfoSTAT® (Córdoba, Argentina).
La fitasa utilizada es el resultado de la expresión de un gen modificado de Escherichia coli por parte de una levadura Pichia pastoris (Precizion Fit TS, Smizyme-TS). Semanalmente se registró peso vivo y consumo de alimento, calculándose conversión alimenticia y relación peso/conversión. Al concluir el ensayo se faenaron 20 aves por tratamiento para determinar cenizas en tibia. Los datos fueron sometidos a análisis de varianza y prueba de Duncan para la separación de medias, utilizando el software InfoSTAT® (Córdoba, Argentina).
Resultados y Discusión
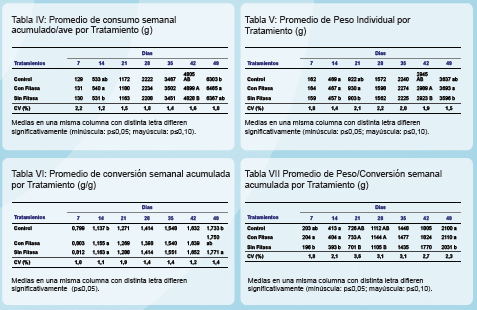

Los pollos que recibieron la dieta CON FITASA tuvieron el mayor consumo a lo largo de toda la experiencia, siendo las diferencias significativas respecto del tratamiento CONTROL a los 48 días y respecto del tratamiento SIN FITASA a los 14 y 42 días. Este efecto de una fitasa favoreciendo el consumo de alimento ha sido reportado en otros trabajos con enzimas similares (Watson et al., 2006). Para el peso vivo individual no se observaron diferencias significativas entre el CONTROL y la dieta CON FITASA a lo largo de toda la experiencia. Los pollos que recibieron la dieta CONTROL siempre tuvieron un peso más alto que los que recibieron la dieta SIN FITASA (diferencias significativas a los 14 días).
Los pollos que recibieron la dieta CON FITASA tuvieron un peso más alto que los que recibieron la dieta SIN FITASA (diferencias significativas a los 14, 21, 42 y 49 días).
Estos resultados muestran la acción de la enzima sobre la utilización de nutrientes que se expresa en un mayor crecimiento. En general no se observaron diferencias en conversión alimenticia entre tratamientos excepto a los 14 y 49 días, donde la conversión del tratamiento SIN FITASA difiere significativamente del CONTROL. Para la variable Peso/Conversión no se observaron diferencias entre los pollos del tratamiento CONTROL y los que recibieron la dieta CON FITASA. Los pollos que consumieron la dieta SIN FITASA tuvieron una relación peso/conversión más baja respecto del CONTROL, siendo las diferencias significativas a los 14 y 49 días.
La misma respuesta se dio al comparar la dieta SIN FITASA con la dieta CON FITASA siendo las diferencias significativas a los 7, 14, 20, 27 y 48 días. El contenido de cenizas en tibias de los tratamientos CONTROL y CON FITASA fue similar, mientras que el del tratamiento SIN FITASA fue significativamente menor respecto del Control.
Los pollos que recibieron la dieta CON FITASA tuvieron un peso más alto que los que recibieron la dieta SIN FITASA (diferencias significativas a los 14, 21, 42 y 49 días).
Estos resultados muestran la acción de la enzima sobre la utilización de nutrientes que se expresa en un mayor crecimiento. En general no se observaron diferencias en conversión alimenticia entre tratamientos excepto a los 14 y 49 días, donde la conversión del tratamiento SIN FITASA difiere significativamente del CONTROL. Para la variable Peso/Conversión no se observaron diferencias entre los pollos del tratamiento CONTROL y los que recibieron la dieta CON FITASA. Los pollos que consumieron la dieta SIN FITASA tuvieron una relación peso/conversión más baja respecto del CONTROL, siendo las diferencias significativas a los 14 y 49 días.
La misma respuesta se dio al comparar la dieta SIN FITASA con la dieta CON FITASA siendo las diferencias significativas a los 7, 14, 20, 27 y 48 días. El contenido de cenizas en tibias de los tratamientos CONTROL y CON FITASA fue similar, mientras que el del tratamiento SIN FITASA fue significativamente menor respecto del Control.
Conclusiones
La 6-FITASA BACTERIANA TERMOESTABLE evaluada permitió obtener similar respuesta zootécnica y de mineralización ósea que los pollos CONTROL, mientras que aquellos alimentados SIN FITASA mostraron peor desempeño y menor incorporación de minerales en tibias.
Referencias Bibliográficas
- FRANCESCH, M., J. BROZ AND J. BRUFAU. 2005. Effects of an experimental phytase on performance, egg quality, tibia ash content, and phosphorus bioavilability in laying hens fed on maize-or barley-based diets. Br. Poult. Sci. 46:340-348.
- IUPAC-IUB, 1984. Recommendations of the nomenclature committee of the international union of biochemistry. En: Enzyme nomenclature. Academic Press Inc., Orlando.
- KORNEGAY E.T., DENBOW D.M., YI Z., RAVINDRAN V., 1996. Response of broilers to graded levels of microbial phytase added to maize-soybean-meal-based diets containing three levels of non phytate phosphorus. Brit. J. Nutr. 75, 839-852.
- KRATZER F.H., VOHRA P., 1986. Role of phytic acid and other phosphates as chelating agents. En: Chelates in nutrition. CRC Press, Boca Raton, Florida, pp. 49-61.
- NELSON T.S., 1976. The hydrolysis of phytate phosphorus by chicks and laying hens. Poult. Sci. 55,2262-2264.
- QIAN H., KORNEGAY E.T., DENBOW D.M., 1996. Phosphorus equivalence of microbial phytase in turkeys diets as influenced by calcium to phosphorus ratios and phosphorus levels. Poult. Sci. 75, 69-81.
- RAVINDRAN, V., W. L. BRYDEN AND E. T. KORNEGAY. 1995. Phytin: Occurrence, bioavailability and implication in poultry nutrition. Poult. Avian Rev. 6:125-143.
- RAVINDRAN V., BRYDEN W.L., KORNEGAY E.T., 1995. Phytates: Occurrence, bioavailability and implications in poultry nutrition. Poult. Avian Dis. Biol. Rev. 6, 125-143.
- ONYANGO, E. M., M. R. BEDFORD AND O. ADEOLA. 2005. Phytase activity along the digestive tract of the broiler chick: A comparative study of an Escherichia coli-derived and peniophora lycii phytase. Can. J. Anim. Sci. 85:61-68.
- REDDY, N. R., C. V. BALAKRISHNAN AND D. K. SALUNKHE, 1982. Phytates in legumes. Adv. Food Res. 28:1-92.
- RODRIGUEZ, E., Y. HAN AND X. G. LEI. 1999. Cloning, sequencing and expression of an Escherichia coli acid phosphatase/phytase gene (appA2) isolated from pig colon. Biochem. Biophys. Res.Comm. 257:117-123.
- RODRIGUEZ, E. J., M. PORRES, Y. HAN AND X. G. LEI. 1999. Different sensitivity of recombinant Aspergillus niger phytase (r-Phy A) and Escherichia coli PH 2.5 acid phosphatase (r-AppA) to trypsin and pepsin in vitro. Arch. Biochem. Biophysiol.365:262-267.
- RUTHERFURD, S. M., T. K. CHUNG, P. C. H. MOREL AND P. J. MOUGHAN. 2004. Effect of microbial phytase on ileal digestibility of phytate phosphorus, total phosphorus, and amino acids in a low-phosphorus diet for broilers. Poult. Sci. 83:61-68.
- SCHONER F.J., HOPPE P., SCHWARZ G., WIESCHE H., 1993. Effects of microbial phytases and inorganic phosphate in broiler chickens: performance and mineral retention at various calcium levels. J. Anim. Phy. Anim Nutr. 69, 235-244.
- SEBASTIAN S., TOUCHBURN S.P., CHÁVEZ E.R., LAGUE P.C., 1996. The effects of supplemental microbial phytase on the performance and utilization of dietary calcium, phosphorus, copper, and zinc in broiler chickens fed corn-soybean diets. Poult. Sci. 75, 729-736.
- SELLE P.H., RAVINDRAN V., CALDWELL R.A., BRYDEN W.L., 2000. Phytate and phytase: consequences for protein utilisation. Nutr. Res. Rev. 13, 255-278.
- SIMONS P.C.M., VERSTEEGH H.A.J., JONBLOED A.W., KEMME P.A., STUMP P., BOS K.D.,
- WOLTERS M.G.E., BEUDEKER R.F., VERSCHOOR G.J., 1990. Improvement of phosphorus availability by microbial phytase in broilers and pigs. Br. J. Nutr. 64, 525-540.
- WODZINSKI, R. J. AND A. H. J. ULLAH. 1996. Phytase. pages 263-302 Advances in applied microbiology. Vol. 42. Academic press,New York.
- WYSS M., BRUGGER R., KRONENBERGER A., REMY R., FIMBELD R., OESTERHELT G., LEHMANN M., VAN LOON A.P., 1999. Biochemical characterization of fungal
Contenido del evento:
Temas relacionados:
Autores:
Instituto Nacional de Tecnología Agropecuaria - INTA
Instituto Nacional de Tecnología Agropecuaria - INTA
Instituto Nacional de Tecnología Agropecuaria - INTA
Universidad Nacional de Lujan
Mostrar más
Recomendar
Comentar
Compartir
Recomendar
Responder
Recomendar
Responder

¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.










.jpg&w=3840&q=75)