¿Son las enzimas que degradan los polisacáridos no amiláceos (PNAs) el link entre la nutrición y la salud intestinal?
Publicado: 31 de julio de 2022
Por: Luis-Miguel Gómez-Osorio, PhD Country Manager Colombia
Mensajes claves:
1. Los polisacáridos no amiláceos (PNAs) son compuestos de las plantas con efectos adversos sobre la nutrición y la salud intestinal
2. Las enzimas que degradan los PNAs actúan por tres modos de acción principalmente: reducción de viscosidad intestinal, liberación de nutrientes “enjaulados” y generación de compuestos prebióticos
3. Las enzimas hidrolizan factores anti-nutricionales liberando compuestos prebióticos con capacidad de modular el sistema inmune local y sistémico, generando un puente entre la nutrición y la salud animal
4. El mejoramiento en la función de barrera intestinal por XOS y MOS, sea directo o a través de enzimas degradadoras de PNAs, ayuda a prevenir la colonización de patógenos y potenciar la inmunidad, mejorando la salud intestinal en los monogástricos.
2. Las enzimas que degradan los PNAs actúan por tres modos de acción principalmente: reducción de viscosidad intestinal, liberación de nutrientes “enjaulados” y generación de compuestos prebióticos
3. Las enzimas hidrolizan factores anti-nutricionales liberando compuestos prebióticos con capacidad de modular el sistema inmune local y sistémico, generando un puente entre la nutrición y la salud animal
4. El mejoramiento en la función de barrera intestinal por XOS y MOS, sea directo o a través de enzimas degradadoras de PNAs, ayuda a prevenir la colonización de patógenos y potenciar la inmunidad, mejorando la salud intestinal en los monogástricos.

Introducción
Los polisacáridos no amiláceos (PNAs) son una parte significativa de los ingredientes de las plantas, que pueden variar en rangos de 10 a 75% y se usan principalmente en las raciones de alimentos para monogástricos (1). Los PNAs más importantes en los cereales y subproductos agroindustriales usados en dietas para monogástricos son los arabinoxilanos y los mananos, los cuales actúan como potenciales factores pro-inflamatorios ocasionando inflamación intestinal crónica (2). La proporción de PNAs solubles, poseen actividades anti-nutricionales especialmente en dietas para aves y cerdos, ocasionando cambios en la fisiología intestinal, microbiota y en la salud intestinal. Contrariamente, se ha reportado que la porción insoluble de los PNAs actúa de manera diferente comparado con los PNAs solubles ya que los primeros tienen efectos benéficos en el tracto gastrointestinal y en la secreción de enzimas endógenas.
Las enzimas que degradan los PNAs han sido propuestas para ayudar a incrementar la energía metabolizable (EM) en las dietas para monogástricos con alto, medio y bajo contenido de fibra. Se han publicado artículos científicos, demostrando el mejoramiento que pueden llegar a tener estas enzimas en el alimento sobre el desempeño, explicado por tres modos de acción principalmente: Reducción de la viscosidad, destrucción de la pared celular por solubilización de polímeros específicos (liberación de los almidones y las proteínas que estaban encapsuladas en la parde vegetal) y la generación de oligosacáridos que se producen por la destrucción de la misma pared celular promoviendo el crecimiento de bacterias benéficas o lo que se conoce como efecto prebiótico (3,4) (Figura 1).
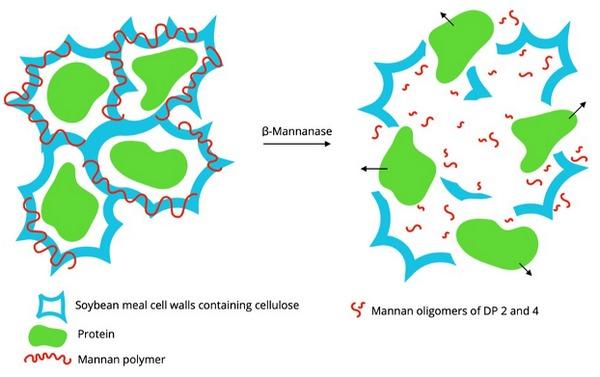
Figura 1. Explicación del modo de acción de enzimas que degradan PNAs en un sustrato como la torta de soya (SBM) usando como ejemplo a las beta mananasas. Existe una respectiva solubilización de la pared celular, principalmente componentes de la hemicelulosa, produciendo oligosacáridos de grado de polímeros entre 2 y 4 los cuales tienen un efecto prebiótico. Tomado de Gomez-Osorio et al, 2021.
Reducción de Viscosidad
Las fibras solubles formadoras de viscosidad intestinal, tales como arabinoxilanos, pectinas, glucanos y mananos, aun no es claro si la viscosidad es la causante del deterioro en el desempeño productivo y en la disminución en la absorción de nutrientes (5). Sin embargo, lo que se sabe es que las enzimas que disminuyen la viscosidad intestinal mejoran los efectos negativos de los PNAs solubles (6). La explicación biológicamente más plausible para los efectos negativos de la viscosidad, radica en que esta disminuye el tiempo de tránsito intestinal de la digesta en el tacto gastrointestinal al punto casi de frenarla por completo, lo cual crea un ambiente de baja concentración de oxígeno (anaerobiosis) por su alta capacidad de interactuar con el agua (7), reduciendo la difusión de enzimas y la posterior hidrólisis de sustratos, lo cual incrementa la presencia de nutrientes libres en el intestino favoreciendo el crecimiento de patógenos intestinales que se alimentan precisamente de proteína y almidones no digeridos, y que compiten por nutrientes con bacterias benéficas. Además, ocasionando un crecimiento exagerado de bacterias o disbiosis y creando un ambiente propicio para bacterias con alto potencial patogénico (8). Ante tales circunstancias, el animal tiende a compensar dichos efectos consumiendo más alimento (con menor eficiencia por supuesto) y secretando más enzimas en el páncreas. Al parecer, el uso de antibióticos específicos de bacterias potencialmente generadoras de viscosidad, parecen diezmar los efectos negativos de dietas con alto potencial viscoso como aquellas con arroz y/o cebada. De acuerdo con lo anterior, se demostró que la inclusión de 3 g/kg de goma guar, una fuente de fibra rica en mananos generadores de alta viscosidad, ocasionó una disminución del 4% en la eficiencia alimenticia en pollos de engorde. Además, se demostró una disminución lineal en la digestibilidad aparente de lípidos, proteína y EM (9). El uso de fibra soluble tipo pectinas en dietas para pollo de engorde, redujo la eficiencia alimenticia hasta en un 28% cuando fue incluida al 3% en la dieta (10). Es por esto por lo que las fibras solubles son indeseables a cualquier nivel debido a los efectos negativos que genera en la digestibilidad de nutrientes.
Dos de los factores claves que afectan la digestión en la presencia de fibras solubles son: la solubilidad (efecto principal en intestino delgado y en la tasa de pasaje) y la fermentabilidad (efecto en intestino grueso). Ambos factores están explicados por el tipo de enlaces y la cantidad de ramificaciones en las unidades de azúcar, las cuales permiten interactuar con moléculas de agua. Es generalmente aceptado que cadenas largas de tipo 1-4, como en la celulosa, son poco solubles, mientras que las ramificaciones 1-3 son altamente solubles como lo es el caso de los b-glucanos (11).
Liberación de Nutrientes
La pared celular vegetal de cereales y leguminosas encapsula almidones y proteína del endospermo, las cuales se usan frecuentemente como ingredientes en las dietas de aves y cerdos. Dicho material no puede ser digerido por las enzimas endógenas del animal. Es lógico pensar que cualquier enzima que sea capaz de romper o aflojar la pared celular, podría facilitar el acceso de las enzimas endógenas a los sustratos adecuados facilitando, la interacción directa entre ellos. Análisis in-vitro han podido demostrar cómo las enzimas degradan parte de la pared celular permitiendo la liberación de proteínas y almidón del endospermo. Por ende, suena lógico pensar que el uso de enzimas mejorará la digestibilidad de la proteína y el almidón porque posibilita un acceso más rápido a las proteasas y amilasas endógenas que previamente estaban “enjauladas” inclusive en sustratos complejos como la torta de palmiste que contiene hasta 45% de PNAs (3,12).
Efecto prebiótico
La degradación de PNAs solubles genera carbohidratos de bajo peso molecular tales como los oligosacáridos, los cuales son considerados prebióticos. Los prebióticos se pueden definir como aquellos ingredientes del alimento no digestibles y que promueven bacterias benéficas en el tracto gastrointestinal, mejorando la salud del hospedero (13). Los prebióticos facilitan el crecimiento de bacterias benéficas como Lactobacillus spp y Bifidobacterium spp, las cuales han sido categorizadas como benéficas para el desarrollo intestinal (14). Para que sean considerados prebióticos deben cumplir con tres condiciones: la primera es que no se hidrolicen o absorban en la parte superior del tracto gastrointestinal, la segunda es que sean un nutriente “selectivo” que apoye el crecimiento y actividad metabólica de la microbiota benéfica. Tercero, el prebiótico debe promover cambios a nivel local y/o sistémico que beneficien al hospedero de alguna manera (15). Ejemplos de prebióticos que cumplen con dichos criterios son los: Fructo-oligosacáridos (FOS), galacto-oligosacáridos (GOS), manano-oligosacáridos (MOS) y polímeros de tipo carbohidrato relacionados. No obstante, la definición aún continúa y otros compuestos han sido clasificados como prebióticos entre los que se puede mencionar a los almidones resistentes y lactulosa (16).
Tanto MOS como XOS juegan un papel fundamental en el mantenimiento de la integridad intestinal por incrementar la secreción de inmunoglobulina A (IgA), la cual es fundamental para conservar la microbiota, atacar los patógenos y cuidar la barrera epitelial mediante el refuerzo de las uniones estrechas, evitando la invasión y establecimiento de patógenos en el íleon, evitando su posterior invasión. También, promueven la producción de mucina la cual refuerza la acción de la IgA. De igual manera, tanto la mucina como la IgA, estimulan la producción de citoquinas anti-inflamatorias y disminuyen las pro-inflamatorias, recuperando la homeostasis posterior a un insulto intestinal.
Los MOS con un grado de polimerización inferior a 5, han sido considerados como potentes prebióticos con efectos butirogénicos excepcionales (16). Entre estos, la manobiosa ha sido una de las más efectivas para la prevención de infecciones bacterianas por el incremento de IgA tanto en aves (17) como en cerdos (18). Cuando se ha suplementado MOS en pollo de engorde, se ha logrado incrementar la concentración de IgA y reducir la excreción de ooquistes (probablemente la IgA inhibe el ciclo de vida de la coccidia) (19). En líneas de cultivo celular de macrófagos de pollo, se ha demostrado que la manobiosa es capaz de eliminar Salmonella spp por incrementar la actividad fagocítica gracias al aumento de H202 y óxido nítrico (20). Por ende, el mejoramiento en la función de barrera intestinal por XOS y MOS, sea directo o a través de enzimas degradadoras de PNAs, ayuda a prevenir la colonización de patógenos y potenciar la inmunidad, mejorando la salud intestinal en los monogástricos.
Referencias
1. Choct M. Feed non-starch polysaccharides for monogastric animals: Classification and function. Anim Prod Sci(2015) 55:1360–1366. doi: 10.1071/AN15276
2. Dal Pont GC, Farnell M, Farnell Y, Kogut MH. Dietary factors as triggers of low-grade chronic intestinal inflammation in poultry. Microorganisms (2020) 8:1–10. doi: 10.3390/microorganisms8010139
3. Gomez-Osorio LM, Oh HG, Lee JJ. Confirmation of Cage Effect and Prebiotic Production Potential of a β-Mannanase, with SBM as Substrate Using Microscopy and Wet Chemistry. J Agric Sci (2021) 13:23. doi: 10.5539/jas.v13n2p23
4. Bedford MR. The evolution and application of enzymes in the animal feed industry: the role of data interpretation. Br Poult Sci (2018) 59:486–493. doi: 10.1080/00071668.2018.1484074
5. Nguyen HT, Bedford MR, Wu SB, Morgan NK. Dietary Soluble Non-Starch Polysaccharide Level Influences Performance, Nutrient Utilisation and Disappearance of Non-Starch Polysaccharides in Broiler Chickens. Animals (2022) 12:1–17. doi: 10.3390/ani12050547
6. Park J, Jung S, Carey JB. Effects of a commercial beta-mannanase product on growth performance, intestinal histomorphology, bone and body composition, and amino acid digestibility in white pekin ducks. J Appl Poult Res (2019) 28:63–71. doi: 10.3382/japr/pfy016
7. Chaplin MF. Fibre and water binding. Proc Nutr Soc (2003) 62:223–227. doi: 10.1079/pns2002203
8. Owusu-Asiedu A, Patience JF, Laarveld B, Van Kessel AG, Simmins PH, Zijlstra RT. Effects of guar gum and cellulose on digesta passage rate, ileal microbial populations, energy and protein digestibility, and performance of grower pigs. J Anim Sci (2006) 84:843–852. doi: 10.2527/2006.844843x
9. Maisonnier S, Gomez J, Carré B. Nutrient digestibility and intestinal viscosities in broiler chickens fed on wheat diets, as compared to maize diets with added guar gum. Br Poult Sci (2001) 42:102–110. doi: 10.1080/00071660020035154
10. Langhout DJ, Schutte JB. Nutritional Implications of Pectins in Chicks in Relation to Esterification and Origin of Pectins. Poult Sci (1996) 75:1236–1242. doi: 10.3382/ps.0751236
11. Tejeda O, Woo K. Role of dietary fiber in poultry nutrition. Animals (2021) 11:461.
12. Gomez-Osorio LM, Nielsen JU, Martens HJ, Wimmer R. Upgrading the Nutritional Value of PKC Using a Bacillus subtilis Derived Monocomponent β-Mannanase. Molecules (2022) 27: doi: 10.3390/molecules27020563
13. Gibson GR. Fibre and effects on probiotics (the prebiotic concept). Clin Nutr Suppl (2004) 1:25–31. doi: 10.1016/j.clnu.2004.09.005
14. Ricke SC, Lee SI, Kim SA, Park SH, Shi Z. Prebiotics and the poultry gastrointestinal tract microbiome. Poult Sci (2020) 99:670–677. doi: 10.1016/j.psj.2019.12.018
15. Roberfroid M. Prebiotics: The concept revisited. J Nutr (2007) 137: doi: 10.1093/jn/137.3.830s
16. Tiwari UP, Fleming SA, Rasheed MSA, Jha R, Dilger RN. The role of oligosaccharides and polysaccharides of xylan and mannan in gut health of monogastric animals. J Nutr Sci (2020) 9:1–9. doi: 10.1017/jns.2020.14
17. Agunos, A; Ibuki, M; Yokomizo, F; Mine Y. Effect of dietary b1-4 mannobiose in prevention of Salmonella enteritidis infection in broilers.pdf. Br Poult Sci (2007) 48:331–341.
18. Ibuki M, Fukui K, Kanatani H, Mine Y. Anti-inflammatory effects of mannanase-hydrolyzed copra meal in a porcine model of colitis. J Vet Med Sci (2014) 76:645–651. doi: 10.1292/jvms.13-0424
19. Gmez-Verduzco G, Cortes-Cuevas A, Lpez-Coello C, Vila-González E, Nava GM. Dietary supplementation of mannan-oligosaccharide enhances neonatal immune responses in chickens during natural exposure to Eimeria spp. Acta Vet Scand (2009) 51:1–7. doi: 10.1186/1751-0147-51-11
20. Ibuki M, Kovacs-Nolan J, Fukui K, Kanatani H, Mine Y. β 1-4 mannobiose enhances Salmonella-killing activity and activates innate immune responses in chicken macrophages. Vet Immunol Immunopathol (2011) 139:289–295. doi: 10.1016/j.vetimm.2010.10.011
2. Dal Pont GC, Farnell M, Farnell Y, Kogut MH. Dietary factors as triggers of low-grade chronic intestinal inflammation in poultry. Microorganisms (2020) 8:1–10. doi: 10.3390/microorganisms8010139
3. Gomez-Osorio LM, Oh HG, Lee JJ. Confirmation of Cage Effect and Prebiotic Production Potential of a β-Mannanase, with SBM as Substrate Using Microscopy and Wet Chemistry. J Agric Sci (2021) 13:23. doi: 10.5539/jas.v13n2p23
4. Bedford MR. The evolution and application of enzymes in the animal feed industry: the role of data interpretation. Br Poult Sci (2018) 59:486–493. doi: 10.1080/00071668.2018.1484074
5. Nguyen HT, Bedford MR, Wu SB, Morgan NK. Dietary Soluble Non-Starch Polysaccharide Level Influences Performance, Nutrient Utilisation and Disappearance of Non-Starch Polysaccharides in Broiler Chickens. Animals (2022) 12:1–17. doi: 10.3390/ani12050547
6. Park J, Jung S, Carey JB. Effects of a commercial beta-mannanase product on growth performance, intestinal histomorphology, bone and body composition, and amino acid digestibility in white pekin ducks. J Appl Poult Res (2019) 28:63–71. doi: 10.3382/japr/pfy016
7. Chaplin MF. Fibre and water binding. Proc Nutr Soc (2003) 62:223–227. doi: 10.1079/pns2002203
8. Owusu-Asiedu A, Patience JF, Laarveld B, Van Kessel AG, Simmins PH, Zijlstra RT. Effects of guar gum and cellulose on digesta passage rate, ileal microbial populations, energy and protein digestibility, and performance of grower pigs. J Anim Sci (2006) 84:843–852. doi: 10.2527/2006.844843x
9. Maisonnier S, Gomez J, Carré B. Nutrient digestibility and intestinal viscosities in broiler chickens fed on wheat diets, as compared to maize diets with added guar gum. Br Poult Sci (2001) 42:102–110. doi: 10.1080/00071660020035154
10. Langhout DJ, Schutte JB. Nutritional Implications of Pectins in Chicks in Relation to Esterification and Origin of Pectins. Poult Sci (1996) 75:1236–1242. doi: 10.3382/ps.0751236
11. Tejeda O, Woo K. Role of dietary fiber in poultry nutrition. Animals (2021) 11:461.
12. Gomez-Osorio LM, Nielsen JU, Martens HJ, Wimmer R. Upgrading the Nutritional Value of PKC Using a Bacillus subtilis Derived Monocomponent β-Mannanase. Molecules (2022) 27: doi: 10.3390/molecules27020563
13. Gibson GR. Fibre and effects on probiotics (the prebiotic concept). Clin Nutr Suppl (2004) 1:25–31. doi: 10.1016/j.clnu.2004.09.005
14. Ricke SC, Lee SI, Kim SA, Park SH, Shi Z. Prebiotics and the poultry gastrointestinal tract microbiome. Poult Sci (2020) 99:670–677. doi: 10.1016/j.psj.2019.12.018
15. Roberfroid M. Prebiotics: The concept revisited. J Nutr (2007) 137: doi: 10.1093/jn/137.3.830s
16. Tiwari UP, Fleming SA, Rasheed MSA, Jha R, Dilger RN. The role of oligosaccharides and polysaccharides of xylan and mannan in gut health of monogastric animals. J Nutr Sci (2020) 9:1–9. doi: 10.1017/jns.2020.14
17. Agunos, A; Ibuki, M; Yokomizo, F; Mine Y. Effect of dietary b1-4 mannobiose in prevention of Salmonella enteritidis infection in broilers.pdf. Br Poult Sci (2007) 48:331–341.
18. Ibuki M, Fukui K, Kanatani H, Mine Y. Anti-inflammatory effects of mannanase-hydrolyzed copra meal in a porcine model of colitis. J Vet Med Sci (2014) 76:645–651. doi: 10.1292/jvms.13-0424
19. Gmez-Verduzco G, Cortes-Cuevas A, Lpez-Coello C, Vila-González E, Nava GM. Dietary supplementation of mannan-oligosaccharide enhances neonatal immune responses in chickens during natural exposure to Eimeria spp. Acta Vet Scand (2009) 51:1–7. doi: 10.1186/1751-0147-51-11
20. Ibuki M, Kovacs-Nolan J, Fukui K, Kanatani H, Mine Y. β 1-4 mannobiose enhances Salmonella-killing activity and activates innate immune responses in chicken macrophages. Vet Immunol Immunopathol (2011) 139:289–295. doi: 10.1016/j.vetimm.2010.10.011
Publicación del Dr. Luis Miguel Gómez-Osorio en su perfil de la red profesional LinkenIn (Junio, 2022) y reproducido en engormix por gentileza del autor
Temas relacionados:
Autores:

Recomendar
Comentar
Compartir
Recomendar
Responder
29 de agosto de 2022
Buenas Tardes, pero nos escribe con terminos cietificos ahora me guastaria que en un comentario, en ¿donde se encuentra eso que daña la salud de los anmales? ¿En que alimentos? para evitarlos?
G r a c i a s
Recomendar
Responder

¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.






