Evaluación de la técnica modificada de tinción Giemsa en la valoración acrosomal de espermatozoides de mamíferos
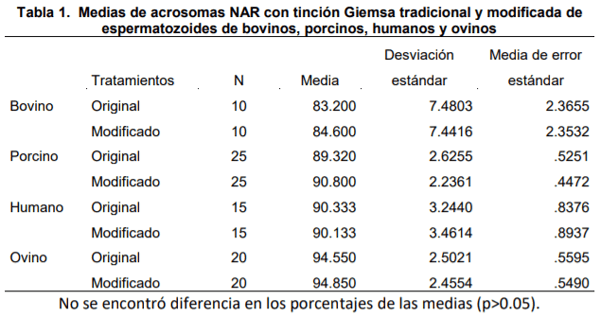
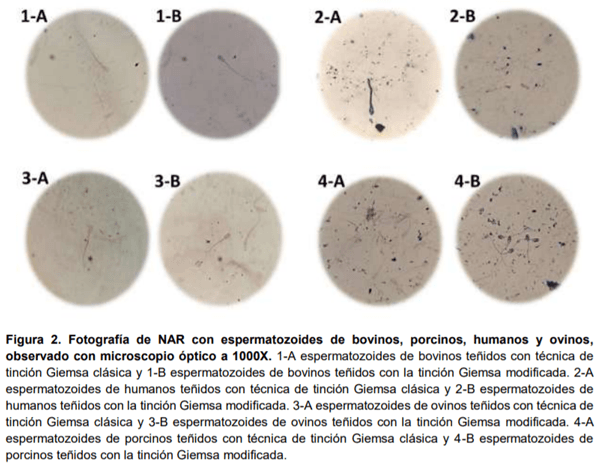
Es importante diseñar técnicas eficientes, prácticas y fáciles de realizar para valorar la integridad acrosomal de los espermatozoides. El objetivo fue evaluar la técnica modificada de tinción Giemsa para valoración del borde apical normal (NAR) en espermatozoides de mamíferos. Se evaluaron 140 laminillas de espermatozoides de 4 diferentes mamíferos (bovinos, ovinos, porcinos y humanos), se dividieron en dos grupos (70 laminillas por grupo). El primer grupo, se evaluó NAR con la técnica clásica de tinción Giemsa y el segundo, con la técnica modificada de Giemsa. Se compararon los porcentajes de acrosomas NAR y los tiempos de cada una de las técnicas. No hubo diferencia entre las medias de acrosomas NAR en ambas técnicas (p<0.05); sin embargo, mientras la técnica convencional tarda 115 min, el tiempo de realización de la técnica modificada fue de 35 minutos, reduciendo el tiempo 80 minutos, con una mejor claridad de la imagen. En conclusión, la técnica de tinción modificada disminuye el tiempo de valoración de NAR y muestra una mejor nitidez de la imagen.
Palabras clave: espermatozoides de mamíferos, Giemsa, integridad acrosomal.
- ATUESTA BJE, Grajales LHA, López BM. 2012. Evaluación de la integridad de la membrana acrosomal a la inducción física y química de la reacción acrosómica en espermatozoides de conejos línea Caldes. Revista Spei Domus. 8 (16): 16-28. ISSN 1794-7928. https://revistas.ucc.edu.co/index.php/sp/article/view/843
- BERNARDI SF, Allende R, Mazzeo MJ, Marini PR. 2011. Evaluación de los cambios ocasionados en espermatozoides bovinos por variaciones en el manejo de las dosis durante su manipulación en inseminación artificial. Investigación Veterinaria. 13: 25-38. ISSN 1668-3498. http://www.scielo.org.ar/scielo.php?script=sci_arttext&pid=S1668- 34982011000200003&lng=es&nrm=iso
- BONET S, Martínez E, Rodríguez EJ, Barrera X. 2006. Manual de Técnicas de Reproducción Asistida en Porcino. Universidad de Girona. Red Temática Nacional de Reproducción Porcina. Pp. 306. ISBN: 978-84-8458-241-0 84-8458-241-8.
- DÍAZ FO, Mesa H, Valencia MJG, Gómez LGH, Uribe FJ. 2009. Evaluación de la integridad acrosomal y la funcionalidad bioquímica de la membrana espermática en cerdos productores con gotas citoplasmáticas persistentes. Revista Científica FCV-LUZ. 19 (5): 500-505. ISSN 0798-2259. http://www.redalyc.org/articulo.oa?id=95911615010
- FERNÁNDEZ VR, Hortas NML, Castilla JA, López TCM, Valladares MJC, Alaminos MM, Ruiz MA., Castejón CFJ, Sánchez LT. 2001. Alteraciones de la madurez nuclear en espermatozoides de varones con antecedentes de criptorquidia. Cirugía Pediatrica. 14: 95-97. ISSN: 0214-1221. https://www.secipe.org/coldata/upload/revista/2001;14.95- 97.pdf
- GONZÁLEZ VA, Mac DM, Grosman G. 2015. Normas para el procedimiento de registro, rotulación, traslado y recepción de biopsias y citología al servicio de anatomía patología del Hospital Provincia Neuquen. Metodología en elaboración de Guías de Prácticas Clínicas. Comité de Docencia e Investigación. Pp. 1-17. http://www.saludneuquen.gob.ar/wp-content/uploads/2016/10/35-NORMASPROCEDIMIENTO-REGISTRO-HPN-2015.pdf
- GORODNER OZ. 2013. Histología: métodos e instrumentos de estudio de la histología parte 1: Técnicas histológica. Universidad Nacional del Noreste. Facultad de Medicina. 2013: 1-13. https://med.unne.edu.ar/sitio/multimedia/imagenes/ckfinder/files/files/histologia_med_cat 2/GUIA%201%20%202013.pdf
- IBM Corp. 2011. IBM SPSS Statistics para Windows, Versión 20.0. Armonk, Nueva York: IBM Corp
- HERNÁNDEZ CL, Quintero MA, Camargo RO, Rojas LM. 2017. Evaluación de la integridad funcional y estructura de espermatozoides caprinos criopreservados mediante diluyentes comerciales. Revista Científica, FCV-LUZ. 27 (1): 35-43. ISSN 0798-2259. http://www.redalyc.org/articulo.oa?id=95950495006
- JUÁREZ DPF, De-Dios VMD, Sagrera RJD, Gutiérrez HPR. 2008. Reversión de vasectomía con criopreservación sistemática de espermatozoides testiculares. Revista Internacional de Andrología. 7: 215-221. ISSN: 1698-031X. http://dx.doi.org/10.1016/S1698-031X(09)73389-8
- LÓPEZ CP, Casasbuenas AJ. 2015. La biopsia y la citología, pilares del diagnóstico médico (II parte). Revista Médica Sanitas. 18 (2): 82-89. ISSN 0123-4250. http://www.unisanitas.edu.co/Revista/55/LA_BIOPSIA_Y_LA_CITOLOGIA.pdf
- MONTESINOS IS, Carvalho JO, Malaquias JV, Arnhold E, Freneau GE, Dode MAN, Fioravanti MCS, Sereno JRB. 2014. Evaluación del semen criopreservado de toros Curraleiro Pé Duro, pertenecientes al banco brasilero de Germoplasma Animal. Animal Genetic Resources. 54: 135-140. 2078-6344. http://dx.doi.org/10.1017/S2078633614000101
- MUIÑO R, Fernández M, Areán H, Viana JL, López M, Fernández A, Peña AI. 2005. Nuevas tecnologías aplicadas al procesado y evaluación del semen bovino en centros de inseminación artificial. ITEA. 3: 175-191. ISSN 1699-6887. https://dialnet.unirioja.es/servlet/articulo?codigo=1271105
- NIETO DKD. 2010. Técnicas de reproducción asistida. Tinciones para la evaluación de la morfología espermática. Informe de pasantía. Universidad Simón Bolívar. https://studylib.es/doc/5936981/t%C3%A9cnicas-de-reproducci%C3%B3n-asistidatinciones-para-la-evalu...
- OSORIO SRE, Giraldo JF, Mesa H, Gómez LG, Henao UFJ. 2007. Evaluación de la integridad acrosómica en el semen de verraco. Vet.Zootec. 1 (1): 41-47. ISSN: 2310- 2799. http://vetzootec.ucaldas.edu.co/downloads/v1n1a07.pdf
- PUENTE MA, Rodríguez D, Tataglione M. 2016. Viabilidad y estado acrosomal en espermatozoides de conejo. Revista Veterinaria Argentina. 33 (339): 1-7. ISSN: 1852- 317X. https://www.veterinariargentina.com/revista/2016/07/viabilidad-y-estadoacrosomal-en-espermatozoides-de-conejo/
- RESTREPO BG, Úsuga SA, Rojano BA. 2013. Técnicas para el análisis de la fertilidad potencial del semen equino. Revista CES Medicina Veterinaria y Zootecnia. 8: 115-127. ISSNe: 1900-9607. http://revistas.ces.edu.co/index.php/mvz/article/view/2838
- RESTREPO BG, Varela GE, Usuga SA. 2016. Evaluación de la calidad espermática epididimal en hipopótamos hippopotamus amphibius (artiodactyla: hippopotamidae) ubicados en el magdalena medio, Colombia. Acta Zoológica Mexicana. 32: 158-167. ISSN 2448-8445. http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S0065- 17372016000200158&lng=es&nrm=iso
- SÁNCHEZ SEM, Oláez HJR, Ávila CA, López ML, Sánchez RSH. 2014. Alteraciones en el semen de pacientes con problemas de infertilidad. Archivos de Medicina. 10 (1): 1-17. ISSN-e 1698-9465. https://dialnet.unirioja.es/servlet/articulo?codigo=5052080
- UGARELLI A, Evangelista VS, Santiani A. 2017. Evaluación de la integridad acrosomal en espermatozoides epididimarios de Alpaca mediante Citometría de Flujo. Revista de Investigación Perú. 28: 130-140. ISSN 1609-9117. http://dx.doi.org/10.15381/rivep.v28i1.12947
- WHATSON PF, Matin ICA.1972. A comparison of changes in the acrosome of Deepfrozen ram and bull spermatozoa. Journal of Reproduction and Fertility. 28: 99-101. ISSN 04493087. https://doi.org/10.1530/jrf.0.0280099.








Estados Unidos de América












