Los probióticos en la ganadería porcina. Importancia de su utilización eficiente
Publicado: 4 de junio de 2014
Por: Vladimir Barrios González, Ana Carvajal Urueña y Pedro Rubio Nistal. ULE. Facultad de Veterinaria. Departamento de Sanidad Animal. Grupo de Enfermedades Digestivas del Cerdo. España
Introducción
La genética ha conseguido que actualmente se disponga de estirpes de cerdos con capacidades productivas impensables hace unos años. Muchos parámetros como la prolificidad de las cerdas, el índice de conversión o la ganancia media diaria han mejorado sustancialmente gracias a programas nacionales de selección y mejora genética. No obstante, los cerdos actuales han sido seleccionados mayoritariamente por estas características productivas pero sin tener en cuenta su resistencia a las enfermedades, muy diferente a la de sus predecesores. Más aún, estos animales son explotados de forma intensiva, llevando la fisiología digestiva a valores límite, siendo muy frecuente la aparición de problemas digestivos.
Por otro lado, el gran aumento del coste de las materias primas del pienso ha hecho que la composición de éstos cambie notablemente. En función de las materias primas disponibles y de los precios del mercado se diseñan nuevas formulaciones que en ocasiones contribuyen a alterar la ecología digestiva y a ocasionar trastornos gastroentéricos.
En consecuencia con lo anteriormente expuesto, diversos estudios apuntan hacia un incremento notable de las enfermedades digestivas en la producción porcina intensiva. España es el segundo productor de ganado porcino de la Unión Europea (UE) y los estudios de nuestro grupo de investigación reportan una mayor incidencia de enfermedades digestivas como la disentería, la colibacilosis, la salmonelosis o las clostridiosis en la última década. Resultados semejantes han sido descritos por otros grupos de investigación de diferentes países europeos (EFSA 2009).
Existe una creciente preocupación de que el uso indiscriminado de antibióticos contribuya a la reducción del arsenal farmacéutico necesario para tratar enfermedades bacterianas en humanos. A tal punto, que el 1 de Enero del año 2006 quedó prohibido por la UE la utilización de estos compuestos como promotores del crecimiento animal (PCA) y a pesar de ello, se ha producido un crecimiento sostenido en el consumo de antimicrobianos en la producción porcina. La mayor incidencia de procesos diarreicos hace que frecuentemente las explotaciones recurran a la aplicación de tratamientos profilácticos o terapéuticos que en ocasiones son instaurados de forma sistemática e indiscriminada, buscando una solución fácil y rápida a los problemas que se observan en la práctica. Sin embargo este empleo de antimicrobianos no está exento de inconvenientes. Por una parte existen problemas de gran relevancia, tanto en sanidad animal como en salud pública, asociados a la aparición de microorganismos patógenos con resistencia o multirresistencia. Dinamarca es un país muy representativo de la producción porcina y cuenta con un programa nacional integrado de vigilancia de resistencias a los antimicrobianos (DANMAP, 2011). Según los datos recogidos, el uso de antibióticos en animales de renta y en animales de compañía así como en el hombre se ha incrementado de forma sostenida entre los años 2005 y 2011 y, a la vez, ha aumentado la resistencia global de los patógenos entéricos. Por ejemplo, las resistencias en Escherichia coli, han pasado de un 2% en 2005 a un 12-18% en el 2011 y en algunos casos, como ocurre con las cefalosporinas de tercera generación, los betalactámicos y las quinolonas, las resistencias se han incrementado hasta el 40%. Igualmente, en España, nuestro grupo de investigación ha demostrado un incremento de resistencia antimicrobiana en los aislados de B. hyodysenteriae, agente etiológico de la disentería porcina, entre los años 2000 y 2009 (Hidalgo et al., 2011 y Looft et al., 2012). El elevado coste asociado a la puesta en el mercado de nuevos productos antimicrobianos hace que el arsenal terapéutico y profiláctico disponible sea cada vez más limitado.
Además, estos efectos no deseados de los antibióticos van más allá de la mera selección de cepas resistentes (Somer y Dantas, 2011; Sekirov et al., 2008; Korhonen, 2010; Ubeda y Palmer 2012). Las mucosas y particularmente el epitelio intestinal se encuentran colonizadas por comunidades microbianas diversas conocidas de forma general como microbiota. Esta microbiota tiene un efecto muy importante sobre la salud y el desarrollo fisiológico del animal y es fundamental para la maduración del sistema inmunitario y principalmente de la inmunidad digestiva. Los tratamientos antimicrobianos para prevenir o erradicar un patógeno que afecte al aparato digestivo (o a cualquier otro aparato, órgano o tejido) pueden provocar efectos considerables a corto y largo plazo sobre esta microbiota intestinal. Estos efectos incluyen cambios en las proporciones relativas de diferentes especies en la microbiota así como cambios en la resistencia de las bacterias de la microbiota.
Por todo ello, existe en la actualidad una necesidad de buscar nuevas alternativas a este uso de antimicrobianos siendo los probióticos una opción saludable, rentable y práctica que puede ayudar al control de las enfermedades digestivas del cerdo. El objetivo de la presente revisión es hacer un análisis comparativo de la evolución del concepto de probiótico vs antibiótico, evaluando la génesis del término y exponiendo una breve cronología de su estudio; además mencionaremos algunas consideraciones ecológicas del tracto gastrointestinal, la composición y clasificación de la biota, presentaremos algunos aspectos básicos del mecanismo de acción de los probióticos y, por último, valoraremos propuestas prácticas de diferentes modos de aplicación de los probióticos en la producción porcina.
Génesis del concepto y el término probiótico
El empleo de microorganismos en beneficio del hombre es muy antiguo. Egipcios y griegos ya emplearon hongos en el tratamiento de ciertas infecciones, basándose en un conocimiento empírico. Igualmente, en la antigua China, hace más de 2500 años, se empleaban alimentos como la cuajada de soja sobre ciertas heridas infectadas. Sin embargo, el término probiótico surge de las ideas de Metchnikoff, un microbiólogo ucraniano y discípulo de Pasteur que recibió el premio Nobel de Medicina en 1908 por sus estudios sobre la inmunidad celular. El fue el primero en describir y estudiar poblaciones búlgaras del Cáucaso que consumían grandes cantidades de “leche fermentada” y que eran inusualmente longevas. Metchnikoff concibió la idea de que esta longevidad era consecuencia de la presencia de determinados microorganismos en su intestino, particularmente lactobacilos, otorgando a este órgano un papel fundamental para la salud del individuo. Como partidario ferviente de sus propias teorías, Metchnikoff consumió leche fermentada durante toda su vida proponiendo que “la dependencia existente entre los microbios intestinales y la comida, hace que sea posible adoptar medidas para modificar la fermentación pútrida en nuestros cuerpos y sustituir los microbios nocivos por microbios útiles”.
En 1906, casi al mismo tiempo, otro discípulo de Pasteur llamado Henry Tissier, detectó que las heces de niños enfermos con diarrea contenían un número muy escaso de unas bacterias muy particulares, caracterizadas por tener forma de Y, las bacterias “bífidas”; por el contrario, estas bacterias eran muy abundantes en las heces de niños sanos. Las bifidobacterias se aislaron por primera vez de un bebé alimentado con leche materna y rápidamente se sugirió que podían ser administradas a pacientes con diarrea para ayudar a restaurar la “microflora” intestinal sana. Su empleo en el tratamiento de diarreas en bebés demostró beneficios clínicos que fueron asociados a un desplazamiento de las bacterias patógenas causantes de la enfermedad. Las observaciones de Metchnikoff y Tissier fueron de tal atractivo comercial que sus trabajos se llevaron a comercialización inmediata. Existen evidencias en el diario “La Vanguardia” en Barcelona en 1911, de que en el Paseo de Gracia existía una tienda que con el nombre de de “yogourth” vendía leche cuajada búlgara que promocionaba como “desinfectante intestinal para enfermos de estómago” y con la imagen de un turco de 117 años que lo consumía.
Ya en el año 1917, durante un brote de shigelosis, el profesor alemán Alfred Nissle aisló una cepa de Escherichia coli de las heces de un soldado no afectado por la enfermedad y utilizó esta cepa en el tratamiento de casos de salmonelosis y de shigelosis aguda, con un éxito sin precedentes. La cepa de E. coli Nissle 1917 aún se utiliza como suplemento microbiano y es, sin ninguna duda, una de las cepas bacterianas más estudiadas y relevantes clínicamente de la historia.
Sin embargo, simultáneamente a estos primeros estudios sobre probióticos, se producen las primeras investigaciones y descubrimientos de antibióticos. En 1897, un médico militar francés, Ernest Duchesne, publicó una tesis doctoral titulada “Contribución al estudio de la competencia vital en microorganismos: antagonismo entre hongos y microbios”, primer trabajo en el que se describen las posibilidades terapéuticas de los hongos derivadas de su actividad antimicrobiana. A principios del siglo XX, Paul Ehrlich y Sahachiro Hata desarrollaron un quimioterápico antiinfeccioso de reducido espectro, la arsfenamina, comercializado como Salvarsán® a partir de 1910, que fue empleado en el tratamiento de la sífilis. En 1928, Alexander Fleming redescubrió la penicilina que pudo ser producida comercialmente a partir de los primeros años de la década de 1940 tras los trabajos de Florey y Chain. Todos ellos compartieron el premio Nobel de Medicina en 1945. Este descubrimiento estimuló la búsqueda de otros antibióticos y desencadenó todo un movimiento de investigación en este sentido. Durante mucho tiempo, la clase médica consideró que la era de las enfermedades infecciosas era ya historia, un grave error que probablemente contribuyó notablemente a que otros abordajes preventivos alternativos y terapéuticos previamente investigados, como los probióticos, cayeran en el olvido durante décadas.
Los estudios más generales dirigidos a incrementar el conocimiento relativo a la composición y estructura de la microbiota intestinal se intensificaron a partir de los años 50. Es entonces cuando comienzan a estudiarse las relaciones entre los animales y la biota microbiana que albergan, considerándose por primera vez al tubo digestivo y a las poblaciones microbianas que en el residen como un ecosistema integrado.
El concepto y el término “probiótico” no fueron acuñados hasta el año 1965 (Lilly & Stillwell, 1965), empleándose inicialmente para identificar “sustancias producidas por microorganismos que promovían el crecimiento de otros microorganismos”. Sin embargo, este sentido amplio del término nunca fue adoptado. Fuller (1989) describió los probióticos como “suplementos alimentarios microbianos vivos que afectan beneficiosamente al animal huésped mejorando su equilibrio intestinal”, concepto que se mantiene vigente en la actualidad. El término probióticos tiene sus orígenes etimológicos del griego “pró” [πρó] que significa ‹delante de› o ‹antes de› unida al prefijo “bio” [βíος] que se traduce en ‹vida› incorporado a “tico” [-t-ik-os/-t-ik-e]. Podría traducirse libremente como “a favor de la vida”. (Gabaudan y Bracero 2012).
El comité de expertos de la Organización de las Naciones Unidas (FAO/WHO, 2001) definió oficialmente como probióticos a los “microorganismos vivos que cuando son administrados a un huésped en cantidades adecuadas le confieren beneficios a la salud”. Aunque esta definición continúa siendo válida, tanto desde el punto de vista de la comunidad científica como para las empresas productoras o para los organismos reguladores, la Asociación Científica Internacional para Probióticos y Prebióticos (ISAPP) ha propuesto las siguientes especificaciones para evitar malas interpretaciones (Schrezenmeir y De Vrese 2001 y Petros et al., 2010):
- Un probiótico debe estar vivo cuando es administrado.
- Debe haber sido sometido previamente a una evaluación controlada que permita documentar los beneficios en la salud del huésped al que estará dirigido y su inocuidad.
- Debe ser un microbio definido taxonómicamente o una combinación de ellos (género, especie y cepa de cada microbio) y la cantidad a administrar (dosis) debe estar cuantificada.
Teniendo en cuenta todo lo anteriormente expuesto y los nuevos descubrimientos relativos al microbioma, proponemos la denominación de probiótico funcional o perecedero para referirnos a “un microorganismo o mezclas de microorganismos viables que, al ser administrados a un huésped en cantidades adecuadas, pueden sobrepasar las barreras gastrointestinales, sobrevivir, adaptarse, colonizar y multiplicarse y a su vez intervenir en el equilibrio existente del microbioma, modificándolo o estabilizándolo, en beneficio de la salud del huésped”. Aquellas cepas con potencialidad probiótica que sean inocuas y a su vez produzcan beneficios al huésped pero que no tengan la capacidad de sobrevivir y multiplicarse en el hospedador quedarían englobadas bajo la denominación de probióticos de tipo transitorio o no perecederos. Por otra parte, los prebióticos incluirían “ingredientes no digeribles por el hospedador que afectan beneficiosamente a la microbiota benéfica exclusivamente, mejorando la salud del hospedador”. Finalmente, los simbióticos son productos surgidos por la unión física de un probiótico y un prebiótico que generalmente se complementan entre sí. Aquellos mutantes no virulentos de patógenos (ej. Escherichia coli, Clostridium difficile, Salmonella Typhimurium…), los cuales también pueden competitivamente proteger contra la infección, pero a la vez son candidatos idóneos a mutación, pudiendo conllevar a problemas de salud, preferiríamos denominarlos “suplementos microbianos benéficos con potencial riesgo” y separarlo del concepto probiótico el cual está integrado exclusivamente por cepas inocuas o generalmente reconocidas como seguras (GRAS) (Marcus et al., 2006).
Consideraciones ecológicas del tracto gastrointestinal (TGI)
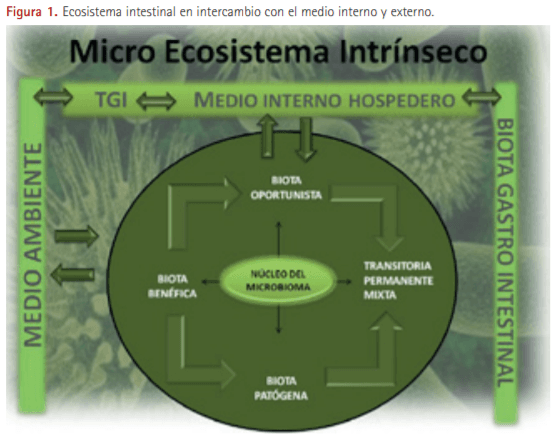
El sistema digestivo de los cerdos, desde la cavidad oral hasta el ano, está colonizado por diversos grupos de organismos o microbiota, que incluyen fundamentalmente bacterias, virus, archaeas y eucariotas. Estas comunidades constituyen un ecosistema, integrado por todo un conjunto de organismos vivos (biocenosis) y el medio físico donde se relacionan (biotopo) (Atlas y Bartha 2001). Todos los organismos que conforman esta microbiota digestiva son interdependientes entre sí y comparten un mismo hábitat. Este medio interno intestinal puede considerarse fisiológicamente como un órgano independiente que participa activamente en la homeostasis del organismo (Hughes 2012; Paul y Toole 2012). Sin un medio intestinal sano, el hospedador no puede alcanzar los niveles de salud adecuados, ni el desarrollo inmunológico y orgánico que le permitan enfrentarse a las posibles agresiones del entorno que le rodea. Es importante conocer que esta microbiota intestinal se integra e interactúa en una simbiosis activa con el individuo, estableciendo una relación provechosa y duradera que permite la supervivencia de ambos (biota-hospedador). Además, el tracto gastrointestinal está en constante intercambio con el medio ambiente por lo que este micro ecosistema intestinal es abierto, estable y adaptable a las distintas condiciones ambientales (ver Figura 1).
Existen múltiples factores que interactúan entre sí y logran mantener las condiciones indispensables que permiten la estabilidad de este ecosistema intestinal, estos son mencionados por diferentes autores (Thompson et al., 2004; Delgado 2005; Bibiloni et al., 2009; Mori et al., 2011), entre ellos encontramos:
- Factores fisiológicos o intrínsecos: la fisiología de cada hospedador condiciona su microbiota intestinal mediante múltiples factores como la edad, las características anatómicas, el estado general de salud (procesos inflamatorios, infecciosos, sistémicos, trastornos metabólicos, deterioro de la dentadura, función salival disminuida...), la fisiología digestiva, la concentración de gases, la actividad hormonal (niveles de cortisol, gastrina, histamina, secretina…) o la respuesta inmunitaria (concentración de inmunoglobulinas A, actividad de las células dendríticas, inmunodeficiencias…), a su vez muchos de estos factores están mediados por la genética de la especie entre otros.
- Factores ambientales extrínsecos: incluyen todos los factores relacionados con la dieta ingerida, alimentos y agua incluyendo la composición físicoquímica de los alimentos (tamaño de partícula, viscosidad, niveles de fibra, hidratos de carbonos fermentables, acidez…), su calidad microbiológica o su calidad nutricional.
- Factores iatrogénicos: encontramos la incorporación de sustancias producidas por el hombre, nutritivas o no, que modifican el ecosistema intestinal, como los antibióticos, contaminantes químicos u otros fármacos que influyen sobre el sistema inmune así como el manejo zootécnico y los sistemas de producción que modifican el entorno donde se alojan los cerdos.
- Factores relacionados con la propia biota intestinal: están relacionados con la composición y estructura de las comunidades de las diferentes especies e incluyen todas aquellas características fisiológicas microbianas y/o sustancias producidas por la propia biota que contribuyen a crear un hábitat estable en el ecosistema intestinal o que le permiten mantenerse en él. Entre estos factores se encuentran la codependencia metabólica entre bacterias, la capacidad de adhesión, la velocidad de multiplicación, la motilidad, la producción de sustancias útiles para otras comunidades bacterianas como los ácidos grasos de cadena corta, vitamina K, biotina, riboflavina, piridoxina, cianocobalamina y las exoenzimas (proteasas, amilasas, lipasas etc.), la segregación de sustancias represoras o antimicrobianas (peróxidos, bacteriocinas, ácido orgánicos), la capacidad de adaptación a los sustratos disponibles en la dieta (degradación de fibra soluble e insoluble, inhibición de los factores antinutricionales, rutas metabólicas alternativas etc.) así como diversos mecanismos de resistencia ambiental (pared celular resistente, producción de esporas, captación de plásmidos, tolerancia a la acidez, concentraciones de NaCl, resistencia al HCl y sales biliares etc.).
Todos estos factores interaccionan entre sí constantemente, afectando y modulando a la biota intestinal que tiene una gran plasticidad y capacidad de adaptación. Cuando a pesar de todas las interacciones se logra mantener un cierto grado de equilibrio, hablamos de una situación o estado de eubiosis (ver Figura 2).
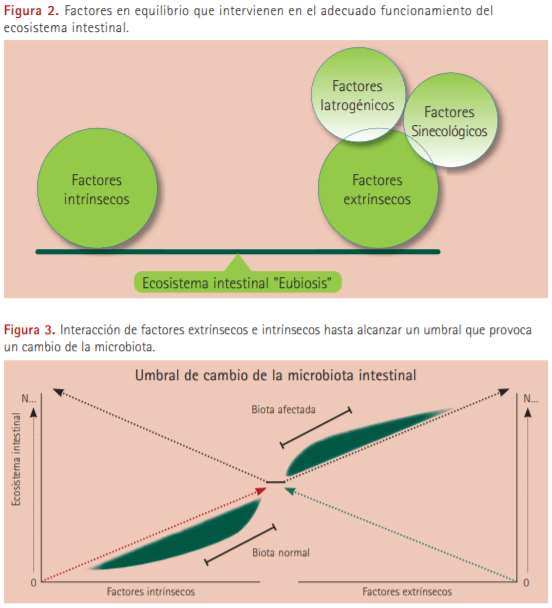
Sin embargo, cuando se sobrepasa lo que podría llamarse el “umbral de cambio” y se altera este ecosistema digestivo se pasa a un estado conocido como disbiosis que podrá afectar a la salud del hospedador (ver Figura 3).
Al conjunto formado por la totalidad de los microorganismos y las interacciones medioambientales en el entorno gastrointestinal se le denomina microbioma. Este término fue acuñado por Joshua Lederberg, en el año 2000, para referirse al hecho de que todos los microorganismos que habitan en el cuerpo humano deben ser incluidos como parte del ser humano y de su genoma, debido a su influencia sobre la fisiología, utilizando para referirse a este conjunto global de individuo y microbiota la denominación de “súper-organismo” (Lederberg 2000).
El estudio del microbioma es un área de la microbiología aplicada en la que aún se precisa mucho trabajo de investigación pero que está teniendo un desarrollo exponencial en los últimos años. Hoy en día, somos conscientes de que la determinación, más o menos exacta, de la composición estructural del núcleo del microbioma permitiría asociar determinadas variaciones de esta comunidad con estados de enfermedad, con sistemas productivos o con diferentes etapas de la producción porcina. La aparición de nuevas técnicas que permiten la amplificación y secuenciación del ADN a costes asequibles está impulsando el desarrollo de la denominada metagenómica o estudio del conjunto de genomas presentes en un determinado hábitat, el cual se ha convertido en la herramienta fundamental para poder identificar los genomas de todos o de la mayoría de los microorganismos presentes en el tracto gastrointestinal sin necesidad de aislarlos y cultivarlos in vitro (Mueller et al., 2012; Balter 2012; Elizabeth et al., 2012).
En la actualidad ya se han completado amplios y ambiciosos estudios sobre el metagenoma intestinal humano. Se han secuenciado millones de genes microbianos procedentes de muestras de heces, se ha creado una base de datos de referencia (Qin et al., 2010) y se están fijando los límites de variación microbiana normal en el ser humano. Se han podido detectar más de 1000 especies diferentes de bacterias y se ha determinado que en un mismo individuo se encuentra una media de 160 especies diferentes de bacterias en el TGI, las cuales presentan poca diversidad y amplias funciones moleculares, clasificando estos grupos en al menos tres enterotipos diferentes (Arumugam et al., 2011) que además se distribuyen en diferentes concentraciones en las distintas regiones del aparato digestivo. Se ha comprobado que en el cuerpo humano hay diez veces más células microbianas en el ecosistema intestinal que en todo el organismo y unas 150 veces más genes microbianos que genes humanos. Así, mientras que el genoma humano contiene algo más de 22.500 genes, en el microbioma se calculan de 5 a 8 millones de genes diferentes (Balter, 2012). La capacidad metabólica de esta masa bacteriana, que pesa entre 200-1500 gramos en un humano adulto, es tremendamente grande y se considera que puede ser superior a la del hígado y tiene, lógicamente, gran importancia en la digestión (De Lorenzo et al., 2011).
Clasificación de la microbiota
Teniendo en cuenta el tránsito gastrointestinal y los efectos sobre el hospedador, la microbiota de nuestros cerdos domésticos puede ser clasificada en diferentes categorías (Vandelle et al., 1990; Gedek, 1991; Mulder 1996; Piad 2001; Barrios et al., 2009; Kraatz 2010 y Sarmiento 2012).
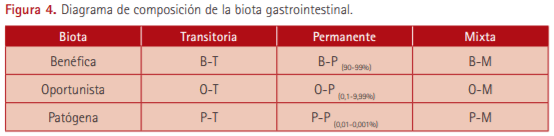
En función del efecto sobre el hospedador podemos distinguir:
- Microbiota benéfica. Incluye todos aquellos microrganismos que producen beneficios al hospedador y no tienen, generalmente, capacidad patógena en el individuo sano.
- Microbiota oportunista. Su presencia produce ciertos beneficios al hospedador pero también tiene la capacidad de inducir lesiones en determinadas condiciones.
- Microbiota patógena. Incluye toda aquella que tiene capacidad patógena en el animal sano y produce efectos nocivos al hospedador. Conjuntamente con la microbiota oportunista representan el 0,01-0,001% del total de la biota.
En función de su localización y permanencia en el tracto gastrointestinal se diferencian:
- Microbiota transitoria o satélite. Se ingiere con la dieta, el agua o desde el medio ambiente y no tiene la capacidad para colonizar el aparato digestivo del hospedador de forma permanente. Se conoce también como microbiota alóctona. Representa aproximadamente el 1% del total y está conformada principalmente por anaerobios facultativos (enterobacterias como E. coli y Enterococcus spp.).
- Microbiota estable, permanente o latente. Es capaz de colonizar el tracto digestivo y desarrollarse en dicho ambiente, ocupando nichos específicos del hospedador. También se conoce como microbiota autóctona, aunque no es originaria del tracto digestivo ya que proviene del exterior pero está perfectamente adaptada a este ambiente. En su mayoría es benéfica y representa el 90-99% del total, estando constituida principalmente por anaerobios, facultativos y estrictos, entre los que se encuentran las bacterias formadoras de ácido láctico (BAL) como los lactobacilos, las bifidobacterias y los estreptococos así como las bacterias formadoras de ácidos grasos (bacteroides y eubacterias).
- Microbiota semipermanente o mixta. Es una biota inestable que proviene del medio externo pero que tiene cierta capacidad de supervivencia en el tracto digestivo. Si existen ciertas condiciones predisponentes es capaz de colonizar este hábitat y multiplicarse en él temporalmente. Está integrada tanto por bacterias patógenas como benéficas.
De una forma global, las actuaciones sobre la microbiota intestinal deben centrarse en potenciar, estimular y proteger la microbiota benéfica permanente al tiempo que se contrarresta, inhibe o elimina la biota patógena y con capacidad de ser permanente (ver Figura 4). El éxito en el empleo de probióticos estará en dependencia de estas capacidades.
Los aislados que quieran emplearse como probióticos deberán cumplir estos preceptos básicos: se deberá evaluar su implantación y sus interacciones con el resto de la biota intestinal. De ningún modo podemos pretender transformar un ecosistema tan estable y complejo mediante la adición eventual de una cepa o de una mezcla de éstas sin el debido estudio previo que permita demostrar su capacidad para sobrevivir, colonizar y mantenerse en el intestino.
Composición microbiológica de la microbiota del TGI
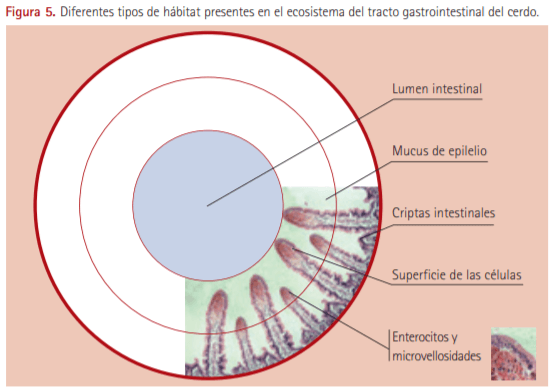
En el TGI existen muy diferentes hábitats en dependencia del órgano que se trate y dentro del propio órgano en función de las subregiones o segmentos que lo componen. Además, desde un punto de vista estructural se han descrito al menos cuatro hábitats bien diferenciados (Thompson et al., 2004): el lumen intestinal con todo su contenido (digesta, residuos y heces en el recto), el gel o placa de mucus que recubre el epitelio en toda su extensión, las capas profundas de moco que se localizan en las criptas intestinales y la superficie de las células epiteliales mucosas y la porción apical de las microvellosidades o glucocálix en el intestino (ver Figura 5).
En el momento actual no existen estudios completos que nos proporcionen información acerca de las poblaciones contenidas en todas estas regiones y subregiones del tracto gastrointestinal del cerdo aunque es esperable que con el aporte de la metagenómica este conocimiento se genere en los próximos años. En términos generales las especies predominantes en el tracto digestivo del cerdo son bacterias anaerobias y Gram- aunque las bacterias Gram+ también alcanzan proporciones significativas (Zentek et al., 2012).
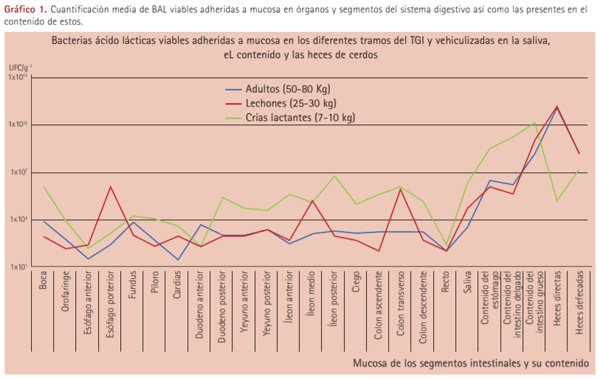
A continuación se describe de una forma muy básica la composición aproximada de la microbiota digestiva del cerdo doméstico en los diferentes segmentos del tracto gastrointestinal. Los resultados obtenidos por nuestro equipo en lo que respecta a la concentración del ácido láctico de bacterias viables adheridas a la mucosa y presentes en los contenidos de los diferentes tramos del tracto gastrointestinal de cerdos sanos a diferentes edades se muestran en el gráfico 1. En sentido general se aprecia un crecimiento microbiano logarítmico que se va manifestando desde el inicio del TGI hasta el recto y las heces defecadas.
La colonización de la cavidad oral, la laringe y el esófago se produce durante el parto a través del contacto con la biota materna presente en útero y vagina e inmediatamente después del mismo, mediante la adquisición a partir del ambiente en el que está el recién nacido: bacterias provenientes de la piel, de las heces de la propia madre así como del canal del pezón. Así, en un principio esta microbiota es simple y generalmente aerobia (cocos Gram+) y comienza a enriquecerse gradualmente con algunos anaerobios, entre ellos BAL (Godoy et al., 2010). Debido al pH ligeramente alcalino de la boca, la microbiota es diversa y se conoce que existen especies diferentes en cada sitio anatómico de ésta, quedando su composición altamente relacionada con el estado clínico de las encías y los dientes (Thompson et al., 2004).
La gran mayoría de los microorganismos en el estómago se localizan en este órgano de forma transitoria. Su cantidad y variabilidad dependen del pH y de la segregación de ácido clorhídrico, mucina y pepsinógeno aunque ciertos lactobacilos llegan a alcanzar una población relativamente elevada (104 -106 ufc/g de mucosa). Existen además especies del género Helicobacter que colonizan el estómago (Helicobacter heilmannii y Helicobacter suis) y se han asociado con gastritis y disminución de la ganancia media diaria de hasta de 50 g/día (Tannock 1999 y De Bruyne et al., 2012).
En el intestino delgado, la concentración de bacterias varía enormemente en los dos tercios anteriores dado que confluyen en este segmento la secreción entérica, gástrica y pancreática que resultan en potentes bactericidas, ello unido a la motilidad intestinal, más intensa en este tramo y en estrecha dependencia con los movimientos peristálticos, provoca cambios cuantitativos significativos (Mori et al., 2012). La concentración de bacterias en duodeno y yeyuno no excede, normalmente, de 105 ufc/g de contenido intestinal, con predominio de las especies anaerobias facultativas como los estreptococos (Craig et al., 2012). La microbiota del íleon es realmente importante, tanto o más que la contenida en el intestino grueso, alcanzándose concentraciones de hasta 108 ufc/g de contenido intestinal con predominio de especies anaerobias estrictas y microaerofílicas como Bacteroides spp., Lactobacillus spp., Leuconostoc spp., Pediococcus spp., Lactococcus spp. y Streptococcus spp. En esta región también son relevantes las bacterias de la familia Enterobacteriaceae que incluyen microorganismos beneficiosos e importantes patógenos como Salmonella spp., E. coli, Yersinia enterocolítica o Shigella spp. entre otros muchos (Arumugam et al., 2012 y Zentek et al., 2012).
Tras el paso de la válvula ileocecal, límite entre intestino delgado e intestino grueso, se produce un cambio brusco en la composición de la microbiota. Además, se observan importantes diferencias, tanto cualitativas como cuantitativas, en función de la localización. El ciego y colon del cerdo contienen elevadas cantidades de microorganismos, superiores a 1011 ufc/g (Kraatz, 2010), incluyendo bacterias Gram+ y Gram-, aunque estas últimas predominan particularmente en el ciego.
Principales efectos beneficiosos de los probióticos
En la literatura se describen ampliamente los efectos beneficiosos de los probióticos (Tannock 1999; Pérez 2001; Delgado 2005; Lee et al., 2007; Rondón 2009, Barrios et al., 2009; Kraatz 2010; Craig et al., 2012; Zentek et al., 2012; Hunter 2012; Reid 2012; Ringel et al., 2012 y Sarmiento 2012). A continuación mencionaremos algunos de estos efectos, particularmente los más estudiados o aquellos respecto a los cuales existe un mayor grado de acuerdo en la comunidad científica.
Los probióticos tienen un marcado impacto sobre la actividad metabólica intestinal. El aumento en la capacidad de digestión de la lactosa es uno los efectos mejor conocidos de las BAL. En este sentido, se ha demostrado el efecto de la β-glucanasa producida por cepas de Lactobacillus sobre la mejora de la digestibilidad de la materia seca, la proteína y la energía metabolizable en cerdos. Además, la fermentación bacteriana en el intestino permite aprovechar componentes de la dieta no digeribles produciendo ácidos grasos de cadena corta, principalmente acético, propiónico y butírico, que son una fuente importante de energía. El ácido butírico, además, tiene un efecto directo sobre los enterocitos y especialmente en los enterocitos del colon, estimulando su hipertrofia, multiplicación y metabolismo e incrementando su capacidad de absorción de nutrientes y agua. Además, este ácido butírico ejerce un efecto protector y antitumoral en el colon que podría explicar, al menos parcialmente, el efecto anticarcinogénico asociado a los probióticos descrito en algunos trabajos.
Los probióticos reducen la absorción de algunas sustancias tóxicas como NH3 , aminas, indol, mercaptanos, sulfitos y a su vez, aseguran la protección de las sales biliares y ácidos grasos frente a su biotransformación en productos tóxicos y nocivos. El amoniaco y el metano pueden ser deletéreos para los animales y se ha demostrado que las bacterias probióticas disminuyen la presencia de bacterias metanogénicas así como de aquellas que hidrolizan la urea y el ácido úrico y, por consiguiente, reducen la producción de amoniaco. Esta disminución del amoníaco intestinal favorece la salud intestinal al minimizar sus efectos lesivos sobre los enterocitos. Algunas bacterias intestinales son capaces de producir factores de crecimiento poliaminas tales como putrescina, cadaverina, espermidina y espermina que pueden estar implicados en la carcinogénesis o el desarrollo de procesos mórbidos intestinales. Hasta ahora las bacterias probióticas secuenciadas no poseen la capacidad de producir estas sustancias y si tienen la facultad de atenuar un exceso de producción de las mismas a nivel intestinal.
Los probióticos, además, producen sustancias con acción antibacteriana como el peróxido de hidrógeno, distintos tipos de ácidos orgánicos así como una amplia gama de bacteriocinas. Algunas de estas bacteriocinas tienen un potente efecto antibacteriano contra muchos patógenos entéricos como Salmonella spp., E. coli o Campylobacter spp., entre otros.
Más aún, algunos trabajos demuestran que algunas cepas de Lactobacillus spp. inhiben la adherencia a las células intestinales de ciertos patógenos tanto bacterianos (Salmonella, E. coli, Yersinia spp., Campilobacter spp. y Listeria spp. etc.) así como víricos, por ejemplo, empleando líneas celulares intestinales y macrófagos se ha demostrado su capacidad para proteger frente a la infección por el virus de la estomatitis vesicular.
El sistema inmunológico asociado al TGI constituye entre el 70 y el 80% del total del sistema inmunitario del cerdo y como hemos comentado anteriormente los probióticos tienen una importancia fundamental para el mantenimiento de la homeostasis de este ecosistema. Los probióticos contribuyen a la activación del sistema inmune del animal en las primeras semanas de vida, a la maduración del mismo durante su desarrollo y al mantenimiento de su capacidad funcional durante toda su vida. En este sentido, debemos conocer que algunas bacterias probióticas tienen capacidad para translocarse, pasando desde el TGI a los nódulos linfáticos mesentéricos y a otros órganos como el bazo y el hígado, donde pueden sobrevivir y estimular la inmunidad sin provocar perjuicios al hospedador. Se ha demostrado que el consumo sistemático de bacterias probióticas, particularmente lactobacilos, incrementa los niveles de γ-interferón en humanos. Los estudios in vivo muestran que altas dosis de lactobacilos (3x1012 ufc/ ml/día) estimulan también el nivel de las células natural killer (NK) y algunas cepas pueden actuar como adyuvantes orales y prevenir las infecciones entéricas.
Por último, los probióticos en el cerdo tienen actividad hipocolesterolémica y disminuyen significativamente el contenido de colesterol en el hígado y en la canal.
Múltiples mecanismos de acción y efectos benéficos tienen los probióticos sobre todo cuando estabilizan el ecosistema intestinal, producen vitaminas y aportan energía, inhiben competitivamente a los patógenos y crean una barrera protectora sobre toda la mucosa entérica, es por ello que se hace necesario definir: ¿cuándo es el momento óptimo de su aplicación, qué dosis y frecuencia de uso podemos emplear en nuestras granjas?, por lo consiguiente, su uso debe basarse en la selección de las cepas adecuadas así como en el efecto beneficioso que sería deseable en cada caso.
Propuestas de diferentes modos de aplicación de los probióticos en la producción porcina
La eficacia de un probiótico está condicionada por múltiples factores. No existe un probiótico universal, válido para cualquier indicación sea ésta profiláctica, terapéutica, paliativa, metabólica o inmunitaria. Es por ello que en muchas ocasiones es conveniente emplear probióticos constituidos por mezclas de distintas especies que se complementen o que potencien el o los efectos deseados.
La eficacia depende, en primer lugar, de las cepas y de su viabilidad. Está probado que dentro de una misma especie puede haber diferencias notables entre la actividad de cepas prácticamente idénticas. Hay que tener en cuenta que los probióticos tienen que atravesar la barrera gástrica y resistir también el efecto de la batería enzimática, las sales y ácidos biliares, con el fin de alcanzar, en la concentración necesaria, el segmento del tracto gastrointestinal donde queremos que lleven a cabo su acción. La selección de cepas debe tener en cuenta estos criterios o, alternativamente, pueden administrarse protegidos de distintas formas con el fin de que sean liberados exactamente allá donde sea necesario que ejerzan su actividad (Pérez 2000).
Otros factores importantes que afectan a la eficacia son la dosis, el momento de administración y la frecuencia de ésta. También su presentación en asociación con sustancias prebióticas, que favorecen la multiplicación bacteriana, en forma de simbióticos afecta notablemente su potencial efecto beneficioso (Hunter 2012; Reid 2012; Ringel et al., 2012).
Las situaciones más comunes en las que la aplicación de probióticos en producción porcina podría ser de utilidad incluyen las siguientes:
- Cerdos con la biota del TGI no establecida: lechones en los primeros días de vida.
- Cerdos sometidos a situaciones que propician disbiosis: destetes, traslados, vacunación, cambios de alimentación etc.
- Cerdos con la microbiota afectada por tratamientos farmacológicos: principalmente por tratamientos con antibióticos u otros productos que afecten directa o indirectamente a la microbiota.
- Cerdos con procesos infecciosos en curso: particularmente con infecciones del aparato digestivo.
- Cerdas reproductoras: en las etapas de gestación y lactación.
- Cerdos clínicamente sanos: incluyendo tanto lechones, como cerdos de cebo y reproductores.
Cerdos con la biota del TGI no establecida
En los cerdos, como en el resto de los animales, la biota se instaura de forma gradual a partir de la madre y del ambiente. La colonización temprana del cerdito proviene de las bacterias útero-vaginales, aquellas que están en el área del parto provenientes de las heces de la madre, las originarias del canal del pezón y todas aquellas que sean capaces de transmitirse durante la lactancia por el eje entero - mamario. Durante los primeros días de nacidos el cerdo aún no dispone de un ecosistema intestinal estable y en estos animales, el uso de probióticos puede contribuir a una colonización precoz por parte de bacterias beneficiosas. Esta microbiota beneficiosa estimula la maduración del sistema inmune intestinal y además, puede favorecer la competición con bacterias patógenas importantes en esta etapa, como E. coli o distintas especies de Clostridium. En esta etapa, lo más conveniente es la utilización de mezclas de bacterias de distintas especies con alta capacidad de adherencia, de crecimiento rápido y de probada actividad contra los patógenos, que se podrán administrar por vía oral en los primeros días de vida o con el pienso de lactación una vez que los lechones empiezan a ingerirlo. Es importante tener en cuenta, que en ningún caso se podrán emplear antibióticos simultáneamente a un tratamiento con probióticos (Cousin et al., 2012).
En los cerdos, como en el resto de los animales, la biota se instaura de forma gradual a partir de la madre y del ambiente. La colonización temprana del cerdito proviene de las bacterias útero-vaginales, aquellas que están en el área del parto provenientes de las heces de la madre, las originarias del canal del pezón y todas aquellas que sean capaces de transmitirse durante la lactancia por el eje entero - mamario. Durante los primeros días de nacidos el cerdo aún no dispone de un ecosistema intestinal estable y en estos animales, el uso de probióticos puede contribuir a una colonización precoz por parte de bacterias beneficiosas. Esta microbiota beneficiosa estimula la maduración del sistema inmune intestinal y además, puede favorecer la competición con bacterias patógenas importantes en esta etapa, como E. coli o distintas especies de Clostridium. En esta etapa, lo más conveniente es la utilización de mezclas de bacterias de distintas especies con alta capacidad de adherencia, de crecimiento rápido y de probada actividad contra los patógenos, que se podrán administrar por vía oral en los primeros días de vida o con el pienso de lactación una vez que los lechones empiezan a ingerirlo. Es importante tener en cuenta, que en ningún caso se podrán emplear antibióticos simultáneamente a un tratamiento con probióticos (Cousin et al., 2012).
Cerdos sometidos a situaciones que propician disbiosis
Existen determinados momentos en la vida productiva del cerdo en los que, de forma habitual y por distintas razones, se producen con relativa frecuencia alteraciones de la microbiota intestinal, ligadas en muchos casos a situaciones de estrés como por ejemplo el destete, cambios de alimentación, traslados, vacunaciones, desparasitaciones o reagrupaciones entre otras (Johnson et al., 2012). En estas situaciones con elevado riesgo de inducción de disbiosis también tiene cabida el empleo profiláctico de probióticos o incluso de simbióticos, generalmente mezclas de distintas especies de bacterias, complementarias entre sí, y que contribuyan a reequilibrar la microbiota o a evitar su desequilibrio y a dificultar la multiplicación de patógenos. La aplicación, en este caso, se recomienda desde unos días antes y hasta unos días después de la situación específica de estrés (Somer & Dantas, 2011).
Existen determinados momentos en la vida productiva del cerdo en los que, de forma habitual y por distintas razones, se producen con relativa frecuencia alteraciones de la microbiota intestinal, ligadas en muchos casos a situaciones de estrés como por ejemplo el destete, cambios de alimentación, traslados, vacunaciones, desparasitaciones o reagrupaciones entre otras (Johnson et al., 2012). En estas situaciones con elevado riesgo de inducción de disbiosis también tiene cabida el empleo profiláctico de probióticos o incluso de simbióticos, generalmente mezclas de distintas especies de bacterias, complementarias entre sí, y que contribuyan a reequilibrar la microbiota o a evitar su desequilibrio y a dificultar la multiplicación de patógenos. La aplicación, en este caso, se recomienda desde unos días antes y hasta unos días después de la situación específica de estrés (Somer & Dantas, 2011).
Cerdos con la microbiota afectada por tratamientos farmacológicos
Los antibióticos, por sus propias características y por la frecuencia de su utilización son los quimioterapéuticos que provocan mayores alteraciones de la microbiota. Su administración sistemática puede provocar una importante disbiosis que podrá agravar el cuadro clínico previo o desencadenar otros trastornos asociados con este que podrán retrasar la recuperación de los animales. En este caso, la aplicación de probióticos o simbióticos durante varios días, una vez completado el tratamiento antibiótico, puede contribuir a restaurar el equilibrio de la microbiota digestiva y con ello acelerar la incorporación del cerdo a niveles óptimos de productividad (Ringel et al., 2012).
Los antibióticos, por sus propias características y por la frecuencia de su utilización son los quimioterapéuticos que provocan mayores alteraciones de la microbiota. Su administración sistemática puede provocar una importante disbiosis que podrá agravar el cuadro clínico previo o desencadenar otros trastornos asociados con este que podrán retrasar la recuperación de los animales. En este caso, la aplicación de probióticos o simbióticos durante varios días, una vez completado el tratamiento antibiótico, puede contribuir a restaurar el equilibrio de la microbiota digestiva y con ello acelerar la incorporación del cerdo a niveles óptimos de productividad (Ringel et al., 2012).
Cerdos con procesos infecciosos en curso
Los probióticos también pueden emplearse como terapéuticos ante cualquier proceso infeccioso que afecte al aparato digestivo (Ringel et al., 2012). Aunque esta indicación está muy poco desarrollada, existen posibilidades de utilización de los probióticos en una especie de “lucha biológica”. En caso de que exista un diagnóstico etiológico concreto se podrán emplear de forma específica bacterias probióticas seleccionadas por su acción inhibitoria o bactericida contra el agente patógeno identificado. La simple inhibición competitiva impuesta a la multiplicación masiva de la bacteria patógena en cuestión, limita los daños y facilita la reacción del sistema inmunitario del animal. Más aún, será posible aplicar asociaciones probióticas con un amplio espectro frente a las bacterias patógenas frecuentes en aquellos casos en los que no exista un diagnóstico etiológico (Chai et al., 2012).
Los probióticos también pueden emplearse como terapéuticos ante cualquier proceso infeccioso que afecte al aparato digestivo (Ringel et al., 2012). Aunque esta indicación está muy poco desarrollada, existen posibilidades de utilización de los probióticos en una especie de “lucha biológica”. En caso de que exista un diagnóstico etiológico concreto se podrán emplear de forma específica bacterias probióticas seleccionadas por su acción inhibitoria o bactericida contra el agente patógeno identificado. La simple inhibición competitiva impuesta a la multiplicación masiva de la bacteria patógena en cuestión, limita los daños y facilita la reacción del sistema inmunitario del animal. Más aún, será posible aplicar asociaciones probióticas con un amplio espectro frente a las bacterias patógenas frecuentes en aquellos casos en los que no exista un diagnóstico etiológico (Chai et al., 2012).
Cerdas reproductoras
Durante la gestación, la cerda sufre cambios significativos en su metabolismo y en su fisiología digestiva. El uso de probióticos en esta etapa puede contribuir, en primer lugar, a mejorar la capacidad digestiva de la cerda y a la mejora de sus parámetros inmunológicos gestacionales (Schierack et al., 2012). Por otra parte, durante la gestación se determinan aspectos muy relevantes relativos al desarrollo futuro del feto y a su capacidad inmunológica (Rautava et al., 2012), el peso vivo al nacimiento y su viabilidad. La suplementación de la cerda gestante con probióticos puede contribuir a estimular el desarrollo del feto y de su sistema inmunitario y también se han constatado mejoras en parámetros como el peso al nacimiento, el número de lechones nacidos vivos y el porcentaje de supervivencia de los lechones (Deng et al., 2012).
Durante la gestación, la cerda sufre cambios significativos en su metabolismo y en su fisiología digestiva. El uso de probióticos en esta etapa puede contribuir, en primer lugar, a mejorar la capacidad digestiva de la cerda y a la mejora de sus parámetros inmunológicos gestacionales (Schierack et al., 2012). Por otra parte, durante la gestación se determinan aspectos muy relevantes relativos al desarrollo futuro del feto y a su capacidad inmunológica (Rautava et al., 2012), el peso vivo al nacimiento y su viabilidad. La suplementación de la cerda gestante con probióticos puede contribuir a estimular el desarrollo del feto y de su sistema inmunitario y también se han constatado mejoras en parámetros como el peso al nacimiento, el número de lechones nacidos vivos y el porcentaje de supervivencia de los lechones (Deng et al., 2012).
La lactación y la gestación tienen un coste metabólico muy elevado para la cerda que se intenta compensar estimulando el consumo de pienso hasta valores máximos. Estas condiciones propician la aparición de problemas digestivos que comprometen tanto la producción de leche, y en consecuencia la supervivencia de los lechones, como el propio metabolismo de la cerda y su vida reproductiva posterior. Durante la lactación, la administración de probióticos a las cerdas puede ser eficaz en ambos sentidos. La mejora de la fisiología digestiva redundará en una mejor lactación, que a su vez tendrá un efecto directo sobre la camada, limitará el gasto metabólico de la cerda y, consecuentemente, repercutirá sobre su vida productiva posterior (Deng et al., 2012).
Por otra parte, la administración de probióticos adecuadamente seleccionados a la cerda lactante contribuirá también al establecimiento de la microbiota en su camada favoreciendo la salud general del lechón.
Cerdos clínicamente sanos
En cualquier fase de la vida de un cerdo sano también puede ser de utilidad la aplicación de probióticos con el fin de mejorar principalmente su fisiología digestiva, su metabolismo, la digestibilidad de los alimentos así como la calidad de sus carnes (Suo et al., 2012). En este sentido, los probióticos pueden emplearse como suplementos a algunas de las enzimas habitualmente utilizadas en nutrición porcina. Además, ante cualquier vacunación programada, podrían emplearse con el fin de potenciar y favorecer la respuesta inmunológica. Este también es un campo nuevo para la aplicación de probióticos que necesita ser desarrollado (Wen et al., 2012).
En cualquier fase de la vida de un cerdo sano también puede ser de utilidad la aplicación de probióticos con el fin de mejorar principalmente su fisiología digestiva, su metabolismo, la digestibilidad de los alimentos así como la calidad de sus carnes (Suo et al., 2012). En este sentido, los probióticos pueden emplearse como suplementos a algunas de las enzimas habitualmente utilizadas en nutrición porcina. Además, ante cualquier vacunación programada, podrían emplearse con el fin de potenciar y favorecer la respuesta inmunológica. Este también es un campo nuevo para la aplicación de probióticos que necesita ser desarrollado (Wen et al., 2012).
Conclusiones y valoración final
El conocimiento de los probióticos ha aumentado considerablemente en los últimos años, como lo refleja en número de publicaciones sobre los mismos que se pueden encontrar en cualquier base de datos. Sin embargo, el ecosistema digestivo tiene una gran complejidad y es necesario completar su estudio en profundidad. Existen gran cantidad de interacciones entre la fisiología del propio animal y su microbiota digestiva y ambas, a su vez, están intensamente influidas por gran número de factores externos entre los que destacan el alimento y el agua que ingiere. Se hace necesario, a la hora de diseñar los productos probióticos, un mayor conocimiento de estas interacciones y de las posibilidades de modularlas. Sin embargo, podemos concluir sin lugar a dudas que el empleo de probióticos en producción porcina es una importante herramienta que debemos considerar para la mejora de la salud digestiva y del estado general de los cerdos, reduciendo racionalmente el uso de antibióticos.
Agradecimientos:
Agencia Española de Cooperación Internacional para el desarrollo (AECID) y al Ministerio de Asuntos Exteriores y de Cooperación (MAEC)
Agencia Española de Cooperación Internacional para el desarrollo (AECID) y al Ministerio de Asuntos Exteriores y de Cooperación (MAEC)
Referencias
1. Arumugam m., raes j., pelletier e., le paslier d., yamada t., mende d. R.,fernandes g. R., tap j., bruls t., batto j. M., bertalan m., borruel n., casellas f., fernandez l., gautier l., hansen t., hattori m., hayashi t., kleerebezem m., kurokawa k., leclerc m., levenez f., manichanh c., nielsen h. B., nielsen t., pons n., poulain j., qin j., sicheritz-ponten t., tims s., torrents d., ugarte e., zoetendal e. G., wang j., guarner f., pedersen o., de vos w. M., brunak s., doré j., weissenbach j., and ehrlich s. D. (2011). Enterotypes of the human gut microbiome. Journal nature, vol. 473: page 174–180.
2. Atlas r. M. Y bartha r. (2001). Ecología microbiana y microbiología ambiental. 4ta edición. Editorial addison-wesley. Madrid.
3. Balter m. (2012). Taking stock of the human microbiome and disease. Journal science vol. 336: page 1247.
4. Barrios v. G., samaniego m. F., urueña a. C., arcos m., nistal p., naharro g., laurencio m., pérez q. M., boucourt r. Savón l. Y domínguez h. (2009). Importancia del estudio de la biota intestinal indígena, para la obtención de biopreparados con propiedades probióticas en cerdos. Cd de monografías, umcc. Consultado en línea [http://monografias.Umcc.Cu/monos/ v2009/agronomia/m09agr15.Pdf.].
5. Bibiloni r., membrez m. And chou c. J. (2009) microbiota intestinal, obesidad y diabetes. Journal ann nestlé, vol 67: page 39–48.
6. Chai w., burwinkel m., wang z., palissa c., esch b., twardziok s., rieger j., wrede p., schmidt m.F. (2012). Antiviral effects of a probiotic enterococcus faecium strain against transmissible gastroenteritis coronavirus. Journal archives of virology. Doi 10.1007/ s00705-012-1543-0. Consultado en línea: [http://link.Springer.Com/article/10.1007%2 fs00705-012-1543-0#]
7. Cousin f.J., louesdon s., maillard m.B., parayre s., falentin h., deutsch s.M., boudry g., ene g. (2012). The first dairy product exclusively fermented by propionibacterium freudenreichii: a new vector to study probiotic potentialities in vivo. Journal food microbiology, vol. 32(1): page 135-46.
8. Craig l. Maynard c. L., elson c.O., hatton r.D. And weaver c. T. (2012). Reciprocal interactions of the intestinal microbiota and immune system. Journal nature, vol 489: page 231–24.
9. Danmap (2011). Use of antimicrobiall agents and occurrence of antimicrobial resistance in bacteria from food animals, food and humans in denmark. National food institute. Statens serum institute. Consultado en línea: [http://www.Danmap.Org/downloads/~/media/ projekt%20sites/danmap/danmap%20reports/ danmap_2011.Ashx].
10. De bruyne e., flahou b., chiers k., meyns t., kumar s., vermoote m., pasmans f., millet s., dewulf j., haesebrouck f. And ducatelle r. (2012). An experimental helicobacter suis infection causes gastritis and reduced daily weight gain in pigs. Journal veterinary microbiology, vol. 160(3–4): page 449-454.
11. De lorenzo d., serrano j., portero-otín m., pamplona r. (2011). Nutrigenómica y nutrigenética hacia la nutrición personalizada. Editado por librooks barcelona s.L.L. Isbn: 978-84-938910-1-5. Barcelona. España.
12. Delgado s. (2005). Tesis presentada en opción al grado científico de doctor en ciencias veterinarias. Microbiota intestinal humana: análisis y evolución de poblaciones representativas e identificación de bacterias probióticas. Instituto de productos lácteos de asturias (ipla-csic). Oviedo. España.
13. Deng j., li y., zhang j., yang q. (2012). Co-administration of bacillus subtilis rjgp16 and lactobacillus salivarius b1 strongly enhances the intestinal mucosal immunity of piglets. Journal research in veterinary science. Pmid:22901748. Consultado en [http:// www.Sciencedirect.Com/science/article/pii/ s0034528812002330]
14. Efsa (2009). Report of the task force on zoonoses data collection on the analysis of the baseline survey on the prevalence of salmonella in slaughter pigs, in the e.U. The efsa journal, vol. 7: page1377.
15. Elizabeth k. C., keaton s., les d., brendan j.M.B., relman d. A. (2012). The application of ecological theory toward an understanding of the human microbiome. Journal science, vol. 336: page 1255.
16. Fao/who (2001). Expert consultation on evaluation of health and nutritional properties of probiotics in food including powder milk with live lactic acid bacteria. Córdoba, argentina; 1-4 october. Consultado en: [http://www.Who. Int/foodsafety/publications/fs_ management/ probiotics/en/index.Html].
17. Fuller r. (1989). A review: probiotics in man and animals. Journal of applied bacteriology, vol. 66: page 365-378.
18. Gabaudan f. C. Y bracero j. U. (2012). Dicciomed. Eusal.Es. Diccionario médico-biológico, histórico y etimológico. Ediciones universidad de salamanca. España. Consultado el 12/12/2012, en: [http://dicciomed.Eusal.Es].
19. Gedek b. (1991). Regulation of the intestinal flora through food. Journal zeitschrift fur hygiene und infektionskrankheitenzb, vol. 191: page 272-301.
20. Godoy c., melej c., silva n. (2010). Medición de cambios cuantitativos de la microbiota subgingival posterior a la remoción de placa bacteriana supragingival. Revista clínica. Periodoncia implantolología y rehabiitación oral, vol. 31: page 5-10.
21. Hidalgo, a., carvajal, a., vester, b., pringle, m., naharro, g., rubio, p. (2011). Trends towards lower antimicrobial susceptibility and characterization of acquired resistance among clinical isolates of brachyspira hyodysenteriae in spain. Journal antimicrob agents chemother, vol. 55: page 3330-3337.
22. Hughes v. (2012). Microbiome: cultural differences. Journal
23. Hunter p. (2012). The changing hypothesis of the gut. Journal nature, embo reports, vol. 13: page 498 – 500.
24. Johnson l., thomas a., and söderholm g. J. D. (2012). Physiology of the gastrointestinal tract. Chapter 74 - effects of stress on intestinal mucosal functions. Vol 2. (fifth edition). Edit. Academic press: page 1979–2000. Isbn: 978-0-12- 382026-6. San diego, usa.
25. Kellyn s. Betts (2011) a study in balance: how microbiome are changing the shape of environmental health. Journal ncbi: environ health perspective, vol. 119(8).
26. Korhonen j. (2010) antibiotic resistance of lactic acid bacteria. Publications the university of eastern finland, vol. 7, editor kopijyvä, isbn.9526100964, 9789526100968. Finlandia.
27. Kraatz m. (2010). Lactobacilli and other lactic acid-related bacteria in the mucosal proximal gastrointestinal tract of pigs: a review of ecology for two derivative approaches for isolation of novel species. Journal current research, technology and education topics in applied microbiology and microbial biotechnology, vol. 1: page 674-686.
28. Lederberg j. (2000). Infectious history. Journal science, vol. 288 n0 5464 page: 287-293.
29. Lee s.J., cho s.J. And park e.A. (2007). Effects of probiotics on enteric flora and feeding tolerance in preterm infants. Journal neonatology, vol. 91(3): page 174-179.
30. Lilly d.M. And stillwell r.H. (1965). Probiotics: growth-promoting factors produced by microorganisms. Journal science, vol. 147: page 747-748.
31. Looft t., johnson t., allen h. K., bayles d. O., alt d. P., stedtfeld r. D. Woo jun sul w. J., stedtfeld t. M., chai b., cole j. R., hashsham s. A., tiedje j. M. And stanton t. B. (2012). In-feed antibiotic effects on the swine intestinal microbiome. Journal pnas, vol. 109 n0 5: page 1691–1696.
32. Marcus j. Claesson, ian b. Jeffery, susana conde, susan e. Power, eibhlís m. O’connor, siobhán cusack, hugh m. B. Harris, mairead coakley, bhuvaneswari lakshminarayanan, orla o’sullivan, gerald f. Fitzgerald, jennifer deane, michael o’connor, norma harnedy, kieran o’connor, denis o’mahony, douwe van sinderen, martina wallace, lorraine brennan, catherine stanton, julian r. Marchesi, anthony p. Fitzgerald, fergus shanahan, colin hill, r. Paul ross & paul w. O’toole mcfarland lv. (2006). Meta-analysis of probiotics for the prevention of antibiotic associated diarrhea and the treatment of clostridium difficile disease. American journal of gastroenterology, vol. 101(4): page 812-822.
33. Mori k., ito t., miyamoto h., ozawa m., wada s., kumagai y., matsumoto j., naito r., nakamura s., kodama h., and kurihara y. (2011). Los suplementos microbianos para la cerda afectan a la composición de la microbiota intestinal y los ácidos orgánicos fecales en lechones destetados. Journal of bioscience and bioengineering, vol. 112(2): page145-150.
34. Mueller k., ash c., pennisi e., smith o., (2012). The gut microbiota. Journal science, vol. 336 (8): page 1245.
35. Mulder r. (1996). Probiotics and competitive exclusion microflora against salmonella. World poultry special salmonella, vol. 1: page 30-32.
36. Paul w. And toole o. (2012).Gut microbiota composition correlates with diet and health in the elderly. Journal nature, vol. 488: page 178–184.
37. Pérez, m. (2000). Obtención de un hidrolizado de crema de levadura de destilería y evaluación de su actividad probiótica. Tesis presentada en opción al grado científico de doctor en ciencias veterinarias. Instituto de ciencia animal. Complejo científico universidad agraria de la habana. Cuba.
38. Petros a. M., georgia z., christos m., kalantzopoulosa g., potb b., tsakalidoua e., (2010). Probiotic potential of lactobacillus strains isolated from dairy products. International dairy journal, vol. 16: page 189–199.
39. Piad b.R.E. (2001) evaluación de la actividad probiótica de un hidrolizado enzimático de crema de destilería en pollitas de reemplazo de ponedora. Tesis en opción al grado científico de doctor en ciencias veterinarias. Instituto de ciencia animal de la habana. Cuba.
40. Qin j., li r., raes j. Et al. (2010). A human gut microbial gene catalogue established by metagenomic sequencing. Journal nature, vol. 46: page 59-65.
41. Rautava s., luoto r., salminen s., and isolauri e. (2012). Microbial contact during pregnancy, intestinal colonization and human disease. Journal nature reviews gastroenterology and hepatology, vol. 9: page 565-576.
42. Reid g. (2012). Microbiology: categorize probiotics to speed research. Journal nature, vol. 485: page 446.
43. Ringel y., quigley e. M. And lin h. C. (2012). Using probiotics in gastrointestinal disorders. The american journal of gastroenterology supplements, vol. 1: page 34-40.
44. Rondón, a.J. (2009). Tesis presentada en opción al grado científico de doctor en ciencias veterinarias. Instituto de ciencia animal de la habana. Complejo científico universidad agraria de la habana. Cuba.
45. Sarmiento l. A. R. (2012). Análisis de la microbiota intestinal en un modelo animal. Guía para el estudio de prebióticos y probióticos. Isbn-13 978-3-659-05343-6, isbn-10 3659053430 editorial académica española. España.
46. Schierack p., filter m., scharek l., toelke c., taras d., tedin k., haverson k., lübke-becker a., wieler l.H. (2012). Effects of bacillus cereus var. Toyoi on immune parameters of pregnant sows. Journal veterinary immunology and immunopathology, vol. 127 (inssues 1-2): page 26-37.
47. Schrezenmeir j, de vrese m. (2001). Probiotics, prebiotics, and symbiotic – approaching a definition. The american journal of clinical nutrition, vol. 73 (2 supple): page 361-364.
48. Sekirov i., tam m. N., jogova m., robertson m. L., li y., lupp c., brett b. (2008). Antibiotic-induced perturbations of the intestinal microbiota alter host susceptibility to enteric infection. Journal infection and immunity, vol. 76 n0 10: page 4726-4736.
49. Somer m., and dantas g. (2011). Antibiotics and the resistant microbiome. Current opinion in microbiology, vol. 14: page 556–563.
50. Suo c., yin y., wang x., lou x., song d., wang x., gu q. (2012). Effects of lactobacillus plantarum zj316 on pig growth and pork quality. Journal bmc veterinary research, vol 25: page 8-89.
51. Tannock, g. W. (1999). A fresh look at the intestinal microflora. Probiotics: a critical review. Editado por g. W. Tannock. Horizon scientific press. Isbn 1-898486-15-8. England.
52. Thompson o. C. C., maldonado j.L. And gil a. H. (2004). La microbiota intestinal en el niño y la influencia de la dieta sobre su composición. Revista alimentación nutrición y salud, vol. 11, n0 2: page 37-48.
53. Ubeda c., pamer e. G. (2012). Antibiotics, microbiota, and immune defense. Trends in immunology, vol. 33 (9): page 459-466.
54. Vandelle, m.; teller, e.; focant m. (1990) probiotics in animal nutrition: a review. Journal arch tierernahr, vol. 40(7): page 67-543.
55. Wen k., li g., bui t., liu f., li y., kocher j., lin l., yang x., yuan l. (2012). High dose and low dose lactobacillus acidophilus exerted differential immune modulating effects on t cell immune responses induced by an oral human rotavirus vaccine in gnotobiotic pigs. Journal vaccine, vol. 30(6): page 1198-207.
56. Zentek j., buchheit-renko s., männer k., pieper r., vahjen w. (2012). Intestinal concentrations of free and encapsulated dietary medium-chain fatty acids and effects on gastric microbial ecology and bacterial metabolic products in the digestive tract of piglets. Journal archives of animal nutrition, vol. 66(1): page 14-26.
Temas relacionados:
Autores:
Universidad de Leon - España
Universidad de Leon - España
Universidad de Leon - España
Recomendar
Comentar
Compartir

¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.







.jpg&w=3840&q=75)