Efecto de la alimentación con paja de trigo tratada con Pleurotus florida en la flora ruminal de ovinos
Publicado: 16 de noviembre de 2007
Por: O.D. Montañez, María Esther Ortega, M.A. Cobos, A. Larqué (Colegio de Postgraduados, COLPOS) y J.E. García (Depto. de Nutrición Animal: Univ. Autónoma Agraria Antonio Narro), México.
Entre ellos se halla el uso de agentes biológicos,como son los hongos de la pudrición blanca,los que producen enzimas capaces de degradarla lignina de pajas y rastrojos (Ruiz-Dueñas et al. 1999, Toumela et al. 2000, Saparratet al. 2002 y Tuomela 2002). Con ellos aumentala digestibilidad y el consumo de estos forrajes(Agosin et al. 1985, Henicz 1987, Yamakawaet al. 1992a, Permana et al. 2000 y Arora et al.2002). Sin embargo, se ha encontrado que durantela degradación de la lignina se formandiferentes ácidos fenólicos (Jung y Fahey 1983,Agosin et al.1986, Henicz 1987, Akin et al. 1993,Hofrichter 2002 y Koroleva et al. 2002) y enparticular el ácido ferúlico y p-cumárico (Chessonet al. 1982), los que pueden afectar elcrecimiento de algunas bacterias ruminalescomo Ruminococcus albus, R. flavesfaciens yFibrobacter succinogenes.
Por esto, el objetivo de este estudio fuedeterminar si al alimentar borregos con paja de trigo, en la que se cultivó el hongo comestiblede la pudrición blanca Pleurotus florida, seafecta la digestibilidad del alimento, así comoel número de bacterias totales, celulolíticas,protozoarios, pH, concentración de amoníacoruminal y ácidos grasos volátiles en el rumen.
Materiales y Métodos
Se utilizaron ocho borregos criollos machoscon canula ruminal, con 32 ± 7.22 kg de pesopromedio, desparasitados con Ivomec-F (1 mL50 kg-1 de peso vivo) e inyectados con vitaminaA, D y E antes de iniciar el experimento.
Estos se alojaron en jaulas individuales. Posteriormente,se distribuyeron al azar en dos tratamientos:dieta con paja de trigo sin tratar(PST, Testigo) y dieta con paja de trigo tratadacon Pleurotus florida (PT), con cuatro repeticionespor tratamiento.
La paja de trigo tratada se utilizó previamentecomo sustrato para cultivar el hongocomestible Pleurotus florida durante 60 d. Despuésde la cosecha, la paja que quedó se utilizópara alimentar a los borregos.
Las dietas consistieron en 70 % de paja detrigo (PST o PT) y 30 % de un concentradobalanceado (67 % de maíz molido, 17 % de sorgomolido, 10 % de melaza, 5 % de harina desoya, 0.5 % de premezcla mineral y 0.5 % de salcomún), destinado a cubrir los requerimientosde mantenimiento de estos animales (NRC1985).
Los animales tuvieron un período de adaptacióna las dietas de 15 d. El alimento se ofreciódos veces al día (8:00 y 4:00 h), con accesolibre al consumo de agua, la cual se cambiódiariamente. En este período se ofreció el alimentoad libitum durante 10 d, para estimar elconsumo diario por animal. Posteriormente,durante cinco días, se redujo al 90 %, con elpropósito de asegurar que los animales consumieranla dieta en su totalidad. En los últimostres días de adaptación, a cada animal sele colocó una bolsa recolectora de heces, paraque cada uno se acostumbrara a ella.
Concluido este período, durante ocho díasse recolectaron totalmente las heces, para determinarla digestibilidad in vivo de la materiaseca (MS), materia orgánica (MO), proteína cruda(PC), fibra detergente neutro (FND), fibradetergente ácido (FDA), celulosa y hemicelulosa.
En las dietas y en las pajas (tratada y sintratar) se determinó MS, PC y cenizas, segúnAOAC (1990) y la FND, FDA, celulosa, hemicelulosay lignina, de acuerdo con van Soest etal. (1991). En las heces se realizaron las determinacionesantes señaladas, a excepción de lalignina.
Dos días antes de concluir la recolecciónde heces, y 3 h después de ofrecido el alimentode la mañana, se extrajo líquido ruminal a cadaanimal mediante la canula. Inmediatamente semidió el pH con un potenciómetro portátil y setomaron muestras para determinar la concentraciónde AGV por cromatografía de gases(Erwin et al. 1961) y nitrógeno amoniacal(McCullough 1967).
En el último día del experimento se volvió aextraer líquido ruminal a todos los animales, parael conteo de bacterias totales (BT), bacteriascelulolíticas (BC) y protozoarios. Se prepararondos medios de cultivo anaerobios para BTy BC (Cobos y Yokoyama 1995). Para estimar laconcentración de BT, se inoculó 1 mL de fluidoruminal con 9 mL de medio de cultivo en tubosde 18 x 150 mm y se realizaron diluciones de10-1 a 10-12. Esta serie de diluciones se realizópor triplicado. Para estimar la concentración deBC se siguió el mismo procedimiento usado paraBT, con diluciones de 10-1 hasta 10-10. En amboscasos, la concentración de bacterias por mLde fluido ruminal se estimó con la técnica delnúmero más probable (Harrigan y Cance 1990).
Para facilitar el conteo de protozoarios semezcló 1 mL de líquido ruminal fresco con 1 mLde solución de Coleman (Williams y Coleman1992) en tubos de cultivo de 13 x 100 mm. Elconteo se realizó con una cámara de Neubauery un microscopio de contraste, a una magnificacióntotal de 400X. Se estimó la media como elpromedio de 20 observaciones por animal.
Los datos obtenidos se analizaron medianteuna comparación de medias, utilizando unaprueba de F (SAS 1999).
Resultados
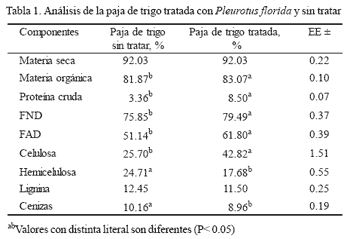
El contenido de MS en la paja tratada y sintratar fue similar, pero sí hubo diferencias entreambas (P < 0.05), ya que en la paja tratada,usada para cultivar los hongos, aumentó elcontenido de MO, PC, FND, FDA y celulosa.Sin embargo, el de hemicelulosa y cenizas disminuyó(tabla 1).
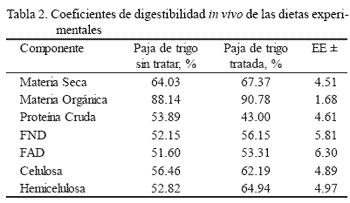
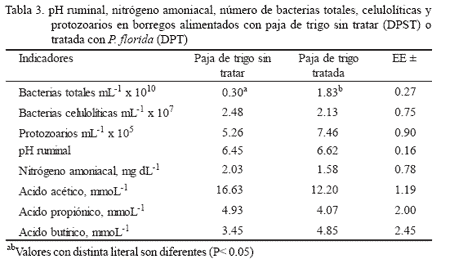
Los coeficientes de digestibilidad no mostrarondiferencias entre los dos tratamientos(tabla 2). Los valores de pH, nitrógenoamoniacal, ácido acético, propiónico y butíricofueron similares en ambos. La concentraciónpor mL de BT fue superior (P < 0.05) en la pajatratada, sin que se encontraran diferencias entrelas dos dietas en la concentración de BC oprotozoarios (tabla 3).
Discusión
El contenido de MS en la paja tratada y sintratar fue similar, lo que se corresponde con loobtenido por Apráez (1989), Coronel y Martínez(1995) y Aceves (1997), quienes tampoco encontrarondiferencias significativas con respectoal contenido de MS de la paja tratada ysin tratar. También coincide con los resultadosde Kishan et al. (1990), Jung et al. (1992),Kerem et al. (1992) y Triparthi y Yadav (1992),los que informaron pérdidas en el contenidode los sustratos utilizados.
El contenido de MO fue mayor en la pajade trigo tratada que en la no tratada (P < 0.05),presentando ésta un menor contenido de cenizascon respecto a la paja testigo. Estos resultadoscontrastan con los obtenidos porLangar et al. (1980), quienes observaron quedurante la fructificación de Pleurotus ostreatussobre la paja de trigo, la materia orgánica yotros componentes de la pared celular, exceptola lignina, disminuyeron su contenido despuésde la cosecha. Ortega et al. (1986) informaronque el contenido de cenizas aumentó alos 60 d de incubada la paja de cebada conPleurotus ostreatus, debido a que hubo posiblementeuna mayor utilización de materia orgánicapor parte del hongo.
En otro estudio en el que se incubóPleurotus ostreatus en una combinación de50 % de paja de trigo y 50 % de ensilado dealgodón, se encontró que la pérdida de materiaorgánica fue baja al combinar pajas tratadas(Silanikove et al. 1988). Por otra parte, al cultivardos hongos Pleurotus ostreatus y Pleurotusflorida en paja de cebada, se encontró quela materia orgánica de la paja tratada con Pleurotusflorida tuvo un coeficiente de digestibilidadmayor que el de la paja tratada con Pleurotusostreatus, en tanto que la menor digestibilidadla tuvo la paja sin tratar (Coronel y Martínez1995). También Karunanandaa et al. (1995) informaronpérdidas de materia orgánica en pajade arroz tratada con hongos de la pudriciónblanca, principalmente en el momento de la fructificación.
Se observó una mayor concentración deproteína cruda en la paja de trigo tratada conrespecto a la no tratada (P < 0.05). Iguales resultadosobtuvieron Coronel y Martínez (1995)y Coronel y Ortega (1998), quienes encontrarondiferencias significativas en paja de trigo ycebada, tratadas con especies del géneroPleurotus y concluyeron que este incrementoen la proteína cruda se debía a la presencia detallos y cuerpos fructíferos del hongo en elsustrato, los que quedan después de la cosecha.
Rao y Naik (1990), al utilizar Pleurotusostreatus, incubado en paja de trigo, para romperel complejo ligno-celulosa, y después ofrecerla paja tratada a animales rumiantes, encontraronque mejoró el consumo y aumentó el porcentaje de proteína cruda de las pajas. Estosmismos autores plantean que algunosmicroorganismos asociados con el hongo tienenla capacidad de fijar nitrógeno atmosférico,lo que resulta en mayor contenido de nitrógenoen las pajas tratadas. Sin embargo, Ortegaet al. (1986) y Aceves (1997), no informarondiferencias significativas en los valores deproteína cruda, ya sea en la paja de trigo tratadacomo en la sin tratar.
La FND y FAD fueron mayores en la pajade trigo tratada con el hongo que en la testigo(P < 0.05). Estos resultados contrastan con losde Coronel y Martínez (1995) y Aceves (1997),quienes no encontraron diferencias significativascon respecto a la FND entre la paja detrigo y cebada, tratadas con especies de hongosdel genero Pleurotus, y la paja sin tratar,aunque sí observaron aumento no significativoen FAD. Asumieron así que las cepas dePleurotus utilizaron estos componentes comofuente de energía. Ortega et al. (1986) observarondisminución en la paredes celulares(FND) a los 45 y 60 d después de incubada lapaja de cebada con Pleurotus ostreatus. En unestudio de Silanikove et al. (1988), en el que seutilizaron tres sustratos para el cultivo dePleurotus ostreatus, al combinar 50 % de pajade trigo y 50 % de ensilado de algodón, seencontró que las pérdidas del complejo ligninacarbohidratofueron significativas, con lo quese incrementó el contenido de fibra detergentesoluble, y mejoró la calidad del sustrato. Poresto, se puede pensar que el sustrato sobre elque se inocula este hongo influye en los cambiosde los componentes de la fibra. Calzada etal. (1987a), al incubar Pleurotus ostreatus enpaja de trigo y pulpa de café, encontraron pérdidasen FND y en carbohidratos estructurales.
La celulosa fue mayor en la paja tratada,no sucedió así con la hemicelulosa y las cenizas,las que resultaron mayores en la paja detrigo sin tratar (P<0.05). Por otra parte, el contenidode lignina fue menor en la paja de trigotratada con Pleurotus florida, con respecto ala sin tratar, aunque no hubo diferencias significativasentre tratamientos. Estos resultadosson similares a los de Gintevorá y Lazarová(1987 y 1988), quienes al incubar Pleurotusostreatus en paja de trigo, observaron que lahemicelulosa y lignina eran descompuestas enmayor cantidad que la celulosa. Debido a queson dos componentes energéticos, semetabolizan casi en la misma proporción, durantela fase de crecimiento del hongo. Moysony Verachtert (1991) y Jung et al. (1992) observaronque la lignina no es el único componenteque se degrada durante el crecimiento fungal,y asumieron que la energía liberada durante laruptura de la lignina no es suficiente para elcrecimiento del hongo, por lo que otros componentescomo la glucosa, hemicelulosa y celulosa,se utilizan como fuente de energía parael desarrollo del hongo. Esto depende en granparte de la especie y la cepa que se emplee.
López y González (1997) plantean que antes dela formación del cuerpo fructífero, la degradaciónde hemicelulosa, celulosa y lignina presentapocas alteraciones. Sin embargo, en elmomento de la fructificación, y hasta despuésde la cosecha, la cantidad de estos compuestosse reduce hasta en 80 %. Ortega et al. (1986)y Tsang et al. (1987) al trabajar con especiesdel hongo Pleurotus, encontraron en elsustrato utilizado mayor disminución del contenidode celulosa y hemicelulosa que delignina. Langar et al. (1980), Yamakawa et al.(1992ab) y López y González (1997) afirman quedurante la fructificación del Pleurotusostreatus, la materia orgánica y otros componentesde la pared celular, excepto la lignina,disminuyen su contenido después de la cosecha,la hemicelulosa casi desaparece y la celulosabaja en 50 %. Coronel y Martínez (1995)no encontraron diferencias en el contenido decelulosa, tanto en la paja de cebada tratadacomo en la no tratada, por lo que concluyeronque las cepas del hongo Pleurotus, usaronhemicelulosa como fuente de energía. Tambiéninformaron menor contenido de lignina en lapaja de cebada tratada, aunque no hubo diferenciassignificativas. Atribuyeron estos resultadosa las bajas temperaturas y a las variacionesen la humedad relativa, las que se presentarondurante el crecimiento y desarrollo delhongo, así como también a otros factores como el tiempo de incubación en el sustrato, su composición,la actividad enzimática y el genotipode la cepa. Sin embargo, Ortega et al. (1986)informaron al trabajar con paja de cebada, inoculadapor 45 o 60 d, aumento en la lignina,aunque no fue significativo. Esto tuvo su explicaciónpor la disminución del porcentaje deFND, hemicelulosa y celulosa, el cual provocamayor concentración de lignina. También agreganque el alto contenido de lignina en las pajastratadas puede deberse a la gran variabilidadgenética entre cepas de Pleurotus ostreatus,las que tienen diferencias en cuanto a lacinética con la que degradan los diferentescomponentes del sustrato utilizado, ya que tienencepas incapaces de producir enzimasfenoloxidasas, encargadas de la degradaciónde la lignina (Leal 1982).
Los mayores coeficientes de digestibilidadse observaron en el tratamiento de paja tratada,exceptuando a la proteína cruda, aunqueestas diferencias no fueron significativas. Enestudios (Calzada et al. 1987b) con borregosalimentados con paja de cebada y trigo, inoculadacon hongos del género Pleurotus, se obtuvouna mayor digestibilidad de la MS, FND,FAD y celulosa que la encontrada en este trabajo.
Sin embargo, la composición del sustratoen el que se cultivan los hongos, la duracióndel cultivo y las cepas que se utilicen, afectanla degradación de los diferentes componentesde la paja (Mester y Tien 2000 y Kapich et al.2004). Así lo demuestra el trabajo de Bis’ko yBilav (1992), quienes cultivaron tres cepas diferentesde P. ostreatus en tres sustratos (pajade trigo, residuos de lino y residuos de girasol).
Estos se analizaron antes de inocularloscon el hongo, después del crecimiento delmicelio y al aparecer los cuerpos fructíferos.
La utilización de celulosa y lignina fue diferenteen dependencia de la cepa utilizada. La pérdidade celulosa fue mayor en el período decrecimiento y durante la aparición de los cuerposfructíferos; mientras que, después de laaparición de ellos, se utilizó la celulosa y ligninade manera similar, exceptuando los residuosde girasol, en los que hubo mayor utilizaciónde lignina. Esto se atribuye a la mayor actividadde las enzimas fúngicas monofenolmonoxigenasay endo-1,4-ß-glucanasa en elgirasol, que a su vez depende de la disponibilidadde oxígeno y de la interacción del miceliocon el sustrato.
Karunanandaa et al. (1995) estudiaron diferentesfracciones botánicas de paja de arroz(hoja o tallo), colonizadas por varios hongosde la pudrición blanca, Cyathus stercoreus(Cs), Atcc-36910, Phanerochaete chrysosporium(Pc) BKM y Pleurotus sajor-caju (Ps) 537,e informaron que en la paja testigo la digestibilidadin vitro fue similar para hojas y tallos. Enla paja tratada con Cs y Ps aumentó la digestibilidadde las hojas, debido a una mayor degradaciónde hemicelulosa que de celulosa. Encontraste, Pc degradó en forma similar lahemicelulosa y celulosa de las hojas, reduciendola digestibilidad de la paja una vez cosechadoel hongo, en tanto que solamente Ps aumentóla digestibilidad de los tallos. Estos autoresconcluyen que el aumento en la digestibilidadde las pajas tratadas con hongos, dependede la especie de hongo, sustrato y fraccionesbotánicas de ésta.
Todos estos factores afectan el aprovechamientode las pajas utilizadas para el cultivo dehongos por parte de los animales que las consumen.
En este estudio no se observaron diferenciasen la digestibilidad de las dietas quecontenían paja tratada y sin tratar. Aunque disminuyóel contenido de lignina en la paja tratada,esta disminución no fue significativa, loque coincide con lo observado por otros autores(Adamovic et al. 1998). Esto pudo ocasionarque otros componentes de la paja tratadano fueran degradados en el rumen en una mayorproporción que los de la paja no tratada.
En cuanto al pH y a la concentración denitrógeno amoniacal en el rumen, no se encontrarondiferencias significativas al proporcionarlas dos dietas. Estos resultados son similaresa los encontrados por Henics (1987), quienno observó diferencias cuando utilizó paja detrigo tratada con Pleurotus ostreatus para alimentarnovillos.
Tampoco se encontraron diferencias en laconcentración de ácidos grasos volátiles entrelos dos tratamientos. Esto resulta similar alo observado por Jalc et al. (1994), quienes alrealizar la fermentación ruminal in vitro de pajade trigo sin tratar y tratada con hongos de lapudrición blanca, no encontraron diferenciasen la concentración de ácidos grasos volátiles,ni en la producción total de masa microbiana,lo que podría indicar que el crecimiento delhongo en la paja no afecta la fermentaciónruminal, ni el desarrollo de los microorganismosruminales.
El contenido de bacterias totales fue mayor(P < 0.05) en el tratamiento con paja tratada.
Sin embargo, la concentración promediodeterminada en ambos tratamientos se encontróen el rango normal inferior de bacteriasruminales totales (1010-1012 bacterias por mLde fluido ruminal) (Cobos 1994). Esto pudocontribuir a que no se observaran diferenciasen otras variables, como lo es la digestibilidad.
La concentración de bacterias celulolíticasfue similar en ambos tratamientos y se encuentradentro de valores normales (107 bacteriaspor mL de fluido ruminal) (Vélez y Cobos 1997).
Encontrar concentraciones similares de estasbacterias en las dos dietas indica que el crecimientodel hongo en la paja no afecta ciertosfactores que determinan la concentración debacterias celulolíticas, como son el pH ruminaly las características propias del forraje, por loque tampoco influyó en el nivel de hidrólisisde celulosa (Dehority y Tirabasso 1998)Con respecto a la concentración deprotozoarios ruminales por mL de fluidoruminal, tampoco se observaron diferenciassignificativas entre tratamientos. La concentracióndeterminada se encuentra dentro delintervalo normal (104-106) (Cobos 1994), lo quedemuestra que el cultivo de Pleurotus floridaen paja de trigo no afecta la viabilidad de bacteriasy protozoarios ruminales.
Los resultados de este trabajo indican queal tratar la paja con el hongo Pleurotus floridano mejoró su digestibilidad. Sin embargo, demuestranque es posible usar la paja de trigo,que ha sido utilizada como sustrato para cultivareste hongo, en dietas para ovinos, sin quese afecte la digestibilidad de la ración o la poblaciónmicrobiana del rumen.
Referencias
Aceves, O. J. 1997. Evaluación nutricional de lapaja de trigo tratada con el hongo Pleurotusostreatus en ovinos. Tesis de Maestría. Centrode Ganadería. Colegio de Postgraduados. 100 pp
Adamovic, M., Grubic, G., Milenkovic, I., Jovanovic,R., Protic, R., Sretenovic, L. & Stoicevic,L. 1998. The biodegradation of wheat straw byPleurotus ostreatus mushrooms and its use incattle feeding. Anim. Feed Sci. Technol. 71:357
Agosin, E., Monties, B. & Odier, E. 1985. Structuralchanges in wheat straw components during decayby lignin-degrading white-rot fungi in relation toimprovement of digestibility for ruminants. J.Sci. Food Agric. 36:925
Agosin, E., Tollier, M.T., Brillouet, J.M., Thivend,P. & Odier, E. 1986. Fungal pretreatment ofwheat straw: Effects on the biodegradability ofcell walls, structural polysaccharides, lignin andphenolic acids by rumen microorganisms. J. Sci.Food Agric. 37:97
Akin, D.E., Borneman, W.S., Rigsby, L.L. & Martin,S.A. 1993. P-coumaroyl and ferulolylarabinoxylans from plant cell walls as sbstratesfor ruminal bacteria. Appl. Environ. Microbiol.59:644
AOAC 1990. Official Methods of Analysis. Ass.Off. Anal. Chem. 15th Ed. Washigton, D.C.
Apráez, G.J.E. 1989. Evaluación de la digestibilidady paredes celulares de la pulpa de café inoculadacon el hongo Pleurotus ostreatus. Tesis de Maestría.Facultad de Medicina Veterinaria y Zootecnia.División de Estudios de Postgrado. UNAM.México, D. F. 65 pp.
Arora, D.S., Chander, M. & Gill, P.K. 2002.Involvement of lignin peroxidase, manganeseperoxidase and laccase in degradation and selectiveligninolysis of wheat straw. Int. BiodeteriorationBiodegradation 50:115
Bis’ko, N.A. & Bilay, V.T. 1992. The growth ofPleurotus ostreatus on lignocellulosic materials.Micol. Neotrop. Appl. 5:49
Calzada, J.F., de León, R., de Arriola, M.C. & Rolz,C. 1987a. Growth of mushrooms on wheat strawand coffee pulp: Strain selection. BiologicalWastes 20:217
Calzada, J.F., Franco, L.F., de Arriola, M.C., Rolz,C. & Ortiz, M.A. 1987b. Acceptability, body weight changes and digestibility of spent wheatstraw after harvesting of Pleurotus sajor-caju.Biological Wastes 22:303
Chesson, A., Stewart, C.S. & Wallace, R.J. 1982.Influence of plant phenolic acids on growth andcellulolytic activity of rumen bacteria. Appl.Environ. Microbiol. 44:597
Cobos, M.A. 1994. Microbiología del rumen. En:Producción de carne bovina en corrales. Escuelade Medicina Veterinaria y Zootecnia. BeneméritaUniversidad Autónoma de Puebla. Puebla,México. p.165
Cobos, M.A. & Yokoyama, M.Y. 1995. Clostridiumparaputrificum var. Ruminantium: colonisation anddegradation of shrimp carapaces in vitro observedby scanning electron microscopy. En: RumenEcology Research Planning. Proc. of Workshopheld at International Livestock Research Institute.Addis Abeba, Etiopía. Nairobi, Kenya. p. 151
Coronel, R.U. & Martínez, J.S. 1995. Efecto de lainoculación del hongo comestible Pleurotusostreatus sobre el valor nutricional de la pajausada en la alimentación de rumiante. Tesis deLicenciatura. Departamento de Zootecnia.UACH. Chapingo, México. 111 pp
Coronel, R.U. & Ortega, C.M.E. 1998. Effect offeeding barley straw upgraded by Pleurotus insheep. Proc. Nutr. Soc. 57:81A.
Dehority, B.A. & Tirabasso, P.A. 1998. Effect of ruminalcellulolytic bacterial concentrations on in situ digestionof forage cellulose. J. Anim. Sci. 76:2905
Erwin, E.S., Marco, G.J. & Emery, E. 1961. Volatilefatty acid analysis of blood and rumen fluid bygas chromatography. J. Dairy Sci. 44:1768
Ginterová, A. & Lazarová, A. 1987. Degradationdynamics of lignocellulose materials by woodrottingPleourotus fungi. Folia. Microbiol. 32:434
Ginterová, A. & Lazarová, A. 1988. Energytransformation of lignocellulosics into fruit bodiesof the wood-rotting fungus Pleourotus. Folia.Microbiol. 34:141
Harrigan, W.F. & Cance, E.Mc. 1990. Laboratorymethods in food and dairy microbiology. 8th Ed.Harrigan, W.F. (Eds.). Academic Press, GreatBritain. 452 p.
Henics, Z. 1987. Wheat straw upgraded by Pleurotusostreatus. World Rev. Anim. Prod. 23:56
Hofrichter, M. 2002. Review: Lignin conversion bymanganese peroxidase (MnP). EnzymeMicrobial Technol. 30:454
Jalc, D, Zitnan, T. & Nerud, F. 1994. Effect offungus-treated straw on ruminal fermentation invitro. Anim. Feed Sci. Technol. 46:131
Jung, H.G. & Fahey, G.C. 1983. Nutritionalimplications of phenolic monomers and lignin. Areview. J. Anim. Sci. 57:206
Jung, H.G., Valdez, F.R., Abad, A.R., Blanchette,R.A. & Hatfield, R.D. 1992. Effect of white rotbasidiomycetes on chemical composition and invitro digestibility of oat straw and alfalfa stems.J. Anim. Sci. 70:1928
Kapich, A. N., Prior, B. A., Botha, A., Galkin, S.,Lundell, T. & Hatakka, A. 2004. Effect oflignocellulose-containing substrates onproduction of ligninolytic peroxidases insubmerged cultures of Phanerochaetechrysosporium ME-446. Enzyme MicrobialTechnol. 34:187
Karunanandaa, K., Varga, G.A., Akin, D.E., Rigsby,L.L. & Royse, D.J. 1995. Botanical fractions ofrice straw colonized by white-rot fungi: changesin chemical composition and structure. Anim.Feed. Sci. Technol. 55:179
Kerem, Z., Friejem, D. & Hadar, Y. 1992. Lignocellulosedegradation during solid-state fermentation:Pleurotus ostreatus vs Phanerochaete chrysosporium.Appl. Environ. Microbiol. 58:1121
Kishan, S., Ral, S.N., Flegel, T.W. & Neelakantan,S. 1990. Solid substrate fermentation of groundon un-ground wheat straw with Pleurotusostreatus. Indian J. Anim. Sci. 60:1230
Koroleva, O., Gavrilova, P.V., Stepanova, V.E.,Lebedeva, I.V., Sverdlova, N.I., Landesman, O.E.,Yavmetdinov, S.I. & Yarapolov, A.I. 2002.Production of lignin modifying enzymes by cocultivedwhite-rot fungi Cerrena maxima andCoriolus hirsutus and characterization of laccasefrom Cerrena maxima. Enzyme MicrobialTechnol. 30:573
Langar, P.N., Sehgal, J.P. & Garcha, H.S. 1980.Chemical changes in wheat and paddy strawsafter fungal cultivation. Indian J. Anim. Sci.50:942
Leal, L.L. 1982. La importancia del papel de la ligninaen la utilización de los desperdicios agrícolas.Cuadernos de Posgrado. 4. Alimentos. Facultadde Química. Universidad Nacional Autónoma deMéxico. p. 82
López, C.E.A. & González, A. 1997. Cultivo dehongos comestibles (setas). Manual técnico parael cultivo de hongo seta (Pleurotus ostreatus).Programa de capacitación y extensión. Alianzapara el Campo. México.
McCullough, H. 1967. The determination ofammonia in whole blood by direct colorimetricmethod. Clin. Chem. Acta 17:297
Mester, T. & Tien, M. 2000. Oxidation mechanismof ligninolytic enzymes involved in the degradationof environment pollutants. Int. BiodeteriorationBiodegradation. 46:51
Moyson, E. & Verachtert, H. 1991. Growth of higherfungi on wheat straw and their impact on thedigestibility of the substrate. Appl. Microbiol.Biotechnol. 36:421
NRC 1985. Nutrient requirements of sheep. NationalAcademy Press. Washington, D.C. 99 pp
Ortega, C.M.E., Can, A.B., Herrera, P.F. & Pérez-Gil, R.F. 1986. Efecto de la inoculación del hongocomestible Pleurotus ostreatus en la composiciónquímica y digestibilidad de la paja de cebada.Arch. Latinoamer. Nutr. 36:345
Permana, I.G., Mba, C. & Zadrazil, F. 2000. Use ofsugarcane bagasse for mushroom and animal feedproduction. Proc. International Society forMushroom Sci. Congress. Maastricht, TheNetherlands. p. 110
Rao, R. & Naik, D.G. 1990. Influence of two levelsof N and S on the growth and lignolytic ability ofPleurotus ostreatus on wheat and paddy straws.Indian J. Anim. Nutr. 7:71
Ruiz-Dueñas, F.J., Guillen, F., Camarero, S., Perez-Boada, M., Martinez, M.J. & Martinez, A.T.1999. Regulation of peroxidase transcript levelsin liquid cultures of the lignilolytic Pleurotuseryngii. Appl. Environm, Microbiol. 65:4458
SAS 1999. User’s guide statistics. SAS InstituteInc., Cary, NC, USASaparrat, C.N.M., Guillén, F., Arambarri, M.A.,
Martínez, T.A. & Martínez, M.J. 2002.Induction, isolation, and characterization of twolaccases from the white rot basidiomyceteCoriolopsis rigida. Appl. Environ. Microbiol.68:1534
Silanikove, N., Danai, O. & Levanon, D. 1988.Composted cotton straw silage as a sustrate forPleurotus sp. cultivation. Biol. Wastes. 25:219
Tripathi, J.P. & Yadav, J.S. 1992. Optimisation ofsolid sustrate ferementation of wheat straw intoanimal feed by Pleurotus ostreatus: a pilot effort.Anim. Feed Sci. Technol. 37:59
Tsang, L.J., Reid, I.D. & Coxworth, E.C. 1987.Delignification of wheat straw by Pleurotus spp.under mushroom growth conditions. ApplEnviron. Microbiol. 53:1304
Tuomela, M. 2002. Degradation of lignin and other14C-labelled compounds in compost and soilwith an emphasis on white-rot fungi. Academicdissertation in Microbiology. Department ofApplied Chemistry and Microbiology. Divisionof Microbiology. University of Helsinki, Finland.82 p.
Tuomela, M., Vikman, M., Hatakka, A. & Itävaara,M. 2000. Biodegradation of lignin in a compostenvironment: a review. Bioresource Technol.72:169
Van Soest, P.J., Robertson, J.B. & Lewis, B.A. 1991.Methods of dietary fiber, neutral detergent fiberand non-starch polysaccharides in relation toanimal nutrition. J. Dairy Sci. 74:3583
Vélez, H.L. & Cobos, P.M. 1997. Comparación dela digestibilidad in vitro de tres leguminosas entrebacterias cecales de la iguana negra, del conejoy bacterias ruminales. XV Simposio GeneralManuel Cabrera Valtierra. Facultad de MedicinaVeterinaria y Zootecnia, Universidad NacionalAutónoma de México. México, D.F. p. 174
Williams, A.G. & Coleman, G.S. 1992. The rumenprotozoa. Brock/Springer Series inContemporary Bioscience. Springer-Verlag, NewYork, Inc. 439 p.
Yamakawa, M., Abe, H. & Okamoto, M. 1992a.Effect of incubation with edible mushroom,Pleurotus ostreatus, on in vitro degradability ofrice straw. Anim. Sci. Technol. 63:180
Yamakawa, M., Abe, H. & Okamoto, M. 1992b.Effect of incubation with edible mushroom,Pleurotus ostreatus on voluntary intake anddigestibility of rice straw by sheep. Anim. Sci.Technol. 63: 129
Zadrazil, F. 1984. Microbial conversión oflignocellulose into feed. Eds. Sundstol, F. andOven, E. Straw and other fibrous byproducts asfeed. Elsevier. New York. p. 276
Temas relacionados:
Autores:
COLPOS Colegio de Postgraduados - Mexico
Recomendar
Comentar
Compartir
COLPOS Colegio de Postgraduados - Mexico
15 de mayo de 2010
Iván Rodríguez Carrascal Zootecnista UN Medellín Col.
Con respecto a la PAJENIZA, tengo tres preguntas:
1.- Es indispesable medir el pH de la solución? o la ceniza tiene este valor
2.-Podría adicionarsele melaza diluida para hacerla mas palatable?
3.-Comercialmente donde se puede conseguir el hongo y bajo que nombre?
Gracias por el tema tan interesante
Respuesta a las preguntas
no es necesario medir pH no tiene mucho caso.
si pudieras adicionar melaza es claro que aumentaría el consumo por parte de los animales, ademas, te comento que dado que el hongo remueve mucha lignina de la pared celular, la paja se hace polvoza dado que pierde dureza y pues la melaza ayuda mucho a aglutinar la paja.
en Colombia no se quien pueda venderlo comercialmente, pero debe de haber alguien que la venda, es posible también, desarrollar la tecnología para la obtención del micelio para inocular la paja. El nombre comercial de hongo, es setas, oreja de ratón, pero el mas conocido es el de setas.
Recomendar
Responder
COLPOS Colegio de Postgraduados - Mexico
15 de mayo de 2010
Se requiere de una esterilización previa de la paja, esto se hace calentando la paja en agua hasta llevar la temperatura de la misma a 80 grados centígrados por aproximadamente media hora, y posterior a esto se deja enfriar y se procede a realizar el empacado y obvio el cultivo del hongo comestible, evitando con esto que se presente contaminación
Recomendar
Responder
COLPOS Colegio de Postgraduados - Mexico
26 de julio de 2008
El forraje usado como sustrato para el cultivo de setas puede usarse en cualquier animal que consuma forraje, por ejemplo vacas, borregos, caprinos...
Recomendar
Responder
COLPOS Colegio de Postgraduados - Mexico
25 de julio de 2008
Javier...
puedes utilizar cualquier cosa que este compuesta por celulosa, hemicelulosa o lignina...ósea pastos, rastrojos, pajas, papel, cartón, aserrín, etc., la idea principal es general productos de alta calidad a partir de otros de baja calidad.
saludos
Recomendar
Responder
COLPOS Colegio de Postgraduados - Mexico
25 de julio de 2008
Con relación a la pregunta planteada por Emilio Izaguirre le comento que efectivamente los mamíferos o los mono gástricos no cuentan con las enzimas que degraden los carbohidratos estructurales de los vegetales, es por eso que parte del objetivo de esta línea de investigación se basa en la idea de obtener productos de alto valor biológico, como es los hongos comestibles a partir de productos de desecho o de bajo valor nutritivo, es decir, que de productos como las pajas y rastrojos no aprovechables por mamíferos se obtengan productos que puedan ser aprovechados por ellos, y a su vez se mejore la calidad nutritiva de estos subproductos agrícolas y sean mejor utilizados por los rumiantes. El funcionamiento metabólico del hongo a groso modo radica en que este posee enzimas como lacas y peroxidasas que pueden degradar los componentes de la pared celular del los vegetales (celulosa, lignina o hemicelulosa) ya que sus componentes le sirven de nutrientes para su crecimiento y los transforma en cuerpos fructiferos (lo que le llamamos hongos) que son altos en proteina (hasta 30 [percent]) y con un perfil de aminoácidos excelente por lo cual se dice que son de alto valor biológico.
De antemano te comento que acaba de salir el mes pasado otro trabajo sencillo sobre este tema publicado por un servidor lo puedes encontrar en esta dirección http://www.interciencia.org en el numero 6 correspondiente al mes de junio de este año...el trabajo se titula USE OF Pleurotus pulmonarius TO CHANGE THE NUTRITIONAL QUALITY OF WHEAT STRAW. I. EFFECT ON CHEMICAL COMPOSITION que esperemos pongan pronto en este foro.
Recomendar
Responder
COLPOS Colegio de Postgraduados - Mexico
1 de abril de 2008
España
Hola, tengo dos preguntas por si alguien puede contestarme.
Tras la recolección de las setas ¿no se queda la paja demasiado desecha?
Y otra cuestión ¿vale cualquier Pleurotus para poder aprovechar luego la paja como forraje?
En efecto queda así y eso es el indicio de que si existió al parecer una deslignificación del forraje y esta se puede aprovechar mucho mejor dado que al reducir la cantidad de lignina la digestibilidad de este teóricamente se incrementa aunque en el resultado solo fue numéricamente. Al menos en los estudios que existe menciona que los hongos del genero pelurotus puedes degradar cualquier parte de la pared celular vegetal, sin embargo, el pleurotus oestreatus a mostrado mejor degradación de la lignina, aunque debemos de pensar que la idea principal de esto es aprovechar los residuos de cosecha lo mejor posible mediante un método no contaminante y que ademas produzca alimento de alto valor biológico.
Recomendar
Responder
9 de julio de 2011
me gustaria saber si con paja de trigo o cebada se puede alimentar a los cerdos ibericos
Recomendar
Responder
Universidad Nacional De Colombia (UNAL)
15 de mayo de 2010
hola, que tratamientos se le realizan a esa paja de trigo para la esterilizacion y asi evitar posibles contaminaciones con otros tipos de microoorganismos, la contaminacion afecta el producto a obtener o sea los hongos.
Recomendar
Responder
20 de agosto de 2008
Iván Rodríguez Carrascal Zootecnista UN Medellín Col.
Con respecto a la PAJENIZA, tengo tres preguntas:
1.- Es indispesable medir el pH de la solución? o la ceniza tiene este valor
2.-Podría adicionarsele melaza diluida para hacerla mas palatable?
3.-Comercialmente donde se puede conseguir el hongo y bajo que nombre?
Gracias por el tema tan interesante
Recomendar
Responder
25 de julio de 2008
EDUARDO ANDRADE LOPEZ
LIBRES, PUEBLA,
edandradel@hotmail.com
AGRADEZCO A LOS PONENTES la INFORMACIÓN SOBRE Le USO FINAL DEL FORRAJE RESULTANTE DE La PRODUCCION DE SETAS, CONOZCO A ALGUNOS PRODUCTORES QUE El FORRAJE Lo TIRAN DESPUÉS DE La COSECHA, DESCONOCEN El USO QUE Le PUEDEN, Ya QUE SI NO CUENTAN CON OVINOS, PUEDEN VENDERLO Y ASI AUMENTAR SUS INGRESOS ECONÓMICOS.
Recomendar
Responder

¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.





