Intoxicación alimentaria por citrinina
Acción de los fitoreguladores sobre la expresión de la micotoxina citrinina
Publicado: 28 de noviembre de 2020
Por: Prof. Dr. Sergio Paulo Severo de Souza Diniz, Profesor Associado Retirado del Departamento de Bioquímica, Universidad Estadual de Maringá (UEM), Maringá; Paraná; Brasil
INTRODUCCIÓN
En países con climas cálidos, la citrinina plantea un grave problema de intoxicación alimentaria. Esta toxina afecta el sistema renal en los hombres, promoviendo cambios en la membrana mitocondrial. Paralelamente, la citrinina tiene propiedades antifúngicas, inhibiendo también el crecimiento de levaduras, como Saccharomyces cerevisae (Ammar et.al. 2000).
El ácido ascórbico estimula la producción de citrinina por Penicillium citrinum; mientras que la riboflavina inhibe esta producción en un 50% a altas concentraciones. La hidroxilamina y la colchicina inhiben tanto el crecimiento de P. citrinum como la producción de micotoxinas (Giridhar y Reddy,1997b).
Estos mismos autores encontraron que el ácido indolacético (AIA), el ácido indolbutírico (IBA), el ácido naftilacético (ANA) estimulaban la producción de citrinina, mientras que el ácido nicotínico inhibía su producción. Los fitoreguladores ácido indolacético (AIA), ácido indolbutírico (IBA) y 2,4-dinitrofenol (2,4-D), también estimularon el crecimiento de P. citrinum, incluso a bajas concentraciones, mientras que el ácido nicotínico tuvo poco efecto sobre la crecimiento micelial (Giridhar y Reddy, 1997a).
El primer aislamiento de esta micotoxina fue realizado por Hethrington en Londres en 1931. Entre los hongos productores de citrinina se encuentran los siguientes: Aspergillus niveus, Penicillium citrinum, Penicillium canascens, Penicillium citreaviride, Penicillium fallatanum, Penicillium implicatum, Penicillium jensenum velnsenum, , Penicillium steckii y Monascus ruber.
Esta micotoxina es un contaminante natural en trigo, centeno, maíz, cebada y avena. Responsable de parte del problema del arroz amarillo en el Japón de la posguerra.
Problemas causados por la citrinina
Los seres directamente afectados por la contaminación con citrinina son los mamíferos, como hombres, cerdos y perros; y pájaros. Los principales síntomas que presenta la ingestión de esta toxina son: en mamíferos, nefrotoxicosis con polidipsia y poliuria y daño hepático leve, en forma de infiltración grasa. Además de la acción tóxica sobre los riñones que consiste en glomerulonefritis, con deformación y agrandamiento de los túbulos renales. En aves, hipertrofia renal, aumento del consumo de agua, heces acuosas.
En 1995, Jand et al., asociaron la aparición de algunas enfermedades en aves con la presencia de algunas micotoxinas en sus dietas. Entre los cuales, citrininas, aflatoxinas, ocratoxinas y esterigmatocistina; que estaban presentes solos o combinados.
Los efectos de la citrinina sobre las mitocondrias de la corteza renal y el hígado fueron estudiados por Chagas et al.(1995), donde los autores encontraron que esta micotoxina influye en la fluidez de la membrana mitocondrial. La citrinina promueve la reducción de la amplitud del edema en presencia de iones Na+, y esta alteración interfiere con el complejo I de la cadena respiratoria, además de afectar a la enzima ATP sintasa, aunque no afecta a la membrana mitocondrial interna.
El efecto es proporcional a la concentración de citrinina, siendo el tejido renal más susceptible que el tejido hepático. Ribeiro et al.(1998), reportaron la inhibición por citrinina de la peroxidación lipídica mitocondrial, verificando la reversión de este proceso por altas concentraciones de Fe+++.
Mecanismos de expresión de los cítricos
La vía biosintética de producción de citrinina por el hongo Monascus ruber, fue estudiada por Hajjaj et al.(1999). Galtier (1998) encontró que la citrinina y la aflatoxina B-1, la ocratoxina A y la rubratoxina B se unen de forma reversible a las proteínas del plasma sanguíneo, mientras que la zearalenona se une a los componentes de los glóbulos rojos.
En una investigación en Bulgaria informada por Vrabcheva et al. (2000), la presencia de citrinina, en granos de trigo, avena, maíz y cebada a valores máximos de 420 ng / g. Malmstron y colaboradores en 2000; reportaron la producción de citrinina por Penicillium citrinum y P. steckii, además de producir también ácido tanzaváico. La producción de citrinina acompañada de un pigmento rojo soluble en agua se registró en el hongo filamentoso Monascus ruber (Hajjaj et al., 1999, 2000).
Prasad (1998), investigó el efecto de la citrinina y la aflatoxina B-1, en varias combinaciones, sobre la germinación, el crecimiento de las plántulas, los niveles de clorofila, carotenoides, almidón, azúcar, proteínas y ácidos nucleicos en el maíz (Zeamays cv. Suwan ). Los resultados apuntan al potencial inhibidor tanto de la aflatoxina B-1 como de la citrinina en los diferentes parámetros investigados anteriormente, con la excepción del almidón.
Los estudios llevados a cabo por Stormer y Hoiby (1996) con ocratoxina A y citrinina, mostraron que tales toxinas interfieren con el metabolismo del hierro (Fe) en el cuerpo. En la naturaleza, estas dos toxinas podrían afectar la absorción de este elemento de otros microorganismos competidores. La posibilidad de que estas toxinas interfieran con la absorción de hierro podría provocar nefropatía.
La concentración de fosfato y el pH son factores determinantes en la producción de citrinina; así como los aceites de oliva, soja y maíz se pueden utilizar como única fuente de carbono (Pimentel et al., 1996). Los efectos de la citrinina sobre la biosíntesis de pigmentos, proteínas y ácidos nucleicos en semillas de maíz, fue informado por Sinhá y Prasad (1996). La citrinina actuó como reductor o inhibidor parcial del contenido de clorofila, proteínas, carotenoides y ácidos nucleicos. Este efecto depende de la concentración de la toxina.
Características químicas de la citrinina
Tiene fórmula química, C13H14O5. Su nombre químico es: ácido 4,6-dihidro-8-hidroxi-3, 4,5-trimetil-6-oxi-3H-2-benzopiran-7-carboxílico. Tiene un peso molecular de 250,24 g/ mol y punto de fusión de 175ºC. En cuanto a solubilidad, es prácticamente insoluble en agua; soluble en alcohol, dioxano. Demostrando un LD50: 33 a 67 mg/kg para ratas adultas.
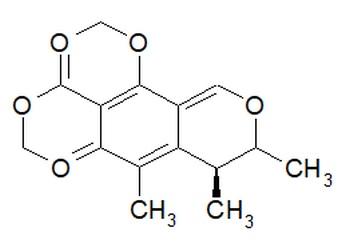
Estructura molecular de citrinina.
Referencias
- Ammar, H.; Michaelis, G.; Lisowsky, T. 2000. A screen of yeast respiratory mutants for sensitivity against the mycotoxin citrinin identifies the vacuolar APTase as an essential factor for the toxicity mechanism. Current Genetics v.37, n.5, p.277-284.
- Chagas, G.M.; Oliveira, M.B.M.; Campello, A. P.; Kluppel, M.L.W. 1995. Mechanism of citrinin-induced dysfunction of mitochondria.3. Effects on renal cortical and liver mitochondrial swelling. J. Apllied Toxicology v.15, n.2, p.91-95.
- Diniz, S.P.S.S. Mycotoxins: Biochemical Approach. Ed. Albatroz, Rio de Janeiro, 2015. 186p.
- Franco, C.M.; Fente, C.A.; Vazquez, B.; Cepeda, A.; Lallaoui, L.; Mahuzier, G. 1996. Sample and sensitive high-performance liquid chromatography fluorescence meted determination of citrinin – Application to the analysis of fungal cultures and cheese extracts. J. Chromatography A v.723, n.1, p.69-75.
- Galtier, P. 1998. Biological fate of mycotoxins in animals. Revue de medecine veterinaire v.149, n.6, p.549-554.
- Giridhar, P; Reddy, S.M. 1997. Influence of vitamins and chemical mutagens on citrinin production by Penicillium citrinum: Study-I. National Acad. Sci. Letters-India v.20, n.5-6, p.59-61, a.
- Giridhar, P; Reddy, S.M. 1997. Effect of growth regulators on citrinin production by Penicillium citrinum: Study-II. National Acad. Sci. Letters-India, v.20, n.5-6, p.62-63, b.
- Hajjaj, H.; Klaébe, A.; Loret, M.O.; Goma, G.; Blanc, P.J.; François, J. 1999. Biosynthetic pathway of citrinin in the filamentous fungus Monascus rubber as revealed by C-nuclear magnetic resonance. Appl. Environ. Microbiol. v. 65, n.1, p.311-314.
- Hajjaj, H.; Klaebe, A.; Goma, G.;Blanc, P.J.; Barbier, E.; Francois, J. Médium-chain fatty acids affect citrinin production in the filamentous fungus Monascus ruber. Appl. Environ. Microbiol. v.66; n.3; p.1120-1125. 2000.
- Jand, S.K.; Singh, P.P.; Singh, A. Observatiions on occurrence of poultry diseases associated with mycotoxins in feed. Indian J. Animal Sci. v. 65, n.10, p.1063-1067, 1995.
- Malmstron, J.; Christophersen, C.; Frisvad, J.C. Secondary metabolites chracteristic of Penicillium citrinum, Penicillium steckii and related species. Phytochemistry v.54; n.3, p.301-309, 2000.
- Pimentel, M.C.B.; Melo, E.H.M.; Lima, J.L.; Duran, N. Production of lípase free of citrinin by Penicillium citrinum . Mycopathologia v.133, n.2, p.119-121,1996.
- Prasad, G. Combined effects of aflatoxin B-1 and citrinin on maize seedlings. Biologia Plantarum v.40, n.3, p.441-447, 1998.
- Ribeiro, S.M.R.; Campello, A.P.; Chagas, G.M.; Kluppel, M.L.W. Mechanism of citrinin-induced dysfunction of mitochondria. VI. Effect on iron-induced lipid peroxidation of rat liver mitochondria and microsomes. Cell Biochemistry and Function v.16, n.1, p. 15-20, 1998.
- Sinhá, K.K. e Prasad, G. Effects of citrinin on pigment, protein and nucleic acid contents in maize seeds. Biologia Plantarum v.38, n.2, p.317-320, 1996.
- Stormer, F.C. e Hoiby, E.A. Citrinin, ochratoxin A and iron. Possible implications for their biological function and induction of nephropathy. Mycopathologia v.134, n.2, p.103-107, 1996.
- Vrabcheva, T.; Usleber, E.; Dietrich, R.; Martlbauer, E. Co-occurrence of ochratoxin A and citrinin in cereals from Bulgarian villages with a history of Balkan endemic nephropathy. J. Agricultural and Food Chemistry v.48, n.6, p.2483-2488. 2000.
spssDiniz – 25/11/2020
Temas relacionados:
Autores:

Recomendar
Comentar
Compartir
7 de abril de 2021
Agradezco infinitamente su gran aportación Dr. Sergio Paulo de Souza Diniz. y su contribución en el cuidado de la salud humana, así como otras especies animales, pero, sobre todo, en afectaciones hepáticas. Saludos especiales desde México.
Recomendar
Responder

¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.
Usuarios destacados en Micotoxinas

José Rodrigo Mendoza
ADM Animal Nutrition
PhD. Investigador / Líder del Laboratorio de Microbiología
Estados Unidos de América
Estados Unidos de América

Maria Arreaza
Alltech
Strategic Initiatives,Client Relations, Business Development
Estados Unidos de América
Estados Unidos de América



