Vitamina D en bovinos y su salud
La vitamina D en la salud y en las patologías del bovino: un enfoque no clásico
La vitamina D es una vitamina liposoluble de relevancia para el ganado lechero, que no solo interviene en la homeostasis del calcio y el metabolismo óseo, sino que además ha sido asociada a la modulación del sistema inmunológico y a la menor incidencia de ciertas patologías del bovino. Las últimas acciones del secoesteroide, referidas como no clásicas, son de más reciente descubrimiento y continúan en estudio. El objetivo de esta revisión bibliográfica fue presentar y analizar los roles de la vitamina D y sus metabolitos en la salud y en las patologías del bovino. Se incluyó una sección sobre los efectos inmunomoduladores y antibacterianos en la glándula mamaria bovina, donde se conoce que la vitamina y sus precursores disminuyen la invasión bacteriana y regulan la expresión de componentes de la respuesta inmunitaria innata. A los fines de contextualizar, también se describe el metabolismo de la vitamina D, la fuente y cuantificación de sus metabolitos en leche y plasma de bovinos, su papel en la nutrición y en la prevención de enfermedades, así como la toxicidad. En conclusión, el estudio de los efectos no clásicos de estos esteroides aporta evidencias que pueden ser utilizadas para diseñar terapias con compuestos naturales para ser aplicadas en animales productores de alimentos.
Palabras clave: vitamina D; bovinos; patologías; inmunomodulador; antimicrobiano
INTRODUCCIÓN
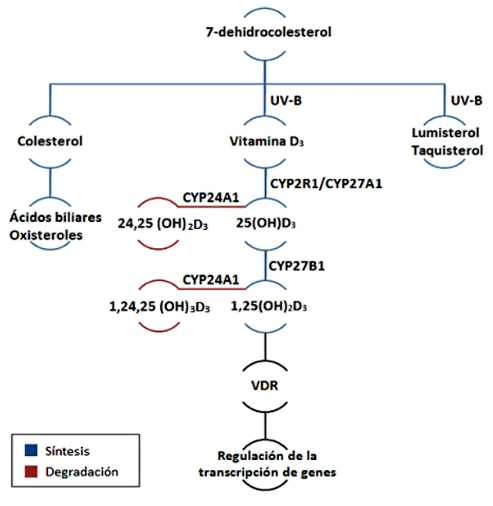
Metabolitos y Metabolismo de la Vitamina D
Niveles de Vitamina D
Suplementación

Funciones Clásicas de la Vitamina D
Funciones No Clásicas de la Vitamina D
Efectos Inmunomoduladores y Antimicrobianos de la Vitamina D en la Glándula Mamaria
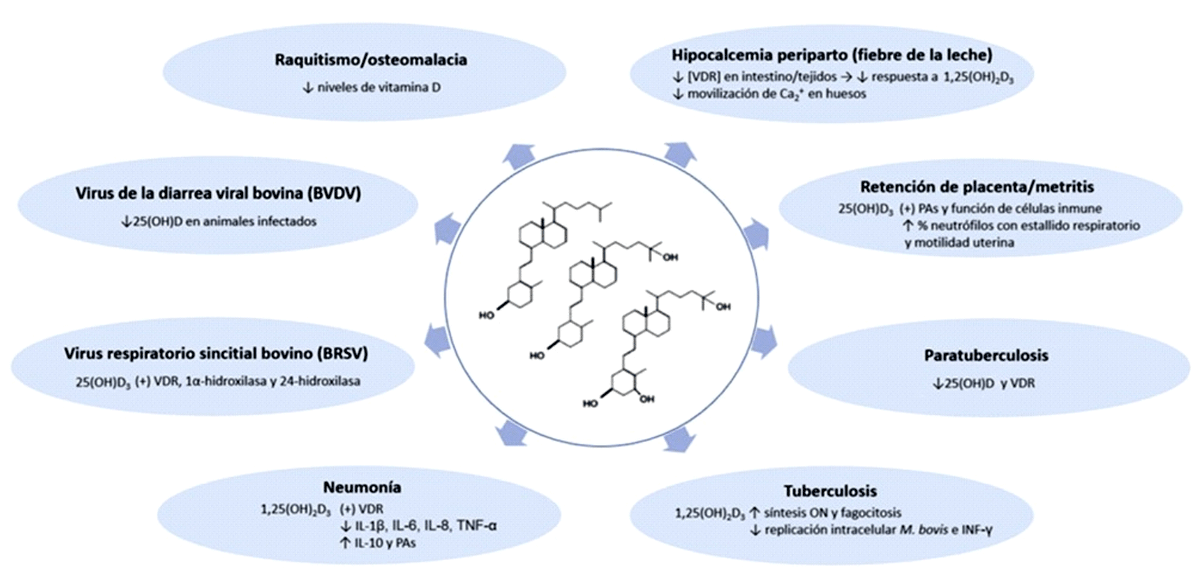
Evidencias que Asocian la Vitamina D con Patologías No Mamarias
CONCLUSIONES
1. Alva-Murillo N, Téllez-Pérez AD, Medina-Estrada I, Álvarez-Aguilar C, Ochoa-Zarzosa A, López-Meza JE. 2014. Modulation of the inflammatory response of bovine mammary epithelial cells bycholecalciferol (vitamin D) during Staphylococcus aureus internalization. Microb Pathogenesis 77: 24-30. doi: 10.1016/j.micpath.2014.10.006.
2. Asgharpour P, Dezfouli MRM, Nadealian MG, Eftekhari Z, Borojeni GRN. 2020. Effects of 1,25-dihydroxy vitamin D3 on clinical symptoms, proinflammatory and inflammatory cytokines in calves with experimental pneumonia. Res Vet Sci 132 186-193. doi: 10.1016/j.rvsc.2020.04.018.
3. Atalla H, Gyles C, Mallard B. 2011. Staphylococcus aureus small colony variants (SCVs) and their role in disease. Anim Health Res Rev 12: 33-45. doi: 10.1017/S1466252311000065.
4. Bandzaite V, Klimiene I, Špakauskas V, Matusevièius A. 2005. Interaction between the levels of hormones and minerals in sera of healthy and sick cows. Pol J Vet Sci 8: 269-274.
5. Barkema HW, Schukken YH, Zadoks RN. 2006. Invited review: The role of cow, pathogen, and treatment regimen in the therapeutic success of bovine Staphylococcus aureus mastitis. J Dairy Sci 89: 1877-1895. doi: 10.3168/jds.S0022-0302(06)72256-1.
6. Bikle D. 2009. Nonclassic actions of vitamin D. J Clin Endocr Metab 94: 26-34. doi: 10.1210/jc.2008-1454
7. Blanco A, Blanco G. 2016. Química Biológica. 10° ed. Buenos Aires, Argentina: El Ateneo. 470 p.
8. Bohl LP, Isaac P, Breser ML, Orellano MS, Correa SG, Tolosa de Talamoni NG, Porporatto C. 2021. Interaction between bovine mammary epithelial cells and planktonic or biofilm Staphylococcus aureus: The bacterial lifestyle determines its internalization ability and the pathogen recognition. Microb Pathogenesis 152:104604. doi: 10.1016/j.micpath.2020.104604.
9. Bouillon R, Bikle D. 2019. Vitamin D metabolism revised: fall of dogmas. J Bone Miner Res 34: 1985-1992. doi: 10.1002/jbmr.3884.
10. Callaby R, Hurst E, Handel I, Toye P, Bronsvoort BM, Mellanby RJ. 2020. Determinants of vitamin D status in Kenyan calves. Sci Rep 10: 20590. doi: 10.1038/s41598-020-77209-5.
11. Celi P, Williams S, Engstrom M, McGrath J, La Marta J. 2018. Safety evaluation of dietary levels of 25 hydroxyvitamin D3 in growing calves. Food Chem Toxicol 111:641-649. doi: 10.1016/j.fct.2017.11.053.
12. Chin SF, Osman J, Jamal R. 2018. Simultaneous determination of 25 hydroxyvitamin D2 and 25-hydroxyvitamin D3 in human serum by ultra performance liquid chromatography: an economical and validated method with bovine serum albumin. Clin Chim Acta 485: 60-66. doi: 10.1016/j.cca.2018.06.024.
13. Commission Implementing Regulation (EU). 2017. Concerning the authorisation of cholecalciferol as a feed additive for all animal species. [Internet]. Disponible en: http://extwprlegs1.fao.org/docs/pdf/eur169214.pdf.
14. DeGaris PJ, Lean IJ. 2008. Milk fever in dairy cows: a review of pathophysiology and control principles. Vet J 176: 58-69. DOI: 10.1016/j.tvjl.2007.12.029.
15. Dittmer KE, Thompson KG. 2011. Vitamin D metabolism and rickets in domestic animals: a review. Vet Pathol 48: 389-407. doi: 10.1177/0300985810375240.
16. Eder K, Grundmann SM. 2022. Vitamin D in dairy cows: metabolism, status and functions in the immune system. Arch Anim Nutr 76: 1-33. doi: 10.1080/1745039X.2021.2017747.
17. EMEA/MRL. 1998. Committee for veterinary medicinal products, vitamin D, summary report. [Internet], Disponible en: https://www.ema.europa.eu/en/documents/mrl-report/vitamin-d-summary-reportcommittee-veterinary-medicinalproducts_en.pdf.
18. Felipe V, Morgante CA, Somale PS, Varroni F, Zingaretti ML, Bachetti RA, Correa SG, et al. 2017. Evaluation of the biofilm forming ability and its associated genes in Staphylococcus species isolates from bovine mastitis in Argentinean dairy farms. Microb Pathogenesis 104: 278-286. doi: 10.1016/j.micpath.2017.01.047.
19. Ferrari D, Lombardi G, Banfi G. 2017. Concerning the vitamin D reference range: pre-analytical and analytical variability of vitamin D measurement. Biochem Medica 27: 030501. doi: 10.11613/BM.2017.030501.
20. Frutis-Murillo M, Sandoval-Carrillo MA, Alva-Murillo N, Ochoa-Zarzosa A, López-Meza JE. 2019. Immunomodulatory molecules regulate adhesin gene expression in Staphylo-coccus aureus: Effect on bacterial internalization into bovine mammary epithelial cells. Microb Pathogenesis 131, 15-21. doi: 10.1016/j.micpath.2019.03.030.
21. García SA. 2018. Fisiología veterinaria. Madrid: Tébar Flores. 720 p.
22. García-Barragán Á, Gutiérrez-Pabello JA, Alfonseca-Silva E. 2018. Calcitriol increases nitric oxide production and modulates microbicidal capacity against Mycobacterium bovis in bovine macrophages. Comp Immunol Microb 59: 17-23. doi: 10.1016/j.cimid.2018.09.001.
23. Gardner RM, Reinhardt TA, Horst RL. 1988. The biological assessment of vitamin D3 metabolites produced by rumen bacteria. J Steroid Biochemist 29: 185-189. doi: 10.1016/0022-4731(88)90264-6.
24. Girgis CM, Brennan-Speranza TC. 2021. Vitamin D and skeletal muscle: current concepts from preclinical studies. JBMR Plus 5: e10575. doi: 10.1002/jbm4.10575.
25. Goff JP, Reinhardt TA, Horst RL. 1991. Enzymes and factors controlling vitamin D metabolism and action in normal and milk fever cows. J Dairy Sci 74: 4022-4032. doi: 10.3168/jds.S00220302(91)78597-4.
26. Goff JP, Reinhardt TA, Horst RL. 1995. Milk fever and dietary cationanion balance effects on concentration of vitamin D receptor in tissue of periparturient dairy cows. J Dairy Sci 78: 2388-2394. doi: 10.3168/jds.S00220302(95)76867-9.
27. Gomes FP, Shaw PN, Whitfield K, Hewavitharana AK. 2015. Simultaneous quantitative analysis of eight vitamin D analogues in milk using liquid chromatography-tandem mass spectrometry. Anal Chim Acta 891: 211-220. doi: 10.1016/j.aca.2015.08.017.
28. Gresham HD, Lowrance JH, Caver TE, Wilson BS, Cheung AL, Lindberg FP. 2000. Survival of Staphylococcus aureus inside neutrophils contributes to infection. J Immunol 164: 3713-3722. doi: 10.4049/jimmunol.164.7.3713.
29. Gunnink JW. 1984. Pre-partum leucocytic activity and retained placenta. Vet Quart 6: 52-54. doi: 10.1080/01652176.1984.9693910.
30. Hajikolaei MRH, Nouri M, Amirabadi SH, Shariari A, Constable PD. 2021. Effect of antepartum vitamin D3 (cholecalciferol) and postpartum oral calcium administration on serum total calcium concentration in Holstein cows fed an acidogenic diet in late gestation. Res Vet Sci 136: 239-246. doi: 10.1016/j.rvsc.2021.02.017.
31. Halasa T, Huijps K, Østerås O, Hogeveen H. 2007. Economic effects of bovine mastitis and mastitis management: a review. Vet Quart 29: 18-31. doi: 10.1080/01652176.2007.9695224.
32. Herrmann M, Farrell CJL, Pusceddu I, Fabregat-Cabello N, Cavalier E. 2017. Assessment of vitamin D status a changing landscape. Clin Chem Lab Med 55: 3-26. doi: 10.1515/cclm-20160264.
33. Hewison M. 2010. Vitamin D and the intracrinology of innate immunity. Mol Cell Endocrinol 321: 103-111. doi: 10.1016/j.mce.2010.02.013.
34. Hibbs JW, Conrad HR. 1983. The relation of calcium and phosphorus intake and digestion and the effects of vitamin D feeding on the utilization of calcium and phosphorus by lactating dairy cows. Ohio Agricultural Research and Development Center. Research Bulletin 1150.
35. Hidiroglou M, Karpinski K. 1989. Providing vitamin D to confined sheep by oral supplementation vs ultraviolet irradiation. J Anim Sci 67: 794-802. doi: 10.2527/jas1989.673794x.
36. Hodnik JJ, Ježek J, Stariè J. 2020. A review of vitamin D and its importance to the health of dairy cattle. J Dairy Res 87: 84-87. doi: 10.1017/S0022029920000424.
37. Holcombe SJ, Wisnieski L, Gandy J, Norby B, Sordillo LM. 2018. Reduced serum vitamin D concentrations in healthy early-lactation dairy cattle. J Dairy Sci 101: 1488-1494. doi: 10.3168/jds.2017-13547.
38. Holick MF, MacLaughlin JA, Doppelt SH. 1981. Regulation of cutaneous previtamin D3 photosynthesis in man: skin pigment is not an essential regulator. Science 211: 590-593. doi: 10.1126/science.6256855.
39. Holick MF. 1981. The cutaneous photosynthesis of previtamin D3: a unique photoendocrine system. J Invest Dermatol 77: 51-58. doi: 10.1111/1523-1747.ep12479237.
40. Holick MF. 2023. The one-hundredyear anniversary of the discovery of the sunshine vitamin d3: historical, personal experience and evidence-based perspectives. Nutrients 15: 593. doi: 10.3390/nu15030593.
41. Hollis BW, Napoli JL. 1985. Improved radioimmunoassay for vitamin D and its use in assessing vitamin D status. Clin Chem 31: 1815-1819.
42. Hollis BW, Roos BA, Draper HH, Lambert PW. 1981. Vitamin D and its metabolites in human and bovine milk. J Nutr 111: 1240-1248. doi: 10.1093/jn/111.7.1240.
43. Horst RL, Goff JP, Reinhardt TA. 1990. Advancing age results in reduction of intestinal and bone 1,25-dihydroxyvitamin D receptor. Endocrinology 126: 1053-1057. doi: 10.1210/endo-126-21053.
44. Horst RL, Goff JP, Reinhardt TA. 1994. Calcium and vitamin D metabolism in the dairy cow. J Dairy Sci 77: 1936-1951. doi: 10.3168/jds.S00220302(94)77140-X.
45. Horst RL, Goff JP, Reinhardt TA. 1997. Calcium and vitamin D metabolism during lactation. J Mammary Gland Biol 2: 253-263.
46. Horst RL, Littledike ET. 1982. Comparison of plasma concentrations of vitamin D and its metabolites in young and aged domestic animals Comp Biochem Phys B 73: 485-489. doi: 10.1016/0305-0491(82)90064-5.
47. Horst RL, Reinhardt TA. 1983. Vitamin D metabolism in ruminants and its relevance to the periparturient cow. J Dairy Sci 66: 661-678. doi: 10.3168/jds.S0022-0302(83)81844-X.
48. Hymøller L, Jensen SK. 2010. Vitamin D(3) synthesis in the entire skin surface of dairy cows despite hair coverage. J Dairy Sci 93: 2025-2029. doi: 10.3168/jds.2009-2991.
49. Ismailova A, White JH. 2022. Vitamin D, infections and immunity. Rev Endocr Metab Dis 23: 265-277. doi: 10.1007/s11154-021-09679-5.
50. Jäpelt RB, Didion T, Smedsgaard J, Jakobsen J. 2011. Seasonal variation of provitamin D2 and vitamin D2 in perennial ryegrass (Lolium perenne L.). J Agr Food Chem 59: 10907-10912. doi: 10.1021/jf202503c.
51. Jones G, Prosser DE, Kaufmann M. 2014. Cytochrome P450-mediated metabolism of vitamin D. J Lipid Res 55:13-31. doi: 10.1194/jlr.R031534.
52. Kasalová E, Aufartová J, Krèmová LK, Solichová D, Solich P. 2015. Recent trends in the analysis of vitamin D and its metabolites in milk -a review. Food Chem 171: 177-190. doi: 10.1016/j.foodchem.2014.08.102.
53. Keane OM. 2019. Symposium review: Intramammary infections -Major pathogens and strain-associated complexity. J Dairy Sci 102: 4713-4726. doi: 10.3168/jds.2018-15326.
54. Keefe G. 2012. Update on control of Staphylococcus aureus and Streptococcus agalactiae for management of mastitis. Vet Clin N Am-Food A 28:203-216. doi: 10.1016/j.cvfa.2012.03.010.
55. Kimura K, Goff JP, Kehrli ME, Reinhardt TA. 2002. Decreased neutrophil function as a cause of retained placenta in dairy cattle. J Dairy Sci 85: 544-550. doi: 10.3168/jds.S0022-0302(02)74107-6.
56. Klein GB. 2014. Cunningham. Fisiología Veterinaria. 5a ed. Barcelona: Elsevier Health Sciences. 656 p.
57. Kurjogi M, Issa Mohammad YH, Alghamdi S, Abdelrahman M, Satapute P, Jogaiah S. 2019. Detection and determination of stability of the antibiotic residues in cow's milk. PLoS One 14: e0223475. doi: 10.1371/journal.pone.0223475.
58. Lean IJ, Degaris PJ, Celi P, Mcneill DM, Rodney RM, Fraser DR. 2014. Influencing the future: Interactions of skeleton, energy, protein and calcium during late gestation and early lactation. Anim Prod Sci 54: 1177-1189.
59. Lean IJ, DeGaris PJ, McNeil DM, Block E. 2006. Hypocalcemia in dairy cows: meta-analysis and dietary cation-anion difference theory revisited. J Dairy Sci 89: 669-684. doi: 10.3168/jds.S00220302(06)72130-0.
60. Lippolis JD, Reinhardt TA, Sacco RA, Nonnecke BJ, Nelson CD. 2011. Treatment of an intramammary bacterial infection with 25-hydroxyvitamin D(3). PloS One 6: e25479. doi: 10.1371/journal.pone.0025479.
61. Littledike E, Horst R. 1980. Problems with vitamin D injections for prevention of milk fever: toxicity of large doses and increased incidence of small doses. J Dairy Sci 63: 89.
62. Machado M, Castro MB, Gimeno EJ, Barros SS, Riet-Correa F. 2020. Enzootic calcinosis in ruminants: A review. Toxicon 187: 1-9. doi: 10.1016/j.toxicon.2020.08.009.
63. Makris K, Sempos C, Cavalier E. 2020. The measurement of vitamin D metabolites: part I-metabolism of vitamin D and the measurement of 25 hydroxyvitamin D. Hormones 19: 81-96. doi: 10.1007/s42000-019-00169-7.
64. Martinez N, Risco CA, Lima FS, Bisinotto RS, Greco LF, Ribeiro ES, Maunsell F, et al. 2012. Evaluation of peripartal calcium status, energetic profile, and neutrophil function in dairy cows at low or high risk of developing uterine disease. J Dairy Sci 95: 7158-7172. doi: 10.3168/jds.2012-5812.
65. Martinez N, Rodney RM, Block E, Hernandez LL, Nelson CD, Lean IJ, Santos JEP. 2018. Effects of prepartum dietary cation-anion difference and source of vitamin D in dairy cows: health and reproductive responses. J Dairy Sci 101: 2563-2578. doi: 10.3168/jds.201713740.
66. Mawer EB, Backhouse J, Holman CA, Lumb GA, Stanbury SW. 1972. The distribution and storage of vitamin D and its metabolites in human tissues. Clin Sci 43: 413-431. doi: 10.1042/cs0430413
67. Maxie MG. 2016. Jubb, Kennedy & Palmer's Pathology of domestic animals. 6th ed. USA: Elsevier. 798 p.
68. McDermott CM, Beitz DC, Littledike ET, Horst RL. 1985. Effects of dietary vitamin D3 on concentrations of vitamin and its metabolites in blood plasma and milk of dairy cows. J Dairy Sci 68: 1959-1967. doi: 10.3168/jds.S0022-0302(85)81057-2.
69. McGrath BA, Fox PF, McSweeney PL, Kelly AL. 2016. Composition and properties of bovine colostrum: a review. Dairy Sci Technol 96: 133-158.
70. Mello JRB. 2003. Calcinosis-calcinogenic plants. Toxicon 41: 1-12. doi: 10.1016/s0041-0101(02)00241-6.
71. Merriman KE, Poindexter MB, Kweh MF, Santos JEP, Nelson CD. 2017. Intramammary 1,25-dihydroxyvitamin D3 treatment increases expression of host-defense genes in mammary immune cells of lactating dairy cattle. J Steroid Biochem 173: 33-41. doi: 10.1016/j.jsbmb.2017.02.006.
72. Merriman KE, Powell JL, Santos JEP, Nelson CD. 2018. Intramammary 25hydroxyvitamin D3 treatment modulates innate immune responses to endotoxininduced mastitis. J Dairy Sci 101: 7593-7607. doi: 10.3168/jds.2017-14143.
73. Michigami T. 2017. Update on recent progress in vitamin D research. Vitamin D metabolism and its regulation. Clin Calcium 27:1517-1523.
74. Mizokami A, Kawakubo-Yasukochi T, Hirata M. 2017. Osteocalcin and its endocrine functions. Biochem Pharmacol 132: 1-8. doi: 10.1016/j.bcp.2017.02.001.
75. [NRC] National Research Council. 2001. Nutrient requirements of dairy cattle. [Internet]. Disponible en: https://profsite.um.ac.ir/~kalidari/software/NRC/HELP/NRC%202001.pdf.
76. Nelson CD, Lippolis JD, Reinhardt TA, Sacco RE, Powell JL, Drewnoski ME, O'Neil M, et al. 2016. Vitamin D status of dairy cattle: outcomes of current practices in the dairy industry. J Dairy Sci 99: 10150-10160. doi: 10.3168/jds.2016-11727.
77. Nelson CD, Reinhardt TA, Beitz DC, Lippolis JD. 2010. In vivo activation of the intracrine vitamin D pathway in innate immune cells and mammary tissue during a bacterial infection. PloS One 5: e15469. doi: 10.1371/journal.pone.0015469.
78. Nelson CD, Reinhardt TA, Lippolis JD, Sacco RE, Nonnecke BJ. 2012. Vitamin D signaling in the bovine immune system: a model for understanding human vitamin D requirements. Nutrients 4: 181-196. doi: 10.3390/nu4030181.
79. Nonnecke BJ, McGill JL, Ridpath JF, Sacco RE, Lippolis JD, Reinhardt TA. 2014. Acute phase response elicited by experimental bovine diarrhea virus (BVDV) infection is associated with decreased vitamin D and E status of vitamin-replete preruminant calves. J Dairy Sci 97: 5566-5579. doi: 10.3168/jds.2014-8293.
80. Oliveira M, Bexiga R, Nunes SF, Carneiro C, Cavaco LM, Bernardo F, Vilela CL. 2006. Biofilm-forming ability profiling of Staphylococcus aureus and Staphylococcus epidermidis mastitis isolates. Vet Microbiol 118: 133-140. doi: 10.1016/j.vetmic.2006.07.008.
81. Oliver SP, Murinda SE. 2012. Antimicrobial resistance of mastitis pathogens. Vet Clin N Am-Food A 28:165-185. doi: 10.1016/j.cvfa.2012.03.005.
82. Prabhu AV, Luu W, Li D, Sharpe LJ, Brown AJ. 2016. DHCR7: A vital enzyme switch between cholesterol and vitamin D production. Prog Lipid Res 64: 138-151.
83. Qamar MU, Aatika Chughtai MI, Ejaz H, Mazhari BBZ, Maqbool U, Alanazi A, et al. 2023. Antibiotic resistant bacteria, antimicrobial resistance genes, and antibiotic residue in food from animal sources: one health food safety concern. Microorganisms 11:161. doi: 10.3390/microorganisms11010161.
84. Rainard P. 2003. The complement in milk and defence of the bovine mammary gland against infections. Vet Res 34: 647-670. doi: 10.1051/vetres:2003025.
85. Ramagopalan SV, Heger A, Berlanga AJ, Maugeri NJ, Lincoln MR, Burrell A, Handunnetthi L, et al. 2010. A ChIP-seq defined genome-wide map of vitamin D receptor binding: associations with disease and evolution. Genome Res 1352-1360. doi: 10.1101/gr.107920.110.
86. Riollet C, Rainard P, Poutrel B. 2000. Cells and cytokines in inflammatory secretions of bovine mammary gland. Adv Exp Med Biol 480: 247-258. doi: 10.1007/0-306-46832-8_30.
87. Rossi BF, Bonsaglia ECR, Castilho IG, Dantas STA, Salina A, Langoni H, Pantoja JCF, et al. 2019. Genotyping of long term persistent Staphylococcus aureus in bovine subclinical mastitis. Microb Pathogenesis 132: 45-50. doi: 10.1016/j.micpath.2019.04.031.
88. Sacco RE, Nonnecke BJ, Palmer MV, Waters WR, Lippolis JD, Reinhardt TA. 2012. Differential expression of cytokines in response to respiratory syncytial virus infection of calves with high or low circulating 25-hydroxyvitamin D3. PloS One 7: e33074. doi: 10.1371/journal.pone.0033074.
89. Schmid A, Walther B. 2013. Natural vitamin D content in animal products. Adv Nutr 4: 453-462. doi: 10.3945/an.113.003780.
90. Serrano Díaz N, Guío E, González A, Paredes LP, Cristina D, Lesmes Q, Becerra S. 2017. Cuantificación de vitamina D: de la investigación a la práctica clínica. Biosalud 16: 67-79.
91. Sommerfeldt JL, Napoli JL, Travis Littledike E, Beitz DC, Horst RL. 1983. Metabolism of orally administered [3H] ergocalciferol and [3H] cholecalciferol by dairy calves. J Nutr 113: 2595-2600. doi: 10.1093/jn/113.12.2595.
92. Sordillo LM. 2018. Mammary gland immunobiology and resistance to mastitis. Vet Clin N Am-Food A 34: 507-523. doi: 10.1016/j.cvfa.2018.07.005.
93. Sorge US, Molitor T, Linn J, Gallaher D, Wells SW. 2013. Cow-level association between serum 25-hydroxyvitamin D concentration and Mycobacterium avium subspecies par tuberculosis antibody seropositivity: a pilot study. J Dairy Sci 96: 1030-1037. doi: 10.3168/jds.2012-5929.
94. Stabel JR, Reinhardt TA, Hempel RJ. 2019. Short communication: Vitamin D status and responses in dairy cows naturally infected with Mycobacterium avium ssp paratuberculosis. J Dairy Sci 102: 1594-1600. doi: 10.3168/jds.201815241.
95. Téllez-Pérez AD, Alva-Murillo N, Ochoa-Zarzosa A, López-Meza JE. 2012. Cholecalciferol (vitamin D) differentially regulates antimicrobial peptide expression in bovine mammary epithelial cells: implications during Staphylococcus aureus internalization. Vet Microbiol 160: 91-98. doi: 10.1016/j.vetmic.2012.05.007.
96. Thompson KG, Cook TG. 1987. Rickets in yearling steers wintered on a swede (Brassica napus) crop. New Zeal Vet J 35: 11-13. doi: 10.1080/00480169.1987.35360.
97. Tiraboschi G, Isaac P, Breser ML, Porporatto C, Bohl LP. 2021. Vitamina D (calcitriol) estimula la fagocitosis de Staphylococcus spp aislados de bovinos con mastitis. Rev Med Vet (B. Aires) 101(2).
98. Tomkins NW, Elliott R, McGrath JJ, Schatz T, Tomkins NW, Elliott R, McGrath JJ, Schatz T. 2020. Managing plasma P concentrations in beef heifers with a slow release vitamin D supplementation. Anim Prod Sci 60: 610-617. doi: 10.1071/AN17601.
99. Van Mosel M, Van't Klooster AT, Van Mosel F, Van Der Kuilen J. 1993. Effects of reducing dietary [(Na+ + K+) (Cl-+ SO4=)] on the rate of calcium mobilisation by dairy cows at parturition. Res Vet Sci 54: 1-9. doi: 10.1016/00345288(93)-90002-w.
100. Vanderhaeghen W, Piepers S, Leroy F, Van Coillie E, Haesebrouck F, De Vliegher S. 2015. Identification, typing, ecology and epidemiology of coagulase negative staphylococci associated with ruminants. Vet J 203: 44-51. doi: 10.1016/j.tvjl.2014.11.001.
101. Vieira-Neto A, Negro G, Zimpel R, Poindexter M, Lopes F, Thatcher WW, Nelson CD, et al. 2021. Effects of injectable calcitriol on mineral metabo-lism and postpartum health and performance in dairy cows. J Dairy Sci 104: 683-701. doi: 10.3168/jds.202018448.
102. Voyich JM, Braughton KR, Sturdevant DE, Whitney AR, Saïd-Salim B, Porcella SF, Long RD, et al. 2005. Insights into mechanisms used by Staphylococcus aureus to avoid destruction by human neutrophils. J Immunol 175: 3907-3919. doi: 10.4049/jimmunol.175.6.3907.
103. Wasserman RH. 1975. Active vitamin D-like substances in Solanum malacoxylon and other calcinogenic plants. Nutr Rev 33: 1-5. doi: 10.1111/j.17534887.1975.tb07074.x.
104. Waters WR, Nonnecke BJ, Rahner TE, Palmer MV, Whipple DL, Horst RL. 2001. Modulation of Mycobacterium bovis-specific responses of bovine peripheral blood mononuclear cells by 1,25-dihydroxyvitamin D(3). Clin Diagn Lab Immun 8: 1204-1212. doi: 10.1128/CDLI.8.6.1204-1212.2001.
105. Webster J. 2020. Understanding the 3th dairy cow. ed. Bristol: Wiley Blackwell. 140 p.
106. Weir RR, Strain JJ, Johnston M, Lowis C, Fearon AM, Stewart S, Pourshahidi LK. 2017. Environmental and genetic factors influence the vitamin D content of cows' milk. P Nutr Soc 76: 76-82. doi: 10.1017/S0029665116000811.
107. Wen G, Eder K, Ringseis R. 2020. 1,25-hydroxyvitamin D3 decreases endoplasmic reticulum stress-induced inflammatory response in mammary epithelial cells. PloS One 15: e0228945. doi: 10.1371/journal.pone.0228945.
108. Wilkens MR, Oberheide I, Schröder B, Azem E, Steinberg W, Breves G. 2012. Influence of the combination of 25-hydroxyvitamin D3 and a diet negative in cation-anion difference on peripartal calcium homeostasis of dairy cows. J Dairy Sci 95: 151-164. doi: 10.3168/jds.2011-4342.
109. Yue Y, Hymøller L, Jensen SK, Lauridsen C, Purup S. 2017. Effects of vitamin D and its metabolites on cell viability and Staphylococcus aureus invasion into bovine mammaryepithelial cells. Vet Microbiol 203: 245-251. doi: 10.1016/j.vetmic.2017.03.008.
110. Yue Y, Hymøller L, Jensen SK, Lauridsen C. 2018. Effect of vitamin D treatments on plasma metabolism and immune parameters of healthy dairy cows. Arch Anim Nutr 72: 205-220. doi: 10.1080/1745039X.2018.1448564.
111. Zempleni J, Rucker RB, McCormick DB, Suttie JW. 2007. Handbook of vitamins. 4th ed. Florida, USA: Elsevier . 605 p.
112. Zerwekh JE. 2008. Blood biomarkers of vitamin D status. Am J Clin Nutr 87: 1087S-1091S. doi: 10.1093/ajcn/87.4.1087S.


Luis Fernando Londoño Franco

Saludos Lucana y Carna. Por su trabajo de Investigación y por compartirlo con Nosotros. Por muchos años he utilizado la Vitamina AD3-E.en vacas secas al secado y repetirla.s la vas presenta una baja condición corporal, esto lo hago un mes antes del parto. La Vitamina D.,tratando de evitar problemas de hipocalcemia al parto. Me gustara su opinión al respecto y en segundo lugar que ampliarán lo referente a la acción de la Vitamina D, en mejorar la inmunologia, en problemas de mastitis en las vacas lactantes y secas. Saludos