Degradación ruminal del almidón
Publicado: 25 de agosto de 2017
Por: G.D. MENDOZA M., L.A. MIRANDA R., P.A. HERNÁNDEZ G.
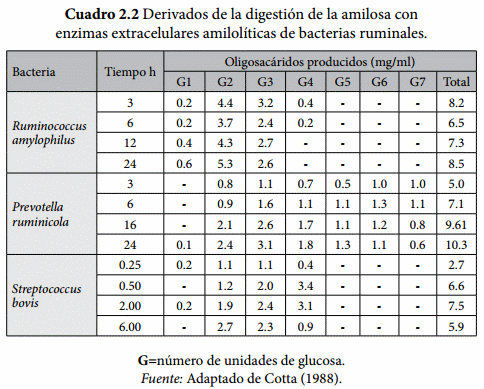
La hidrólisis del almidón en el rumen es fundamentalmente microbiana como resultado de diversas enzimas amilolíticas (Cuadro 2.1). Durante la degradación del almidón por parte de los microorganismos se producen cantidades diversas de glucosa y oligosacáridos derivados de la maltosa [α-d-glucopiranosil (1→4) α-d-glucopiranosa] como la maltotriosa (3 glucosas), maltotetraosa (4 glucosas), maltopentosa (5 glucosas), maltohexosa (6 glucosas) y maltoheptosa (7 glucosas) (Baldwin y Allison, 1983; Cotta, 1988; Cuadro 2.2); así como α dextrinas las cuales son oligosacáridos ramificados que contienen de uno a tres enlaces α-(1→6), uno o más enlaces adyacentes α-(1→4) y una mezcla heterogénea con grados de polimerización de 4 a 19 glucosas. Los resultados de investigación obtenidos por Cotta (1988), demuestran que la cantidad y tipo de oligosacárido derivado de la actividad amilolítica de enzimas extraídas de las principales especies microbianas del rumen, varía de acuerdo al tiempo de incubación y la especie bacteriana involucrada (Cuadro 2.2).
Entre los principales microorganismos amilolíticos del rumen se encuentran: Ruminobacter amylophilus (anteriormente clasificado como Bacteroides amylophilus), Prevotella ruminicola (denominado anteriormente como Bacteroides ruminicola), Streptococcus bovis, Succinomonas amylolytica y los protozoarios del rumen. El hongo ruminal Neocallimastix frontalis tiene una alfa amilasa; sin embargo, su importancia en la digestión del almidón es desconocida (Mountfort y Asher, 1988).

Los productos que resultan de la incubación de la amilosa con bacterias amilolíticas, indican que las bacterias poseen endoamilasas con actividad similar a la de α-amilasa. La liberación de glucosa sugiere que la enzima glucoamilasa se encuentra presente (Cotta, 1988). La α-amilasa es una endohidrolasa que rompe predominantemente los enlaces glucosídicos α-(1→4) de los polisacáridos y que producen oligosacáridos de bajo peso molecular. La glucoamilasa es un exohidrolasa que incide principalmente en los enlaces α-(1→4) en el grupo no reductor al final de la cadena de almidón y de los fragmentos (oligosacáridos) de almidón producidos por la acción hidrolítica de la α-amilasa. La glucoamilasa también desdobla de forma limitada enlaces α-(1→6). La enzima α-amilasa hidroliza aleatoriamente; mientras que la β-amilasa lo hace en forma escalonada en enlaces alternos, con lo que se libera maltosa de las cadenas lineales del almidón. La β-amilasa es una exohidrolasa que actúa en el grupo final no reductor de la molécula (Reilly, 1985). La β-amilasa no puede hidrolizar o sobrepasar los enlaces α-(1→6), que dan origen a ramificaciones en las cadenas de almidón (Manners, 1989), por lo que la presencia de ramificaciones inhibe la acción de la β-amilasa y limita la extensión de la degradación del almidón (Chesson y Forsberg, 1988).
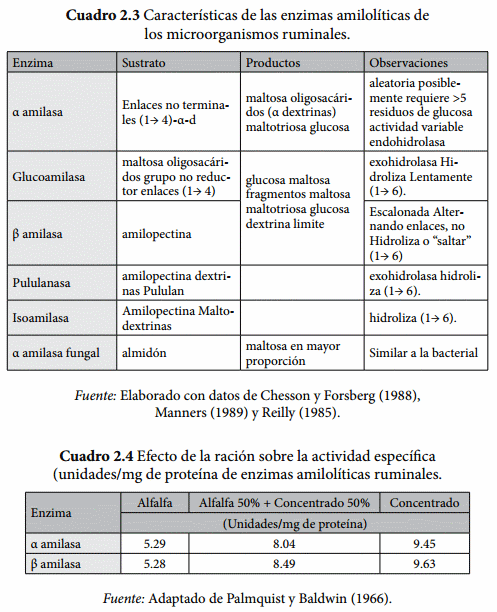
Las enzimas desramificadoras hidrolizan el enlace glucosídico (α-1→6) entre las cadenas de la amilopectina (Manners, 1989). La pululanasa es una enzima de este tipo, y ha sido aislada en Prevotella ruminicola 118B por Thurn y Kotarski (1987) (Cuadro 2.3).
Referente a los protozoarios del rumen, los estudios de Coleman (1986) mostraron que varias especies de protozoarios ruminales poseen alfa amilasa y que Entodinium caudatum presenta la mayor actividad amilolítica. Mould y Thomas (1958) encontraron α y β-amilasa en protozoarios holotricos. Las α-amilasas aisladas en Isotricha sp y Dasytricha sp tienen diferente pesos moleculares, puntos isoeléctricos y pH’s óptimos de actividad. Otros investigadores (Mould y Thomas, 1958) también detectaron una enzima R en protozoarios holotricos. La enzima R descrita en algunos estudios de los años cincuenta se ha identificado ahora como dextrinasa (Manners, 1989).
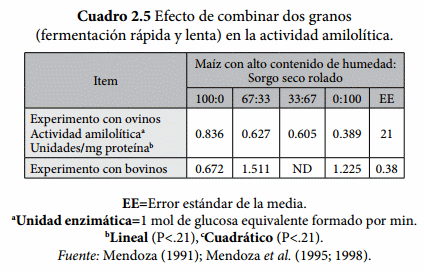
La actividad específica de las enzimas microbianas puede ser modificada por el tipo de dieta. Palmquist y Baldwin (1966) encontraron una mayor actividad amilolítica de células lavadas cuando se incrementó el concentrado en la dieta (Cuadro 2.4). La actividad amilolítica in vitro de protozoarios es mayor en medios de cultivo con almidón que con forrajes (Coleman, 1986). Existe poca información acerca de los cambios de la actividad amilolítica debido al uso de diferentes granos. Mendoza et al. (1995; 1999) evaluaron la actividad enzimática amilolítica por efecto de dos granos solos o combinados (Cuadro 2.5); maíz con alto contenido de humedad, caracterizado por contener almidón de tasa de fermentación rápida y; sorgo seco rolado, cuyo almidón se fermenta lentamente en el rumen (Britton y Stock, 1986). En términos generales Mendoza (1991) observo una mayor actividad amilolítica con la combinación de grano que en los granos solos. De hecho, se ha observado que los rumiantes tienen un mejor comportamiento productivo en los corrales de engorda, cuando son alimentados con una combinación de granos de distinta fermentación (Stock et al., 1987 a, b), lo cual puede estar asociado a los cambios en la actividad amilolítica.
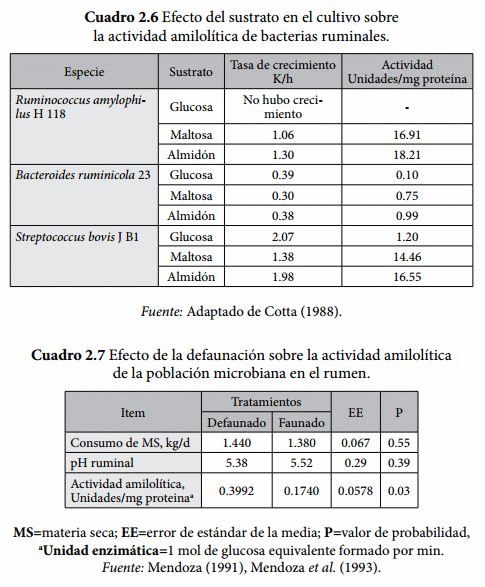
Estudios microbiológicos conducidos por Cotta (1988) mostraron la actividad amilolítica de especies de Bacteroides (actualmente clasificado como Prevotella), Ruminobacter y Streptococcus, fue modificada por el tipo de carbohidrato en el cultivo y la tasa de crecimiento microbiana (Cuadro 2.6). Dicha actividad fue menor en el medio en cuya fuente de carbono fue la glucosa y fue mayor en el medio con almidón o maltosa. Hobson y Summers (1967) demostraron que la actividad de la amilasa de Ruminococcus amylophilus tiene dos máximos de acuerdo con tasa de crecimiento pero la actividad máxima de amilasa se registró a un pH de 6.1 en cultivos con 1.11 mg de bacterias secas/mL.
La presencia o ausencia de protozoarios el rumen puede modificar la actividad amilolítica. Mendoza et al. (1993) reportaron que la actividad amilolítica es menor en ovinos faunados (Cuadro 2.7), lo cual se ve reflejado en una menor digestión ruminal del almidón y una menor caída del pH ruminal post-alimentación. Esto último implicaría que los protozoarios están involucrados en la regulación del pH ruminal y en la reducción del riesgo de que dietas altas en granos induzcan una acidosis subaguda.
La determinación de la actividad amilolítica de los protozoarios tiene el inconveniente de no poder diferenciar la actividad enzimática propia del protozoario de la de enzimas intracelulares de las bacterias que han sido consumidas por el protozoario (Chesson y Forsberg, 1988); de hecho las estimaciones de la actividad amilolítica de ciliados separados mostró resultados contrarios a los observados in vivo (Mendoza y Britton, 1990).
En estudios sobre la actividad amilolítica del fluido extracelular e intracelular, Cotta (1988) observó que la localización de la amilasa en las bacterias podría variar con el sustrato usado en el medio; sin embargo, en esos estudios no fue posible dilucidar si la actividad de la enzima detectada en el líquido extracelular se debía a la producción extracelular o a la lisis bacteriana (Anderson y Salyers, 1989a). Sin embargo, estudios realizados con líquido ruminal de animales alimentados con dietas altas en grano, indican que la mayor actividad amilolítica puede ser intracelular o asociada a la membrana (Mendoza y Britton, 1991).
Estudios realizados por Anderson y Salyers (1989 ab) con Bacteroides thetaiotaomicron, indican que la mayoría de las enzimas amilolíticas están asociadas a la célula y no son extracelulares, y otras enzimas como la α-glucosidasa y la maltasa se localizan en el citoplasma. La presencia de enzimas ligadas a la célula ha sido demostrada en algunas bacterias ruminales. Streptococcus bovis posee dos amilasas ligadas y una amilasa extracelular que es liberada durante el crecimiento (Walker, 1965). Entre 80 y 90% de la actividad de la pululanasa y la amilasa en Prevotella ruminicola 118B corresponde a enzimas ligadas a la célula (Thurn y Kotarski, 1987).
Anderson y Salyers (1989b) encontraron que células de Bacteroides thetaiotaomicron ligaban almidón radiactivo. Esta actividad mostraba una cinética de saturación y se reducía por el tratamiento con proteinasa K. Por lo tanto, los autores plantearon la hipótesis de que existe una proteína ligadora de almidón en la superficie de la célula. La actividad ligadora del almidón y la actividad amilolítica fueron estimuladas por maltosa y se presume que ambas están controladas por los mismos genes en la bacteria.
Anderson y Slyers (1989b) sugieren que la adherencia al almidón por Bacteroides thetaiotaomicron, podría ser el primer paso en la utilización del almidón. En términos generales, las especies de bacterias son muy similares en su metabolismo y comparten propiedades comunes entre miembros del mismo género. Por lo tanto, es posible que existan sitios específicos de adherencia en Bacteroides ruminales similares a los descritos en las bacterias del colon. Sin embargo, esta actividad no ha sido estudiada en bacterias ruminales y es posible que la adherencia al almidón sea resultado de propiedades de la enzima.
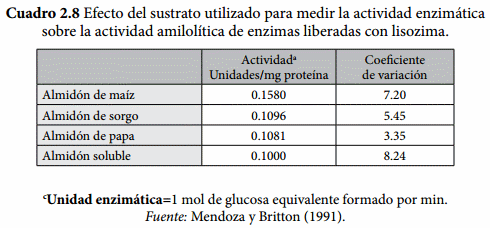
En estudios realizados con enzimas amilolíticas liberadas con lisozima (Mendoza, 1991) se encontró una mayor actividad amilolítica al usar almidón de maíz, comparado con almidón purificado de sorgo, de papa o soluble (Cuadro 2.8); sin embargo, esta mayor actividad estaba relacionada a un mayor contenido de azúcares reductores iniciales, por lo que se considera ésta fue una fuente de error en las estimaciones de actividad amilolítica, y se recomienda utilizar almidón de papa debido a su bajo contenido inicial de azúcares reductores que resultan en menor variación (Mendoza y Britton, 1991).
Las herramientas de biología molecular están ahora permitiendo conocer mejor las enzimas y los genes que los codifican, por ejemplo de origen microbiano se han identificado en Butyrivibrio fibrisolvens endoglucanasas (genes H17c endI; A46 celA) una Cellodextrinasa (gen H17c cedI), una b-Glucosidasa (gen H17c bg1A) y una enzima ramificadora de glucógeno (gen H17c glgB). En Prevotella ruminicola se ha identificado una endoglucanasas (gen AR20 celA) y en Streptococcus bovis una amilasa (gen amyA). En los hongos se han encontrado endoglucanasas Neocallimastix frontalis (gen MCH3 celA), N. patriciarum (gen celB) y Orpinomyces joyonii (gen celA) y en el protozoario Epidinium ecaudatum una endoglucanasas (gen epi3) (Selinger et al., 1996).
A pesar de que en el campo de microbiología y enzimática ruminal hay pocos estudios, experimentos con Bacteroides thetaiotaomicron en co-cultivo con otros microorganismos muestran que se pueden potenciar las actividades enzimáticas de una u otra bacteria en co-cultivo (Sonnenburg et al., 2006), lo cual es algo que se debe de explorar en microorganismos ruminales.
Este conocimiento es importante dado que la digestión del almidón en el rumen de muchos granos es incompleta y será necesaria la manipulación de la actividad enzimática o la adición de otras enzimas exógenas hidrolíticas con actividad excepcional o especificidad, en los pasos clave de digestión limitante en la hidrólisis del almidón. Los avances en la tecnología de adn recombinante facilitará la incorporación de nuevas enzimas y nuevos suplementos enzimáticos que permitan mejorar la digestión (Selinger et al., 1996).
Parte del Libro "Alimentación de ganado bovino con dietas altas en grano" ISBN: 978-607-28-1031-0
Temas relacionados:
Autores:
Universidad Autónoma Metropolitana - UAM (México)
Referentes que Recomendaron :
VÍCTOR MONTERROSA, Alejandro Villa-GodoyRecomendar
Comentar
Compartir
1 de septiembre de 2017
Dr. German, un saludo. Un artículo muy interesante. Quisiera saber si usted ha trabajando con pulido de arroz como fuerte de almidon para rumiantes. Y que porcentaje de almidón tiene este sub producto?
Saludos
Ing. Noel
Recomendar
Responder
Recomendar
Responder

¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.





