Absorción, metabolismo y homeostasis del zinc en los animales y el hombre.
El zinc es requerido para una gran cantidad de funciones esenciales en el organismo, relacionadas con unas 300 metaloenzimas zinc dependientes y, además, con su rol en la regulación de la expresión génica, la señalización intracelular, la estabilidad de membranas biológicas, etc. El objetivo de este trabajo es revisar y discutir los conocimientos generados en los últimos años acerca de los procesos de absorción y el metabolismo del zinc en el organismo, así como los distintos mecanismos implicados en la homeostasis del zinc.
Palabras claves: zinc, metabolismo, animales, seres humanos.
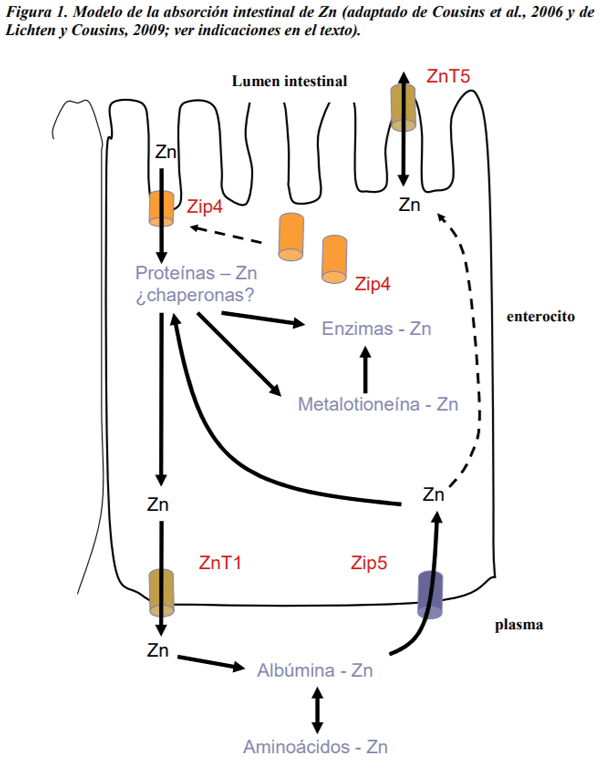
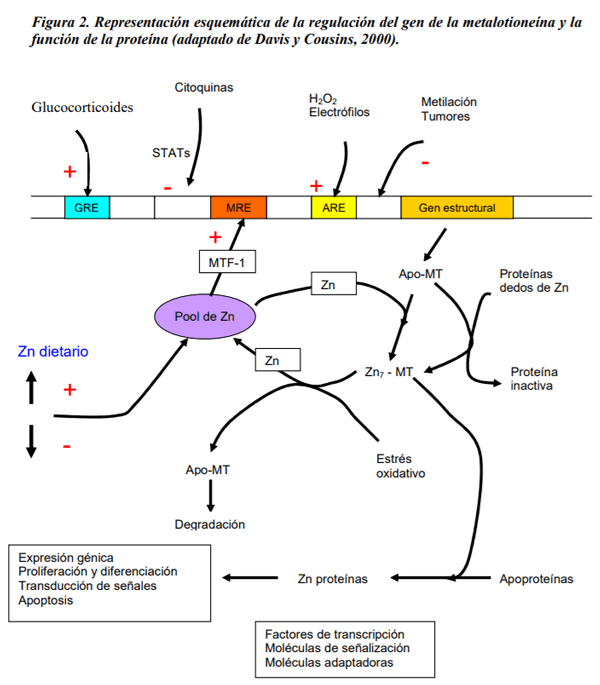
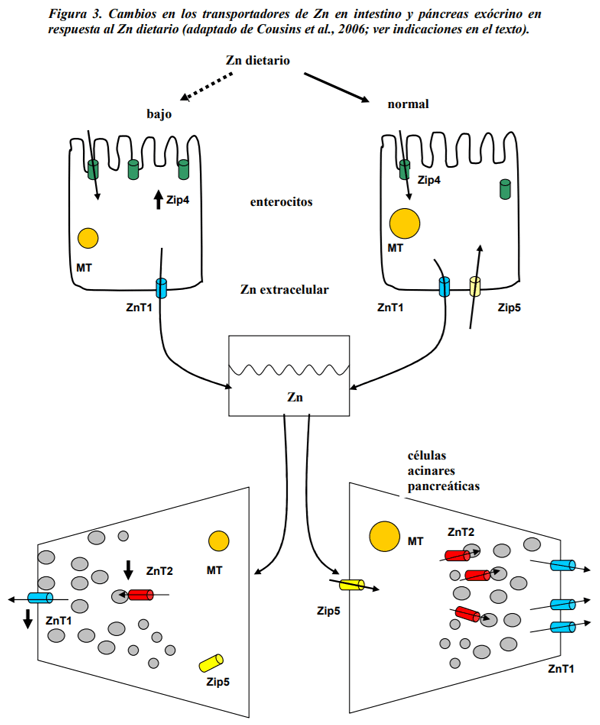
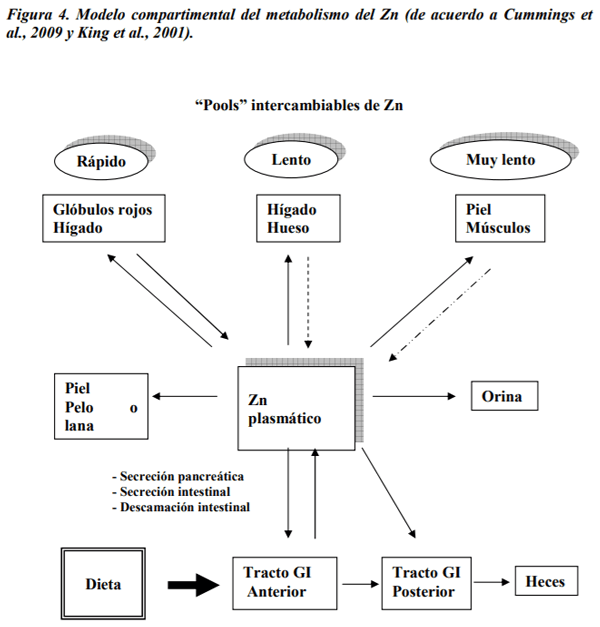
Abu-Handam, D.k.; Migdal, S.D.; Whitehouse, R.; Rabbani, P.; Prasad, A.S.; McDonald, F.D. 1981. Renal handling of zinc: effect of cysteine infusion. Am. J. Physiol. Renal Physiol. 241: F487-F494.
Ackland, M.L.; Mercer, J.F. 1992. The murine mutation, lethal milk, results in production of zinc-deficient milk. J. Nutr. 122: 1214-1218.
Agget, P.J.; Favier, A. 1993. Zinc. Internat. J. Vit. Nutr. Res. 63: 301-307. Andrews, G.K. 2008. Regulation and function of Zip4, the acrodermatitis enteropathica gene. Biochem. Soc. Trans. 36: 1242-1246.
Argiratos, V.; Samman, S. 1994. The effect of calcium carbonate and calcium citrate on the absorption of zinc in healthy female subjects. Eur. J. Cl. Nutr. 48: 198-204.
Arora, S.P.; Hatfield, E.E; Garrigus, U.S.; Lohman, T.G.; Doane, B.B. 1969. Zinc-65 uptake by rumen tissue. J. Nutr. 97: 25-28.
Baer, M.T.; King, J.C. 1984. Tissue levels and zinc excretion during experimental zinc depletion in young men. Am. J. Clin. Nutr. 39: 556-570.
Berzin, N.I.; Bauman, V.K. 1987. Vitamine A-dependent zinc-binding protein and intestinal absorption of zinc in chicks. Br. J. Nutr. 57: 255-268.
Biehl, R.R.; Baker, D.H.; DeLuca, H. 1995. 1 alfa-hydroxlylated cholecalciferol compounds act additively with microbial phytase to improve phosphorus, zinc and manganese utilization in chicks fed soy-based diets. J. Nutr. 125: 2407-2416.
Blakeborough, P.; Salter, D.N. 1987. The intestinal transport of zinc studied using brush-border-membrane vesicles from the piglet. Br. J. Nutr. 57: 45-55.
Bobilya, D.J.; Johanning, G.L.; Veum, T.L.; O’Dell, B.L. 1994. Chronological loss of bone zinc during dietary zinc deprivation in neonatal pigs. Am. J. Clin. Nutr. 59: 649-653.
Bronner, F. 1987. Intestinal calcium absorption: mechanisms and applications. J. Nutr. 117: 1347-1352.
Brzóska, M.M., Moniuszko-Jakoniuk, J. 2001. Interactions between cadmium and zinc in the organism. Food Chem. Toxicol. 39: 967-980.
Chimienti, F.; Devergnas, S.; Favier, A.; Seve, M. 2004. Identification and cloning of a beta-cell-specific zinc transporter, ZnT-8, localizated into insulin secretory granules. Diabetes 53: 2330-2337.
Condomina, J.; Zomoza-Sabina, T.; Granero, L.; Polache, A. 2002. Kinetics of zinc transport in vitro in rat small intestine and colon: interactions with copper. Eur. J. Pharm. Sc. 16: 289-285.
Coppen, D.E.; Davies, N.T. 1987. Studies on the effects of dietary zinc dose on 65Zn absorption in vivo and on the effects of Zn status on the 65Zn absorption and body loss in young rats. Br. J. Nutr. 57: 35-44.
Cousins, R.J. 1985. Absorption, transport, and hepatic metabolism of copper and zinc: Special reference to metallothionein and ceruloplasmin. Physiol. Rev. 65: 238-309.
Cousins, R.J. 2011. Advances in zinc transporters and metabolism. 14th International Symposium on Trace Elements in Man and Animals. Enshi, Hubei, China. Proceedings, p. 46.
Cousins, R.J.; Lee-Ambrose, L.M. 1992. Nuclear zinc uptake and interactions and metallothioneine gene expression are influcenced by dietary zinc in rats. J. Nutr. 122: 56-64.
Cousins, R.J.; Liuzzi, J.P.; Lichten, L.A. 2006. Mammalian zinc transport, trafficking, and signals. J. Biol. Chem. 281: 24085-24089.
Cousins, R.J.; McMahon, R.J. 2000.Integrative aspects of zinc transporters. J.Nutr. 130: 1384S-1387S.
Cragg, R.A., Phillips, S.R.; Piper, J.M.; Varma, J.S.; Campbell, F.C.; Mathers, J.C.; Ford, D. 2005. Homeostatic regulation of zinc transporters in the human small intestine by dietary zinc supplementation. Gut 54: 469-478. Cummings, J.E.; Kovacic, J.P. 2009. The ubiquitous role of zinc in health and disease. J. Vet. Emerg. Crit. Care 19: 215-240.
Dalton, T.; Fu, K.; Palmiter, R.D.; Andrews, G.K. 1996. Transgenic mice that overexpress metallothionein-I resist dietary zinc deficiency. J. Nutr. 126: 825-833.
Davidson, L.; Almgren, S.; Sandstrom, B.; Hurrell, R.F. 1995. Zinc absoption in adult humans: the effect of iron fortification. Br. J. Nutr. 74: 417-425. Davis, S.R.; Cousins, R.J. 2000. Metallothionein expression in animals: a physiological perspective on function. J. Nutr. 130: 1085-1088.
Doyle, J.J.; Pfander, W.H., Grebing, S.E.; Pierce, J.O., 2nd. 1974. Effect of dietary cadmium on growth, cadmium absorption and cadmium tissue levels in growing lambs. J. Nutr. 104: 160-166.
Dufner-Beattie, J.; Kuo, Y-M; Gitschier, J.; Andrews, G.K. 2004. The adaptative response to dietary zinc in mice involves the differential cellular localization and zinc regulation of the zinc transporters Zip4 and Zip5. J. Biol. Chem. 279: 49082-49090.
Dufner-Beattie, J.; Wang , F.; Kuo, Y-M.; Gitschier, J.; Eide, D.; Andrews,
GK. 2003b. The acrodermatitis enteropathica gene Zip4 encodes a tissue-specific, zinc-regulated zinc transporter in mice. J. Biol. Chem. 278: 3374-3378.
Dursun, N.; Aydogan, S. 1995. The influence of dietary iron on zinc in rat. Biol. Trace Elem. Res. 48: 161-171.
Eide, D.J. 2006. Zinc transporters and the cellular trafficking of zinc. Biochim. Biophys. Acta 1763: 711-722.
Emmert, J.L.; Baker, D.H. 1995. Zinc stores in chickens delay the onset of zinc deficiency symptoms. Poultry Sci. 74: 1011-1021.
Fairweather-Tait, S. 1995. Iron-zinc and calcium-Fe interactions in relation to Zn and Fe absorptions. Proc. Nutr. Soc. 54: 465-473.
Fischer Walker, C.; Kordas, K.; Stoltzfus, R.J.; Black, R.E. 2005. Interactive effects of iron and zinc on biochemical and functional outcomes in supplementation trials. Am. J. Clin. Nutr. 82: 5-12.
Flanagan, P.R.; Haist, J.; Valberg, L.S. 1983. Zinc absorption, intraluminal Zn and intestinal metallothionein levels in zinc-deficient and zinc-repleted rodents. J. Nutr. 113: 962-972.
Fleet, J.C.; Turnbull, A.J.; Bourcier, M.; Wood, R.J. 1993. Vitamin D-sensitive and quinacrine-sensitive zinc transport in human intestinal cell line Caco-2. Am. J. Physiol. 264: G1037-G1045.
Fontenot, J.P.; Miller, R.F.; Price, N.O. 1964. Effect of calcium level and zinc supplementation of fattening lamb rations. J. Anim. Sci. 23: 874 (Abstract).
Forbes, R.M. 1961. Excretory patterns and bone deposition of zinc, calcium and magnesium in the rat as influenced by zinc deficiency, EDTA and lactose. J. Nutr. 74: 194-200.
Ford, D. 2004. Intestinal and placental zinc transport pathways. Proc. Nutr. Soc. 63: 21-29.
Fordyce, E.J.; Forbes, R.M.; Robbins, K.R.; Erdman, J.W., Jr. 1987. Phytate x calcium/zinc molar ratios: Are they predictive of zinc bioavailability? J. Food Sci. 52: 440-445.
Fredlund, K.; Isaksson, M.; Rossander-Hulthen, L.; Almgren, A.; Sandberg, A.S. 2006. Absorption of zinc and retention of calcium: dose-dependent inhibition by phytate. J. Trace Elem. Med. Biol. 20: 49-57.
Fukada, T.; Yamasaki, S.; Nishida, K.; Murakami, M.; Hirano, T. 2011. Zinc homeostasis and signaling in health and diseases. J. Biol. Inorg Chem. 16: 1123-1134.
Giroux, E.; Prakash, N.J. 1977. Influence of zinc-ligand mixtures on serum zinc levels in rats. J. Pharm. Sci. 66: 391-395.
Giroux, E.L.; Durieux, M.; Schechter, P.J. 1976. A study of zinc distribution in human serum. Bioinorg. Chem. 5: 211-218.
Gisbert-González, S.L.; Torres-Molina, F. 1996. Zinc uptake in five sectors of the rat gastrointestinal tract: kinetic study in the whole colon. Pharm.l Res. 13: 1154-1161.
Haaranen, S. 1963. Zinc requirements of dairy cattle for removal of deficiency symptoms. Feedstuffs 35: 17-18.
Hambidge, K.M.; Casey, C.E.; Krebs, N.F. 1986. Zinc. In: Trace Elements in Human and Animal Nutrition, Vol. 2. W. Mertz, Ed. Academic Press, New York. p. 1-37.
Hambidge, K.M.; Krebs, N.F.; Westcott, J.E.; Miller, L.V. 2006. Changes in zinc absorption during development. J. Pediatric. 149: S64-S68.
Hambidge, K.M.; Miller, L.V., Westcott, J.M.; Sheng, X.; Krebs, N.F. 2010. Zinc bioavailability and homeostasis. Am. J. Clin. Nutr. 91(suppl):1478S–1483S.
He, L.; Girijashanker, K.; Dalton, T.P.; Reed, J.; Li, H.; Soleimani, M.; Nebert, D.W. 2006. ZIP8, memeber of the solute- carrier39 (SLC39) metal-transporter familiy: characterization of transporter properties. Mol. Pharmacol. 70: 171-180.
Helston, R.M.;, Phillips, S. R.; McKay, J.A.; Jackson, K.A.; Mathers, J.C.; Ford, D. 2007. Zinc transporters in the mouse placenta show a coordinated regulatory response to changes in dietary zinc intake. Placenta 28: 437-444.
Hempe, J.M.; Cousins, R.J. 1992. Cysteine-rich intestinal protein and intestinal metallothionein: an inverse relationships as a conceptual model for zinc absorption in rats. J. Nutr. 122: 89-95. Hill, G.M.; Link, J.E. 2009. Transporters in the absorption and utilization of zinc and copper. J. Anim. Sci. 87 (E. Suppl): E85-E89.
Hoadley, J.E.; Leinart, A.S.; Cousins, R.J. 1987. Kinetic analysis of zinc uptake and serosal transfer by vascularly perfused rat intestine. Am. J. Physiol. 252: G825-G831.
Hunt, C.D.; Johnson, P.E. 1990. The effects of dietary zinc on human sperm morphology and seminal mineral loss. In: Trace Element Metabolism in Man and Animals-7. Hurley, L.S., Lonnerdal, B. y Rucher, R.B., eds. Plenum, New York, USA.
Jackson, M.J. 1989. Physiology of zinc: general aspects. In: Zin in human biology. C.F. Mills, Ed. Springer-Verlag. London. p. 1-14
Jackson, M.J.; Jones, D.A.; Edwards, R.H.T. 1982. Tissue zinc levels as an index of body zinc status. Clin. Physiol. 2: 333-343.
Jackson, M.J.; Jones, D.A.; Edwards, R.H.T. 1984. Zinc homeostasis in man: studies using a new stable isotope-dilution technique. Br. J. Nutr. 51: 199-208.
Johnson, P.E.; Hunt, C.D.; Milne, D.B.; Mullen, L.K. 1993. Homeostatic control of zinc metabolism in men: zinc excretion and balance in men fed diets low in zinc. Am. J. Clin. Nutr. 57: 557-565.
Jou, M-Y.; Hall, A.G.; Phillips, A.F.; Kelleher, S.L.; Lönnerdal, B . 2009. Tissue-especific alterations in zinc transporter expression in intestine and liver reflect a threshold for homeostatic compensation during dietary zinc deficiency in weanling rats. J. Nutr. 139: 835–841.
Kaler, P.; Prasad, R. 2007. Molecular cloning and functional characterization of novel zinc transporter rZip10 (Slc39a10) involved in zinc uptake across rat renal brush-border membrane Am. J. Physiol. Renal Physiol. 292: F217–F229.
Kambe, T. 2011. An overview of a wide range of functions of ZnT and Zip transporters in the secretory pathway. Biosci. Biotechnol. Biochem. 75: 1036-1043.
Kelleher, S.L.; Lönnerdal, B. 2002. Zinc transporters in the rat mammary gland respond to marginal zinc and vitamin A intakes during lactation. J. Nutr. 132: 3280-3285.
Kelleher, S.I.; Lönnerdal, B. 2005. Zip3 plays a major role in zinc uptake into mammary epithelial cells and is regulated by prolactin. Am. J. Phisiol. 288: C1042-C1047.
Kelleher, S.L.; McCormick, N.H.; Velásquez, V.; López, V. 2011. Zinc in specialized secretory tissues: Roles in the pancreas, prostate, and mammary gland. Adv. Nutr. 2: 101-111.
Kelleher, S.L.; Seo, Y.A.; López, B. 2009. Mammary gland zinc metabolism: regulation and dysregulation. Genes Nutr. 4: 83-94.
Kim, B.-E.; Wang, F.; Dufner-Beattie, J.; Andrews, G.K.; Eide, D.E.; Petris, M.J. 2004. Zn2+-stimulated endocytosis of the mZip4 zinc transporter regulates its location at the plasma membrane. J. Biol. Chem. 279: 4523-4530.
Kincaid, R.L. 1979. Biological availability of zinc from inorganic sources with excess dietary calcium. J. Dairy Sc. 62: 1081-1085.
King, J.C.; Shames, D.M.; Woodhouse, L.R. 2000. Zinc homeostasis in humans. J. Nutr. 130: 1360S-1366S.
King, J.C.; Shames, D.M.; Lowe, N.M.; Woodhouse, L.R.; Sutherland, B.; Abrams, S.A.; Turnlund, J.R.; Jackson, M.J. 2001. Effect of acute zinc depletion on zinc homeostasis and plasma kinetics in men. Am. J. Clin. Nutr. 74: 116-124.
Kirchgessner, M. 1993. Underwood memorial lecture: Homeostasis and homeorhesis in trace element metabolism. In: Trace Elements in Man and Animals - TEMA 8. Anke, M., Meissner, D. y Mills, C.F., eds. Verlag Media Touristik, Dresden, Germany. P. 4.21.
Kirchgessner, M.; Schwarz, W.A.; Roth, H.-P. 1978. Homeostasis of Zn-metabolism in experimentally induced Zn deficiency of dairy cows. Trace Element Metabolism in Man and Animals - 3. M. Kirchgessner, Ed. Freising-Weihenstephen, West Germany. p. 116-121.
Kirchgessner, M.; Paulicks, B.R.; Roth, H.-P. 1993. Zinc in animal nutrition. Function, deficiency, diagnosis, requirements, supply and absorption. Ciencia e Inv. Agraria 20: 182-201.
Kirschke, C.P.; Huang, L. 2003. ZnT7, a novel mammalian zinc transporter, accumulates zinc in the Golgi Apparatus. J. Biol. Chem. 278: 4096-4102.
Kordas, K.; Stoltzfus, R.J. 2004. New evidence of iron and zinc interplay at the enterocyte and neural tissues. J. Nutr. 134:1295-1298.
Krebs, N.R. 2000. Overview of zinc absorption and excretion in the human gastrointestinal tract. J. Nutr. 130: 1374S-1377S.
Kreuzer, M.; Kirchgessner, M. 1994. Effect of oral and i.v. iron on tissue retention and excretion of copper and zinc in growing rats. J. Anim. Physiol. a. Anim. Nutr. 72: 242-251.
Kroneman, J.; Mey, G.J.K. v.d.; Helder, A. 1975. Hereditary zinc deficiency in Dutch Friesian cattle. Zentralblat Vet. Med. A 22: 201-208.
Lee, D.-Y.; Prasad, A.S.; Hydrick-Adair, C.; Brewer, G.; Johnson, P.E. 1993. Homeostasis of zinc in marginal human zinc deficiency: rol of absorption and endogenous excretion of zinc. J. Lab. Clin. Med. 122: 549-556.
Lee, H.H.; Prasad, A.S.; Brewer, G.J.; Owyang, C. 1989. Zinc absorption in human small intestine. Am. J. Physiol. 256: G87-G91.
Lee, J.; Treloar, B.P.; Grace, N.D. 1994. Metallothionein and trace element metabolism in sheep tissues in response to high and sustained zinc dosages. II. Expresion of metallothionein m-RNA. Aus. J. Agric, Res. 45: 321-332.
Levenson, C.W.; Shay, N.F.; Hempe, J.M.; Cousins, R.J. 1994. Expression of cysteine-rich intestinal protein in rat intestine and transfected cells is not zinc dependent. J. Nutr. 124: 13-17.
Lewis, P.K. Jr.; Hoekstra, W.G.; Grummer, R.H. 1957. Restricted calcium feeding versus zinc supplementation for the control of parakeratosis in swine. J. Anim. Sci. 16: 578-588.
Lichten, L.A.; Cousins, R.J. 2009. Mammalian zinc transporters: nutritional and physiological regulation. Annu. Rev. Nutr. 29: 153-176.
Lin, W.; Chai, J.; Love, J.; Fu, D. 2010. Selective electrodiffusion of zinc ions in a Zrt-, Irt-like protein, ZIPB. J. Biol. Chem.285: 39013-39020.
Liuzzi, J.P.; Bobo, J.A.; Lichten, L.A.; Samuelson, D.A.; Cousins, R.J. 2004. Responsive transporter genes within the murine intestinal-pancreatic axis form a basis of zinc homeostasis. Proc. Natl. Acad. Sci. USA 101: 14355-14360.
Liuzzi, J.P.; Blanchard, R.K.; Cousins, R.J. 2001. Differential regulation of zinc transporter 1,2, and 4 mRNA expression by dietary zinc in rats. J. Nutr. 131: 46-52.
Liuzzi, J.P.; Cousins, R.J. 2004.Mammalian zinc transporters. Annu. Rev.Nutr. 24: 151-172.
Liuzzi, J.P.; Lichten, L.A.; Rivera, S.; Blanchard, R.K.; Aydemir, T.B.; Knutson, M.D.: Ganz, T.; Cousins, R.J. 2005. Interleukin-6 regulates the zinc transporter Zip14 in liver and contributes to the hypozincemia of the acute-phase response. Proc. Natl. Acad. Sci. USA 102: 6843-6848.
Lönnerdal, B. 2000. Dietary factors influencing zinc absorption. J. Nutr. 130: 1378S-1383S.
Lönnerdal, B. 2007. Trace element transport in the mammary gland. Annu. Rev. Nutr. 27: 165-177.
Lönnerdal, B.; Bell, J.G.; Hendrickx, A.G.; Burns, R.A.; Keen, C.L. 1988. Effect of phytate removal on zinc absorption from soy formula. Am. J. Clin. Nutr. 48: 1301-1306.
Lönerdal, B.; Kuna, C.; Sandberg, A.-S.; Sandström, B. 1989. Inhibitory effects of various inositol phosphates on zinc and calcium absorption. J. Nutr. 119: 211-214.
Luecke, R.W.; Hoefer, J.A.; Brammell; Schmidt, D.A. 1957. Calcium and parakeratosis of swine. J. Anim. Sci. 16: 3-11.
Machen, M.; Montgomery, T.; Holland, R.; Braselton, E.; Dunstan, R.; Brewer, G.; Yuzbasiyan-Gurkan, V. 1996. Bovine hereditary zinc deficiency: lethal trait A 46. J. Vet. Diagn. Inv. 8: 219-227.
Maret, W. 2003. Cellular zinc and redox states converge in the metallothionein- thionein pair. J. Nutr. 133: 1460S-1462S. McDowell, L.R. 1992. Minerals in animal and human nutrition. Academic Press. San Diego, CA, USA.
McGuire, S.O.; Miller, W.J.; Gentry, R.P.; Neathery, M.W.; Ho, S.Y.; Blackmon, D.M. 1985. Influence of high dietary iron as ferrous carbonate and ferrous sulfate on iron metabolism in young calves. J. Dairy Sc. 68: 2621-2628.
McMahon, R.J.; Cousins, R.J. 1998. Regulation of de zinc transporter ZnT-1 by dietary zinc. Proc. Natl. Acad. Sci. USA, 95: 4841-4846.
Menard, M.P.; Cousins, R.J. 1983. Zinc transport by brush border membrane vesicles from rat intestine. J. Nutr. 113: 1434-1442.
Miller, J.K.; Cragle, R.G. 1965. Gastrointestinal sites of absorption and endogenous secretion of zinc in dairy cattle. J. Dairy Sc. 48: 370-373.
Miller, L.V.; Hambidge, K.M.; Naake, V.L.; Hong, Z.; Westcott, J.L.; Fenessey, P.V. 1994. Size of the zinc pools that exchange rapidly with plasma zinc in humans: alternative techniques for measuring and relation to dietary zinc intake. J. Nutr. 124: 268-276.
Miller, W.J. 1970. Zinc nutrition in cattle: a review. J. Dairy Sci. 53: 1123-1135. Miller, W.J. 1975. New concepts and developments in metabolism and homeostasis of inorganic elements in dairy cattle. A review. J. Dairy Sc. 58: 1549-1560.
Mills, C.F. 1978. Zinc in ruminant nutrition. The Rowett Research Institute. Annual Report of Studies in Animal Nutrition and Allied Sciences. 34: 105-115.
Mills, C.R.; Dalgarno, A.C. 1967. The influence of dietary calcium concentration on epidermal lesions of zinc deficiency in lambs. Proc. Nutr. Soc. 26: XIX.
Mills, C.F.; Dalgarno, A.C., Williams, R.B., Quarterman, J. 1967. Zinc deficiency and the zinc requirements of calves and lambs. Br. J. Nutr. 21:751-768.
Milne, D.B.; Canfield, W.K.; Mahalko, J.R.; Sandstead, H.H. 1983. Effect of dietary zinc on whole body surface loss of zinc: impact on estimation of zinc retention by balance method. Am. J. Clin. Nutr. 38:181-186.
Mohanna, C.; Nys, Y. 1999. Changes in zinc and manganese availability in broiler chicks induced by vegetal and microbial phytases. Anim. Feed Sci. Techn. 77: 241-253.
Mullis, L.A.; Spears, J.W.; McCraw, R.L. 2003. Effects of breed (Angus vs Simmental) and copper and zinc source on mineral status of steers fed high dietary iron. J. Anim. Sci. 81: 318-322.
National Research Council. 1998.Nutrient Requirements of Swine. 10th Ed. National Academy Press, Washington, D.C., USA.
Neathery, M.W.; Miller, W.J.; Blackmon, D.M.; Gentry, R.P. 1973. Zinc-65 metabolism, secretion into milk, and biological half-life in lactating cows. J. Dairy Sc. 1526-1530.
Oberleas, D.; Muhrer, M.E.; O’Dell, B.L. 1962. Effects of phytic acid on zinc availability and parakeratosis in swine. J. Anim. Sci. 21: 57-61.
O’Brien, K.O.; Zavaleta, N.; Caulfield, L.E.; Wen, J.; Abrams, S.A. 2000. Prenatal iron supplements impair zinc absorption in pregnant Peruvian women. J. Nutr. 130: 2251-2255.
O’Dell, B.L.; Reeves, P.G. 1989. Zinc status and food intake. In: Zinc in human biology. C.F. Mills, Ed. Springer-Verlag, London. p. 173-181.
O’Dell, B.L.; Savage, J.E. 1960. Effect of phytic acid on zinc availability. Proc. Soc. Exp. Biol. Med. 103: 304-306.
O’Dell, B.L.; Yoke, J.M.; Savage, J.E. 1964. Zinc availability in the chick as affected by phytate, calcium and ethylenediaminetetraacetate. Poult. Sci. 43: 415-419.
Ott, E.A.; Smith, W.H.; Stob, M.;
Beeson, W.M. 1964. Zinc deficiency syndrome in the young lamb. J. Nutr. 82: 41-50.
Outten, C.E.; O’Halloran, T.V. 2001.Fentomolar sensitivity of metalloregulatory proteins controlling zinc homeostasis. Science 292: 2488-2492.
Palmiter, R.D.; Findley, S.D. 1995. Cloning and functional caracterization of a mammalian zinc transporter that confers resistence to zinc. EMBO J. 14: 639-649.
Parry, W.H. 1977. Distribution of protein-bound zinc in normal and zind-deficient lamb plasma. Nutr. Metab. 21 (suppl. 1): 48-49.
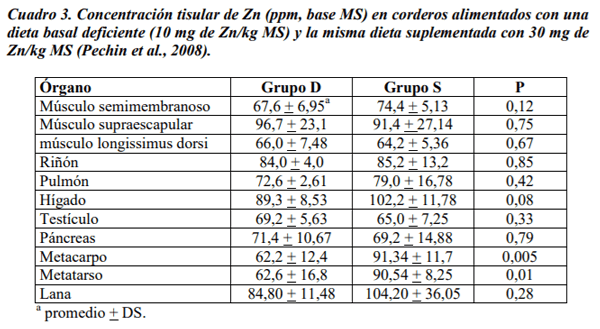
Pechin, G.H.; Corbellini, C.N.; Cseh, S. B. 2008. Deficiencia experimental de zinc en ovinos. 2. Efecto sobre la concentración tisular de zinc y cobre. Rev. Arg. Prod. Anim. 28 (Supl. 1): 84-85.
Pechin, G.H.; Corbellini, C.N.; Cseh, S.B.; Álvarez, A.R.; Ginart, L.; Denda, S.S. 2010. Comparación de sulfato de zinc versus un complejo aminoácidos-zinc en corderos. 2. Efecto sobre la concentración tisular de zinc y cobre. Rev. Arg. Prod. Anim. 30 (Supl. 1): 498-499.
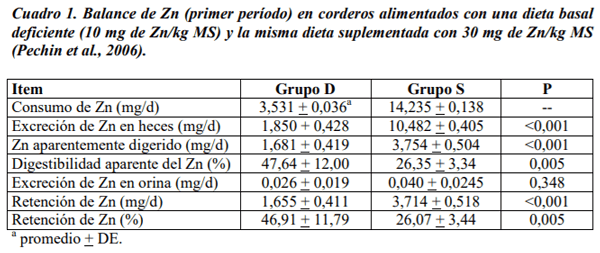
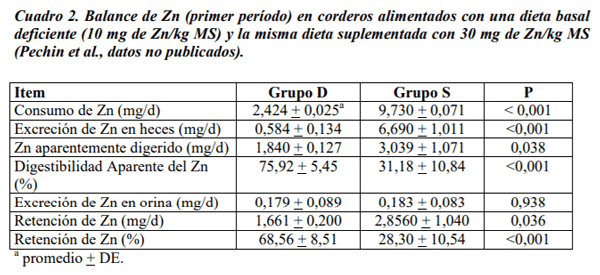
Pechin, G.H.; Corbellini, C.N.; Cseh, S.B.; Álvarez, A.R.; Mángano, V. 2006. Deficiencia experimental de zinc en ovinos. 1. Efectos sobre el crecimiento, la producción de lana y parámetros bioquímicos. Rev. Arg. Prod- Anim. 26 (Supl. 1): 44-45.
Peres, J.M.; Bureau, F.; Neuville, D.; Arhan, P.; Bougle, D. 2001. Inhibition of zinc absorption by iron depends on their ratio. J. Trace Elem. Med. Biol. 15: 237-241.
Perry, T.W.; Beeson, W.M.; Smith, W.H.; Mohler, M.T. 1968. Value of zinc supplementation of natural rations for fattening beef cattle. J. Anim. Sci. 27: 1674-1677.
Pond, W.G. 1983. Effect of dietary calcium and zinc levels on weight gain and blood and tissue mineral concentrations of growing Columbia- and Suffolk- sired lambs. J. Anim. Sci. 56: 952-959.
Pond, W.G.; Wallace, M.H. 1986. Effect of gestation-lactation diet calcium and zinc levels and of parenteral vitamins A, D and E during gestation on ewe body weight and lamb weight and survival. J. Anim. Sci. 63: 1029-1025.
Prabowo, A.; Spears, J.W.; Goode, L. 1988. Effects of dietary iron on performance and mineral utilization in lambs fed a forage-based diet. J. Anim. Sci. 66: 2028-2035.
Qian, W.J.; Aspinwall, C.A.; Battiste, M.A.; Kennedy, R.T. 2000. Detection of secretion from single pancreatic beta-cells using extracellular fluorogenic reactions and confocal fluorescence microscopy. Anal. Chem. 72: 711-717.
Reeves, P.G. 1995. Adaptation responses in rats to long-term feeding of high-zinc diets: emphasis on intestinal metallothionein. J. Nutr. Biochem. 6: 48-54.
Reeves, P.G. 1998. Copper metabolism in metallothionein-null mic fec a high-zinc diet. J. Nutr. Biochem. 9: 598-601.
Reeves, P.G.; Rossow, K.L. 1996. Zinc-and/or cadmium-induced intestinal metallothionein and copper metabolism in adults rats. J. Nutr. Biochem. 7: 128-134.
Reeves, P.G.; Rossow, K.L.; Bobilya, D.J. 1993. Zinc-induced metallothionein and copper metabolism in intestinal mucosa, liver, and kidney of rats. Nutr. Res. 13: 1419-1431.
Revy, P.S.; Jondreville, C.; Dourmad, J.Y.; Nys, Y. 2004. Effect of zinc supplemented as either an organic or an inorganic source and of microbial phytase on zinc and other minerals utilisation by wanling pigs. Anim. Feed Sci. Technol. 116: 93-112.
Roberson, K.D.; Edwards, H.M., Jr.1994. Effects of 1,25- dihydroxycholecalciferol and phytase on zinc utilization in broiler chicks. Poultry Sci.73: 1312-1326.
Ryu, M.-S., Langkamp-Henke, B.; Chang, S.-M., Shankar, M.N.; Cousins, R.J. 2011. Genomic analysis, cytokine expression, and microRNA profiling reveal biomarkers of human dietary zinc depletion and homeostasis. Proc. Natl. Acad. Sci. 108: 20970-20975.
Salomons, N.W.; Jacob, R.A. 1981. Studies on the bioavailability of zinc in humans: effects of heme and nonheme iron on the absorption of zinc. Am. J. Clin. Nutr. 34: 475-482.
Sandstrom, B.; Sandberg, A.S. 1992. Inhibitory effects of isolated inositol phosphates on zinc absorption in humans. J. Trace Elements Electro. Health Dis. 6: 99-103.
Sato, M.; Bremner, I. 1993. Oxygen free radicals and metallothionein. Free Radic. Biol. Med. 14: 325-337.
Saylor, W.W.; Morrow, F.D.; Leach, R.M., Jr. 1980. Copper- and zinc-binding proteins in sheep liver and intestine: effects of dietary levels of the metals. J. Nutr. 110: 460-468.
Seal, C.J.; Mathers, J.C. 1989. Intestinal zinc transfer by everted gut sacs from rats given diets containing different amounts and types of dietary fibre. Br. J. Nutr. 62: 151-163.
Sekler, I.; Sensi, S.L.; Hershfinkel, M.; Silverman, W.F. 2007. Mechanism and regulation of cellular zinc transport. Mol. Med. 1 3: 337-343.
Sian, L.; Mingyan, X.; Miller, L.V.; Tong, L.; Krebs, N.F.; Hambidge, K.M. 1996. Zinc absorption and intestinal losses of endogenous zinc in young Chinesse women with marginal zinc intakes. Am. J. Clin. Nutr. 63: 348-353.
Simpson, C.J.; Wise, A. 1990. Binding of zinc and calcium to inositol phosphates (phytate) in vitro. Br. J. Nutr. 64: 225-232. Smith, K.T.; Cousins, R.J. 1980. Quantitative aspects of zinc absorption by isolated, vascularly perfused rat intestine. J. Nutr. 110: 316-323.
Stake, P.E.; Miller, W.J.; Blackmon, D.M.; Gentry, R.P.; Neathery, M.W.1974. Role of pancreas in endogenous zinc excretion in the bovine. J. Nutr. 104: 1279-1284.
Stake, P.E.; Miller, W.J.; Neathery, M.W.; Gentry, R.P. 1975. Zinc-65 absorption and tissue distribution in two-, and siw-month-old Holstein calves and lactating cows. J. Dairy Sci. 58: 78-81.
Standish, J.F.; Ammerman, C.B. 1971. Effect of excess dietary iron as ferrous sulfate and ferric citrate on tissue mineral composition of sheep. J. Anim. Sci. 33: 481-484.
Standish, J.F.; Ammerman, C.B.; Palmer, A.Z.; Simpson, C.F. 1971. Influence of dietary iron and phosphorus on performance, tissue mineral composition and mineral absorption in steers. J. Anim. Sci. 33: 171-178.
Standish, J.F.; Ammerman, C.B.; Simpson, C.F.; Neal, F.C.; Palmer, A.Z. 1969. Influence of graded levels of dietary iron, as ferrous sulfate, on performance and tissue mineral composition of steers. J. Anim. Sci. 29: 496-503.
Steel, L.; Cousins, R.J. 1985. Kinetics of zinc absorption by luminally and vascularly perfused rat intestine. Am. J. Physiol 248: G46-G53.
Suhy, D.A.; Simon, K.D.; Linzer, D.I.; O’Halloran, T.V. 1999. Metallothionein is part of a zinc-scavenging mechanism for cell survival under conditions of extreme zinc deprivation. J. Biol. Chem. 274: 9183-9192.
Suttle, N.F. 2010. Mineral nutrition of Livestock. Fourth Edition. CAB International. Wallinford. UK.
Tacnet, F.; Watkins, D.W.; Ripoche, P. 1990. Studies of zinc transport into brush-border membrane vesicles isolated from pig small intestine. Biochim. Biophys. Acta 1024: 323-330.
Van Campen, D.R. 1969. Copper interference with the intestine absorption of Zn-65 in rats. J. Nutr. 97: 104-108.
Van Campen, D.R.; House, W.A. 1974. Effect of a low protein diet on retention of an oral dose of 65Zn and on tissue concentrations of zinc, iron, and copper in rats. J. Nutr. 104: 84-90.
Vasák, M. 2005. Advances in metallothionein structure and functions. J. Trace Elem. Med. Biol. 19: 13-17.
Wada, L.; Turnlund, J.R.; King, J.C. 1985. Zinc utilization in young men fed adequate and low zinc intakes. J. Nutr. 115: 1345-1354.
Wang, K.; Zhou, B.; Kuo, Y.M.; Zenansky, J.; Gitscher, J. 2002a. A novel meber of a zinc transporter family is defective in acrodermatitis enteropathica. Am. J. Hum. Genet. 7: 66-73.
Walsh, C.T.; Sandstead, H.H.; Prasad, A.S.; Newberne, P.M.; Fraker, P.J. 1994. Zinc: Health effects and research priorities for the 1990s. Environ. Health Perspect. 102 (suppl. 2): 5-46.
Wapnir, R.A.; Khani, D.E.; Bayne, M.A.; Lifshitz, F. 1983. Absorption of zinc by the rat ileum: effects of histidine and other low-molecular-weight ligands. J. Nutr. 113: 1346-1354.
Wastney, M.E.; House, W.A.; Barnes, R.M.: Subramanian, K.N.S. 2000. Kinetics of zinc metabolism: variation with diet, genetics and disease. J. Nutr. 130: 1355S-1359S.
Wegner, T.N.; Ray, D.E.; Lox, C.D.; Stott, G.H. 1973. Effect of stress on serum zinc and plasma corticoids in dairy cattle. J. Dairy Sci. 56: 748-752.
Weigand, E.; Kirchgessner, M. 1978a. Homeostatic adaptation of Zn absorption and endogenous Zn excretion over a wide range of dietary supply. In: Trace element in man and animals - 3. M. Kirchgessner, Ed. ATW Freising-Weihenstephan, Germany. p. 106-109.
Weigand, E.; Kirchgessner, M. 1978b. Homeostatic adjustments in zinc digestion to widely varying dietary zinc intake. Nutr. Metab. 22: 101-112.
Weigand, E.; Kirchgessner, M. 1980. Total true eficiency of zinc utilization determination and homeostatic dependence upon the zinc supply status in young rats. J. Nutr. 110: 469-480.
Whanger, P.D.; Oh, S-H.; Deagen, J.T. 1981: Ovine and bovine metallothioneins: accumulation and depletion of zinc in various tissues. J. Nutr. 111: 1196-1206.
Whittaker, P. 1998. Iron and zinc interactions in humans. Am. J. Clin. Nutr. 68 (suppl.): 442S-446S.
Wien, E.M.; Glahn, R.P.; Van Campen, D.R. 1994. Ferrous iron uptake by rat duodenal brush border membrane vesicles: Effects of dietary iron level and competing minerals (Zn+2, Mn+2, and Ca+2). J. Nutr. Biochem. 5: 571-577.
Williams, P.J.; Taylor, T.G. 1985. A comparative study of phytate hydrolisis in the gastrointestinal tract of the golden hamster. Br. J. Nutr. 54: 429-435.
Wood, R.J.; Zheng, J.J. 1997. High dietary calcium intakes reduces zinc absorption and balance in humans. Am. J. Cl. Nutr. 65: 1803-1809.
Wright, C.L.; Spears, J.W.; Web, K.E., Jr. 2008. Uptake of zinc from zinc sulfate and zinc proteinate by ovine ruminal and omasal epithelia. J. Anim. Sci. 86: 1357-1363.
Yamaji S.; Tennant, J.; Tandy, S.; Williams, M.; Srai, S.K.S.; Sharp, P. 2001. Zinc regulates the function and expression of the iron transporters DMT1 and IREG1 in human intestinal Caco-2 cells. FEBS Lett. 507: 137-141.
Yang, Y.; Maret, W.; Vallee, B.L. 2001. Differential fluorescence labelling of cysteinyl clusters uncovers high tissue levels of thionein. Proc. Natl. Acad. Sci. U.S.A. 98: 5556-5559.
Yanke, L.J.; Bae, H.D.; Selinger, L.B.; Cheng, K.-J. 1998. Phytase activity of anaerobical ruminal bacteria. Microbiology 144: 1565-1573.
Yi, Z.; Kornegay, E.T.; Denbow, D.M. 1996. Supplemental microbial phytase improves zinc utilization in broilers. Poultry Sci. 75: 540-546.
Zhou, J.R.; Canar, M.M.; Erdman, J.W., Jr. 1993. Bone zinc is poorly released in young, growing rats fed marginally zinc-restricted diet. J. Nutr. 123: 1383-1388.
Zhou, J.R.; Erdman, J.W., Jr. 1995. Phytic acid in health and disease. Crit. Rev. Food Sci. Nutr. 35: 495-508.
Zhou, J.R.; Wong, M.S.; Burns, R.A.; Erdman, J.W. 1992. Phytic acid reduction in soy protein improves zinc bioavailability. J. Nutr. 122: 2466-2473.









.jpg&w=3840&q=75)