Espectroscopia de Infrarrojo Cercano (NIRs) - La técnica de análisis rápidos del futuro
Teoría de Espectroscopia NIR
La palabra “espectroscopia” deriva de la raíz latina spectrum (apariencia, imagen) y la palabra griega skopia (ver). Esta definición es más bien descriptiva de la medición espectroscópica en sí misma; por ejemplo: ver una leve imagen procedente de una muestra (Miller, 2001).
En esencia, la tecnología NIR involucra luz interactuando con un material, donde una radiación electromagnética ocurre en forma de ondas. La longitud de onda es la distancia entre los dos picos o puntos altos, y se indica con el símbolo λ (Shadow, 2000; Figura 1). La longitud de onda en el espectro NIR se mide normalmente en nanometros (nm) donde 1nm = 10-9 m ó 1000nm = .001mm.
Esa parte del espectro visible al ojo humano se extiende de alrededor de 400nm á 800nm, mientras que el espectro infrarrojo se extiende de aproximadamente 2,500nm á 25,000nm. El infrarrojo cercano es considerado esa parte del espectro situada entre la región visible y la región infrarroja. El rango de longitudes de onda que el NIR cubre, está entre 750nm á 2,600nm (Figura 2).
Figura1: Typical wave propagating through space.
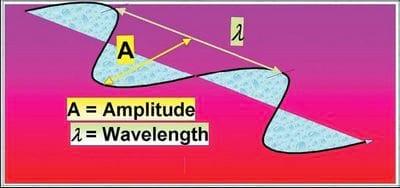
Figure 2: The electromagnetic spectrum.
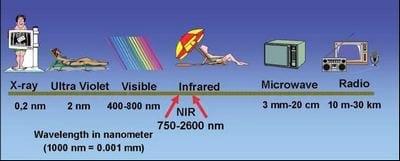
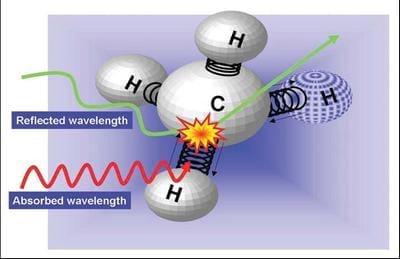
Figure 3: The vibrating bond between carbon (C) and hydrogen (H) atoms absorbs NIR waves of a particular wavelength and reflects all other waves.
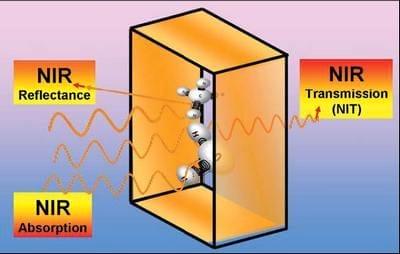
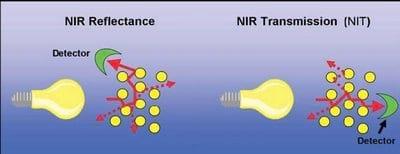
En la práctica, la muestra a ser analizada es bombardeada con rayos NIR de diferentes longitudes de onda como se ilustra en la Figura 4. Por cada longitud de onda, algunos de los rayos serán entonces absorbidos por uniones químicas específicas. Al mismo tiempo, otros rayos serán diseminados y reflejados por otras uniones químicas. Este proceso es comúnmente descrito como Reflectancia NIR. En contraste, algunos de los rayos pasarán a través de la muestra, lo cual es denominado Transmisión NIR (a menudo referida como NIT).
Figure 4: NIR rays absorbed by some bonds, reflected by other bonds (NIR Reflectance) or transmitted through a sample (NIR Transmission generally termed NIT).
Existe a menudo una mala interpretación del término Reflectancia NIR. Los rayos no son simplemente reflejados de la superficie externa, sino que realmente penetran la muestra. Cada vez que se halla que una unión química no absorbe una particular longitud de onda, los rayos son diseminados y reflejados en todas direcciones. Estos haces dispersos pueden entonces ser absorbidos o reflejados por otras uniones químicas, hasta que una porción de los rayos eventualmente salga de la muestra en todas direcciones (Figura 5). La profundidad de penetración del haz dentro de la muestra no está determinada por la posición del detector, sino más bien por la potencia de la fuente de luz.
Figure 5: The penetration of NIR rays in NIR Reflectance and NIR Transmission mode.
La Transmisión NIR, donde el detector está ubicado detrás de la muestra, es ideal para líquidos transparentes y algunos productos que no son demasiado densos ópticamente. Productos tales como muestras de girasol, canola y tierra, que son ópticamente tan densos que permiten que sólo una porción de rayos pasen a través de la muestra, que mediciones confiables son muy difíciles de obtener por NIT. De manera subsiguiente, para mediciones NIT de estos productos, la muestra debe ser vertida en células de muestreo con un tamaño de sólo 6mm. Vastenhoudt (1995) reportó que se acepta generalmente que el análisis de granos intactos por Reflectancia NIR es más exacto que por NIT. Williams y Norris (2001) adicionalmente indicaron que el análisis NIR de grano entero por reflectancia, eliminó el largo de trayectoria como un error de fuente, lo cual sugiere por lo tanto que la Reflectancia NIR antes que la NIT debe ser el principio de medición recomendado para tales productos densos y mezclas que los contengan.
En la práctica, cuando se realiza un análisis en un instrumento NIR, el operador sólo tiene que colocar la muestra en el recipiente para la misma, y presionar un botón para comenzar el análisis. El análisis completo se imprime normalmente en menos de un minuto. Si esto es tan fácil, ¿por qué entonces hay diferencia de opiniones sobre el campo de aplicación y precisión de los resultados NIR? Ciertamente, no es una caja mágica que puede analizar cualquier elemento que se introduzca, pero con el correcto desarrollo y mantenimiento de las calibraciones, esta excitante y nueva técnica está siendo rápidamente implementada como el mayor método de análisis rápidos del futuro.
Calibraciones
El instrumento NIR no se “calibra” como un balance donde las lecturas son ajustadas meramente hacia arriba o abajo a un valor estándar.
El instrumento debe ser capacitado para reconocer diferentes productos y elementos. Este proceso de “formación” se llama procedimiento de calibración, y en este punto yace el secreto del éxito de esta revolucionaria tecnología.
Para la capacitación, un número de muestras son analizadas por métodos químico-analíticos tradicionales para determinar la composición real de las muestras. Cada una de éstas es colocada luego en el instrumento NIR, y se obtienen los valores de reflectancia de las diferentes longitudes de onda. Con la ayuda de un microcomputador y un poderoso software químico-métrico, la combinación de los resultados analíticos y los valores de reflectancia son transformados a las constantes de calibración. Este software es tan poderoso que debe tenerse gran cuidado ya que no presenta simplemente una solución estadística, sino que realmente suministra una solución científica que puede ser verificada.
Para desarrollar una nueva calibración o aún mantener las ya existentes, es importante primeramente procurarse físicamente de un grupo ideal de muestras. De cada producto, el conjunto de muestras procurado debe incluir muestras que representen tantas variaciones de los componentes analíticos y nutritivos con las que puedan contarse. Este grupo debe idealmente contener también muestras representando la variación natural que pueda darse. Esto incluye la variación en variedades de cultivos, áreas de crecimiento, condiciones de crecimiento, y temporadas de crecimiento. Dersjant-Li y Peisker (2005) recientemente enfatizaron la gran variación en composición entre muestras de soya recolectadas de diferentes países o aún de distintas áreas dentro de un mismo país. Una vez procurado el grupo de muestras que cubra la mayor parte de las combinaciones, la mayoría de los programas de software de calibración tienen una herramienta, la cual entonces ayuda a seleccionar además un sub-muestreo para preparar la calibración.
Más aún, las calibraciones secundarias a menudo provistas con la compra de los instrumentos NIR, raramente representarían un verdadero reflejo de las muestras de áreas locales, y usualmente necesitan bastante ajuste. Esto puede hacerse agregando un número de muestras cuidadosamente seleccionadas de un producto específico local, a los datos existentes de calibración.
Factores que pueden afectar la exactitud de los resultados analíticos
La veracidad de los resultados NIR está determinada normalmente por la comparación de resultados de los análisis químicos tradicionales. Sin embargo, la mayoría de de los factores que afectan la exactitud de los resultados NIR afectan también los resultados de los análisis químicos tradicionales. Por lo tanto, un estudio cuidadoso de todos los factores que afectan los resultados analíticos certeros y confiables de las muestras, es esencial para asegurar que se usan valores realistas para calibrar y comparar resultados, y para garantizar que el usuario comprende el valor genuino de los resultados que recibe. Para demostrar el efecto de varios factores influenciando la exactitud de los resultados obtenidos para muestras específicas, un amplio estudio fue realizado por el Sr. Gerrie Scholtz y el Profesor Hentie van der Merwe en la Universidad de Free State, utilizando más de 600 muestras de alfalfa como parte de un proyecto para desarrollar un nuevo sistema de graduación de calidad para la alfalfa en Sudáfrica (Scholtz, 2005; inédito). Algunos de los datos preliminares de este estudio junto con pruebas efectuadas por Groenewald (2005; inédito) serán usados para ilustrar la variación en los resultados analíticos que pueden ser causados por algunos de los factores mayores. El término “variación” en la discusión que sigue debajo adicionalmente expresa la diferencia entre el valor máximo y el mínimo obtenidos para cada resultado.
Variación de muestra y laboratorio
Un problema de magnitud en la preparación de buenas calibraciones y la verificación de la eficacia de las aplicaciones NIR es obtener análisis químicos confiables. Uno de los conceptos erróneos es que los resultados químicos de laboratorios son absolutos y siempre exactos. Los laboratorios a menudo suministran resultados expresados a dos puntos decimales, donde la variación que se da dentro de la muestra y durante la preparación de la misma y los procedimientos analíticos puede ser mucho mayor.
Los resultados analíticos que siguen son ejemplos típicos recibidos para una muestra de alfalfa que fue analizada en un laboratorio específico: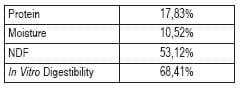
Las primeras preguntas que surgen al evaluar estas lecturas son qué significan estos resultados, y cómo debería ser interpretados? Aún más, es importante conocer la exactitud de tales resultados cuando se utilizan valores absolutos obtenidos de un laboratorio específico.
Por lo tanto, si el efecto en conjunto de la variación de la muestra, la variación de manejo, la variación de la preparación de la muestra y la variación analítica fueron comprendidas por el laboratorio, es más correcto expresar el resultado como: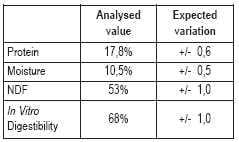
Al determinar la variación esperada y proveerla con los análisis, el usuario estará provisto con una mayor comprensión del valor real del resultado, y podrá tomar mejores e informadas decisiones, basadas en tales resultados.
Es sorprendente cuán a menudo la variación dentro de las muestras no es comprendida correctamente, y es considerada para tomar decisiones atinadas basados en los resultados analíticos. Por ejemplo, una sola muestra de un kilogramo o aún menos, es tomada usualmente de un gran lote de producto, y enviada para análisis. El resultado de tal muestra es entonces aceptado como absoluto, y es utilizado para evaluar el lote íntegro, y se ajustan los procesos productivos o los valores de matriz consecuentemente.
Para demostrar la influencia de ambas variaciones, del laboratorio y de la muestra, fueron realizadas pruebas en muestras de alfalfa (Groenewald, 2005; inédito) para determinar el tipo y tamaño de la variación que puede darse con los resultados analíticos. Con este estudio:
• Las fracciones de tallos y hojas de la misma muestra de alfalfa fueron analizadas separadamente para comparar la variación de calidad normal entre estas dos fracciones.
• Cuatro muestras separadas como obtenidas, bien mezcladas (a – d, Figura 6) fueron analizadas cuatro veces en un instrumento NIR (PERTEN DA7200, Perten Instruments AB, Suecia) para determinar la repetición que puede esperarse con esta tecnología bajo condiciones bien controladas.
• Cinco muestras separadas como obtenidas, bien mezcladas (e – i, Figura 6) fueron cuidadosamente divididas en dos porciones. Cada una de las diez porciones fue luego enviada al mismo laboratorio, en diferentes momentos, para ser analizadas. La variación fue entonces determinada entre los resultados de las dos porciones duplicadas de cada una de las cinco muestras.
• Una muestra separada bien mezclada fue cuidadosamente separada en dos porciones. Cada una de las mismas fue luego enviada a un laboratorio diferente para ser analizada. Este ejercicio fue repetido nueve veces con distintas muestras (j – r, Figura 6), utilizando un número de diferentes laboratorios reconocidos para comparar la variación típica experimentada entre tales laboratorios.
Los análisis fueron realizados en una variedad de nutrientes. La conclusión alcanzada para los diferentes nutrientes fue básicamente la misma. Para el propósito de este artículo, sólo la variación en los valores de proteínas será ilustrada (Figura 6).
Figure 6: Variation experienced in protein analytical results of various lucerne samples.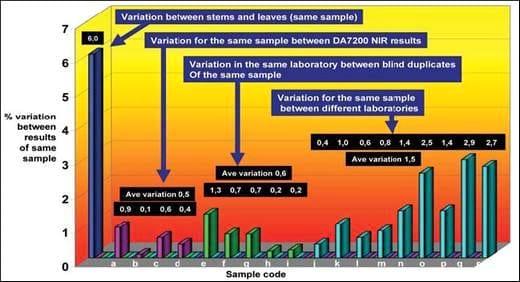
De este estudio, fue evidente que la repetición de resultados NIR fue al menos tan bueno como con los duplicados a ciego del mismo producto al ser químicamente analizado por el mismo laboratorio. Esto confirma la afirmación hecha por Williams y Norris (2001), que la precisión de los instrumentos NIR modernos es a menudo superior que aquella del método de referencia con el cual son comparados. En contraste, la variación en los resultados obtenidos por la misma muestra entre diferentes laboratorios, ilustra el problema, el cual a menudo surge si un solo laboratorio de referencia no es utilizado. De hecho, las variaciones pueden deberse a distintos métodos analíticos, diferentes procedimientos de manipulación, una posible contaminación durante el manejo/molido de la muestra, un error humano, y una multitud de otros factores. Esto no es –por lo tanto- una pregunta sobre qué laboratorio o método es más correcto, sino más bien asegurarse que el mismo laboratorio de referencia es usado para una aplicación particular, especialmente para resolver disputas.
La mayoría de los laboratorios se enorgullecen de su funcionamiento en los esquemas de control dentro del laboratorio, a donde muestras homogéneas, cuidadosamente preparadas son enviadas. Tales pruebas de esquema de control de las muestras a menudo reciben una atención más cuidadosa que las muestras mediocres de rutina, y esto no incluye necesariamente el aspecto más importante de la preparación de la muestra. Para análisis, donde la repetición entre diferentes laboratorios puede ser controlada fácilmente, un pequeño grupo de laboratorios cuidadosamente seleccionados y controlados podría ser utilizado. En la selección del grupo de laboratorios correcto, las muestras reales en su estado natural (idealmente tan variables como puedan ser experimentadas bajo condiciones normales) deberían, al ser distribuidas, ser además expuestas a los procedimientos completos de preparación y molienda de la muestra. De esta forma, los laboratorios seleccionados pueden estar mejor equipados para reportar también la variación real que el cliente puede esperar en muestras típicas, y no sólo la variación teórica que el instrumento utilizado para los análisis puede lograr. Sin embargo, para más aplicaciones analíticas complejas (por ejemplo: digestibilidad in vitro, aminoácidos, NDF, ADF, etc.), donde es sabido que existe una variación significativa entre los diferentes laboratorios, usar un solo laboratorio de referencia puede bien ser la mejor solución.
Barton y Keys (2001) hicieron un estudio independiente para ilustrar más la extensión entre los errores de laboratorio cuando se envían muestras a cuatro laboratorios muy reconocidos. En este ejemplo, la variación fue expresada como la desviación del estándar (SD), la cual es calculada por la fórmula:
SD = Σx2 - [(Σx)2 /N]/(N-1)}½ donde N es el número de muestras y x es el resultado analítico de una muestra particular.
El resultado del estudio fue como sigue: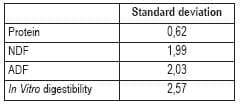
De la discusión previa, es aún más claro que cuando dos partes entran a un acuerdo de abastecimiento, o si las regulaciones de graduación de calidad (por ejemplo, con alfalfa) son formuladas, un laboratorio de referencia debería ser acordado de antemano por todas las partes afectadas. Para la industria del alimento para animales, este laboratorio debería ser –por ejemplo- el mismo que se utiliza para desarrollar y mantener la información usada en modelos de simulación computada y programas de regresión lineal para la formulación de alimentos para animales. La precisión del método de referencia debería ser además determinada por el análisis de muestras duplicadas a ciego en diferentes épocas. Esta precisión debería ser registrada en el acuerdo y reportada con cada análisis.
Variación de muestreo
El muestreo es la fuente individual de error más importante en cualquier análisis químico o físico-químico de artículos agrícolas, y de la mayoría de los ingredientes y productos alimenticios. Idealmente, la muestra debe ser verdaderamente representativa de la población total en cada sentido, incluyendo composición química, constitución física y presencia de material extraño (Williams y Norris, 2001). El muestreo representativo de forrajes es aún más complicado donde se debe tener cuidado para proteger la proporción natural de hojas y tallos. En alfalfa seca, por ejemplo, la proporción hojas/tallos puede ser fácilmente alterada por una preparación de muestra y un muestreo descuidados.
Como parte de su proyecto, Scholtz (2005; inédito) realizó un experimento para determinar la variación que puede darse dentro de una misma consignación de alfalfa (Figura 7). El envío consistió de 30 pacas, y una muestra de cada una fue extraída con un calador y analizada para contenido de proteína.
Figure 7: Variation in protein results obtained from 30 individual lucerne bales and by averaging different number of samples from the same consignment.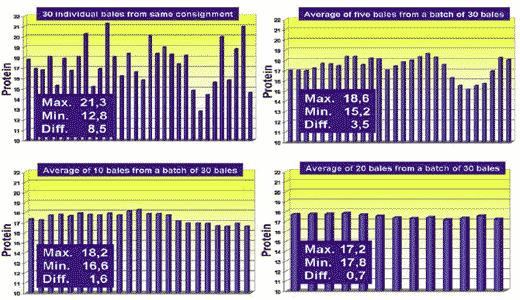
Cuando solo una paca fue muestreada y utilizada para evaluar la consignación entera, el resultado podría haber estado entre 12,8% y 21,3%, dependiendo de qué paca fue seleccionada. Si se eligieron cinco pacas al azar, y el promedio de esas cinco pacas solían representar la consignación, el resultado podría haber estado entre 15,2% y 18,6%. Para un promedio de diez pacas, la variación estuvo entre 16,2% y 18,2%; y si veinte pacas fueron seleccionadas como representativas de la consignación, la variación hubiera estado entre 17,2% y 17,8%, dependiendo de cuáles veinte pacas fueron seleccionadas. Las muestras con los valores más bajos y más altos fueron reanalizadas y la exactitud de los análisis fue confirmada. De este experimento puede concluirse que para una consignación de 30 pacas, al menos veinte tuvieron que ser analizadas para conseguir un valor promedio de proteína que esté dentro de la exactitud aceptable. Si este experimento es factible de hacerse, en la práctica necesita ser determinado; sin embargo esta variación de análisis es la realidad, y tiene que ser claramente comprendido cuando se realiza un análisis para determinar el valor nutritivo de un gran lote de cualquier producto específico. También debe ser enfatizado que los resultados obtenidos para una paca en particular no representa necesariamente el valor promedio de la paca. Durante el muestreo, una porción mayormente de tallos o de hojas puede haber sido tomada, dependiendo de la posición del calador y de la técnica. En un experimento ulterior, varias muestras deben ser tomadas de una paca individual para determinar la variación debido a la posición y el ángulo de calado de la muestra. Está previsto que los resultados de tal experimento pueden bien indicar que menos pacas pueden ser “muestreadas”, pero más muestras pueden ser tomadas de cada paca para dar mejores resultados representativos de un total menor de muestras.
Variación causada por la pulverización de la muestra
La pulverización es otra causa principal de variación en resultados analíticos (químicos y NIR). Esta es probablemente la mayor causa de contaminación entre pruebas, especialmente en operaciones de rutina cuando se procesa un gran número de muestras. Así mismo, el tamaño medio de partícula, la distribución del tamaño de partículas, y por lo tanto la señal difusa de reflectancia pueden ser afectadas marcadamente por el estado del molino utilizado en la muestra. Esta es una de las fases más importantes del trabajo analítico, y debería ser asignada solamente a trabajadores competentes y meticulosos. (Williams y Norris, 2001). Uno de los mayores avances en la tecnología NIR moderna es que los instrumentos disponibles ahora pueden analizar muestras exacta y efectivamente sin un previo pulverizado.
Ambiente operativo
Es importante considerar cuidadosamente las condiciones ambientales requeridas por varios instrumentos. Algunos instrumentos NIR pueden operar bajo condiciones de fábrica, donde hay variación de vibraciones y temperatura. Otros instrumentos están más ajustados a condiciones de laboratorio solamente, y pueden requerir medioambiente específico con temperaturas y aire acondicionado controlados, y áreas operativas libres de vibraciones. Esto no siempre puede ser fácil de lograr en un ambiente de producción, y debería por tanto ser tenido en cuenta cuando se realicen compras de ciertos instrumentos para tales ambientes.
Mantenimiento de calibración
Una buena calibración operativa debe ser continuamente chequeada y actualizada. La principal razón para una verificación y actualización de la calibración no se relaciona con el instrumento, sino más bien con la composición de la muestra. Las calibraciones desarrolladas con muestras de solo una estación, puede no ser necesariamente aplicable a todas las cosechas de las temporadas siguientes. Los cambios en las condiciones ambientales, variedades o una multitud de otros factores externos tales como pesticidas utilizados, control de maleza, grado de madurez, variaciones de humedad y muchos otros, sí ocurren (Dersjant-Li y Peisker, 2005), y pueden afectar la veracidad de los resultados NIR si no son incluidos en el grupo de datos de capacitación. Es por tanto necesario establecer procedimientos apropiados de verificación y actualización de la calibración. Las muestras deberían ser regularmente enviadas para análisis clínicos normales para confirmar que la calibración es aún aplicable para ese producto en particular.
Conclusión
Manejado apropiadamente, la Espectroscopía NIR es la tecnología ideal para análisis rápidos. En la industria del alimento para animales puede ser utilizada para la gradación de calidad de la materia prima (por ejemplo, alfalfa), análisis de ingredientes para la formulación del alimento, y verificación de la calidad del producto final. No se requieren habilidades especiales o preparación de muestras; los instrumentos son fáciles de operar, y los resultados están disponibles de inmediato. La preparación de la calibración, y especialmente los programas de mantenimiento de una calibración apropiada, son sin embargo esenciales para asegurar resultados confiables continuos. Finalmente, tomar decisiones informadas, basadas en algunos resultados analíticos (NIR, así como también análisis químicos tradicionales), es importante tomar en cuenta la variación normal dentro de un producto determinado, y consecuentemente, sabiendo lo que sería la exactitud esperada de los resultados.  Engormix.com agradece a los autores del artículo técnico y especialmente a AFMA (Animal Feed Manufacturers Association) y su Gerente General Hansie Bekker
Engormix.com agradece a los autores del artículo técnico y especialmente a AFMA (Animal Feed Manufacturers Association) y su Gerente General Hansie Bekker

Los análisis con NIR y MIR, tiene la precisión que le puedes generar. La Librería de espectros es la gran fuente. Pero lo importante es que con tu propia información, generes tu librería y tendrás en manos el más potente e instantáneo analizador.
Sugiero una comunidad. Un foro de usuarios.


California Pellet MILL (CPM)



FIGAP - Exposición Internacional





E.S.E. & INTEC











