INTRODUCCIÓN
La micoplasmosis aviar es una enfermedad ampliamente difundida en el mundo (Cerdá et al., 1998), convirtiéndose en una de los problemas sanitarios más importantes de la industria aviar. Mycoplasma Spp es de gran interés en la medicina veterinaria debido a las grandes pérdidas que genera en la producción animal. Entre los más importantes en avicultura se encuentra el MG, responsable de la ERC de las aves, que resulta en una pobre conversión alimenticia, una disminución en la producción de huevos y un aumento en la muerte embrionaria (Ver Tabla 1) (Kleven, 1990).
Mycoplasma spp., es miembro de la clase mollicutes, del orden Mycoplasmatales, género Mycoplasma. Son bacterias procariotas que poseen ácido desoxirribonucleico (DNA) y ácido ribonucleico (RNA), con un genoma de peso de 5x1<J kilodaltons (kDa) y carecen de pared celular (Stivkovits & Kempf, 1996), solamente están rodeadas por una membrana plasmática, lo que las hace muy resistentes a los antibióticos cuyo mecanismo se basa en la eliminación de la pared celular (Pulido, 2009).
Tabla 1 Parámetros zootécnicos en pollos de engorde con Mycoplosm a spp.
Ilustración 1 Colonias de Mycoplosmo go/lisepticum
Estas bacterias tienden a ser especie específico, habiéndose identificado más de 100 especies, algunas de ellas no patógenas. Por lo general colonizan las superficies mucosas, y aunque la mayoría de las especies no son invasivas, el MG tiene la capacidad de penetrar las células de la tráquea (Kleven & Fletcher, 1983). MG se mantiene viable de 2 a 5 años cuando es almacenado a -30°C, y se han recuperado MG de cornetes liofilizados y almacenados por 14 años (Ley et al., 2003).
Mycoplasma spp., se puede transmitir de manera vertical y horizontal, siendo importante considerar en la horizontal la presencia de aves silvestres y de traspatio. En estudios realizados por Ley et al., (1997) se comprobó la presencia de MG en pinzones (Corpadacus mexicanus) por pruebas moleculares de Reacción en Cadena de la Polimerasa (PCR).
Tanto el MG como el Mycoplasma synooiae (MS) pueden causar una infección subclínica del tracto respiratorio, produciendo traqueítis, sinusitis y aerosaculitis (Kleven et al., 1998), debido a que estos microorganismos están comprometidos en la ERC que general- mente se presenta posterior a una inmunización con vacunas vivas de la enfermedad de Newcasde y Bronquitis (Cerda et al., 1998; Sisa &Pulido, 2009).
Para el control y tratamiento del MG se usan antibióticos que tengan acción en el RNA de la bacteria. Las más frecuentes son las pleuromutilinas (tiamulina), derivados de los macrólidos (tilosina, kitasamicina, eritromicina, josamicina y espectinomicina), las quinolonas (enrofloxacina, ciprofloxacina, norfloxacina) y las tetraciclinas. El uso de la tiamulina es efectivo para el tratamiento de MG y el MS a una dosis entre 12,5-25 mg/kg en el agua de bebida o en el alimento (Laber, et al., 1977).
El objetivo de esta revisión de literatura, es estudiar la respuesta de las diferentes pruebas serológicas en los pollos de engorde y analizar la efectividad del antimicoplágsmico tiamulina a una dosis de tratamiento, que va desde 12,5 mg/kg- 25 mg/kg administrado en el alimento o agua de bebida, corroborando la disminución en las lesiones causa das por la ERC.
Morfología
MG cuando se tiñe con Giemsa, presenta las características de las bacterias gramnegativas, a la luz del microscopio el organismo es cocoide, de un tamaño de 0.25 a 0.5JJ., para el movimiento sus membranas están en contacto con el substrato facilitando su desplazamiento y patogenicidad en la tráquea (Bredt et al., 1973).
Sintomatología
En los pollos de engorde en el campo, la enfermedad clínica por MG se desarrolla desde la tercera o cuarta semana de edad, se caracteriza por descargas nasales y conjuntivitis, usual- mente de carácter leve o subclínico. Cuando las cepas de MG son agresivas se presenta traqueítis y aerosaculitis grave. Además, pueden coexistir infecciones secundarias con MS, virus respiratorios (pe. Bronquitis Infecciosa y Newcastle), y otras bacterias como Escherichia coli causando la ERC (Kleven, 1.990).
Requerimientos de Crecimiento In Vitro
Para su replicación y crecimiento se usan varios medios, uno de los más comunes es el de Frey que está compuesto de 10 a 1S% de suero inactivado de cerdo, caballo o ave. Cuando se usa suero de cerdo, es conveniente mezclar acetato de talio (1:4000) y penicilina (2000UI/ml), para su identificación el MG fermenta la glucosa a pH de 7.8 y una temperatura de 37°C lo que causa una reacción con el rojo fenol que va de naranja hasta amarillo indicando el crecimiento, el cual se observa de 3 a S días (Frey et al., 1970).
El medio de Frey tiene la siguiente composición: 1SO ml de suero porcino calentado a S6°C por una hora, 100 ml de extracto de levadura fresca al 2S% (p/v), 10 ml de glucosa en solución al 10% (p/v), 10 ml de acetato de talio al S% (p/v), S ml de penicilina G a 200.000 UI, y 20 ml solución rojo fenol al 0,1%, el pH se ajusta a 7.8 (Frey et al., 1970).
Estructura Antigénica para la Lectura de las Pruebas
La respuesta inmunológica a la infección se mide con las pruebas de laboratorio Aglutinación Rápida en Placa (ARP), Inhibición de la Hemaglutinación (HI), e Inmuno-ensayo Ligado a Enzima (ELISA). Las características antigénicas del MG son específicas a las respuestas de los anticuerpos policlonales, estos son usados para identificar los antígenos e inhibición de la hemaglutinación y pruebas de inmunofluorescencia. Se considera que una sola de estas pruebas no es suficiente para un diagnóstico definitivo, se deben complementar varias pruebas para mayor sensibilidad y especificidad (Kleven et al., 1997).
Diagnóstico Serológico
La ARP continúa siendo la técnica más empleada; la mayor ventaja es la alta sensibilidad, permitiendo detectar bajos títulos de anticuerpos IgM en forma temprana (7 a 10 días post infección) pero tiene inconvenientes de especificidad, ya que da reacciones falsas positivas con sueros de aves vacunadas con bacterinas oleosas o con infecciones de Stafhylococcus spp. y Streptococcus spp (Glisson et al., 1984). En esos casos se debe hacer tratamiento térmico a los sueros (descomplementar) en baño maría a S6°C por 30 minutos y diluirlos en Phosphate Buffer Solution (PBS) (las reacciones inespecíficas desaparecen en sueros 1:10). También es común observar reacciones cruzadas suaves, en sueros positivos a MS y Mycoplasma iowae (MI), especies que comparten un alto grado de correlación antigénica con el MG (Bradbury et al., 1983); esta técnica es generalmente empleada como prueba tamiz o "screening" para detección de muestras positivas, las cuales deben ser luego confirmadas por una prueba serológica de mayor especificidad, como la prueba de ELISA o HI (Cerda et al., 1998). La interpretación de los resultados de la prueba rápida en placa es la siguiente: 0/10: negativo, 1/10:sospechosos, 2/10: francamente positivo.
La prueba de ELISA es muy sensible, determina IgG, lo cual es muy recomendable en pollitos de un día de vida, detecta anticuerpos tardíos de los 1S a 21 días post infección; esto permite diagnosticar desafíos de campo por aumentos significativos de los títulos de las inmunoglobulinas IgG, los resultados se interpretan de acuerdo a las recomendaciones del laboratorio productor del Kit de HI, y es de la siguiente manera 0: negativos, entre 1- 2SOO: control, y >SOOO: reto de campo o respuesta vacunal.
La prueba de HI, es de muy alta especificidad y se emplea generalmente para confirmar los resultados ARP y ELISA (Vanderman et al., 1969), detecta IgG entre los 1S y 21 días post infección, pero su sensibilidad es baja. En ocasiones se pueden obtener falsos negativos debido a la presencia de variantes antigénicas que difieren de las cepas utilizadas como antígenos en la prueba de HI (Avakian et al., 1998). En la interpretación de resultados como norma general se considera una muestra positiva con un título de 1:40 y negativas menor o igual 1:20 (Cerda et al., 1998).
Biología Molecular
La técnica de la PCR puede utilizarse para la detección del DNA del MG, y es especialmente útil dada su alta sensibilidad, se usa fundamentalmente para monitorear los lotes de abuelas y reproductoras pesadas (Lauerman, 1998; García et al., 2005). El resultado que arroja la prueba es de positiva o negativa para la muestra evaluada de MG.
Recientemente se describió el desarrollo y la validación de una prueba de PCR en tiempo real, utilizando una sonda marcada Taqman. La prueba demostró ser altamente específica con un índice de detección de 25 copias de DNA por reacción y un límite de cuantificación de 100 copias de DNA, además de específica fue altamente sensible y rápida. Esta técnica ofrece una gran ventaja para el diagnóstico de micoplasmosis, ya que puede detectar infecciones en forma muy temprana, antes que las aves seroconviertan (Callison et al., 2006).
Las técnicas de PCR- RFLP (Polimorfismo en la Longitud del Fragmento de Restricción) y PCR-RAPD (DNA polimórfico amplificado al azar) (Hong et al., 2005) siguen presentando una mayor reproductibilidad y especificidad para estudios de diferenciación de cepas de campo, para fines epidemiológicos o para diferenciación de cepas vacúnales, sin embargo re- quieren de aislamiento, identificación y purificación de la cepa estándar (Cerda et al., 1998).
Se han utilizado diferentes regiones del genoma para realizar la prueba de PCR como: el 16S rRNA, el gapA, la LP, el mgc2, vlha (Kempf, 1998) y la región intergenica del rRNA 16S-23S (Raviv, 2007). El gen 16SrRNA corresponde a una región altamente conservada del genoma de las bacterias y permite establecer las relaciones filogenéticas existentes entre los organismos procariotas (Herrera, 2010).
Control y Tratamiento de la Enfermedad
Para evitar la transmisión horizontal del MG al pollo de engorde, en muchos países se mantienen los planteles de reproductoras pesadas libres del MG, y se aplican protocolos de bio- seguridad muy estrictos, además, las empresas han comenzado a aplicar planes de control mediante las vacunas vivas, oleosas y programas de medicación preventiva o curativa (Feberwee et al., 2006). El objetivo de usar vacunas vivas no es lograr la erradicación del MG, es desplazar la cepa de campo virulenta por la vacunal, existen reportes de desplazamiento de la cepa de campo por una cepa vacunal tipo F en forma experimental (Kleven, et al., 19 98). Sin embargo, existen programas de erradicación del MG mediante la aplicación de enrofloxacina y oxitetraciclina (Stanley et al., 2002)
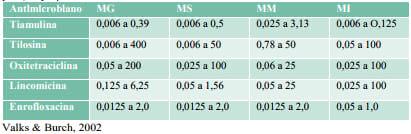
Según los estudios el FTH (ver tabla 2) es el antibiótico más efectivo para el tratamiento del MG, MS, MI, y Mycoplasma meliagridis (MM) (Valks, 2002), por las bajas concentraciones mínimas inhibitorias (MIC) que deben ser usadas para eliminar la micoplasmosis aviar.Se ha demostrado que al usar tiamulina a una dosis de 25 mg/kg (250 ppm) en el agua de bebida, las lesiones en el saco aéreo fueron del 3%, y el reaislamiento del MG fue del 10%, comparada con la tilosina, donde las lesiones de los sacos aéreos fueron de un 52% y el reaislamiento de un 50%, cuando se usó tilosina una dosis de 50mg/kg (500ppm) en el agua de bebida (Stipkovits et al., 1999).
En un estudio en el que se usaron aves de 8 semanas de edad, la tiamulina se administró a concentraciones de 0.0125% (12,5mg/Kg), O.025% (25mg/Kg) y tilosina a 0.05% (50 mg/ kg) en el agua de bebida durante un periodo de 5 días, se realizaron estudios de farmacocinética 48 horas después y los resultados fueron que la tiamulina alcanzó niveles séricos 3 y 6 veces más altos respectivamente que la tilosi.na (Ziv et al.,1980).
Tabla 2 Rangos de sensibilidad antimicrobial (IJ/ml.) Contra Mycoplasm o gollisepticum [MG). Mycoplosmo
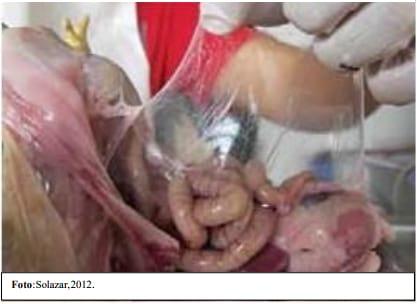
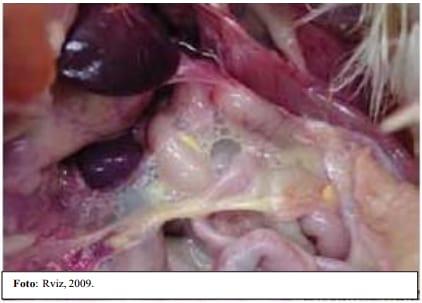
Ilustración 3 Fotog10ms 2 y 3. Saco aéreo notmd
Ilustración 2 Saco Aéreo con ERC.
Actividad de lo Tiomulino frente o Aislamientos de Campo
En Taiwán se evaluaron 100 aislamientos de campo de 35 granjas avícolas, el 98% fueron sensibles a una MIC de 0,4 p/rrd de tiarnulina, y solo el 55% fueron sensibles a la tilosina; diversos antibióticos mostraron resistencia. La tiamulina también demostr6 tener actividad contra ciertas bacterias y clamidias (Thakata, et al., 1992).En otro estudio reportado por Valks & Furch (2002), MG no mostró desarrollo de resistencia en los últimos 25 años en lotes de pollos tratados con tiarnulina.
La tiamulina se concentra 46 veces en el tejido pulmonar más que su nivel en suero sanguíneo, esta alta absorción en el tejido respiratorio brinda la protección contra otras bacterias que se localizan en esta región anatómica. En suero la absorci6n de la tiamulina supera el 90% alcanzando el máximo a nivel sanguíneo a las 2 horas después de su administración oral, se metaboliza en el hígado y se excreta a través del riñ6n (Ziv et al., 1980).
Discusión
El diagn6stico de laboratorio para M,ccplasmta aviares, todavía continua siendo, un tema de discusión, ya que los estudios más recientes sugieren que para confirmar un problema en campo es necesario emplear varias pruebas, porque cada una analiza diferentes tipos de inmunoglobulinas en diferentes edades de las aves, el desarrollo de técnicas más sensibles y específicas como la PCR en tiemporeal permite vislumbrar una interpretación más exacta de la enfermedad.
Es absolutamente claro que para mantener los planteles de pollos de engorde controlados para MG, es necesario que las reproductoras estén libres de dicho microorganismo. Esto es un proceso difícil de lograr en nuestro país por el manejo de las granjas con diferentes edades.
Las características farmacocinéticas de la tiamulina, la convierten en un antibi6tico de elecci6n parael tratamiento de la micoplasmos en pollos de engorde. Su uso a dosis de 12,5 a 25 mg/kg garantiza su eficacia en el tratamiento de las diferentes especies de micoplasmas avíales.
Referencias
- Avakian, A.P.; Kleven, S.H.; Glisson J.R. 1998. Evaluation of the specificity and sensitive of two commercial enzymeleked immnunoabsorvent assay kits, the serum plate agglutination test and the hemagglutination- inhibition test for antibodyes formed in response to Mycoplasma gallisepticum. Avian Disiseases. 32: 262-272.
- Bradbury, J.; Forrest, M. Mycoplasma Lipofaciens a new species. 1983. Int Sys Bacteriol. 33:329-335. Bredt, W. 1973. Motitlity of Mycoplasmas, Amn NY. Aead Science. 225: 246-250.
- Callison, S.A.; Riblet, S.M.; Sun, S.; Kleven, S.H. 2006. Development and validation of real-time Taqman polimerasa chain reaction Assay detection of Mycoplasma gallisepticum. Avian Diseases. 50:537-544.
- Cerda, R.O.; Xavier, J.A.; Petrucelli, M.; Echeveriogaray. 1998. Aislamiento de Mycoplasma Synoviae de pollos parrilleros y gallinas reproductoras, primera comunicación de la República Argentina. Analecta Veterinaria. 18:41-46.
- Feberwee, A.; Vernooij, J.C.M.; Gielkens, A.L.J. 2006. Effect of Vaccine live on the horizontal transmission of Mycoplasma Gallisepticum. Avian Pathology. 35:359-366.
- Frey, M.C.; Hanson; Anderson, D.P. 1970. Medium for the Isolation of Avían Mycoplasma. Amj Veterinary Research. 29: 2163-2171.
- Garcia, M.; Ikuta, N.; Levisohn; Kleven, S.H. 2005. Evaluation in Chickens. Avian Diseases. 49: 125-132.
- Glisson, J.R.; Dawe, J.F.; Kleven, S. 1984. The effect of oilemulsion vaccines on occurrence of nonspecific plate agglutination reactions for Mycoplasma gallisepticum and M. synoviae. Avian Diseases. 28:397-405.
- Herrera, J.M. 2010. Filogenia bacteriana mediante el análisis de rRNA 16S. Universidad Nacional Autónoma de México. 67-70.
- Kempf, L. 1998. DNA amplification methodos for diagnosis in epidemiological investigation of avian mycoplasmas. Avian Pathologist. 7:7-14.
- Kleven, S.; Swayne, H.D.E.; Glisson, J.M.; Jackwood, M.W.; Person, J:W.; Reed, W. 1998. Chapter 19. In: Laboratory Manual for the isolation and identification of Avian pathologist: Kennett Square, PA. 74-80.
- Kleven, S. 2003. Chapter 11. In: Mycoplasmosis in Diseases of poultry 11 ED. Iowa State University. Kleven, S.; Calnenek, W.; Barnes, W.; Beard, C:W.; McDouglad, L.R.; Y. M. 1997. Chapter 11. In: Saif Disease of Poultry, 10th Ed. Iowa State, University press. Ames, IA. 191-193.
- Kleven, S.; King, D.; Anderson. 1972. Airsaculitis in broilers from Mycoplasma synoviae; Effect on air sac lesión of vaccinating with infectius bronchitis and Newcastle virus. Avian Diseases. 16: 916-924.
- Kleven, S.H. 1990. International Organization of Mycoplasmology Meeting, Babolna, Hungary. Avian Pathology. 19:795. Kleven, S.; Fletcher, W. 1983. 27 Laboratory Infection of house sparrows. Avian Diseases. 7: 308.
- Kleven, S.H. 1990. Summary of discusion of avian mycoplasma Avían Diseases. 719. Laber, G.; Schuzle, E. 1977. Tratmen of Mycoplasma Gallisepticum with Tiamulin the journal of Antibiotics. 30 (12): 1119.
- Laureman, L.H. 1998. Mycoplasma PCR assay. In: Laureman, L.H (Ed), Nucleotid Acid Amplification assay for diagnosis of animal disease. American Association of Veterinary Laboratory Diagnosis, Ames, IA. 41-42.
- Ley, J.M.; Milles, S.H. 1997. C 41. Transmision de Mycoplasma gallisepticum. Avian Diseases. 187-194.
- Pulido, L.M. 2009. Experiencias positivas en el control Mycoplasma en Granjas Comerciales. Universidad Nacional de Colombia. 1-8.
- Raviv, Z.; Callison, S.; Ferguson-Noel.; Labinis, N.; Wooten, N.L.; Kleven, S. 2007. The Mycoplasma gallisepticum 16s- 23S rRNA Intergenic espacer region sequence as a novel toll for epizootiological studies. Avian Diseases. 51(2): 555-560.
- Stipkovists, L.; Burch, D.G.S. 1997. Evaluación de la eficacia de la Tiamulina en pollos, Un modelo para Mycoplasma Gallisepticum; Octagon Service. Budapest, Hungria. 81.
- Stipkovits, L.; Burch, D. 1994. 9th European Poultry Conference 1,171. Stipkovits, L.; Salyi, R.; Glavits.; Burch, D:G:S. 1999. Testing the compatibility of combination of Tiamulin/ Clortetracicline 1:3 premix given in feed at different levels. Avian Pathology. 28:579-586.
- Stipkovits, L.; Gravitas, L.; Evanics, E.; Szabo, E. 1993. Additional data en Mycoplasma disease of goslings. Avian Pathology. 22:171-176.
- Stipkovits, L.; Burch, D.G.S. 1997. Evaluation of efficacy of tiamulin in the prevention of model infection with Mycoplasma gallisepticum in chikens, proceedings of the Xth World Veterinary Poultry Association Congress, Budapest, Hungary. 81.
- Stipkovits, L.; Kempf, I. 1996. Mycoplasmoses in poultry. Rev Sci Tech. 15:1495-1525.
- Takatha, T. and others. 1992. 19th Worlds poultry Congress, Amsterdam. The Netherlands.
- Vandermann, T.H.; Yoder, H.W. 1969. Preparation of Mycoplasmas Synoviae Hemaglutinating antigen and its use in the hemaglutination inhibition test. Avian Diseases. 13:654-661.
- Valks, M. 2002. CMI de Tiamulina para Mycoplasma gallisepticum. Documento de Marketing.
- Valks, M.; Burch, D.G.S. 2002. Comparative activity and resistence development of tiamulin and other antimicrobials against of Mycoplasma, Word Veterinary Poultry, El Cairo. 200.
- Ziv, G. 1980. Comparative activity and resistence and development of tiamulin and other antimicrobials against Avian mycoplasma. The Veterinary Quarterly. 2(4):206.
Este trabajo es la primera de cuatro partes de Consideraciones Epidemiológicas sobre Mycopasmas spp en Aves y Cerdos: