Efecto de la relación calcio y fósforo sobre las características óseas, porcentaje de cenizas e integridad esquelética en pollos de carne
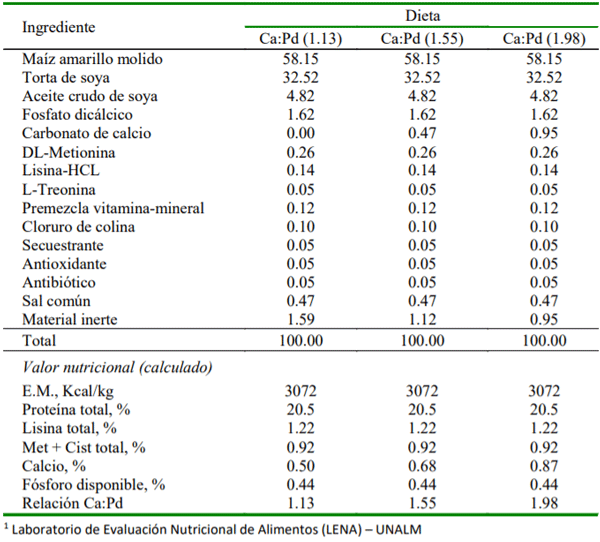
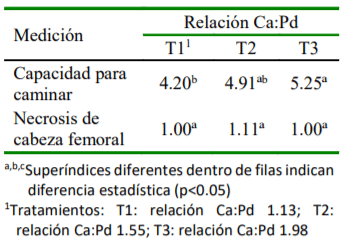
El objetivo del presente ensayo fue determinar el efecto de la relación calcio (Ca) y fósforo disponible (Pd) sobre la morfometría y mineralización ósea e integridad esquelética de pollos de carne. Se utilizaron 60 pollos de la línea Cobb 500 de un día de edad distribuidos en 12 unidades experimentales y asignados, durante 21 días, a uno de los siguientes tratamientos: T1, Ca:Pd baja (1.13); T2, Ca:Pd media (1.55); T3, Ca:Pd adecuada (1.98). Todas las dietas contenían 3072 Kcal de EM/kg y 20.50 % de proteína cruda. El alimento, en forma de harina, y el agua fue ofrecido ad libitum. En el día 21 de edad se sacrificaron todos los animales para extraer fémures, tibias y metatarsos. Se evaluaron variables que incluyeron morfometría ósea (peso, longitud, ancho, volumen y densidad), integridad esquelética (capacidad para caminar y lesiones en la cabeza femoral) y se determinó el contenido de ceniza en la tibia. La data fue analizada empleando un Diseño Completamente alAzar usando el procedimientoANOVAyla prueba de Duncan para la comparación de medias. Los resultados mostraron que el contenido de ceniza en tibia fue afectado significativamente (p<0.01) por cada cambio en la relación Ca:Pd. En comparación con las relaciones Ca:Pd de 1.98 y 1.55, la relación Ca:Pd de 1.13 afectó la capacidad para caminar (p<0.03) y la densidad de la tibia (p<0.05). En conclusión, el contenido de ceniza en tibia es sensible a cambios en la relación Ca:Pd, mientras que indicadores de integridad esquelética solo son afectados cuando la relación Ca:Pd está por debajo de 1.55.
Palabras clave: calcio; fósforo; morfometría ósea; pollos de engorde
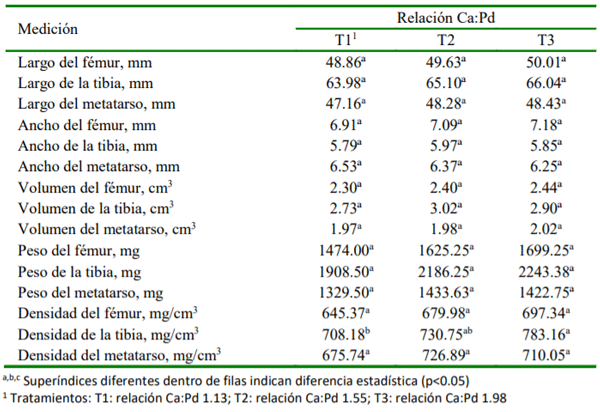
- La densidad del hueso tibia es la característica ósea de morfometría más influenciada por cambios en la relación Ca:Pd.
- La integridad esquelética evaluada a través de la capacidad para caminar está influenciada con relaciones Ca:Pd de 1.13.
- El contenido de ceniza en tibia fue la variable más sensible a cambios en relación Ca:Pd.
- 1. Abudabos AM. 2012. Optimal dietary phosphorus for broiler performance,- bone integrity and reduction of phosphorus excretion. Asian J Anim Vet Adv 7: 288-298. doi: 10.3923/ajava.- 2012.288.298.
- 2. Acosta A, Lon-Wo E, Cárdenas M, Febles M, Dieppa O, Almeida M. 2009. Determinación de la biodisponibilidad relativa del fósforo en la fosforita del yacimiento Trinidad de Guedes, mediante pruebas de crecimiento y mineralización ósea en pollos y gallinas ponedoras. Rev Cubana Cienc Agríc 43: 55-59.
- 3. Aguilar J, Zea O, Vílchez C. 2018. Rendimiento productivo e integridad ósea de pollos de carne en respuesta a suplementación dietaria con cuatro fuentes de fitasa comercial. Rev Inv Vet Peru 29: 169-179. doi: 10.15381/rivep.v29i1.14078
- 4. Almeida ICL, Mendes AA, Balog A, Vulcano LC, Ballarin AW, Almeida ICL, et al. 2008. Study on the bone mineral density of broiler suffering femoral joint degenerative lesions. Braz J Poult Sci 10: 103-108. doi: 10.1590/ S1516-635X2008000200005
- 5. Angel R, Saylor WW, Mitchell AD, Powers W, Applegate TJ. 2006. Effect of dietary phosphorus, phytase, and 25- hydroxycholecalciferol on broiler chicken bone mineralization, litter phosphorus, and processing yields. Poult Sci 85: 1200- 1211. doi: 10.1093/ps/85.7.1200.
- 6. Applegate TJ, Lilburn MS. 2002. Growth of the femur and tibia of a commercial broiler line. Poult Sci 81: 1289-1294. doi: 10.1093/ps/81.9.1289
- 7. Bar A, Shinder D, Yosefi S, Vax E, Plavnik I. 2003. Metabolism and requirements for calcium and phosphorus in the fast-growing chicken as affected by age. Brit J Nutr 89: 51-60. doi: 10.1079/BJN2002757
- 8. Baumel JJ, Witmer LM, King AS, Breazile JE, Evans HE, Vanden Berge JC. 1993. Handbook of avian anatomy: Nomina anatomica avium. 2nd ed. Publication N.° 23. Massachusetts, USA: Nuttall Ornithological Club. 401 p.
- 9. Bond PL, Sullivan TW, Douglas JH, Robeson LG. 1991. Influence of age, sex, and method of rearing on tibia length and mineral deposition in broilers. Poult Sci 70: 1936-1942. doi: 10.3382/ ps.0701936
- 10. Buckner GD, Insko WM, Harms A, Faull E. 1950. The comparative rates of growth and calcification of the femur, tibia and metatarsus bones of the male and female New Hampshire chicken having straight keel. Poult Sci 29: 332- 335. doi: 10.3382/ps.0290332
- 11. Chung TK, Rutherfurd SM, Thomas DV, Moughan PJ. 2013. Effect of two microbial phytases on mineral availability and retention and bone mineral density in low-phosphorus diets for broilers. Brit Poult Sci 54: 362-373. doi: 10.1080/ 00071668.2013.783902
- 12. Cobb-Vantress. 2012. Guía de manejo del pollo de engorde. [Internet].
- 13. da Silva CS; Baraldi SM, Francelino L, Quirino MF, Mack JO, Roque AI. 2003. Bone development of broiler chickens fed diets with different amino acid and calcium levels during the starter phase. Int J Morphol 21: 101-106. doi: 10.4067/S0717-95022003000200001
- 14. de Groote G, Huyghebaert G. 1997. The bio-availability of phosphorus from feed phosphates for broilers as influenced by bio-assay method, dietary Ca-level and feed form. Anim Feed Sci Tech 64: 329- 340.
- 15. Driver JP, Pesti GM, Bakalli RI, Edwards Jr HM. 2005. Calcium requirements of the modern broiler chicken as influenced by dietary protein and age. Poult Sci 84: 1629-1639. doi: 10.1093/ps/84.10.1629
- 16. García AR, Dale NM. 2006. Foot ash as a means of quantifying bone mineralization in chicks. J Appl Poult Res 15:103-109. doi: 10.1093/japr/15.1.103
- 17. Han HC, Qu HX, Wang, JG, Chen GH, Yan YF, Zhang JL, Hu FM, et al. 2015. Comparison of the growth and mineralization of the femur, tibia, and metatarsus of broiler chicks. Braz J Poult Sci 17: 333-340. doi: 10.1590/1516- 635X1703333-340
- 18. Kayode Z, Omolara M, Henry O. 2016. Effect of strain and age on bone integrity of commercial broiler chickens. Biotechnol Anim Husb 32: 195-203. doi: 10.2298/BAH1602195
- 19. Kestin SC, Knowles TG, Tinch AE; Gregory NG. 1992. Prevalence of leg weakness in broiler chickens and its relationship with genotype. Vet Rec 131: 190-194. doi: 10.1136/vr.131.9.190
- 20. Kocabagli N. 2001. The effect of dietary phytase supplementation at different levels on tibial bone characteristics and strength in broilers. Turk J Vet Anim Sci 25: 797-802.
- 21. Leach RM, Lilburn MS. 1992. Current knowledge on the etiology of tibial dyschondroplasia in the avian species. Poult Sci 4: 57-65.
- 22. Marques A, Murakami A, do Amaral C, Ospina I, Picoli K, Mangili M. 2013. Use of vitamin D3 and its metabolites in broiler chicken feed on performance, bone parameters and meat quality. Asian Austral J Anim 26: 408- 415. doi: 10.5713/ajas.2012.12455
- 23. Martínez DA. 2012. Evaluación de un producto a base de aceite esencial de orégano sobre la integridad intestinal, la capacidad de absorción de nutrientes y el comportamiento productivo de pollos de carne. Tesis de Magíster. Lima: Univ. Nacional Agraria La Molina. 268 p.
- 24. Nelson TS, Kirby LK, Johnson ZB. 1990. Effect of minerals on the incidence of leg abnormalities in growing broiler chickens. Nut Res 10: 525-533.
- 25. Pintar J, Homen B, Gazic K, Grbesa D, Sikiric M, Cerny T. 2004. Effects of supplemental phytase on performance and tibia ash of broiler fed different cereals based diets. Czech J Anim Sci 49: 542-548.
- 26. Quarantelli A, Cacchioli A, Romanelli S, Righi F, Alpigiani I, Gabbi C. 2007. Effects of different levels of dietary biotin on the performance and bone structure of broilers. Ital J Anim Sci 6: 5-17. doi: 10.4081/ijas.2007.5
- 27. Rath NC, Huff GR, Huff WW, Balog JM. 2000. Factors regulating bone maturity and strength in poultry. Poult Sci 79: 1024-1032. doi: 10.1093/ps/79.7.1024
- 28. Ribeiro F, Martínez S, Augusto L, Barbosa J, Morais A, Rita M, Amoroso L. 2011. Determination of broiler femur parameters at different growth phases. Int J Poultry Sci 10: 849-853. doi: 10.3923/ijps.2011.849.853
- 29. Rutten M, Leterrier Cu, Constantin P, Reiter K, Bessei W. 2002. Bone development and activity in chickens: response to reduced weight-load on legs. Anim Res 51: 327-336.
- 30. SAS Institute. 2000. The SAS System for Windows. User´s Guide Statistics v8. SAS Institute, Inc., Cary, USA.
- 31. Sato M. 1995. Comparative X-ray densitometry of bones from ovariectomized rats. Bone 17: 157-162. doi: 10.1016/8756-3282(95)00288-O
- 32. Takita TS. 1998. Efeito do genotipo, do ambiente e da interacao genotipo x ambiente na incidencia de discondroplasia tibial em frangos de corte machos. Tese de Mestrado. Brasil: Univ. Estadual Paulista. 41 p.
- 33. Thiex N, Novotny L, Crawford A. 2012. Determination of ash in animal feed: AOAC official method 942.05 revisited. J AOAC Int 95: 1392-1397. doi: 10.5740/jaoacint.12-129
- 34. Thorp BH, Waddington D. 1997. Relationships between the bone pathologies, ash and mineral content of long bones in 35-day-old broiler chickens. Res Vet Sci 62: 67-73. doi: 10.1016/S0034-5288(97)- 90183-1
- 35. Yan F, Angel R, Ashwell C, Mitchell A, Christman M. 2005. Evaluation of the broiler’s ability to adapt to an early moderate deficiency of phosphorus and calcium. Poult Sci 84: 1232-1241. doi: 10.1093/ps/84.8.1232
- 36. Walk CL, Santos TT, Bedford MR. 2014. Influence of superdoses of a novel microbial phytase on growth performance, tibia ash, and gizzard phytate and inositol in young broilers. Poult Sci 93: 1172-1177. doi: 10.3382/ps.2013-03571
- 37. Williams B, Waddington D, Solomon S, Thorp B, Farquharson C. 2010. Skeletal development in the meat-type chicken. Brit Poultry Sci 41: 141-149. doi: 10.1080/713654918.
- 38. Li X, Zhang D, Yang TY, Bryden WL. 2016. Phosphorus bioavailability: a key aspect for conserving this critical animal feed resource with reference to broiler nutrition. Agriculture 6: 1-15. doi: 10.3390/agriculture6020025
- 39. Zhang X, Liu G, McDaniel G.R, Roland DA. 1997. Responses of broiler lines selected for tibial dyschondroplasia incidence to supplementary 25- hydroxycholecalciferol. J Appl Poultry Res 6: 410-416. doi: 10.1093/japr/6.4.410






Estados Unidos de América









