Caracterización físico-química y microbiológica de la vinaza concentrada de destilería de alcohol
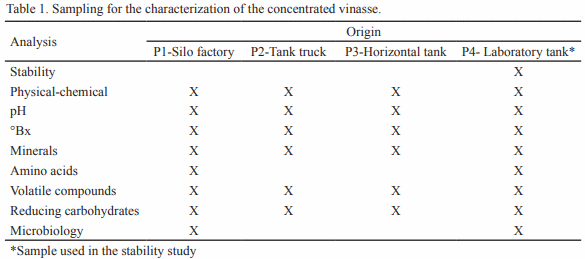
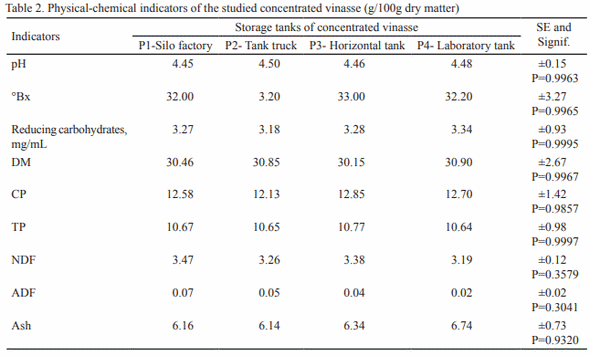
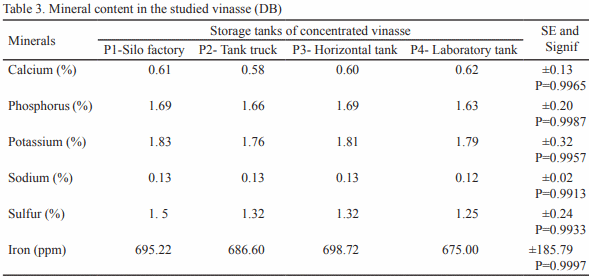
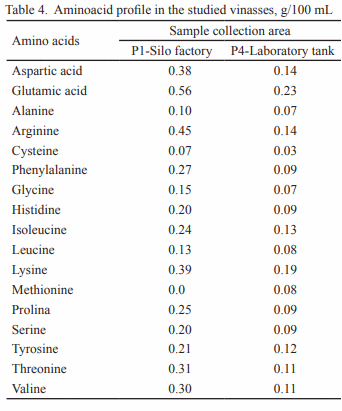
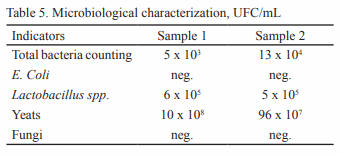
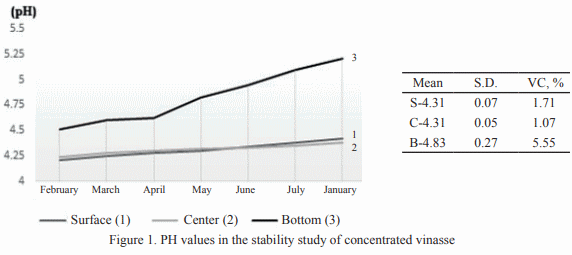
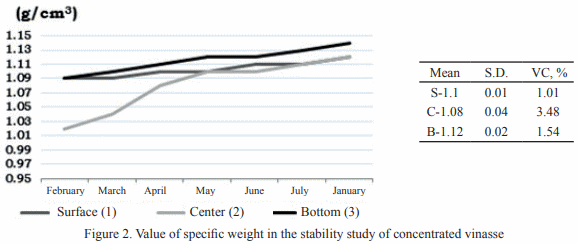
Se estudió la vinaza concentrada de destilería de alcohol para su posible utilización como aditivo en la alimentación animal. Para ello se seleccionaron muestras de diferentes depósitos y se analizó la composición química, física, microbiológica y estabilidad (pH y peso específico). En cada depósito se tomaron muestras por triplicado en frascos esterilizados de 25 mL y se realizó el muestreo durante cinco meses. Para el estudio de estabilidad, que se extendió doce meses, se utilizó la vinaza almacenada en el laboratorio. Los resultados indican que la vinaza concentrada presenta bajo valor de pH y 30 % aproximadamente de materia seca, siendo superior a las producidas antes en Cuba. Con el estudio microbiológico se demostró la inocuidad de la vinaza, al no informarse presencia de E. Coli ni de hongos. El análisis de estabilidad mostró que las vinazas no experimentan transformaciones en los indicadores analizados (pH 4.2 a 5.21 y peso específico 1.02 a 1.14 g/cm3 ) durante los cinco meses. Con los resultados obtenidos en el estudio se demuestra la potencialidad de la vinaza concentrada como aditivo en la alimentación animal.
Palabras clave: vinaza, composición, materia seca, estabilidad, aditivo
- AOAC, G. W. 2016. Official methods of analysis of AOAC International. 20th ed., Rockville, MD: AOAC International, ISBN: 978-0-935584-87-5, Available: , [Consulted: September 22, 2016].
- Aristizábal, A. C. E. 2015. “Caracterización físico-química de una vinaza resultante de la producción de alcohol de una industria licorera, a partir del aprovechamiento de la caña de azúcar”. Ingenierías USBMed, 6(2): 36–41, ISSN: 2027- 5846, DOI: 10.21500/20275846.1729, Available: , [Consulted: February 4, 2018].
- Bermúdez, R. C., Hoyos, J. A. & Rodríguez, S. 2000. “Evaluación de la disminución de la carga contaminante de la vinaza de destilería por tratamiento anaerobio”. Revista Internacional de Contaminación Ambiental, 16(3): 103–107, ISSN: 0188-4999, Available: , [Consulted: February 4, 2018].
- Bernstein, F. C., Koetzle, T. F., Williams, G. J. B., Meyer, E. F., Brice, M. D., Rodgers, J. R., Kennard, O., Shimanouchi, T. & Tasumi, M. 1977. “The Protein Data Bank”. European Journal of Biochemistry, 80(2): 319–324, ISSN: 1432-1033, DOI: 10.1111/j.1432-1033.1977.tb11885.x, Available: , [Consulted: February 4, 2018].
- Berón, M. G. 2005. “Usos alternativos de la vinaza de acuerdo con su composición química”. Tecnicaña, 17(9): 15–19, ISSN: 0123-0409.
- Camacho, L. L., Díaz, de los R. M., Pérez, B. I., Sánchez, G. N. & Ribas, G. M. 2016. “Recuperación del potasio en vinazas de destilerías mediante su precipitación con sulfato de amonio”. ICIDCA. Sobre los Derivados de la Caña de Azúcar, 50(2): 24–28, ISSN: 0138-6204, 1025-3076.
- Christofoletti, C. A., Escher, J. P., Correia, J. E., Marinho, J. F. U. & Fontanetti, C. S. 2013. “Sugarcane vinasse: Environmental implications of its use”. Waste Management, 33(12): 2752–2761, ISSN: 0956-053X, DOI: 10.1016/j.wasman.2013.09.005, Available: , [Consulted: February 21, 2018].
- De Blas, C., Mateos, G. & García-Rebollar, P. 2010. Tablas FEDNA de composición y valor nutritivo de alimentos para la formulación de piensos compuestos. 3rd ed., Madrid, España: Fundación Española para el Desarrollo de la Nutrición Animal (FEDNA), 502 p., Available: , [Consulted: February 4, 2018].
- Di Rienzo, J. A., Casanoves, F., Balzarini, M. G., González, L., Tablada, M. & Robledo, C. W. 2008. InfoStat. version 2008, [Windows], Córdoba, Argentina: Grupo InfoStat, Available: .
- Doorenbos, J., Rijnen, M., Van Laa, H. & Flores, M. A. 2004. “Valoración nutritiva de materias primas en los países bajos”. In: XX Curso de especialización FEDNA, Barcelona, España: Fundación Española para el Desarrollo de la Nutrición Animal (FEDNA), p. 27, Available: , [Consulted: February 4, 2018].
- DuBois, M., Gilles, K. A., Hamilton, J. K., Rebers, P. A. & Smith, F. 1956. “Colorimetric Method for Determination of Sugars and Related Substances”. Analytical Chemistry, 28(3): 350–356, ISSN: 0003-2700, DOI: 10.1021/ac60111a017, Available: , [Consulted: February 4, 2018].
- FEDNA (Fundación Española para el Desarrollo de la Nutrición Animal). 2017. Tablas de ingredientes para piensos. Vinazas de remolacha azucarera. FEDNA, Available: , [Consulted: January 4, 2017].
- Gallo, J. D., Ospina, H. & Santos, E. 1986. “Evaluación preliminar de la vinaza, un desecho de destilería, como posible fuente de nutrientes en la alimentación de aves”. Acta Agronómica, 36(2): 207–220, ISSN: 2323-0118, 0120-2812, Available: , [Consulted: February 4, 2018].
- García, A., Duarte, F. & Magaña, A. 1991. “Crecimiento y finalización de cerdos con diferentes niveles de vinaza”. Livestock Research for Rural Development, 3(1), ISSN: 0121-3784, Available: , [Consulted: February 4, 2018].
- García, C. Y., López, M. G. & Bocourt, R. 2009. “Fructans in Agave fourcroydes, potentialities for its utilization in animal feeding”. Cuban Journal of Agricultural Science, 43(2): 169–171, ISSN: 0034-7485, Available: , [Consulted: February 21, 2018].
- Gibson, G. R. & Roberfroid, M. B. 2008. Handbook of prebiotics. Boca Raton: CRC Press, 485 p., ISBN: 978-0-8493-8171-3. Gómez, P. J. F. 2009. “Nutrición líquida de la caña de azúcar con vinuera”. Revista Tecnicaña, 13(21): 31–32, ISSN:
- 0123–0409. Hidalgo, K., Rodríguez, B., Valdivié, M. & Febles, M. 2009. “Utilization of distillery vinasse as additive of broiler chickens ”. Cuban Journal of Agricultural Science, 43(3): 273–276, ISSN: 0034-7485, 2079-3472, Available: , [Consulted: February 21, 2018].
- Knecht, R. & Chang, J. Y. 1986. “Liquid chromatographic determination of amino acids after gas-phase hydrolysis and derivatization with (dimethylamino) azobenzenesulfonyl chloride”. Analytical Chemistry, 58(12): 2375–2379, ISSN: 0003- 2700, DOI: 10.1021/ac00125a006, Available: , [Consulted: February 4, 2018].
- Krishnamurti, C. R., Heindze, A. M. & Galzy, G. 1984. “Application of reversed-phase high-performance liquid chromatography using pre-column derivatization with o-phthaldialdehyde for the quantitative analysis of amino acids in adult and fetal sheep plasma, animal feeds and tissues”. Journal of Chromatography A, 315: 321–331, ISSN: 0021-9673, Available: , [Consulted: February 7, 2018].
- Leeson, E. 2006. “Temas de interés presentes y futuros en nutrición de aves”. In: XXII Curso De Especialización FEDNA, Barcelona, España: Fundación Española para el Desarrollo de la Nutrición Animal (FEDNA), pp. 143–150, Available: , [Consulted: February 4, 2018].
- Lugo, P. 2017. Evaluación del uso de la vinaza (residuo industrial) para la obtención de ácido cítrico empleando Aspergillus niger. M.Sc. Thesis, Universidad de Carabobo, Venezuela, 173 p., Available: , [Consulted: March 6, 2018].
- Mancilla, N. A. 2006. Caracterización molecular de fructanos en Agave y Dasylirion spp. identificación de fructosyl transferasas y su expresión en Pichia pastoris. Ph.D. Thesis, CINVESTAV - IPN, México, 192 p.
- Mc-Pherson, D., Reyes, K. & Socarrás, Y. 2002. “Evaluación de alternativas para el aprovechamiento del mosto alcoholero de destilerías y la reducción de la contaminación ambiental”. Tecnología Química, 22(1): 5–9, ISSN: 2224-6185.
- Moraes, B. S., Junqueira, T. L., Pavanello, L. G., Cavalett, O., Mantelatto, P. E., Bonomi, A. & Zaiat, M. 2014. “Anaerobic digestion of vinasse from sugarcane biorefineries in Brazil from energy, environmental, and economic perspectives: Profit or expense?”. Applied Energy, 113: 825–835, ISSN: 0306-2619, DOI: 10.1016/j.apenergy.2013.07.018, Available: , [Consulted: February 4, 2018].
- Otero, M. A., Estévez, R., Saura, G., Martínez, J. A., García, R. & Bello, D. 2010. “Experiencias en la producción de etanol a partir de jugos de caña mezclados. Parte II. Efecto de la temperatura y la concentración de azúcares”. ICIDCA. Sobre los Derivados de la Caña de Azúcar, 43(1): 29–34, ISSN: 0138-6204, 1025-3076, Available: , [Consulted: February 21, 2018].
- Pérez, L. H. 2007. “Beneficios de las levaduras vivas en la obtención de productos con actividad probiótica”. ICIDCA. Sobre los Derivados de la Caña de Azúcar, 41(3): 35–41, ISSN: 0138-6204, 1025-3076, Available: , [Consulted: February 21, 2018].
- Potter, N. N. & Hotchkiss, J. H. 1995. Food science. 5th ed., New York: Chapman & Hall, 608 p., ISBN: 978-0-412-06451-7.
- Rostagno, H., Teixeira, L., Lopes, J., Kazue, N., Guiherme, F., Saraiva, A., Lobão, M., Borges, P., De Oliveira, R., De Toledo, S. & De Oliveira, C. 2017. Tablas brasileñas para aves y cerdos. Composición de Alimentos y Requerimientos nutricionales. 4th ed., Brasil: Departamento de Zootecnia, Universidad Federal de Viçosa, 488 p., ISBN: 978-85-8179-122- 7, Available: , [Consulted: February 7, 2018].
- Scull, I., Savón, L., Gutiérrez, O., Valiño, E., Orta, I., Mora, P. O., Orta, H., Ramos, Y., Molineda, A., Coto, G. & Noda, A. 2012. “Physic - chemical composition of concentrated vinasse for their assessment in animal diets”. Cuban Journal of Agricultural Science, 46(4): 385–389, ISSN: 0034-7485, Available: , [Consulted: February 4, 2018].
- Stemme, K., Gerdes, B., Harms, A. & Kamphues, J. 2005. “Beet-vinasse (condensed molasses solubles) as an ingredient in diets for cattle and pigs – nutritive value and limitations”. Journal of Animal Physiology and Animal Nutrition, 89 (3-6): 179–183, ISSN: 1439-0396, DOI: 10.1111/j.1439-0396.2005.00554.x, Available: , [Consulted: February 4, 2018].
- Tungland, B. c. & Meyer, D. 2002. “Nondigestible Oligo- and Polysaccharides (Dietary Fiber): Their Physiology and Role in Human Health and Food”. Comprehensive Reviews in Food Science and Food Safety, 1(3): 90–109, ISSN: 1541-4337, DOI: 10.1111/j.1541-4337.2002.tb00009.x, Available: , [Consulted: February 21, 2018].
- USDA (United States Department of Agriculture) & FSIS (Food Safety and Inspection Service) 2008. Detection, Isolation and Identification of Escherichia coli O157:H7 from Meat Products and Carcass and Environmental Sponges. USA: USDA - FSIS, 14 p., Available: , [Consulted: February 4, 2018].
- Valdivié, M., Rodríguez, B. & Bernal, H. 2012. Utilización del jugo de caña como fuente de energía. En: Alimentación de aves, cerdos y conejos con yuca, batata, banano, arroz, caña, DDGS y amaranto. 1st ed., Mayabeque, Cuba: EDICA, 149 p., ISBN: 978-959-7171-20-1, Available: , [Consulted: February 4, 2018]. Van Soest, P. J. 1994. Nutritional Ecology of the Ruminant. 2nd ed., Ithaca, NY: Cornell University Press, 488 p., ISBN: 978-0-8014-2772-5, Available: , [Consulted: February 4, 2018].
- Vázquez, B. Y. L., Castro, L. I. & López, O. 2014. “Efecto de la aplicación de vinaza sobre algunos indicadores físicos de un suelo Pardo Sialítico carbonatado cultivado con tomate (Solanum lycopersicum L.) cv. Amalia”. Revista Ingeniería Agrícola, 4(4): 24–29, ISSN: 2227-8761, Available: , [Consulted: February 4, 2018].
- Zúñiga, C. V. & Gandini, A. M. A. 2013. “Caracterización ambiental de las vinazas de residuos de caña de azúcar resultantes de la producción de etanol”. DYNA, 80(177): 124–131, ISSN: 2346-2183, Available: , [Consulted: February 4, 2018].







.jpg&w=3840&q=75)