Cama de aves de corral, un factor importante en la seguridad alimentaria*
La cama es un componente esencial en la producción de aves de corral, ya que habitan sobre este material la mayor parte de su ciclo productivo, por consiguiente, en ella se puede encontrar heces, bacterias entéricas, patógenos de importancia zoonótica y/o de transmisión alimentaria, plaguicidas y antimicrobianos,los cuales pueden afectar la sanidad de las aves.Después del ciclo de producción avícola, la cama es comúnmente utilizada como fertilizante orgánico para mejorar la calidad de los suelos y los cultivos. A pesar de su amplio uso en la avicultura y agricultura, se conoce poco acerca de su importancia en la seguridad alimentaria, por lo cual, lapresente revisión discute acerca de los patógenos y contaminantes presentes en la cama y sus riesgos para la seguridad alimentaria, además las prácticas de manejo y tratamientos más adecuados. Información que será útil para maximizar los usos de la cama y los desechos avícolas, para que estos no representen un peligro para las personas, animales y el medio ambiente.
PALABRAS CLAVE: Agricultura;Antimicrobianos; Avicultura;Cama de aves; Desechos avícolas;Fertilizante; Gallinaza; Patógenos; Pollinaza; Seguridad alimentaria.
ABSTRACT
The litter is an essential component in poultry production, as the birds inhabit this material for most of their production cycle. As a result, located in the litter is feces, enteric bacteria, pathogens of zoonoticimportance and / or foodborne pathogens, pesticides and antimicrobials, which affect the health of birds. After the poultry production cycle, litter is commonly used as an organic fertilizer to improve the quality of the soil and of crops. Despite its wide use in poultry and agriculture, little is known about its importance in food security. The present study provides more information about litter-borne pathogens, the risksassociated with contaminants and zoonotic diseases in the waste generated from poultry, management practices and treatments. It is essential to consider the impact of the litter because not doing so represents a danger to humans, animals, and the environment.
KEY WORDS: Agriculture;Antimicrobials;Poultry; Poultry litter; Poultry waste;Fertilizer;Chicken manure; Pathogens; Poultry manure; Food safety.
Patógenos de transmisión alimentaria en la cama
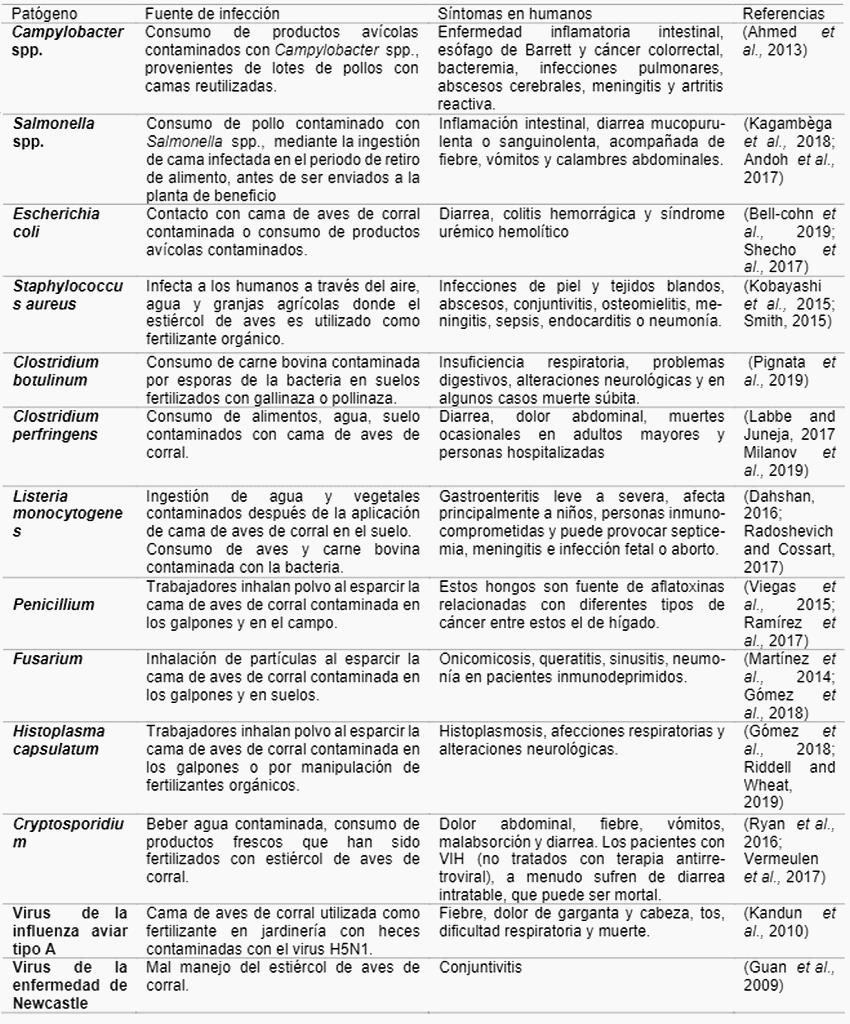
Entre los microorganismos aislados en camas de aves de corral se encuentran patógenos productores de ETAtales como: Salmonella spp, Streptococcus, Campylo-bacter spp, Corynebacterium, Listeria monocytogenes, Globicatella, Bordetella, Escherichia coli, Clostridium perfringens, Clostridium botulinum y Staphylococcus aureus (Bolan et al.,2010) como se muestra en el cuadro 1.
Contaminantes en la cama
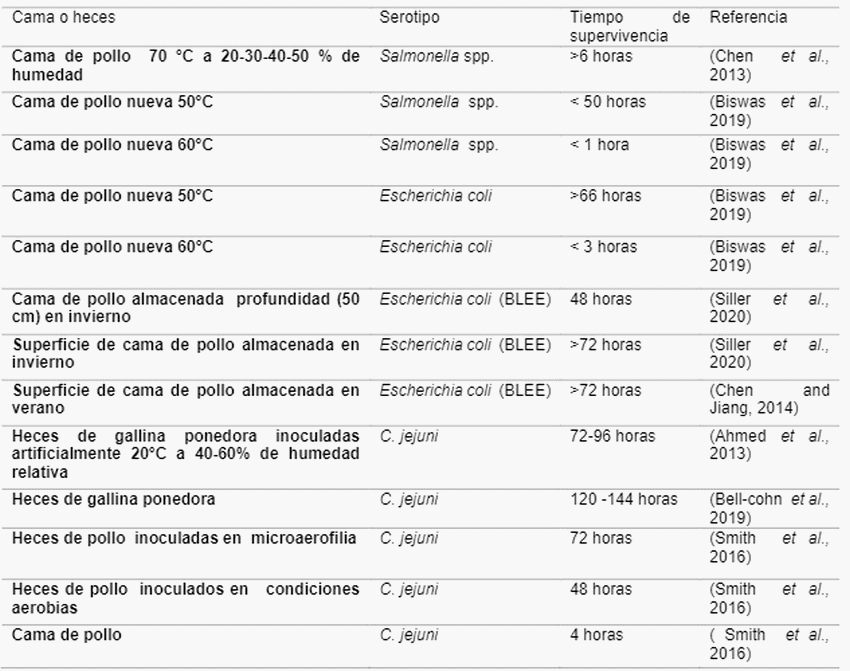
Otros de los contaminantes encontrados con frecuencia en la cama son los residuos de antibióticos, utilizados en la avicultura para prevenir y tratar enfermedades infecciosas o como promotores del crecimiento animal (APC) (Xiong et al.,2018), los cuales se suministran en dosis subterapéuticas en la dieta de las aves, con el fin de aumentar la tasa de crecimiento, rendimiento productivo y proteger la salud de los animales al modificar el sistema inmunológico (Gonzalez and Angeles, 2017).

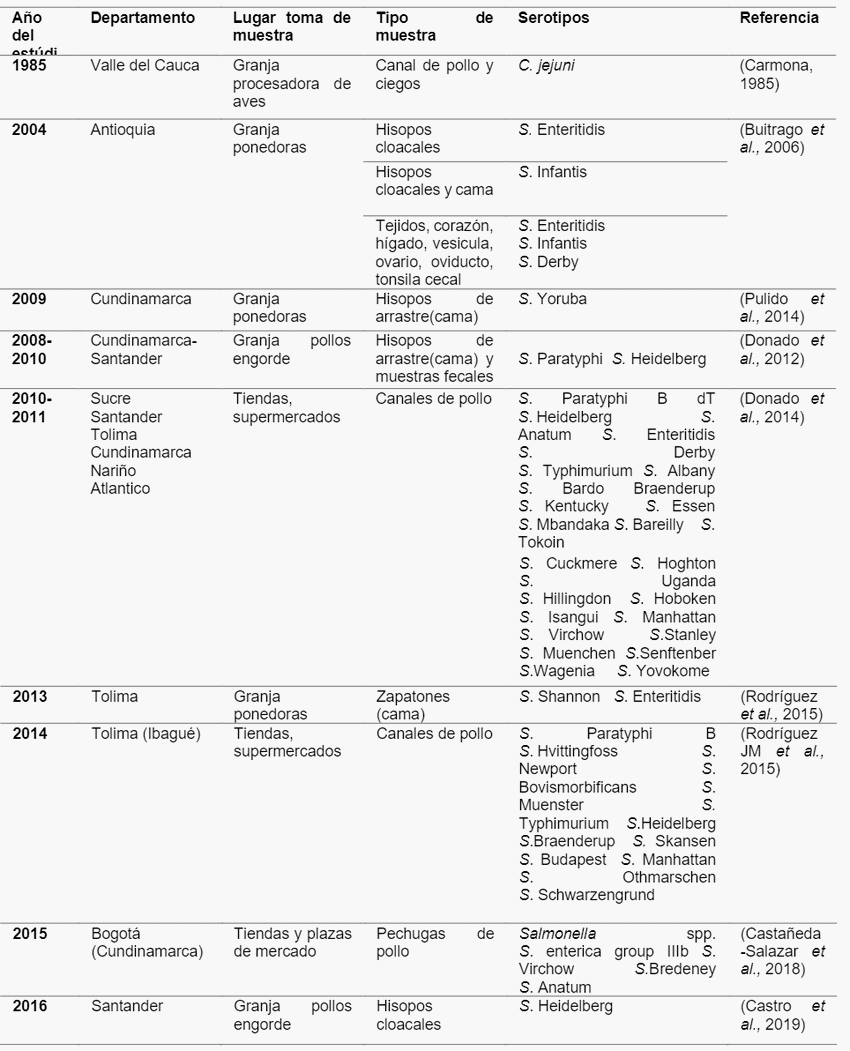
Manejo y tratamientos de la cama
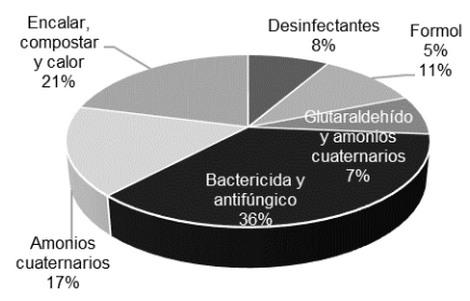
RECOMENDACIONES
Es recomendable realizar análisis microbiológicos a las camas de aves antes, durante y después del ciclo de producción para asegurar la salud de las aves, medio ambiente, animales y humanos. No se debe utilizar gallinaza o pollinaza fresca sin tratamiento, ya que esta práctica contribuye a la diseminación de residuos nocivos, antibióticos, patógenos y sus genes de resistencia. Por otro parte, en Colombia son necesarios estudios que evalúen la supervivencia de patógenos en camas de aves con materiales como viruta de madera y cascarilla de arroz, igualmente en fertilizantes orgánicos derivados de la avicultura con el fin de evaluar el riesgo del uso de estos materiales ya que la mayoría de estudios son en países desarrollados y con diferentes condiciones climáticas.
CONCLUSIONES
En conclusión, con base a la importancia que tiene la cama de aves de corral como fuente indirecta de patógenos y residuos nocivos para los humanos, independientemente del material utilizado para este fin, es necesario realizar procesos adecuados, enfocados al manejo de olores, residuos de antibióticos, patógenos zoonoticos o de transmisión alimentar, que puedan causar problemas de salud pública y de seguridad alimentaria. Además en Colombia existe la necesidad de generar normas para regular los límites de residuos de antibióticos y metales pesados permitidos en desechos avícolas, datos que ayudaran a buscar estrategias para el control de la cama y con ello poder direccionar cual es el uso que se le puede dar después de la cría de aves o como debe ser su disposición final.
AGRADECIMIENTOS Los autores agradecen ala oficina de investigaciones de la Universidad del Tolima,Minciencias y a la Gobernación del Tolima, por la financiación de la investigación.
CONFLICTO DE INTERESES No se declara ningún conflicto de interés
FINANCIACIÓN La presente investigación fue financiada por la convocatoriapara la formación de capital humano de alto nivel para el departamento del Tolima número 755 de 2016 II-Cohorte.
- AGOSTINHO, J.M.A.; CARDOZO, M.V.; BORZI, M.M.; MARIN, J.M. Antibiotic resistance and virulence factors among Escherichia coliisolatesfrom avian organic fertilizer. CiênciaRural, v.50, n.2, 2020, e20180849. https://doi.org/10.1590/0103-8478cr20180849
- AHMED, M.F.M.; SCHULZ, J; HARTUNG, J. Survival of Campylobacter jejuni in naturally land artificially contaminated laying hen feces. Poultry Science, v. 92, 2013, p. 364-369.https://doi.org/10.3382/ps.2012-02496
- ANDOH, L.A.; AHMED, S; OLSEN, J.E.; OBIRI-DANSO, K; NEWMAN, M.J.; OPINTAN, J.A.;DALS-GAARD, A. Prevalence and characterization of Salmonella among humans in Ghana. Tropical medicine and health,v. 45, n. 1, 2017, p. 1-11.https://doi.org/10.1186/s41182-017-0043-z
- ARSI, K; MOORE, P.A.; DONOGHUE, A.M.; DIRAIN, M.L.; DONOGHUE, D.J. Litter TreatmentWith Aluminum Sulfate (Alum) Produced an Inconsistent Reduction in Horizontal Transmission of Campylobacter in Chickens.International Journal of Poultry Science,v. 16, 2017, p. 31-36. https://doi.org/10.3923/ijps.2017.31.36
- BELL-COHN, A.; MAZUR, D.J.; HALL, C.; SCHAEFFER, A.J.; THUMBI-KAT, P. Uropathogenic Escherichia coli-induced fibrosis, leading to lower urinary tract symptoms, is associated with type 2 cytokine signaling.American Journal of Physiology-Renal Physiology, v. 316, n. 4, 2019, F682-F692. https://doi.org/10.1152/ajprenal.00222.2018
- BISWAS, S.; NAZMI, A.; PITESKY, M.; GALLARDO, R.; PANDEY, P. Thermal Inactivation of Escherichia coliand SalmonellaTyphimurium in Poultry Carcass and Litter at Thermophilic Temperatures.The Journal of Applied Poultry Research,v .28, n. 2, 2019, p. 307-317. https://doi.org/10.3382/japr/pfy072
- BOLAN, N.S.; SZOGI, A.A.; CHUASAVA-THI, T.; SESHADRI, B.; ROTHROCK, M.J.; PANNERSEL-VAM, P.Uses and management of poultry litter.World's Poultry Science Journal,v. 66, n. 4, 2010, p.673-698. https://doi.org/10.1017/S0043933910000656
- BROOKS, J.P.; MCLAUGHLIN, M.R.; ADELI, A.; MILES, D.M. Cultivation and Qpcrdetection of pathogenic and antibiotic -resistant bacterial establishment in naive broiler houses.Journal of Environmental Quality, v. 45, 2016, p. 958-966 https://doi.org/10.2134/jeq2015.09.0492
- BUITRAGO, J.D.R.; SUÁREZ, M.C.; URIBE, C. Susceptibilidad antimicrobiana in vitro de cepasde Salmonella spp. en granjas de ponedoras comerciales del departamento de Antioquia.Revista Colombiana de Ciencias Pecuarias, v. 19, n. 3, 2006, p. 297-305.
- CARMONA,F. Presencia de Campylobacter jejuni en aves de corral y sus manipuladores. Biomédica, v. 5, 1985, p. 78-85. https://doi.org/10.7705/biomedica.v5i3-4.1905
- CASTAÑEDA-SALAZAR, R.; PEREIRA-BAZURDO, A.N.; DEL PILAR-PULIDO-VILLAMARIN,A.; MENDOZA-GÓMEZ, M.F.Estimación de la prevalencia de Salmonella spp. en pechugas de pollo para consumo humano provenientes de cuatro localidades de Bogotá, Colombia. Infection, v. 23, 2018, p. 27-32.http://dx.doi.org/10.22354/in.v23i1.752
- CASTRO-VARGAS, R.; DE RUBIO, L. F.; VEGA, A.; RONDON-BARRAGAN, I. Phenotypic and Genotypic Resistance of Salmonella Heidelberg Isolated From One of the Largest Poultry Production Region from Colombia. Poultry Science, v. 18, n. 12, 2019, p. 610-617. http://dx.doi.org/10.3923/ijps.2019.610.617
- CHEN, Z.; JIANG, X. Microbiological Safety of Chicken Litter or Chicken Litter Based Organic Fertilizers. Agriculture, v. 4, 2014, p. 1-29. http://dx.doi.org/10.3390/agriculture4010001
- CHEN, Z., DIAO, J.; DHARMASENA, M.; IONITA, C.; JIANG, X.; RIECK, J. Thermal inactivation of desiccation adaptedSalmonella spp. in aged chicken litter. Applied and environmental microbiology, v.79, n.22, 2013, p. 7013-7020. http://dx.doi.org/10.1128/AEM.01969-13
- CHEN, Z.; JIANG, X. Selection of indigenous indicator organisms for validating desiccation adapted Salmonella reduction in physically heat‐treated poultry litter. Journal of applied microbiology, v. 122, n. 6, 2017, p. 1558-1569. http://dx.doi.org/10.1111/jam.13464
- CHEN, Z.; KIM, J.; JIANG, X. Survival of Escherichia coli O157: H7 and Salmonella enterica inanimal waste based composts as influenced by compost type, storageconation and inoculum level. Journal of applied microbiology, v. 124, n. 5, 2018, p. 1311-1323.https://doi.org/10.1111/jam.13719
- COLOMBIA. INSTITUTO NACIONAL DE SALUD (INS). Informe del Evento Enfermedades Transmitidas por Alimentos, Hasta el Periodo Epidemiológico 12 del año 2017. https://www.ins.gov.co/buscadoreventos/Informesdeevento/ETA%202017.pdf[citado 2 de noviembre 2020]
- COLOMBIA. INSTITUTO NACIONAL DE SALUD (INS).Informe del Evento Enfermedades Transmitidas por Alimentos, Hasta el Periodo Epidemiológico 12 del año 2018. [citado 2 de noviembre 2020]
- COLOMBIA. INSTITUTO NACIONAL DE SALUD (INS). Informe del Evento Enfermedades Transmitidas por Alimentos, Hasta el Periodo Epidemiológico 12 del año 2019. [citado 2 de no viembre 2020]
- COLOMBIA. MINISTERIO DE AMBIENTE Y DESARROLLO SOSTENIBLE. Resolución 1541. (Noviembre 12 de 2013). Por la cual se establecen los niveles permisibles de calidad del aire o de inmisión, el procedimiento para la evaluación de actividades que generan olores ofensivos y se dictan otras disposiciones. Diario Oficial. Bogotá (Colombia): 2013.
- COLOMBIA. FEDERACIÓN NACIONAL DE AVICULTORES (FENAVI). Boletín fenaviquín número278. 2019. citado 3 de enero 2020]
- CONESA, J.A. Dioxins from Agro Waste Combustion: Evaluation and Management. Byproductsfrom Agriculture and Fisheries: Adding Value for Food, Feed, Pharma, and Fuels, 2019, p. 629-640. https://doi.org/10.1002/9781119383956.ch28
- DAHSHAN, H.; MERWAD, A.M.; MOHAMED, T.S. Listeria species in broiler poultry farms: Potential public health hazards.Journal of microbiology and biotechnology,v.26, 2016,p.1551-1556. https://doi.org/10.4014/jmb.1603.03075
- DE CARVALHO, G.B.; SANTOS, N.; MARTINS, J.D.S.; PEREIRA, N.M.; FALLEIROS, M.B.; ARNHOLD, E.; CAFÉ, M.B.Litter quality of broiler fed with to different levels of sulfur amino acid. Journal of Animal Behaviour and Biometeorology,v. 6, n. 1, 2018, p. 21-28.https://doi.org/10.14269/2318-1265/jabb.v6n1p21-28
- DE MELO, T.R.; FIGUEIREDO, A.; MACHADO, W.; TAVARES-FILHO, J. Changes on soil structural stability after in natura and composted chicken manure application. International Journal of Recycling of Organic Waste in Agriculture,v. 8, n. 4, 2019, p. 333-338. https://doi.org/10.1007/s40093-019-0250-1
- DONADO-GODOY, P.; GARDNER, I.; BYRNE, B.A.; LEON, M.; PEREZ-GUTIERREZ, E.; OVALLE, M.V.; TAFUR, M.A.; MILLER, W. Prevalence, risk factors, and antimicrobial resistance profiles of Salmonella from commercial broiler farms in two important poultry-producing regions of Colombia. Journal of food protection,v. 75, n.5, 2012, p. 874-883.https://doi.org/10.4315/0362-028X.JFP-11-458
- DUNLOP, M.W.; BLACKALL, P.J.; STUETZ, R.M. Odour emissions from poultry litter –A review litter properties, odour formation and odorant emissions from porous materials.Journal of Environmental Management, v.177, 2016, p.306–319. https://doi.org/10.1016/j.jenvman.2016.04.009
- FANDIÑO, L.C.; VERJAN-GARCÍA, N. A common SalmonellaEnteritidis sequence type from poultry and human gastroenteritis in Ibague, Colombia. Biomédica, v. 39, 2019,p. 50-62.http://dx.doi.org/10.7705/biomedica.v39i1.4155
- FANG, H.; WANG, H.; CAI, L.; YUNLONG, Y. Prevalence of antibiotic resistance genes and bacterial pathogens in longterm manured greenhouse soils as revealed by metagenomic survey.Environmental science & technology, v. 49, 2015, p. 1095-1104.http://dx.doi.org/10.1021/es504157v
- FARHADI, D. Evaluation of the physical and chemical properties of some agricultural wastes as poultry litter material. Global Journal of Animal Scientific Research, v. 2, 2014, p. 270-276.
- GÓMEZ, L.F.; TORRES, I.P.; MCEWEN, J.G.; DE BEDOUT, C.; PELÁEZ, C.A.; ACEVEDO, J.M.; TAYLOR, M.L.; ARANGO, M. Detection of Histoplasma capsulatum in Organic Fertilizers by Hc100 Nested Polymerase Chain Reaction and Its Correlation with the Physicochemical and Microbiological Characteristics of the Samples.The American journal of tropical medicine and hygiene,v. 98, n. 5, 2018, p. 1303-1312. http://dx.doi.org/10.4269/ajtmh.17-0214
- GONZALEZ, R.M.; ANGELES,H.J.C.Antibiotic and synthetic growth promoters in animal diets: Review of impact and analytical methods. Food Control, v. 72, 2017, p. 255-267. http://dx.doi.org/10.1016/j.foodcont.2016.03.001
- GUAN, J.; CHAN, M.; GRENIER, C.; WILKIE, D.C.; BROOKS,B.W.; SPENCER, J.L. Survival ofavian influenza and Newcastle disease viruses in compost and at ambient temperatures based on virus isolation and real-time reverse transcriptase PCR. Avian diseases,v. 53, n.1, 2009, p. 26-33. http://dx.doi.org/10.1637/8381-062008-Reg.1
- IBRAHIM, M.A.; EMEASH, H.H.; GHONEIM, N.H.; ABDEL-HALIM, M.A. Seroepidemiological Studies on Poultry Salmonellosis and its Public Health Importance.Journal of World’s Poultry Research, v. 3, 2013,p.18–23.
- ISLAM, M.J.; SULTANA, S.; DAS, K.K.; SHARMIN, N.; HASAN, M.N.Isolation of plasmid mediated multidrug resistant Escherichia colifrom poultry. International Journal of Sustainable Crop Production,v. 3, n. 5, 2008, p. 46-50.
- KAGAMBÈGA, A.; THIBODEAU, A.; TRINETTA, V.; SORO, D.K.; SAMA, F.N.; BAKO, C.S.; NDIAYE, A.W.; FRAVALO, P.; BARRO, N.Salmonella spp. and Campylobacter spp. In poultry feces and carcasses in Ouagadougou, Burkina Faso.Food Science & nutrition, v.6, 2018, p. 1601-1606. https://doi.org/10.1002/fsn3.725
- KANDUN, I.N.; SAMAAN, G.; HARUN, S.; PURBA, W.H.; SARIWATI, E.; SEPTIAWATI, C.; WANDRA, T. Chicken faecesgarden fertilizer: possible source of human avian influenza H5N1 infection.Zoonoses Public Health, v.57, 2010,p.285-290. http://dx.doi.org/10.1111/j.1863-2378.2009.01246.x
- KASSEM, I.I.; SANAD, Y.; GANGAIAH, D.; LILBURN, M.; LEJEUNE, J.; RAJASHE-KARA, G. Useof bioluminescence imaging to monitor Campylobacter survival in chicken litter.Journal of applied microbiology,2010, v.109, p. 1988-1997. http://dx.doi.org/10.1111/j.1365-2672.2010.04828.x
- KASSEM, I.I.; KEHINDE, O.; KUMAR, A.; RAJASHEKARA, G. Antimicrobial al resistant Campylobacter in organically and conventionally raised layer chickens. Foodborne pathogens and disease,v.14, n.1, 2017, p. 29-34. http://dx.doi.org/10.1089/fpd.2016.2161
- KIM, J.; DIAO, J.; SHEPHERD, M.W.; SINGH, R.; HERINGA, S.D.; GONG, C.; JIANG, X. Validating thermal inactivation of Salmonella spp. in fresh and aged chicken litter.Applied and environmental microbiology, v.78,2012, p. 1302-1307. http://dx.doi.org/10.1128/AEM.06671-11
- KOBAYASHI,S.D.; MALACHOWA, N.; DELEO, F.R. Pathogenesis of Staphylococcus aureus abscesses.The American journal of pathology,v.185, n.6, 2015, p.1518-1527.http://dx.doi.org/10.1016/j.ajpath.2014.11.030
- KUMAR, K.; THOMPSON, A.; SINGH, A.K.; CHANDER, Y.; GUPTA, S. Enzyme-linked immunosorbent assay for ultrace determination of antibiotics in aqueous samples. Journal of Environ mental Quality,v. 33, n. 1, 2004, p. 250-256. http://dx.doi.org/10.2134/jeq2004.0250
- KYAKUWAIRE, M.; OLUPOT, G.; AMODING, A.; NKEDI-KIZZA, P.; ATEENYI BASAMBA, T. How Safe is Chicken Litter for Land Application as an Organic Fertilizer?: A Review. International journal of environmental research and public health,v. 16, n. 19, 2019, p. 3521-3544. http://dx.doi.org/10.3390/ijerph16193521
- LABBE, R.G.; JUNEJA, V.K. En: Clostridium perfringens. InFoodborne diseases. 3 ed. New York (United States Of America):Elsevier Inc, 2017, p. 235-242.
- LI, X.; PAYNE, J.B.; SANTOS, F.B.; LEVINE, J.F.; ANDERSON, K.E.; SHELDON, B.W. Salmonella populations and prevalence in layer feces from commercial highrise houses and characterization of the Salmonella isolates by serotyping, antibiotic resistance ana-lysis, and pulsed field gel electrophoresis.Poultry science,v. 86, n. 3, 2007, p. 591-597.http://dx.doi.org/10.1093/ps/86.3.591LIU, H.Q.; ZENG, T.T.; WEI, G.X.; ZHANG, R.; LIU, F.; WANG, H. Comparison of dioxin destructionin the fly ash and froths under microwave irradiation.Aerosol and Air Quality Research,v. 19, 2019, p. 925-936. http://dx.doi.org/10.4209/aaqr.2018.09.0337
- MARTÍNEZ-HERNÁNDEZ, L.; CARO-SÁNCHEZ, C.H.; BONIFAZ, A. Infecciones por Fusarium. Dermatologia Revista Mexicana,v. 58,n. 5, 2014, p. 432-442.
- MILANOV, D.; KNEŽEVIĆ, S.; VIDAKO-VIĆ, S.; PAJIĆ, M.; ŽIVKOV-BALOŠ; ALEKSIĆ, N. Microbial contamination of poultry litter duringfattening period. Biotechnology in Animal Husbandry,v. 35, n. 3, 2019, p. 253-265. http://dx.doi.org/10.2298/BAH1903253
- NANDI, S.; MAURER, J.J.; HOFACRE, C.; SUMMERS, A.O. Gram-positive bacteria are a major reservoir of Class 1 antibiotic resistance integrons in poultry litter. Proceedings of the National Academy of Sciences,v. 101, n.18, 2004, p. 7118-7122. http://dx.doi.org/10.1073/pnas.0306466101
- NGAJILO, D.; SINGH, T.; RATS-HIKHOPHA, E.; DAYAL, P.; MATUKA, O.; BAATJIES, R.; JEEBHAY M.F. Risk factors associated with allergic sensitization and asthma phenotypes among poultry farm workers.American journal of industrial medicine,v. 61, 2018, p. 515-523.http://dx.doi.org/10.1002/ajim.22841
- ORGANIZACIÓN MUNDIAL DE LA SALUD (OMS). Resistencia antimicrobiana, reporte global en vigilancia. Ginebra. 2014. https://www.who.int/mediacentre/news/releases/2014/amr-report/es/[citado19 de octubre 2019]
- PATERLINI, H.; GONZÁLEZ, V.; PICONE, L.I. Calidad de la cama de pollo fresca y compostada. Ciencia del suelo,v.35, n.1, 2017, p. 69-78.
- PEREIRA-PEÑATE, N. Uso de microorganismos eficientes (M.E) en pollinaza para disminuir losniveles de amoniaco (NH3) en granjas avícolas comerciales de Sincelejo, Colombia. Revista Colombiana de Ciencia Animal RECIA, v. 8, 2016, p. 386-390. http://dx.doi.org/10.24188/recia.v8.n0.2016.395
- PIGNATA-VIANA, M.C.;SANTOS, J.S.; VIANA, P.T. Epidemiologia e fatores deriscosrelacionados à intoxicação alimentar causada por Clostridium Botu-linum: uma revisão narrativa. Clinical & Biomedical Research,v.39, n.2,2019, p.161-170.http://dx.doi.org/10.4322/2357-9730.85961
- PREMARATHNE, J.M.K.J.K; SATHA-RASINGHE, D.A; HUAT, J.T.Y; BAS-RI, D.F; RUKAYADI, Y.; NAKAGUCHI, Y.; NISHIBUCHI, M.; RADU, S. Impact of human Campylobacter
- infections in Southeast Asia: The contribution of the poultry sector.Critical reviews in food science and nutrition,v.57, 2017, p. 3971-3986. http://dx.doi.org/10.1080/10408398.2016.1266297
- PULIDO-LANDÍNEZ, M.; SÁNCHEZ-INGUNZA, R.; GUARD, J.; DONASCIMENTO, V.P. Presence of SalmonellaEnteritidis and Salmonella Gallinarum in commercial laying hens diagnosed with fowl typhoid disease in Colombia.Avian diseases,v. 58, n.1, 2014, p. 165-170.http://dx.doi.org/10.1637/10598-062613-Case.1
- RADOSHEVICH, L.; COSSART, P. Listeria monocytogenes: towards a complete picture of its physiology and pathogenesis.Nature Reviews Microbiology,v.16, n.1, 2017, p.32-46. http://dx.doi.org/10.1038/nrmicro.2017.126
- RAMÍREZ-HOBAK, L.; GÓMEZ-SÁENZ, A.; VEGA-SÁNCHEZ, D.C.; ARENAS, R. Onicomicosispormohos no dermatofitos. Una revisión. Dermatología Cosmética, Médica y Quirúrgica, v.15, n.3, 2017, p. 184-195.
- REN, X.; ZENG, G.; TANG, L.; WANG, J.; WAN, J.; WANG, J.; DENG, Y.L.; PENG, B. The potential impact on the biodegradation of organic pollutants from composting technology for soil remediation. Waste management, v.72, 2018, p.138-149. http://dx.doi.org/10.1016/j.wasman.2017.11.032
- RIDDELL, J.; WHEAT, L.J. Central Nervous System Infection with Histoplasma capsulatum. Journal of Fungi, v. 5, n. 3, 2019, p. 60-70. http://dx.doi.org/10.3390/jof5030070
- RITZ, C.W.; FAIRCHILD, B.D.; LACY, M.P. Litter Quality and Broiler Performance.CooperativeExtension, University of Georgia (Bulletin 1267).2009. https://extension.uga.edu/publications/detail.html?number=B1267[citado 19 de octubre 2019]
- RODRÍGUEZ, R.; FANDIÑO, C.; DONADO, P.; GUZMÁN, L.; VERJAN, N. Characterization of Salmonella from commercial egg-laying hen farms in a central region of Colombia.Avian diseases,v. 59, n. 1, 2015, p. 57-63. http://dx.doi.org/10.1637/10873-052714-reg
- RODRIGUEZ, J.M.; RONDÓN, I.S.;VERJAN, N. Serotypes of Salmonellain Broiler Carcasses Marketed at Ibague, Colombia.Brazilian Journal of Poultry Science,v. 17, n.4, 2015, p. 545-552.http://dx.doi.org/10.1590/1516-635x1704545-552
- RYAN, U.; ZAHEDI, A.; PAPARINI, A. Cryptosporidium in humans and animals a one healthapproach to prophylaxis.Parasite Immunology,v. 38, n.9, 2016, p. 535-547. http://dx.doi.org/10.1111/pim.12350
- SARAIVA, M.M.S.; MOREIRA-FILHO, A.L.B.; VASCONCELOS, P.C.; NASCIMENTO, P.V.; AZEVEDO, P.S.; NETO, O.F.; GIVISIEZ, P.E.N.; GEBREYES, W.A.; OLIVEIRA, C.J. B. Chemical treatment of poultry litter affects the conjugation of plasmid mediated extended spectrum betalactamase resistance genes in E. coli.Journal of Applied Poultry Research,v. 29, 2019, p. 197-203. https://doi.org/10.1016/j.japr.2019.10.006
- SHAH, M.K.; BRADSHAW, R-; NYARKO, E.; HANDY, E.T.; EAST, C.; MILLNER, P.D.;BERGHOL, T.M.; SHARMA, M. Salmonellaenterica in soils amended with heat-treated poultry pellets survived longer than bacteria in unamended soils and more readily transferred to and persisted on spinach.Applied and environmental microbiology, v.85, n. 10, 2019, e 00334-19. http://dx.doi.org/10.1128/AEM.00334-19S
- SHECHO, M.; THOMAS, N.; KEMAL, J.; MUKTAR, Y. Cloacael carriage and multidrug resistance Escherichia coliO157: H7 from poultry farms, eastern Ethiopia.Journal of veterinary medicine, 2017,p. 1-19.
- http://dx.doi.org/10.1155/2017/8264583
- SHEFFIELD, C.L.; CRIPPEN, T.L.; BEIER, R.C.Multimicrobialcompounds eliminate or reduce Salmonella Typhimurium from one-third of poultry liter samples within 8 days. Research Journal of Poultry Sciences,v. 11, n.1, 2018, p. 5-8.http://dx.doi.org/10.3923/rjpscience.2018.5.8
- SILLER, P.; DAEHRE, K.; THIEL, N., NÜBEL, U.; ROESLER, U. Impact of short-term storage on the quantity of extended spectrum betalactamase proproducing Escherichia coliin broiler litter under practical conditions.Poultry science,v. 99, n. 4, 2020, p. 2125-2135.https://doi.org/10.1016/j.psj.2019.11.043
- SINGH, J.; KALAMDHAD, A.S. Assessment of compost quality in agitated pile composting of water hyacinth collected from different sources. International Journalof Recycling of Organic Waste in Agriculture, v. 4, n. 3, 2015, p. 175-183. http://dx.doi.org/10.1007/s40093-015-0097-z
- SMITH, S.; MEADE,J.; GIBBONS, J.; MCGILL, K.; BOLTON, D.; WHYTE, P.The impact of environmental conditions on Campylobacter jejunisurvival in broiler faeces and litter. Infection ecology & epidemiology,v. 6, n. 1, 2016, p. 31685 -31692.http://dx.doi.org/10.3402/iee.v6.31685SMITH, T.C. Livestock-associated Staphylococcus aureus: the United States experience. PlosPathog, v. 11, 2015,e 1004564. http://dx.doi.org/10.1371/journal.ppat.1004564
- SOLIMAN, E.S; SALLAM, N.H.; ABOUELHASSAN, E.M. Effectiveness of poultry litter amendmen ts on bacterial survival and Eimeria oocystsporulation. Veterinary world,v. 11, n. 8, 2018, p. 1064-1073. http://dx.doi.org/10.14202/vetworld.2018.1064-1073
- STOJCIC, M.Ð.; BJEDOV, S.; ŽIKIC, D.; PERIC, L.; MILOŠEVIC, N.Effect of straw size and microbial amendment of litter on certain litter quality parameters, ammonia emission, and footpad dermatitis in broilers.ArchivesAnimal Breeding, v. 59, 2016, p. 131-137.http://dx.doi.org/10.5194/aab-59-131-2016
- THOMAS, C..; IDLER, C.; AMMON, C.; HERRMANN, C.; AMON, T. Inactivation of ESBL /Ampc producing Escherichia coli during mesophilic and thermophilic anaerobic digestion of chicken manure. Waste managenet, v. 84, 2019, p. 74-82.http://dx.doi.org/10.1016/j.wasman.2018.11.028
- TUALEKA, A.R.; FARADISHA, J.; MAHARJA, R. Determination of No Observed –Adverse effect Level Ammonia in White Mice Through CD4 Expression.Dose-Response, v. 16, 2018, p. 1559325818807790. http://dx.doi.org/10.1177/15593 25818807790.
- VAINIO-KAILA, T.; ZHANG, X.; HÄNNINEN, T.; KYYHKYNEN, A.; JOHASSON,L.S.; WILLFÖR,S.; ÖSTERBERG, M.; SIITONEN,A.; RAUTKARI, L. Antibacterial effects of wood structural components and extractives from Pinus sylvestris and Picea abieson Methicillin-Resistant Staphylococcus aureus and Escherichia coli O157:H7. BioReources, v. 12, 2017, p. 7601-7614. http://dx.doi.org/10.15376/biores.12.4.7601-7614
- VAZ, C.S.L.; VOSS-RECH, D.; DE AVILA, V.S.; COLDEBELLA, A.; SILVA, V.S. Interventions to reduce the bacterial load in recycled broiler litter.Poultry science,v. 96, n. 8, 2017, p. 2587-2594. https://doi.org/10.3382/ps/pex063
- VERMEULEN, L.C.; BENDERS, J.; MEDEMA, G.; HOFSTRA, N. Global Cryptosporidium loads from livestock manure.Environmental science & technology,v.51, n. 15, 2017, p. 8663-8671. http://dx.doi.org/10.1021/acs.est.7b00452
- VIEGAS, S.; VEIGA, L.; ALMEIDA, A.; DOS SANTOS, M.; CAROLINO, E.;VIEGAS, C. Occupational exposure to aflatoxin B1 in a Portuguese poultry slaughterhouse. Annals of Occupational Hygiene,v. 60, n. 2, 2015, p.176-183. http://dx.doi.org/10.1093/annhyg/mev077
- WANG, L.; LILBURN, M.; ZHONG-TANG,Y. Intestinal microbiota of broiler Chicken as affected bylitter manageme regimen. Frontiers in Microbiology, v. 7, 2016, p.1-12. 10.3389/fmicb.2016.00593
- XIE, W.; SHEN, Q.; ZHAO, F.J. Antibiotics and antibiotic resistance from animal manures to soil: a review. European journal of soil science,v. 69, n.1, 2018, p. 181-195.http://dx.doi.org/10.1111/ejss.12494
- XIONG, W.; WANG, M.; DAI, J.; SUN, Y.; ZENG, Z.Application of manure containing tetracyclines slowed down the dissipation of tet resistance genes and caused changes in the composition of soil bacteria.Ecotoxicology and environmental safety,v. 147, 2018, p. 455-460. http://dx.doi.org/10.1016/j.ecoenv.2017.08.061
- YAMAZAKI, W.; UEMURA, R.; SEKIGUCHI, S.; DONG, J.B.; WATANABE, S.; KIRINO, Y.; MISAWA, N. Campylobacter and Salmonellaare prevalent in broiler farms in Kyushu, Japan: Results of a 2-year distribution and circulation dynamics audit. Journal of Applied Microbiology, v. 120, n. 6, 2016, p. 1711–1722. https://doi.org/10.1111/jam.13141
- YANG, X.; LI, Q.; TANG, Z.; ZHANG, W.; YU, G.; SHEN, Q.; ZHAO, F.J. Heavy metal concentrationsand arsenic speciation in animal manure composts in China.Waste Management,v. 64, 2017, p. 333-339. https://doi.org/10.1016/j.wasman.2017.03.015





Excelente Documento colegas, quisiera saber si tienen información sobre indicadores de Bienestar animal durante captura, transporte y desembarque de pollos de engorde en plantas de beneficio animal al igual que indicadores en fases de insensibilización y sangría durante el beneficio.
Gracias quedo atenta Carolina Sierra Morales Mvet.


Estados Unidos de América










