Introducción
Los desechos orgánicos constituyen actualmente una problemática mundial, la búsqueda de soluciones es una tarea primordial que desarrolla nuevas investigaciones en este campo. Una forma de transformar parte de estos desechos en recursos útiles, es la obtención de productos con un alto valor agregado como es el caso de las enzimas proteolíticas, lipolíticas, etc. En Cuba son pocas las proteínas que se aislan de un cultivo bacteriano o se purifican a partir de su fuente natural para abastecer a la industria, por lo cual también se importan. La obtención de preparados enzimáticos que sustituyan enzimas comerciales en diferentes usos, representa un ahorro económico considerable para el país, por otra parte cuando la fuente de obtención de estas.
Materiales y Métodos
Obtención de los crudos enzimáticos. Los crudos enzimáticos se obtuvieron a partir de los desechos de matanza del matadero experimental del Instituto de Ciencia Animal, Mayabeque. Se tomó muestra de la mucosa de abomaso bovino y de estómago porcino, específicamente de la región fúndica. Se emplearon tres animales en cada caso y se recolectó un total de 100g de mucosa, se mezclaron en un homogeneizador de cuchillas con 300ml de tampón fosfato (50mM), según la metodología propuesta por Boeris et al (2009). Los animales a los cuales se les extrajo el órgano consumían la misma dieta base y pertenecían a la categoría superior.
Caracterización de los crudos. Para determinar la presencia de la enzima se realizó una electroforesis en gel de poliacrilamida al 12,5% con SDS, y se empleó como patrón de comparación una solución de pepsina comercial (1mg/mL). Para determinar una posible actividad proteolítica en los extractos, se desarrolló una zimografía con gelatina (16%) como sustrato incluido en un gel de poliacrilamida al 15%, ambos estudios se llevaron a cabo según la metodología propuesta por Lantz y Cibroski (1994). La concentración de proteínas se determinó en un espectrofotómetro UV/VIS Optizen POP, mediante lecturas de absorbancia a 280 nm, y con el empleo de un coeficiente de extinción molar arbitrario igual a la unidad. Para cuantificar la cantidad de pepsina presente en los extractos crudos y en las fracciones purificadas, se realizó la técnica de actividad enzimática por coagulación de la leche según la metodología descrita por Tubio et al (2007). Se tomó como unidad enzimática, la cantidad de enzima que coagula 2 mL de leche descremada a 35°C por minuto.
Activación del pepsinógeno. La activación del pepsinógeno se llevó a cabo al disminuir el pH de la solución a un valor de 2.5 mediante la lenta incorporación de HCl concentrado. Cuando se alcanzó dicho valor de pH se mantuvo a temperatura constante de 20ºC, y se dejó reposar durante 30 min. Posteriormente se llevó a pH 6.4 con adición de NaOH concentrado, se centrifugó a 1500 rpm durante 5 min, y se descartó el pellet.
Purificación de los extractos. La purificación de los crudos se realizó mediante la separación en sistemas bifásicos acuosos formados por poli etilenglicol (PEG) de masa molecular 1500 y fosfato de potasio (50 mM). Los sistemas se prepararon según los diagramas binodiales establecidos por Lei et al (1990) y Tubío et al (2006). Se evaluó el reparto de la pepsina pura en los sistemas bifásicos y luego se determinó el reparto de la pepsina presente en los homogenados HP y HB. El coeficiente de reparto de pepsina (Kpe) se determinó como la relación de actividad enzimática, en las fases superior e inferior, respectivamente y el coeficiente de reparto de proteínas totales (Kp PT), se determinó como la relación de concentración de proteínas en las fases superior e inferior, respectivamente. Se determinaron los parámetros de purificación de proceso. Se calculó el rendimiento (y%) en la fase superior como:

Determinación de la digestibilidad in vitro de la proteína. Para evaluar la capacidad proteolítica de los crudos y sus fracciones purificadas, se empleó la técnica de digestibilidad pepsina HCl propuesta por Furuya (1980). Se utilizó como alimento proteico la harina de soya comercial (Glycine max). Para esto se realizaron dos experimentos. El primer experimento consistió en la determinación de la digestibilidad in vitro de la proteína con el empleo de los extractos crudos, donde se emplearon 3 tratamientos (control con pepsina comercial, extracto crudo bovino y extracto crudo porcino) y se emplearon tres horarios de incubación (2, 4, 6 horas) El segundo experimento consistió en la determinación de la digestibilidad in vitro de la proteína con el empleo de las fracciones purificadas de los extractos, se emplearon tres tratamientos (control con pepsina comercial, fracción purificada del extracto bovino y fracción purificada del extracto bovino) y se emplearon también tres horarios de incubación (2, 4, 6 horas).
Diseño experimental y análisis estadísticos. Para ambos experimentos se empleó un diseño completamente aleatorizado con arreglo factorial 3x3 dispuesto en tres tratamientos y tres horarios de incubación. Para el análisis de los resultados se utilizó el paquete estadístico computarizado InfoStat (Balzarini et al, 2001) versión 5.1 sobre Windows XP. Los valores medios se compararon mediante la dócima de Duncan (1955) en los casos necesarios.
Resultados y Discusión
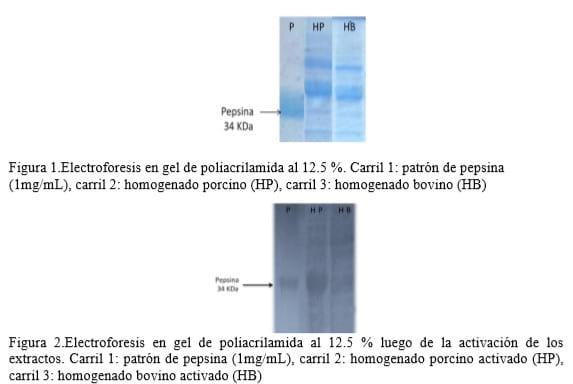
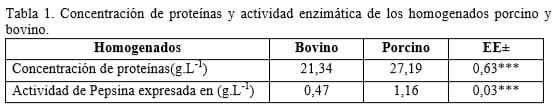
Los resultados de la electroforesis en gel de poliacrilamida con SDS (figura 1) mostraron para ambos homogenados, bandas claras en la región de los 34KDa semejantes al patrón de pepsina, lo que indica la posible presencia de pepsina en las muestras. Luego de la activación de los extractos se intensifican estas bandas asociadas a la presencia de la enzima con la consecuente desaparición de la banda asociada a la presencia de pepsinógeno cercana a los42KDa (figura 2).
Según muestra la figura 3, ambos homogenados presentan mayor actividad proteolítica que el patrón de pepsina que se empleó en el estudio. El proceso de activación del pepsinógeno incrementa la cantidad de pepsina activa, y se observa una mayor actividad proteolítica en los casos que hubo una activación de los extractos. El homogenado porcino (HP) muestra bandas más marcadas que el homogenado bovino (HB), lo que se asocia a una mayor concentración de pepsina en este extracto.
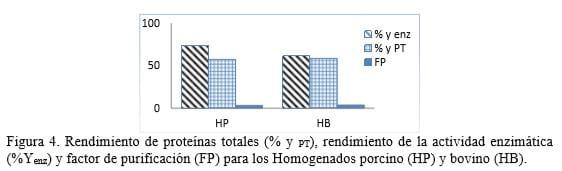
La concentración de proteínas y la actividad enzimática de los crudos se muestran en la tabla 1.
La actividad proteolítica medida como actividad coagulasa de la leche, presenta valores mayores en el caso del HP, aunque ambos crudos exhiben una alta actividad proteolítica. Valores similares de actividad coagulasa se informaron por Boeris et al (2009) y Romero (2012) para homogenados de abomaso bovino. Las diferencias de la actividad enzimática entre los crudos de ambas especies se deben fundamentalmente a las diferencias en cuanto al proceso de digestión que sufren los alimentos en cada caso. Según se reporta en estudios de Álvarez et al (2009) los jugos gástricos de los rumiantes aunque presentan una composición similar al de los monogástricos, tienen una menor actividad proteolítica y una menor secreción de HCl.
Purificación de los homogenados. El estudio del reparto de la pepsina pura en el sistema bifásico formado por PEG 1500/fosfato de potasio mostró una separación satisfactoria de la enzima hacia la fase superior del sistema, con un coeficiente de reparto superior a la unidad, lo que indica una interacción favorable entre la proteína y el PEG. Según estudios de Imelio et al (2008) y Spelzini et al (2011), este comportamiento de la pepsina en los sistemas bifásicos con PEG, se debe fundamentalmente a la hidrofobicidad superficial de la pepsina, pues aunque la mayor parte de los residuos hidrofóbicos de la molécula están hacia el interior de la estructura, esta posee un alto carácter hidrofóbico en la superficie expuesta al solvente.
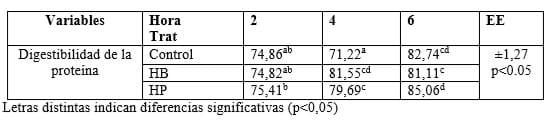
La figura 4 muestra los parámetros de la purificación para cada homogenado. En ambos casos se logró un mayor rendimiento de actividad enzimática que de rendimiento proteico, lo que indica que la enzima se concentró mayoritariamente en la fase superior rica en PEG y la mayoría de sus impurezas hacia la fase inferior y la interface. Por otra parte se lograron factores de purificación superiores a 3, lo que indica que se extrajo la proteína blanco de una mezcla compleja. Estudios anteriores de purificación de pepsina a partir de sus fuentes naturales con el empleo de los sistemas bifásicos PEG/fosfato de potasio, descritos por Boeris et al (2009) y Palomares (2004), refieren valores de rendimiento y factores de purificación similares a este estudio.
Se conoce que el rendimiento de una enzima pura es muy alto (entre 80 y 95%) sin embargo cuando el mismo método se emplea en la purificación de la misma enzima presente en una mezcla compleja, como es el caso de homogenado de tejido animal o tejido vegetal, el rendimiento es más bajo, lo que se debe a la presencia de macromoléculas como ácidos nucleicos y proteínas, que interactúan entre si y causan muchas veces la precipitación de la enzima en la interface (Bassani, 2010). En este estudio se lograron rendimientos entre 60 y 75% lo que indica que se logró concentrar gran cantidad de enzima en la fase superior en un solo paso de purificación. El empleo de los sistemas bifásicos acuosos en la separación de biomoléculas como las enzimas, constituye un método útil, sobre todo para la obtención de preparados enzimáticos que no requieran altos grados de pureza. Estos sistemas bifásicos brindan un entorno adecuado que preserva la actividad biológica de los materiales, y les proporciona a las biomoléculas una alta estabilidad.Según estudios de Marini et al (2011) los sistemas bifásicos acuosos, además de brindar una alternativa simple, rápida, de bajo costo, tienen la importante posibilidad de aplicarse a gran escala.
Determinación de la digestibilidad in vitro de la proteína. El estudio de digestibilidad con el empleo de los homogenados sin purificar mostró una interacción entre los tratamientos y los diferentes horarios de incubación (tabla 2). De manera general se observa un incremento de la digestibilidad a medida que transcurrió el tiempo de incubación. Es interesante destacar que no se encontraron diferencias entre la actividad de la pepsina comercial y la actividad enzimática de los homogenados a los horarios de incubación 2 y 6. Esto parece inferir la posibilidad de sustituir al producto comercial por los preparados naturales que se obtuvieron, puesto que presentan su mayor actividad dentro del período previsto para la digestión de los compuestos nitrogenados en especies monogástricas de acuerdo a lo señalado por Furuya (1980).
Tabla 2.Digestibilidad in vitro con el empleo de los homogenados iniciales. Tratamiento control: Pepsina comercial.
Por su parte, el estudio de digestibilidad con el empleo de las fracciones purificadas de los homogenados (tabla 3), también mostró interacción entre los tratamientos y los diferentes horarios de incubación y se observó un incremento de la digestibilidad a medida que transcurrió el tiempo de incubación. El valor más alto en todos los casos coincidió con la hora 6. No obstante, no hubo diferencias entre los tratamientos para los distintos horarios que se estudiaron. En ambos experimentos, tanto en la digestibilidad con los homogenados sin purificar como en la digestibilidad con las fracciones purificadas, se encontró un aumento de la digestibilidad con respecto al tiempo de incubación. Según Pedraza et al (2012)este efecto se debe al mismo proceso de digestión que experimenta el alimento por la acción enzimática durante las primeras horas, donde el acceso de la enzima al sustrato es más complejo, sin embargo una vez que se digiere parte del mismo, resulta más favorable el ataque proteolítico.
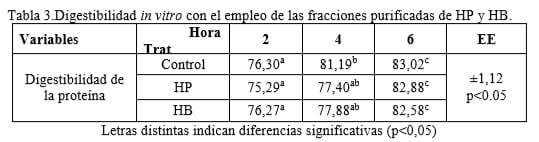
En la literatura consultada, no se informan estudios de digestibilidad in vitro que empleen preparados enzimáticos enriquecidos en pepsina obtenidos a partir de desechos, ni sus fracciones purificadas en lugar del empleo de la enzima pura. Sin embargo este trabajo sugiere que los crudos que se obtienen de estos desechos, poseen una alta concentración de pepsina, la que puede aprovecharse de forma tanto purificada como sin purificar. Es importante señalar que los desechos de la industria cárnica son una fuente importante de numerosas enzimas, por lo que constituyen un recurso interesante en la búsqueda de soluciones a la contaminación ambiental. Los homogenados de mucosa gástrica de estómago porcino y abomaso bovino, así como sus fracciones purificadas, se pueden emplear como sustitutos de la pepsina comercial en estudios de digestibilidad in vitro de la proteína.
Esta metodología ofrece impactos económicos, sociales y ambientales. Los mismos vienen dado por
- Impacto económico La aplicación de esta metodología tiene implícito un impacto económico, ya que el empleo de los desechos de matadero como materia prima en la obtención de enzimas supone la disminución en las importaciones de las mismas, además, al darle un uso racional a estos desechos de matanza también se reducen los gastos por concepto de transporte y tratamiento a los residuales del proceso.
- Impacto social Viene dado por el aporte al conocimiento por primera vez en Cuba se propone una metodología que permita la eficiente utilización de los desechos de matadero para la obtención de proteasas tipo pepsina, con amplia gama de utilización a nivel de laboratorio y una posible inserción a nivel industrial.
- Impacto ambiental Esta metodología tiene un fuerte impacto ambiental pues los mataderos de animales contaminan de forma muy agresiva al medio que los rodea, en este caso en particular esta metodología supone una importante disminución de la carga contaminante de los residuales al darle un uso a los desechos del tracto gastrointestinal de cerdos y bovinos, los que constituyen unos de los principales contaminantes debido a la alta carga microbiológica que poseen y que pueden atentar contra la salud tanto de los trabajadores como de las personas de la comunidad.
Conclusiones
Los crudos enzimáticos obtenidos de mucosa gástrica de estómago porcino y abomaso bovino, así como sus fracciones purificadas, se pueden emplear como sustitutos de la pepsina comercial en estudios de digestibilidad in vitro de la proteína, constituyendo estos preparados una vía de utilización para los desechos de la industria cárnica.
Referencias
Arakawa, T. & Timasheff, S. 1985 Mechanism of polyethylene glycol interaction with proteins. Biochemistry. 24: 6756-6762.
Balzarini, M., Casanoves, F., Di Rienzo, J.A., González, L.A. & Robledo, C.W. 2001. Software estadístico: InfoStat, versión 5.1. Manual de usuario. Universidad Nacional de Córdoba, Argentina.
Basak, A., Strand, S.P., Tribet, C., Jaeger, W. & Dubin, P.L. 2007. Effect of polyelectrolyte structure on protein–polyelectrolyte coacervates: coacervates of bovine serum albumin with poly (diallyldimethylammonium chloride) versus chitosan. Biomacromolecules. 8:3568–77
Bassani, G., Fuciños, P., Picó, G.& Farruggia, B. 2010. Candida rugosa lipase Lip1– polyethyleneglycol interaction and the relation withits partition in aqueous two-phase systems. Colloids and Surfaces B: Biointerfaces. 75(1):532–537
Boeris, V., Spelzini, D., Picó, G.& Farruggia, B. 2009. Aqueous two-phase extraction and polyelectrolyte precipitation combination: A simple and economically technologies for pepsin isolation from bovine abomasum homogenate. Process Biochemistry. 44: 1260– 1264.
Brier, S., Vincenzo, G.M., Capasso, A., Wu, Y., Taylor, R.M., Borotto, M.B., Capasso, C. & Engen, J. 2007. Purification and characterization of pepsins A1 and A2 from the Antarctic rock cod Trematomus bernacchii. FEBS Journal. 274 (1): 6152–6166.
Du, Z., Yu, Y.& Wang, J.H. 2007. Extraction of proteins from biological fluids by use of an ionic liquid/aqueous two-phase system. Chem Eur J. 13(7):2130–2137.
Duncan, D.B. 1955. Multiple range and multiple F tests. Biometrics. 11(1). Imelio, N., Marini, A., Spelzini, D., Picó, G. & Farruggia, B. 2008. Pepsin extraction from bovine stomach using aqueous two-phase systems: Molecular mechanism and influence of homogenate mass and phase volume ratio. Journal of Chromatography B. 873:133–138
Lei, X., Diamond, A. &Hsu, J. 1990. Equilibrium Phase Behavior of the Polyethilene glycol/Potassium Phosphate/water Two-Phase System at 4°C. J. Chem. Eng. Data. 35: 420-423.
Marini, A., Imelio, N., Picó, G., Romanini, D.& Farruggia, B. 2011. Isolation of a Aspergillus niger lipase from a solid culture medium with aqueous two-phase systems. Journal of Chromatography B. 879(1): 2135–2141
Paez de Leon, L., Pinzon, G.& Vasquez, E.1995. Purification and assay of chicken pepsin. Acta científica venezolana. 46(4): 237-241.
Palomares, R.M. 2004. Practical application of aqueous two-phase partition to process development for the recovery of biological products. Journal of Chromatography B. 807: 3-11.
Regmi, P.R., Sauer, W.C. & Zijlstra, R.T. 2008. Prediction of in vivo apparent total tract energy digestibility of barley in grower pigs using an in vitro digestibility techniques. Journal of Animal Science. 86: 2619-2626.
Rocha, G.F., Fernández, G. & Parisi, M. 2010. Estudios de Caracterización Cinética y Fisicoquímica de una Proteinasa Aspártica Aislada de Frutos Maduros de Salpichroa origanifolia. Inf. Tecnol. 21(2):15-23
Spelzini, D., Peleteiro, J., Picó, G.& Farruggia, B. 2008. Polyethyleneglycol–pepsin interaction and its relationship with protein partitioning in aqueous two-phase systems. Colloids and Surfaces B: Biointerfaces. 67: 151–156.
Spelzini, D., Farruggia, B., Perez, N., Rua, M.L. & Pastrana, L. 2011. Production of aspartic peptidases by Aspergillus spp. using tuna cooked wastewater as nitrogen source and further extraction using aqueous two phase system. African Journal of Biotechnology .10(68): 15287-15294.
Spelzini, D., Farruggia, B.& Pico´ G. 2005. Features of the acid protease partition in aqueous two-phase systems of polyethylene glycol–phosphate: chymosin and pepsin. J Chromatogr B. 821: 60–66.
Spelzini, D., Picó, G. & Farruggia, B. 2006. Dependence of chymosin and pepsin partition coeffient with phase volume and polymer pausidispersity in polyethyleneglycol- phosphate aqueous two-phase system. Colloids and surfaces B. Biointerfaces. 51: 80-85.
Tubio, G., Nerli, B.& Picó, G. 2007. Partitioning features of bovine trypsin and alphachymotrypsin in polyethyleneglycol sodium citrate aqueous two-phase systems. J. Chromatogr. B, 852 - 244-249. ISSN: 1570-0232