Cambios nutrimentales en el lechón y desarrollo morfo-fisiológico de su aparato digestivo
Abstract
This review shows the development of the pig gastrointestinal tract (GIT) since intrauterine life. Immediately after birth, the GIT begins another important stage in its ontogenesis, which ensures for the piglets to have access to the protective substances in colostrum and milk nutrients. Another important stage in the development of the GIT begins after weaning. In general, life changes in the days around weaning leading to a decrease in feed intake, which, in turn, leads to nutritional stress that results in the atrophy of intestinal villi, diminishing the piglets ability to digest and absorb nutrients necessary for growth. The small intestine loses weight due to a net loss of intestinal mucosa. The decrease in voluntary feed intake also produces a reduction in both pancreatic enzyme activity, due to lack of substrate, and brush border enzyme activity, due to physical loss of enterocytes in the small intestine and to lack of substrate. Once the animals begin to eat solid food the organism goes through an adaptation process to all the adverse factors previously mentioned and GIT growth and digestive function are restored. During this process, the amount of feed provided to the newly weaned piglet and the ingredients used play an important role in GIT maturation.
Key words: piglet nutrition, weaning, digestive physiology, gastrointestinal tract development.
En esta revisión se muestra el desarrollo que tiene el tracto gastrointestinal (TGI) desde la vida intrauterina. Inmediatamente después del nacimiento el TGI inicia otra fase importante de su ontogénesis, la cual garantiza el acceso de los lechones a sustancias protectoras del calostro y a los nutrimentos de la leche. Otra etapa de importancia en el desarrollo del TGI se da después del destete, en general, en los días alrededor del mismo se presentan cambios en la vida del lechón los cuales conducen a una disminución en el consumo de alimento por la confluencia de una serie de factores que llevan a un estrés nutricional, y tiene como consecuencia la atrofia en las vellosidades intestinales, disminuyendo la capacidad del lechón para digerir y absorber los nutrimentos necesarios para su buen crecimiento. El peso del intestino delgado se ve afectado debido a una pérdida neta de mucosa intestinal. La disminución en el consumo voluntario también produce una reducción en la actividad de las enzimas pancreáticas, por la falta del sustrato necesario para su acción, y de las enzimas de borde en cepillo, en primer lugar por una pérdida física de enterocitos a nivel del intestino delgado y, en segundo lugar, por una ausencia de sustrato. Una vez que los animales empiezan a consumir alimento sólido, el organismo pasa por un proceso de adaptación a todos los factores adversos antes mencionados y los animales comienzan a recuperar el crecimiento del TGI y con ello sus funciones digestivas. En este proceso, la cantidad de alimento que se proporciona, así como las materias primas que lo componen, tienen un papel importante en la maduración del TGI de los lechones recién destetados.
Palabras clave: nutrición de lechones, destete, fisiología digestiva, desarrollo del tracto gastrointestinal.
Desarrollo de los órganos digestivos en el periodo predestete
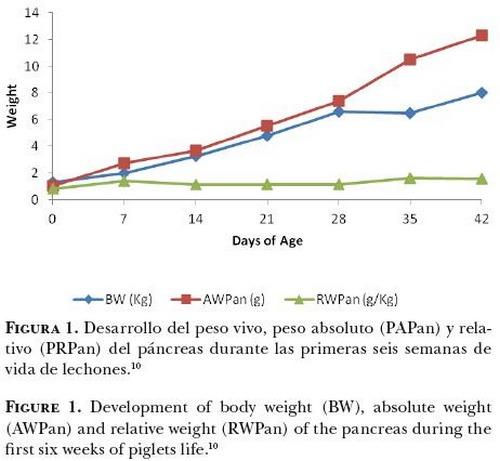
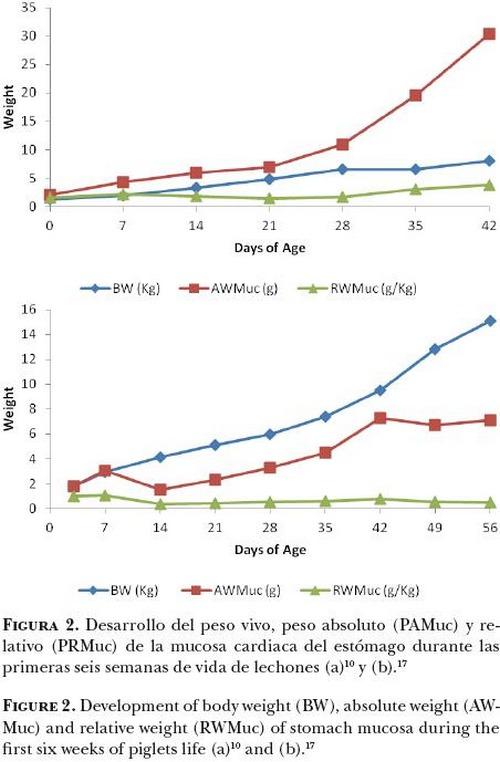
Efecto del destete
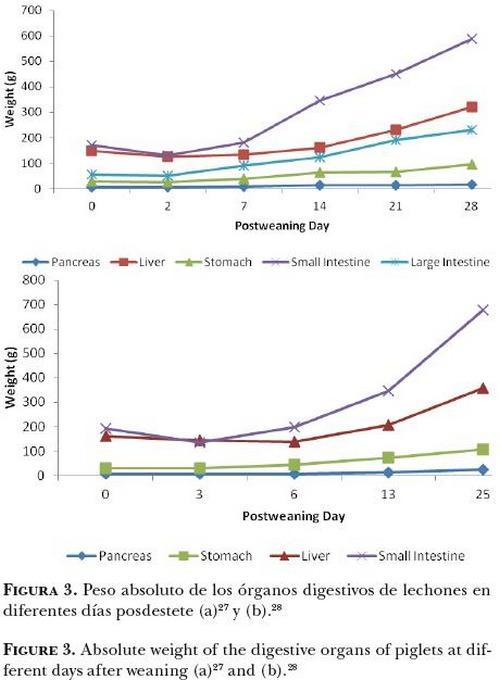
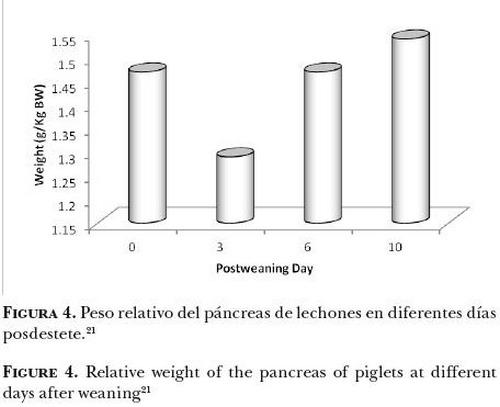
Efecto del consumo de alimento
Influencia de la composición del alimento sobre el TGI
Conclusiones
- 1. CRANWELL PD. Development of the neonatal gut and enzyme systems. In: VARLEY MA, editor. Wallingford UK: CAB International, 1995: 99–154
- 2. ZABIELSKI R, LE HUËRON–LURON I, GUILLOTEAU P. Development of gastrointestinal and pancreatic functions in mammalians (mainly bovine and porcine species): influence of age and ingested food. Reprod Nutr Dev 1999; 39:5–26
- 3. DIRKZWAGER A, VELDMAN B, BIKKER P. A nutritional approach for the prevention of Post Weaning Syndrome in piglets. Anim Res 2005; 54:231–236
- 4. LE DIVIDICH J, SÈVE B. Effects of underfeeding during the weaning period on growth, metabolism, and hormonal adjustments in the piglet. Domest Anim Endocrinol 2000; 19:63–74
- 5. QUINIOU N, NOBLET J. Prediction of tissular body composition from protein and lipid deposition in growing pigs. J Anim Sci 1995; 73: 1567–1575
- 6. NYACHOTI CM, DE LANGE CFM, SCHULZE H. Estimating endogenous amino acid flows at the terminal ileum and true ileal amino acid digestibilities in feedstuffs for growing pigs using the homoarginine method. J Anim Sci 1997; 75: 3206–3213
- 7. DROZDOWSKI LA, CLANDININ T, THOMSON ABR. Ontogeny, growth and development of the small intestine: Understanding pediatric gastroenterology. World J Gastroenterol 2010; 16: 787–799
- 8. KOONG LJ, NIENABER JA, MERSMANN J. Effects of plane of nutrition on organ size and fasting heat production in genetically obese and lean pigs. J Nutr 1983; 113: 1626–1631
- 9. BIKKER P, VERSTEGEN MWA, KEMPS B, BOSH MW. Performance and body composition of finishing gilts (45 to 85 kilograms) as affected by energy intake and nutrition in earlier life: I. Growth of the body and components. J Anim Sci 1996; 74: 806–816
- 10. LINDEMAN MD, CORNELIUS SG, EL KANDELGY SM, MOSER RL. Effect of Age, Weaning and diet on digestive enzyme levels in the piglet. J Anim Sci 1986; 62:1298–1307
- 11. SANGILD PT. Biology of the pancreas before birth. In: PIERZYNOWSKI SG AND ZABIELSKI, editors. Biology of the pancreas in growing animals. Amsterdan, The Netherlands. Elsevier Science BV, 1999:1–13
- 12. SEVE B. Elévage et sevrage des porcelets. In: PÉREZ JM, MORNET P, RÉRAT A, editors. Le porc et son élevage, bases scientifiques et techniques. France: Editorial Maloine, 1986: 403
- 13. CERA KR, MAHAN DC, CROSS RF, REINHART GA, WHITMOYER RE. Effect of age, weaning and postweaning diet on small intestinal growth and jejunal morphology in young swine. J Anim Sci 1988; 66:574–584.
- 14. MOUGHAM PJ, BIRTLES MJ, CRANWELL PD, SMITH WC, PEDRAZA M. The piglet as a model for studing aspects of digestion and absorption in milk–fed human infants. World Rev Nutr Diet 1992; 67:40–113
- 15. XU RJ, TUNGTHANATHANICH P, BIRTLES MJ, REYNOLDS GW, SIMPSON HV. Growth and morphological changes in the small and large intestine in piglets during the first three days after birth. J Dev Physiol 1992; 18:161–172
- 16. VAN DIJKAJ, MARGRY CF, VAN DER LEE AG, HEMKE G, BEYNEN AC. Growth performance and Health status in weanling piglets fed spray–dried proccine plasma under typical Northen european conditions. J Anim Physiol Anim Nutr 2002; 86:17–25
- 17. JENSEN MS, JENSEN SK, JAKOBSEN K. Development of digestive enzymes in pigs with emphasis on lypolitic activity in the stomach and pancreas. J Anim Sci 1997 75:437–445
- 18. LALLÈS JP, BOUNDRY G, FAVIER C, LE FLOC'H N, LURON I, MONTAGNE L et al. Gut function and dysfunction in young pigs: physiology. Anim Res 2004; 53:301–316.
- 19. PLUSKE JR, WILLIAMS IH, AHERNE FX. Nutrition of the neonatal pig. In: VARLEY MA, editor. The neonatal pig: development and survival. Wallingford, UK: CAB International, 1995:187–235
- 20. FOWLER WR. The nutrition of weaned pigs. Pigs News Info 1980, 1:11
- 21. MAKKINK CA, BERNTSEN PJM, OP DEN KAMP BML, KEMP B, VERSTEGEN WA. Gastric protein breakdown and pancreatic enzyme activities in response to two different dietary protein sources in newly weaned pigs. J Anim Sci 1994; 72:2843–2850
- 22. LALLÈS JP, TOULLEC R. Digestion des proteins vègètales et hypersensibilitè digestive chez le veau prèrumiant. INRA. Prod Anim 1996; 9:255–264
- 23. HAMPSON D. Alterations in the pig small intestinal structure at weaning. Res Vet Sci 1986; 40:32–40
- 24. MILLER BG, JAMES PS, SMITH MW, BOURNE FJ. Effect of weaning on the capacity of pig intestinal villi to digest and absorb nutrients. J Agric Sci Camb 1986; 107:579–589
- 25. KELLY D, SMYTH JA, MCCRACKEN KJ. Digestive development of the early–weaned pig. 2. Effect of level of food intake on digestive enzyme activity during the immediate post–weaning period. Br J Nutr 1991; 65:181–188
- 26. KELLY D, KING TP. Digestive physiology and development pigs. In: VARLEY MA, WISEMAN J, editors. The weaner pig, nutrition and Management, 2001: 179–206
- 27. AGUILERA BA, SOUZA RTC, MARISCAL LG, JUÁREZ GY. Desarrollo de los órganos digestivos hasta la cuarta semana posdestete en lechones alimentados con subproductos lácteos. Memorias del XI Congreso de la AMENA y I del CLANA; 2003 agosto 18–23; Cancún, Quintana Roo, México. Querétaro, Querétaro: Cuarón JA, Cortez M, Fernández D., Labandero E, Pérez VG, Quintana M, editores, 2003:335–336.
- 28. ESCOBAR GK, REIS DE SOUZA TC, GUERRERO MJC, MARISCAL LG, AGUILERA BA, BERNAL MGS. Morfología del intestino delgado de lechones destetados alimentados con diferentes fuentes de proteína. Memorias del III Congreso CLANA; 2008 Noviembre 18–21; Cancún, Quintana Roo, México. CELIS A, GARCÍA M, editores, 2008:513–516
- 29. OWSLEY WF, ORR DE, TRIBBLE LF. Effects of age and diet on the development of the pancreas and synthesis and secretion of pancreatic secretions in the young pig. J Anim Sci 1986; 63: 497–504
- 30. EFIRD RC, ARMSTRONG WD, HERMAN DL. The development of digestive capacity in the young pigs: effect of weaning regimen and dietary treatment. J Anim Sci 1982; 55: 1371–1379
- 31. PLUSKE JR, HAMPSON DJ, WILLIAM IH. Factors influencing the structure and function of the small intestine in the weaning pig: a review. Livest Prod Sci 1997; 51: 215–236
- 32. XIANHONG G, DEFA L, RUIPING S. Effect of weaning on small intestinal structure and function in the piglet. Arch Anim Nutr 2002; 56:275–286
- 33. HAMPSON DJ, KIDDER DE. Influence of creep feeding and weaning on brush border enzyme activities in the piglet small intestine. Res Vet Sci 1986; 40:24–31
- 34. REIS DE SOUZA TC, MARISCAL LG, AGUILERA BA. Empleo de dos fuentes de lactosa en la dieta de lechones y sus efectos en el aparato digestivo. Tec Pec Méx 2002; 40:299–308
- 35. REIS DE SOUZA TC, GUERRERO MJC, AGUILERA BA, MARISCAL LG. Efecto de diferentes cereales sobre la morfología intestinal de lechones recién destetados. Tec Pec Méx 2005; 43:309:321
- 36. MEDEL P, LATORRE MA, MATEOS GG. Nutrición y alimentación de lechones destetados precozmente. En: REBOLLAR PG, DE BLAS C, MATEOS GG, editores. XV Curso de especialización avances en nutrición y alimentación animal. Madrid, España: Fundación Española para el Desarrollo de la Nutrición Animal, 1999:145–196
- 37. PIVA A, GRILLI E, FABBRI L, PIZZAMIGLIO V, GATTA PP, GALVANO F et al. Intestinal metabolism of weaned piglets fed a typical United States or European diet with or without supplementation of tributyrin and lactitol. J Anim Sci 2008; 86:2952–2961
- 38. ZIJLSTRA RT, WHANG KY, EASTER RA, ODLE J. Effect of feeding a milk replacer to early–weaned pigs on growth, body composition, and small intestinal morphology, compared with suckled littermates. J Anim Sci 1996; 74:2948–2959
- 39. VENTE–SPREEUWENBERG MAM, VERDONK JMAJ, KOENINKX JFJG, BEYNEN AC, VERSTEGEN MWA. Dietary protein hydrolysates vs. intact proteins do not enhance mucosal integrity and growth performance in weaned piglets. Liv Prod Sci 2004; 85:151–164
- 40. WU G, MEIER SA, KNABE DA. Dietary glutamine supplementation prevents jejunal atrophy in weaned pigs. J Nutr 1996; 126:2578–2584
- 41. HANSENJA, NELSSENJL, GOODBAND RD, WEEDEN TL. Evaluation of animal protein supplements in diets of early–weaned pigs. J Anim Sci 1993; 71:1853–1862
- 42. SMIRICKY MR, GRIESHOP CM, ALBIN DM, WUBBEN JE, GABERT VM, FAHEY GC Jr. The influence of soy oligosaccharides on apparent and true ileal amino acid digestibilities and fecal consistency in growing pigs. J Anim Sci 2002; 80:2433–2441
- 43. PALACIOS MF, EASTER RA, SOLTWEDEL KT, PARSONS CM, DOUGLAS MW, HYMOWITZ T et al. Effect of soybean variety and processing on growth performance of young chicks and pigs. J Anim Sci 2004; 82:1108–1114
- 44. LIENER IE. Factors affecting the nutritional quality of soya products. J Am Oil Chem Soc 1981; 58:406–415
- 45. LI DF, NELSSEN JL, REDDY PG, BLECHA F, HANCOCK JD, ALLEE GL et al. Transient hypersensitivity to soybean meal in the early–weaned pig. J Anim Sci 1990; 68:1790–1799
- 46. FRIESEN KG, NELSSEN JL, GOODBAND RD, BEHNKE KC, KATS LJ. The effect of pre and postweaning exposure to soybean meal on growth performance and on the immune response in the early–weaned pig. J Anim Sci 1993; 71:2089–2098
- 47. DUNSFORD BR, KNABE DA, HAENSLY WE. Effect of dietary soybean meal on the microscopic anatomy of the small intestine in the early weaned pigs. J Anim Sci 1989; 67:1855–1863.
- 48. LESKE KL, JEVNE CJ, COON CN. Effect of oligosaccharide additions on nitrogen–corrected true metabolizable energy of soy protein concentrate. Poult Sci 1993; 72:664–668
- 49. CUMMINGS JH, ENGLYST HN. Gastrointestinal effects of food carbohydrate. Am J Clin Nutr 1995; 61(suppl):938S–945S
- 50. BAKER KM, STEIN HH. Amino acid digestibility and concentration of digestible and metabolizable energy in varieties of soybeans and fed to growing pigs soybean meal produced from conventional, high–protein, or low–oligosaccharide. J Anim Sci 2009; 87:2282–2290
- 51. REIS DE SOUZA TC, AGUILERA MAB, AGUILERA AB, MARISCAL GL, CARRILLO MJG. Digestive tract morphology of piglets fed diets with isolated or concentrate soy protein. Arch Latinoam Prod Anim 2007; 15:134–140
- 52. REIS STC, GUERRERO CMJ, MARISCAL LG, AGUILERA BA. Integridad intestinal en lechones alimentados con dietas complementadas con pasta de canola. XII Congreso Nacional AMENA; 2005 octubre 25–28; Puerto Vallarta, Jalisco, México. Querétaro, Querétaro: AMENA, 2005:1–2
- 53. ESCOBAR GK, REIS DE SOUZA TC, GUERRERO MJC, MARISCAL LG, AGUILERA BA, BERNAL MGS. Morfología del intestino delgado de lechones destetados alimentados con diferentes fuentes de proteína. Memorias del III Congreso CLANA; 2008 Noviembre 18–21; Cancún, Quintana Roo, México. Celis A, García M, editores, 2008: 2008:513–516
- 54. REIS TC, AGUILERA BA, MARISCAL LG, BALDERRAMA PVN, BERNAL SMG, ESCOBAR GK et al. Efecto de las pastas de ajonjolí y soya de sobre el tracto digestivo de lechones destetados. XLVI Reuniones Nacionales de Investigación e Innovación Agroalimentaria y Forestal en México; 2010 Noviembre 22–27; Campeche, Campeche, México. Guadalajara, Jalisco, México: Editores Prometeo SA de CV, 2010:249
- 55. RIOPÉREZ J, SÁNCHEZ CP, CASTAÑO M. Estudio histopatológico del íleon de lechones precozmente destetados dependiente del cereal utilizado en su alimentación. Arch Zootec 1991; 40:261–271
- 56. SALGADO P, FREIRE LPB, MOURATO M, CABRAL F, TOULLEC R, LALLÈS JP. Comparative effects of different legume protein sources in weaning piglets: Nutrient digestibility, intestinal morphology and digestive enzymes. Liv Prod Sci 2002; 74:191–202
- 57. BEDFORD MR, CAMPBELL LD. Enzymes application for monogastric feeds a review. Can J Anim Sci 1992; 72:449–466.
- 58. COWAN WD, KORSBAKA, HASTRUP T, RASMUSSEN PB. Influence of added microbial enzymes on energy and protein availability of selected feed ingredients. Anim Feed Sci Technol 1996; 60:311–319
- 59. GÓMEZ–SOTO JG, REIS DE SOUZA TC, MARISCAL–LANDÍN G, AGUILERA–BARREYRO A, MONTEMAYOR HM. Efecto del nivel de taninos del sorgo sobre la morfofisiología digestiva en lechones destetados. XLVI Reuniones Nacionales de Investigación e Innovación Agroalimentaria y Forestal en México; 2010 Noviembre 22–27; Campeche, Campeche, México. Guadalajara, Jalisco, México: Editores Prometeo SA de CV, 2010:247
- 60. FIGUEROA VJL, CHI MEE, CERVANTES RM, DOMINGUEZ VIA. Functional foods for weanling pigs. Vet Méx 2006; 37:117–136
- 61. WHITE LA, NEWMAN MC, CROMWELL GL, LINDEMANN MD. Brewers dried yeast as a source of mannan oligosaccharides for weanling pigs. J Anim Sci 2002; 80:2619–2628
- 62. JIN Z, YANG YX, CHOI JY, SHINDE PL, YOON SY, HAHNB TW et al. Effects of potato (Solanum tuberosum L. cv. Golden valley) protein having antimicrobial activity on the growth performance, and intestinal microflora and morphology in weanling pigs. Anim Feed Sci Tech 2008; 140:139–154
- 63. MANZANILLA EG, PÉREZ JF, MARTÍN M, BLANDÓN JC, BAUCELLS F, KAMEL C et al. Dietary protein modifies effect of plant extracts in the intestinal ecosystem of the pig at weaning. J Anim Sci 2009; 87:2029–2037
- 64. LIU P, PIAO XS, KIM SW, WANG L, SHEN YB, LEE HS et al. Effects of chito–oligosaccharide supplementation on the growth performance, nutrient digestibility, intestinal morphology, and fecal shedding of Escherichia coli and Lactobacillus in weaning pigs. J Anim Sci 2008; 86: 2609–2618
- 65. MAVROMICHALIS I, PATON F. Nuevos ingredientes en la alimentación de cerdos. XX Curso de Especialización FEDNA: Avances en Nutrición y Alimentación Animal. En: REBOLLAR PG, DE BLAS C, MATEOS GG, editores. Fira de Barcelona, España: Fundación Española para el Desarrollo de la Nutrición Animal, 2004:125–147
- 66. KOTUNIA A, WOLIÑSKIJ, LAUBITZ D,JURKOWSKA M, ROMÉ V, GUILLOTEAU P et al. Effect of sodium butyrate on the small intestine development in neonatal piglets feed by artificial sow. J Physiol Pharm 2004; 55:59–68
- 67. MAZZONI M, LE GALL M, DE FILIPPI S, MINIERI L, TREVISI P, WOLINSKI J et al. Supplemental Sodium Butyrate Stimulates Different Gastric Cells in Weaned Pigs. J Nutr 2008; 138: 1426–1431
- 68. SNEL J, HARMSEN HJM, VAN DER WIELEN PWJJ, WILLIAMS BA. 2. Dietary strategies to influence the gastro–intestinal microflora of young animals, and its potential to improve intestinal health. In: BLOK MC, VAHL H A, DE LANGE L, VAN DE BRAAK AE, HEMKE G, HESSING M, editors. Nutrition and health of the gastrointestinal tract. Wageningen, The Netherlands: Wageningen Academic publishers, 2006:37–60.
- 69. WILLIAMS BA, VERSTEGEN MWA, TAMMINGA S. Fermentation in the large intestine of single–stomached animals and its relationship to animal health. Nutr Res Rev 2001; 14:207–227
- 70. MCCRACKEN KJ, KELLY D. Development of digestive function and nutrition/disease interactions in the weaned pig. In: FARRELL DJ, editor. Recent advances in animal nutrition in Australia. Armidale: Department of Biochemistry, Microbiology and Nutrition, University of New England, 1993:182–192
- 71. BUGAUT M. Occurrence, absorption and metabolism of short chain fatty acids in the digestive tract of mammals. Comp Biochem Physiol 1987; 86B, 439–472
- 72. OFEK I, MIRELMAN D, SHARON N, Adherence of Escherichia coli to human mucosal cells mediated by mannose receptors. Nature 1977; 265:623–625
- 73. MATHEW AG, SUTTON AL, SCHEIDT AB, PATTERSON JA, KELLY DT, MEYERHOLZ KA. Effect of galactan on selected microbial populations and pH and volatile fatty acids in the ileum of the weanling pig, J Anim Sci 1993; 71:1503–1509
- 74. EWING WN, COLE DJA. The Living Gut: An Introduction to Micro–organisms in Nutrition. Dungannon, Ireland: Context: 1994:220
- 75. REIS DE SOUZA TC, MARISCAL LANDÍN G, ESCOBAR GARCÍA K. Algunos factores fisiológicos y nutricionales que afectan la incidencia de diarreas posdestete en lechones. Vet Méx 2010; 41:275–288
- 76. PIVA A, PANCIROLI A, MEOLA E, FORMIGONI A. Lactitol enhances short–chain fatty acid and gas production by swine microflora to a greater extent when fermenting low rather than high fibre diets. J Nutr 1995; 126: 280–289
- 77. MACFARLANE GT, GIBSON GR, BEATTY E, CUMMINGS JH. Estimation of short–chain fatty acid production from protein by human intestinal bacteria based on branched–chain fatty acid measurements, FEMS Microbiol Ecol 1992; 101:81–88
- 78. YOKOYAMA MT, TABORI C, MILLER ER, HOGBERG MG. The effects of antibiotic in the weanling pig diet on growth and the excretion of volatile phenolic and aromatic bacterial metabolites. Am J of Cl Nutr 1982; 35:1417–1424
- 79. RUSSELL JB, SNIFFEN CJ, VAN SOEST PJ. Effect of carbohydrate limitation on degradation and utilization of casein by mixed rumen bacteria. J Dairy Sci 1983; 66:763–775
- 80. RASMUSSEN HS, HOLTUG K, MORTENSEN PB. Degradation of amino to short–chain fatty acids in humans. Scand J Gastroenterol 1988; 23:178–182
- 81. WRONG OM, VINCE AJ. Urea and ammonia metabolism in the human large intestine. Proc Nutr Soc 1984; 43:77–86
- 82. VISEK WJ. Ammonia: its effects on biological systems, metabolic hormones, and reproduction. J Dairy Sci 1984; 67:481–498
- 83. EISEMANN JH, NIENABER JA. Tissue and whole body oxygen uptake in fed and fasted steers. Br J Nutr 1990; 64:399–411
- 84. HAWE SM, WALKER N, MOSS BW. The effects of dietary fibre, lactose and antibiotic on the levels of skatole and indole in faeces and subcutaneous fat in growing pigs. Anim Prod 1991; 54:413–419
- 85. MISIR S, SAUER WC. Effect of starch infusion at the terminal ileum on N balance and apparent digestibilities of nitrogen and amino acids in pigs fed meat–and–bone and soybean meal diets. J Anim Sci 1982; 55:599–607
- 86. KIRCHGESSNER M, KREUZER M, MACHMÜLLER A, ROTH–MAIER DA. Evidence for a high efficiency of bacterial protein synthesis in the digestive tract of adult sows fed supplements of fibrous feedstuffs. Anim Feed Sci Tech 1993; 46:293–306.
Referencias
1. CRANWELL PD. Development of the neonatal gut and enzyme systems. In: VARLEY MA, editor. Wallingford UK: CAB International, 1995: 99–154. [ Links ]
2. ZABIELSKI R, LE HUËRON–LURON I, GUILLOTEAU P. Development of gastrointestinal and pancreatic functions in mammalians (mainly bovine and porcine species): influence of age and ingested food. Reprod Nutr Dev 1999; 39:5–26. [ Links ]
3. DIRKZWAGER A, VELDMAN B, BIKKER P. A nutritional approach for the prevention of Post Weaning Syndrome in piglets. Anim Res 2005; 54:231–236. [ Links ]
4. LE DIVIDICH J, SÈVE B. Effects of underfeeding during the weaning period on growth, metabolism, and hormonal adjustments in the piglet. Domest Anim Endocrinol 2000; 19:63–74. [ Links ]
5. QUINIOU N, NOBLET J. Prediction of tissular body composition from protein and lipid deposition in growing pigs. J Anim Sci 1995; 73: 1567–1575. [ Links ]
6. NYACHOTI CM, DE LANGE CFM, SCHULZE H. Estimating endogenous amino acid flows at the terminal ileum and true ileal amino acid digestibilities in feedstuffs for growing pigs using the homoarginine method. J Anim Sci 1997; 75: 3206–3213. [ Links ]
7. DROZDOWSKI LA, CLANDININ T, THOMSON ABR. Ontogeny, growth and development of the small intestine: Understanding pediatric gastroenterology. World J Gastroenterol 2010; 16: 787–799. [ Links ]
8. KOONG LJ, NIENABER JA, MERSMANN J. Effects of plane of nutrition on organ size and fasting heat production in genetically obese and lean pigs. J Nutr 1983; 113: 1626–1631. [ Links ]
9. BIKKER P, VERSTEGEN MWA, KEMPS B, BOSH MW. Performance and body composition of finishing gilts (45 to 85 kilograms) as affected by energy intake and nutrition in earlier life: I. Growth of the body and components. J Anim Sci 1996; 74: 806–816. [ Links ]
10. LINDEMAN MD, CORNELIUS SG, EL KANDELGY SM, MOSER RL. Effect of Age, Weaning and diet on digestive enzyme levels in the piglet. J Anim Sci 1986; 62:1298–1307. [ Links ]
11. SANGILD PT. Biology of the pancreas before birth. In: PIERZYNOWSKI SG AND ZABIELSKI, editors. Biology of the pancreas in growing animals. Amsterdan, The Netherlands. Elsevier Science BV, 1999:1–13. [ Links ]
12. SEVE B. Elévage et sevrage des porcelets. In: PÉREZ JM, MORNET P, RÉRAT A, editors. Le porc et son élevage, bases scientifiques et techniques. France: Editorial Maloine, 1986: 403. [ Links ]
13. CERA KR, MAHAN DC, CROSS RF, REINHART GA, WHITMOYER RE. Effect of age, weaning and postweaning diet on small intestinal growth and jejunal morphology in young swine. J Anim Sci 1988; 66:574–584. [ Links ]
14. MOUGHAM PJ, BIRTLES MJ, CRANWELL PD, SMITH WC, PEDRAZA M. The piglet as a model for studing aspects of digestion and absorption in milk–fed human infants. World Rev Nutr Diet 1992; 67:40–113. [ Links ]
15. XU RJ, TUNGTHANATHANICH P, BIRTLES MJ, REYNOLDS GW, SIMPSON HV. Growth and morphological changes in the small and large intestine in piglets during the first three days after birth. J Dev Physiol 1992; 18:161–172. [ Links ]
16. VAN DIJKAJ, MARGRY CF, VAN DER LEE AG, HEMKE G, BEYNEN AC. Growth performance and Health status in weanling piglets fed spray–dried proccine plasma under typical Northen european conditions. J Anim Physiol Anim Nutr 2002; 86:17–25. [ Links ]
17. JENSEN MS, JENSEN SK, JAKOBSEN K. Development of digestive enzymes in pigs with emphasis on lypolitic activity in the stomach and pancreas. J Anim Sci 1997 75:437–445. [ Links ]
18. LALLÈS JP, BOUNDRY G, FAVIER C, LE FLOC'H N, LURON I, MONTAGNE L et al. Gut function and dysfunction in young pigs: physiology. Anim Res 2004; 53:301–316. [ Links ]
19. PLUSKE JR, WILLIAMS IH, AHERNE FX. Nutrition of the neonatal pig. In: VARLEY MA, editor. The neonatal pig: development and survival. Wallingford, UK: CAB International, 1995:187–235. [ Links ]
20. FOWLER WR. The nutrition of weaned pigs. Pigs News Info 1980, 1:11. [ Links ]
21. MAKKINK CA, BERNTSEN PJM, OP DEN KAMP BML, KEMP B, VERSTEGEN WA. Gastric protein breakdown and pancreatic enzyme activities in response to two different dietary protein sources in newly weaned pigs. J Anim Sci 1994; 72:2843–2850. [ Links ]
22. LALLÈS JP, TOULLEC R. Digestion des proteins vègètales et hypersensibilitè digestive chez le veau prèrumiant. INRA. Prod Anim 1996; 9:255–264. [ Links ]
23. HAMPSON D. Alterations in the pig small intestinal structure at weaning. Res Vet Sci 1986; 40:32–40. [ Links ]
24. MILLER BG, JAMES PS, SMITH MW, BOURNE FJ. Effect of weaning on the capacity of pig intestinal villi to digest and absorb nutrients. J Agric Sci Camb 1986; 107:579–589. [ Links ]
25. KELLY D, SMYTH JA, MCCRACKEN KJ. Digestive development of the early–weaned pig. 2. Effect of level of food intake on digestive enzyme activity during the immediate post–weaning period. Br J Nutr 1991; 65:181–188. [ Links ]
26. KELLY D, KING TP. Digestive physiology and development pigs. In: VARLEY MA, WISEMAN J, editors. The weaner pig, nutrition and Management, 2001: 179–206. [ Links ]
27. AGUILERA BA, SOUZA RTC, MARISCAL LG, JUÁREZ GY. Desarrollo de los órganos digestivos hasta la cuarta semana posdestete en lechones alimentados con subproductos lácteos. Memorias del XI Congreso de la AMENA y I del CLANA; 2003 agosto 18–23; Cancún, Quintana Roo, México. Querétaro, Querétaro: Cuarón JA, Cortez M, Fernández D., Labandero E, Pérez VG, Quintana M, editores, 2003:335–336. [ Links ]
28. ESCOBAR GK, REIS DE SOUZA TC, GUERRERO MJC, MARISCAL LG, AGUILERA BA, BERNAL MGS. Morfología del intestino delgado de lechones destetados alimentados con diferentes fuentes de proteína. Memorias del III Congreso CLANA; 2008 Noviembre 18–21; Cancún, Quintana Roo, México. CELIS A, GARCÍA M, editores, 2008:513–516. [ Links ]
29. OWSLEY WF, ORR DE, TRIBBLE LF. Effects of age and diet on the development of the pancreas and synthesis and secretion of pancreatic secretions in the young pig. J Anim Sci 1986; 63: 497–504. [ Links ]
30. EFIRD RC, ARMSTRONG WD, HERMAN DL. The development of digestive capacity in the young pigs: effect of weaning regimen and dietary treatment. J Anim Sci 1982; 55: 1371–1379. [ Links ]
31. PLUSKE JR, HAMPSON DJ, WILLIAM IH. Factors influencing the structure and function of the small intestine in the weaning pig: a review. Livest Prod Sci 1997; 51: 215–236. [ Links ]
32. XIANHONG G, DEFA L, RUIPING S. Effect of weaning on small intestinal structure and function in the piglet. Arch Anim Nutr 2002; 56:275–286. [ Links ]
33. HAMPSON DJ, KIDDER DE. Influence of creep feeding and weaning on brush border enzyme activities in the piglet small intestine. Res Vet Sci 1986; 40:24–31. [ Links ]
34. REIS DE SOUZA TC, MARISCAL LG, AGUILERA BA. Empleo de dos fuentes de lactosa en la dieta de lechones y sus efectos en el aparato digestivo. Tec Pec Méx 2002; 40:299–308. [ Links ]
35. REIS DE SOUZA TC, GUERRERO MJC, AGUILERA BA, MARISCAL LG. Efecto de diferentes cereales sobre la morfología intestinal de lechones recién destetados. Tec Pec Méx 2005; 43:309:321. [ Links ]
36. MEDEL P, LATORRE MA, MATEOS GG. Nutrición y alimentación de lechones destetados precozmente. En: REBOLLAR PG, DE BLAS C, MATEOS GG, editores. XV Curso de especialización avances en nutrición y alimentación animal. Madrid, España: Fundación Española para el Desarrollo de la Nutrición Animal, 1999:145–196. [ Links ]
37. PIVA A, GRILLI E, FABBRI L, PIZZAMIGLIO V, GATTA PP, GALVANO F et al. Intestinal metabolism of weaned piglets fed a typical United States or European diet with or without supplementation of tributyrin and lactitol. J Anim Sci 2008; 86:2952–2961. [ Links ]
38. ZIJLSTRA RT, WHANG KY, EASTER RA, ODLE J. Effect of feeding a milk replacer to early–weaned pigs on growth, body composition, and small intestinal morphology, compared with suckled littermates. J Anim Sci 1996; 74:2948–2959. [ Links ]
39. VENTE–SPREEUWENBERG MAM, VERDONK JMAJ, KOENINKX JFJG, BEYNEN AC, VERSTEGEN MWA. Dietary protein hydrolysates vs. intact proteins do not enhance mucosal integrity and growth performance in weaned piglets. Liv Prod Sci 2004; 85:151–164. [ Links ]
40. WU G, MEIER SA, KNABE DA. Dietary glutamine supplementation prevents jejunal atrophy in weaned pigs. J Nutr 1996; 126:2578–2584. [ Links ]
41. HANSENJA, NELSSENJL, GOODBAND RD, WEEDEN TL. Evaluation of animal protein supplements in diets of early–weaned pigs. J Anim Sci 1993; 71:1853–1862. [ Links ]
42. SMIRICKY MR, GRIESHOP CM, ALBIN DM, WUBBEN JE, GABERT VM, FAHEY GC Jr. The influence of soy oligosaccharides on apparent and true ileal amino acid digestibilities and fecal consistency in growing pigs. J Anim Sci 2002; 80:2433–2441. [ Links ]
43. PALACIOS MF, EASTER RA, SOLTWEDEL KT, PARSONS CM, DOUGLAS MW, HYMOWITZ T et al. Effect of soybean variety and processing on growth performance of young chicks and pigs. J Anim Sci 2004; 82:1108–1114. [ Links ]
44. LIENER IE. Factors affecting the nutritional quality of soya products. J Am Oil Chem Soc 1981; 58:406–415. [ Links ]
45. LI DF, NELSSEN JL, REDDY PG, BLECHA F, HANCOCK JD, ALLEE GL et al. Transient hypersensitivity to soybean meal in the early–weaned pig. J Anim Sci 1990; 68:1790–1799. [ Links ]
46. FRIESEN KG, NELSSEN JL, GOODBAND RD, BEHNKE KC, KATS LJ. The effect of pre and postweaning exposure to soybean meal on growth performance and on the immune response in the early–weaned pig. J Anim Sci 1993; 71:2089–2098. [ Links ]
47. DUNSFORD BR, KNABE DA, HAENSLY WE. Effect of dietary soybean meal on the microscopic anatomy of the small intestine in the early weaned pigs. J Anim Sci 1989; 67:1855–1863. [ Links ]
48. LESKE KL, JEVNE CJ, COON CN. Effect of oligosaccharide additions on nitrogen–corrected true metabolizable energy of soy protein concentrate. Poult Sci 1993; 72:664–668. [ Links ]
49. CUMMINGS JH, ENGLYST HN. Gastrointestinal effects of food carbohydrate. Am J Clin Nutr 1995; 61(suppl):938S–945S. [ Links ]
50. BAKER KM, STEIN HH. Amino acid digestibility and concentration of digestible and metabolizable energy in varieties of soybeans and fed to growing pigs soybean meal produced from conventional, high–protein, or low–oligosaccharide. J Anim Sci 2009; 87:2282–2290. [ Links ]
51. REIS DE SOUZA TC, AGUILERA MAB, AGUILERA AB, MARISCAL GL, CARRILLO MJG. Digestive tract morphology of piglets fed diets with isolated or concentrate soy protein. Arch Latinoam Prod Anim 2007; 15:134–140. [ Links ]
52. REIS STC, GUERRERO CMJ, MARISCAL LG, AGUILERA BA. Integridad intestinal en lechones alimentados con dietas complementadas con pasta de canola. XII Congreso Nacional AMENA; 2005 octubre 25–28; Puerto Vallarta, Jalisco, México. Querétaro, Querétaro: AMENA, 2005:1–2. [ Links ]
53. ESCOBAR GK, REIS DE SOUZA TC, GUERRERO MJC, MARISCAL LG, AGUILERA BA, BERNAL MGS. Morfología del intestino delgado de lechones destetados alimentados con diferentes fuentes de proteína. Memorias del III Congreso CLANA; 2008 Noviembre 18–21; Cancún, Quintana Roo, México. Celis A, García M, editores, 2008: 2008:513–516. [ Links ]
54. REIS TC, AGUILERA BA, MARISCAL LG, BALDERRAMA PVN, BERNAL SMG, ESCOBAR GK et al. Efecto de las pastas de ajonjolí y soya de sobre el tracto digestivo de lechones destetados. XLVI Reuniones Nacionales de Investigación e Innovación Agroalimentaria y Forestal en México; 2010 Noviembre 22–27; Campeche, Campeche, México. Guadalajara, Jalisco, México: Editores Prometeo SA de CV, 2010:249. [ Links ]
55. RIOPÉREZ J, SÁNCHEZ CP, CASTAÑO M. Estudio histopatológico del íleon de lechones precozmente destetados dependiente del cereal utilizado en su alimentación. Arch Zootec 1991; 40:261–271. [ Links ]
56. SALGADO P, FREIRE LPB, MOURATO M, CABRAL F, TOULLEC R, LALLÈS JP. Comparative effects of different legume protein sources in weaning piglets: Nutrient digestibility, intestinal morphology and digestive enzymes. Liv Prod Sci 2002; 74:191–202. [ Links ]
57. BEDFORD MR, CAMPBELL LD. Enzymes application for monogastric feeds a review. Can J Anim Sci 1992; 72:449–466. [ Links ]
58. COWAN WD, KORSBAKA, HASTRUP T, RASMUSSEN PB. Influence of added microbial enzymes on energy and protein availability of selected feed ingredients. Anim Feed Sci Technol 1996; 60:311–319. [ Links ]
59. GÓMEZ–SOTO JG, REIS DE SOUZA TC, MARISCAL–LANDÍN G, AGUILERA–BARREYRO A, MONTEMAYOR HM. Efecto del nivel de taninos del sorgo sobre la morfofisiología digestiva en lechones destetados. XLVI Reuniones Nacionales de Investigación e Innovación Agroalimentaria y Forestal en México; 2010 Noviembre 22–27; Campeche, Campeche, México. Guadalajara, Jalisco, México: Editores Prometeo SA de CV, 2010:247. [ Links ]
60. FIGUEROA VJL, CHI MEE, CERVANTES RM, DOMINGUEZ VIA. Functional foods for weanling pigs. Vet Méx 2006; 37:117–136. [ Links ]
61. WHITE LA, NEWMAN MC, CROMWELL GL, LINDEMANN MD. Brewers dried yeast as a source of mannan oligosaccharides for weanling pigs. J Anim Sci 2002; 80:2619–2628. [ Links ]
62. JIN Z, YANG YX, CHOI JY, SHINDE PL, YOON SY, HAHNB TW et al. Effects of potato (Solanum tuberosum L. cv. Golden valley) protein having antimicrobial activity on the growth performance, and intestinal microflora and morphology in weanling pigs. Anim Feed Sci Tech 2008; 140:139–154. [ Links ]
63. MANZANILLA EG, PÉREZ JF, MARTÍN M, BLANDÓN JC, BAUCELLS F, KAMEL C et al. Dietary protein modifies effect of plant extracts in the intestinal ecosystem of the pig at weaning. J Anim Sci 2009; 87:2029–2037. [ Links ]
64. LIU P, PIAO XS, KIM SW, WANG L, SHEN YB, LEE HS et al. Effects of chito–oligosaccharide supplementation on the growth performance, nutrient digestibility, intestinal morphology, and fecal shedding of Escherichia coli and Lactobacillus in weaning pigs. J Anim Sci 2008; 86: 2609–2618. [ Links ]
65. MAVROMICHALIS I, PATON F. Nuevos ingredientes en la alimentación de cerdos. XX Curso de Especialización FEDNA: Avances en Nutrición y Alimentación Animal. En: REBOLLAR PG, DE BLAS C, MATEOS GG, editores. Fira de Barcelona, España: Fundación Española para el Desarrollo de la Nutrición Animal, 2004:125–147. [ Links ]
66. KOTUNIA A, WOLIÑSKIJ, LAUBITZ D,JURKOWSKA M, ROMÉ V, GUILLOTEAU P et al. Effect of sodium butyrate on the small intestine development in neonatal piglets feed by artificial sow. J Physiol Pharm 2004; 55:59–68. [ Links ]
67. MAZZONI M, LE GALL M, DE FILIPPI S, MINIERI L, TREVISI P, WOLINSKI J et al. Supplemental Sodium Butyrate Stimulates Different Gastric Cells in Weaned Pigs. J Nutr 2008; 138: 1426–1431. [ Links ]
68. SNEL J, HARMSEN HJM, VAN DER WIELEN PWJJ, WILLIAMS BA. 2. Dietary strategies to influence the gastro–intestinal microflora of young animals, and its potential to improve intestinal health. In: BLOK MC, VAHL H A, DE LANGE L, VAN DE BRAAK AE, HEMKE G, HESSING M, editors. Nutrition and health of the gastrointestinal tract. Wageningen, The Netherlands: Wageningen Academic publishers, 2006:37–60. [ Links ]
69. WILLIAMS BA, VERSTEGEN MWA, TAMMINGA S. Fermentation in the large intestine of single–stomached animals and its relationship to animal health. Nutr Res Rev 2001; 14:207–227. [ Links ]
70. MCCRACKEN KJ, KELLY D. Development of digestive function and nutrition/disease interactions in the weaned pig. In: FARRELL DJ, editor. Recent advances in animal nutrition in Australia. Armidale: Department of Biochemistry, Microbiology and Nutrition, University of New England, 1993:182–192. [ Links ]
71. BUGAUT M. Occurrence, absorption and metabolism of short chain fatty acids in the digestive tract of mammals. Comp Biochem Physiol 1987; 86B, 439–472. [ Links ]
72. OFEK I, MIRELMAN D, SHARON N, Adherence of Escherichia coli to human mucosal cells mediated by mannose receptors. Nature 1977; 265:623–625. [ Links ]
73. MATHEW AG, SUTTON AL, SCHEIDT AB, PATTERSON JA, KELLY DT, MEYERHOLZ KA. Effect of galactan on selected microbial populations and pH and volatile fatty acids in the ileum of the weanling pig, J Anim Sci 1993; 71:1503–1509. [ Links ]
74. EWING WN, COLE DJA. The Living Gut: An Introduction to Micro–organisms in Nutrition. Dungannon, Ireland: Context: 1994:220. [ Links ]
75. REIS DE SOUZA TC, MARISCAL LANDÍN G, ESCOBAR GARCÍA K. Algunos factores fisiológicos y nutricionales que afectan la incidencia de diarreas posdestete en lechones. Vet Méx 2010; 41:275–288. [ Links ]
76. PIVA A, PANCIROLI A, MEOLA E, FORMIGONI A. Lactitol enhances short–chain fatty acid and gas production by swine microflora to a greater extent when fermenting low rather than high fibre diets. J Nutr 1995; 126: 280–289. [ Links ]
77. MACFARLANE GT, GIBSON GR, BEATTY E, CUMMINGS JH. Estimation of short–chain fatty acid production from protein by human intestinal bacteria based on branched–chain fatty acid measurements, FEMS Microbiol Ecol 1992; 101:81–88. [ Links ]
78. YOKOYAMA MT, TABORI C, MILLER ER, HOGBERG MG. The effects of antibiotic in the weanling pig diet on growth and the excretion of volatile phenolic and aromatic bacterial metabolites. Am J of Cl Nutr 1982; 35:1417–1424. [ Links ]
79. RUSSELL JB, SNIFFEN CJ, VAN SOEST PJ. Effect of carbohydrate limitation on degradation and utilization of casein by mixed rumen bacteria. J Dairy Sci 1983; 66:763–775. [ Links ]
80. RASMUSSEN HS, HOLTUG K, MORTENSEN PB. Degradation of amino to short–chain fatty acids in humans. Scand J Gastroenterol 1988; 23:178–182. [ Links ]
81. WRONG OM, VINCE AJ. Urea and ammonia metabolism in the human large intestine. Proc Nutr Soc 1984; 43:77–86. [ Links ]
82. VISEK WJ. Ammonia: its effects on biological systems, metabolic hormones, and reproduction. J Dairy Sci 1984; 67:481–498. [ Links ]
83. EISEMANN JH, NIENABER JA. Tissue and whole body oxygen uptake in fed and fasted steers. Br J Nutr 1990; 64:399–411. [ Links ]
84. HAWE SM, WALKER N, MOSS BW. The effects of dietary fibre, lactose and antibiotic on the levels of skatole and indole in faeces and subcutaneous fat in growing pigs. Anim Prod 1991; 54:413–419. [ Links ]
85. MISIR S, SAUER WC. Effect of starch infusion at the terminal ileum on N balance and apparent digestibilities of nitrogen and amino acids in pigs fed meat–and–bone and soybean meal diets. J Anim Sci 1982; 55:599–607. [ Links ]
86. KIRCHGESSNER M, KREUZER M, MACHMÜLLER A, ROTH–MAIER DA. Evidence for a high efficiency of bacterial protein synthesis in the digestive tract of adult sows fed supplements of fibrous feedstuffs. Anim Feed Sci Tech 1993; 46:293–306. [ Links ]






Estados Unidos de América








