Perfil serológico del virus de influenza porcina, Mycoplasma hyopneumoniae y Actinobacillus pleuropneumoniae en granjas de Yucatán, México
Introducción
En México, como en otros países, la industria porcina se ve afectada por problemas de origen sanitario, entre éstos el complejo respiratorio porcino (CRP). La presencia de este complejo en las granjas tiene efecto en los indicadores de producción, ocasionando disminución en la tasa de crecimiento, en la ganancia diaria, en la conversión alimentaria y en el consumo y peso de los cerdos al mercado.1 Estrada2 y Hill et al.3,4 notifi can que cerdos afectados con problemas respiratorios presentan una disminución en la ganancia de peso de 41.1 g diarios y tardan 16.7 días más en salir al mercado, aumentando esto último el costo por alimento en 79.8 pesos por cerdo. En el CRP intervienen diferentes agentes etiológicos: Virus de infl uenza porcina, Mycoplasma hyopneumoniae y Actinobacillus pleuropneumoniae. Los animales que logran recuperarse de CRP quedan portadores de esos agentes, siendo éstos los principales diseminadores del problema cuando son introducidos en hatos libres de la enfermedad. En Yucatán los trabajos realizados sobre CRP son escasos y los existentes, en su mayoría, han sido realizados a nivel de rastro.5 Los objetivos de este estudio fueron estimar la frecuencia de cerdos seropositivos al virus de infl uenza porcina, M. hyopneumoniae y A. pleuropneumoniae por etapa de producción; determinar la frecuencia de los serotipos más comunes de A. pleuropneumoniae y los subtipos del virus de infl uenza porcina más comunes en cerdos de engorda, en granjas de producción intensiva de Yucatán, México
Material y métodos
El estudio se realizó en la zona centro de Yucatán, México, donde el clima es cálido subhúmedo, con lluvias en verano (Aw1). La temperatura media anual es 27ºC (rango 7 a 42ºC), con precipitación media anual de 984.4 mm y humedad relativa de 78.2%.6
Se realizó un estudio epidemiológico transversal en 25 granjas porcinas de ciclo completo, de un solo sitio, cuyo destete se realizaba en promedio a los 21 días de edad. De las semanas cuatro a diez los lechones se mantenían en jaulas elevadas, con capacidad para 16 animales por jaula. De las semanas 11 a 24 de edad se mantenían en el área de engorda y fi nalizado en corrales con piso de cemento con capacidad para 16 cerdos por corral. La población de cerdos reproductores por granja variaba de 100 a 1 000 vientres.
En las granjas la bioseguridad era mínima: La limpieza y desinfección de jaulas y edifi cios era parcial; las medidas de higiene del personal eran de bajo nivel sanitario, no se realizaban muestreos serológicos a los animales de remplazo ni se les ponía en cuarentena antes de su ingreso a la granja; tampoco se vacunaba contra ninguno de los agentes aquí estudiados. Durante el periodo de investigación, en las granjas se notifi có la presencia del complejo respiratorio porcino (CRP). Diferentes dosis y antibióticos se utilizaron en las etapas de producción, como medidas profi lácticas, contra los problemas respiratorios, basados en los criterios y experiencias de los médicos veterinarios o de los productores.
Las 25 granjas se seleccionaron por conveniencia y por disponibilidad de los productores. El número de cerdos muestreados por granja fue 40 animales divididos en diez cerdos por cada etapa de producción: Destete, crecimiento, desarrollo y fi nalización. El tamaño de muestra calculado fue el necesario para detectar presencia de anticuerpos contra el virus de la enfermedad de Aujeszky.7 Brevemente se consideró un promedio de población de dos mil cerdos de engorda en las granjas estudiadas, nivel de confi anza del 95% de detectar al menos un animal positivo en una granja, y prevalencias esperadas de 8% y 25% para granja y etapa de producción, respectivamente.8 Dentro de cada granja se seleccionaron al azar diez corrales por etapa de producción y un cerdo por corral.
Las muestras de sangre de los cerdos se obtuvieron de la vena cava anterior por venopunción utilizando vacutainers (sin anticoagulante) de 7 ml y agujas número 21.5. La sangre se dejó coagular a temperatura ambiente y el suero se guardó en viales a –20ºC hasta su utilización para detectar la presencia de anticuerpos contra el virus de infl uenza porcina (VIP) subtipos H1N1 y H3N2, Mycoplasma hyopneumoniae y Actinobacillus pleuropneumoniae.
Para detectar la presencia de anticuerpos contra el VIP se utilizó la prueba de inhibición de la hemaglutinación.9 Los antígenos virales utilizados fueron A/sw/England/163266/87 (H3N2) y A/sw/ Ia/73(H1N1), que se multiplicaron en alantoides de embrión de pollo de nueve a 11 días de edad. Se consideraron muestras positivas que presentaron títulos de 1:80 o más.10 La sensibilidad y especifi cidad de la prueba fueron: 96% y 96%.11
Para la detección de anticuerpos contra M. hyopneumoniae en suero se utilizó la prueba diagnóstica comercial CHEKIT-Hyoptest II, que representa una prueba de ELISA indirecta. La valoración de los sueros se realizó como: negativos (< 20%), sospechosos (20%-30%) y positivos (> 30%). Las muestras con resultados sospechosos fueron analizadas en una segunda ocasión para determinar su interpretación fi nal. La especifi cidad de la prueba de ELISA fue de 99.4% y la sensibilidad de 66.7%.
Para detectar la presencia de anticuerpos contra A. pleuropneumoniae se utilizó la prueba diagnóstica PLEUROTEST,12 que es una prueba de aglutinación directa en placa. La sensibilidad y especificidad de la prueba fueron 86% y 97%, respectivamente.13 Los datos se analizaron mediante estadística descriptiva y pruebas de Ji-cuadrada.14
Resultados
Influenza porcina
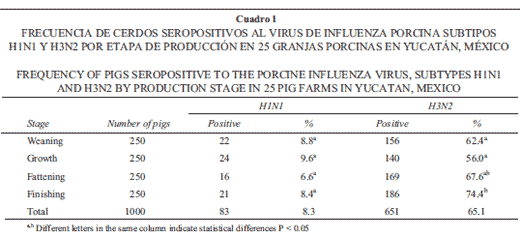
La frecuencia de granjas positivas a VIP fue 56%, mientras que 8.3% y 65.1% de los sueros resultaron positivos a los subtipos H1N1 y H3N2, respectivamente (Cuadro 1). Por etapa de producción, la frecuencia más alta de animales seropositivos al VIP subtipo H1N1 se observó en las etapas de destete y crecimiento, aunque las diferencias entre etapas no fueron signifi cativas (P < 0.05). Para el subtipo H3N2, la mayor frecuencia (74.4%) se observó en la etapa de finalizado (P < 0.05). El 6.6% (66/1 000) de los sueros compartieron los dos subtipos del VIP.
Neumonía micoplasmática
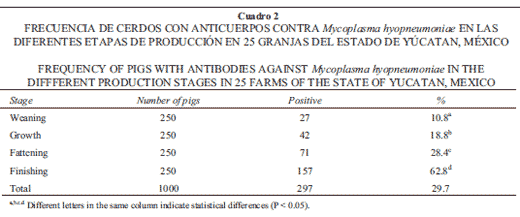
La frecuencia de granjas seropositivas a M. variahyopneumoniae fue 100%, pues en todas se encontró al menos un animal positivo, y la frecuencia individual fue 29.7% (297/1 000). Se observaron diferencias signifi cativas (P < 0.05) por etapa de producción, encontrándose el mayor número de animales seropositivos a M. hyopneumoniae en la etapa de fi nalizado de los cerdos (Cuadro 2).
Pleuroneumonía contagiosa porcina
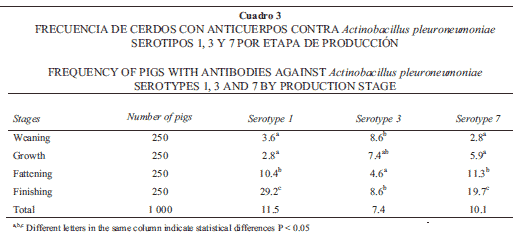
La frecuencia de granjas seropositivas a A. pleuropneumoniae serotipo 1 fue 100%. Doce granjas fueron seropositivas al serotipo 3 (48%) y 13 (52%) fueron seropositivas al serotipo.7 Las frecuencias individuales para los serotipos 1, 3 y 7 fueron 11.5%, 7.4% y 10.1%, respectivamente (Cuadro 3). Los serotipos 1 y 7 fueron los más frecuentes en las etapas de engorda y fi nalizado en comparación con las etapas de destete y crecimiento (Cuadro 3). El serotipo 3 se detectó en 8.6% de los sueros de la etapa de destete, 7.4% en crecimiento, 4.6% en engorda y 8.6% en la etapa de fi nalizado (Cuadro 3). Del total de sueros positivos al serotipo 1, 20 presentaron además anticuerpos contra el serotipo 3 y 34 contra el serotipo 7.
Discusión Influenza porcina
En México este es el primer estudio del patrón de distribución de seropositividad contra el VIP, subtipos H1N1 y H3N2, en granjas comerciales. Los resultados de este estudio indican una frecuencia alta (56%), como la descrita en países de Europa,15,16 lo que indica que el VIP tiene amplia distribución en las granjas porcinas del mundo.
El subtipo H3N2 mostró mayor frecuencia que el subtipo H1N1 en las distintas etapas de producción.
En Canadá y Estados Unidos de América se notifica17 el subtipo H3N2 como un patógeno importante del cerdo. La importancia de este subtipo como agente primario involucrado en enfermedades respiratorias de curso agudo y de formas subclínicas ha sido demostrado por otros autores.15,17,18 En brotes epizootiológicos este subtipo presenta como signos clínicos la presencia de abortos en gran número de marranas.
La baja frecuencia de seropositividad del subtipo H1N1 indica que este subtipo no representa riesgo importante para los cerdos en la región. Sin embargo, se menciona que existe variación de antigenicidad entre las cepas del laboratorio que se utilizan como antígenos y las de campo.17 El 6.6% de animales seropositivos para ambos subtipos representa un riesgo de intercambio de material genético, ya que la infección simultánea de una célula con dos diferentes VIP podría iniciar el intercambio de segmentos del genoma, originando un subtipo con reacomodo genético.19
En un estudio en México con cerdos finalizados que llegaban al rastro y a los cuales se les tomó muestras para detectar la presencia del VIP, subtipo H1N1, se encontró seropositividad de 20.3%.10 Todavía no se conoce la participación que tiene el VIP en México como agente primario o secundario en el complejo respiratorio porcino; sin embargo, en otros países su participación está documentada.15 Tsai et al.,20 en animales fi nalizados, encontraron que la incidencia de anticuerpos al VIP, subtipos H1N1 y H3N2, fue 21.7% y 20.8%, respectivamente; observándose dos incrementos para el subtipo H1N1 durante el estudio. El primer incremento fue 35% y el segundo alcanzó 65% de seropositividad. Asimismo, para el subtipo H3N2 se observó un solo incremento que alcanzó 83% de seropositividad.
Neumonía micoplasmática
La totalidad de las granjas estudiadas fueron seropositivas a M. hyopneumoniae, lo cual muestra la amplia distribución que tiene este microorganismo en las granjas de engorda. Esto coincide con resultados en Yucatán, 93.3%23 y otros descritos en el ámbito mundial. En Suecia y Noruega24 se encontró 62% y 90% de granjas seropositivas. En Alemania24 se encontró que de 75% a 100% de las granjas estudiadas fueron positivas a M. hyopneumoniae no existiendo diferencias por región o variación estacional. En Japón los cerdos seroconvirtieron a M. hyopneumoniae a los cuatro meses de edad en 64.3% de granjas convencionales.25 Asimismo, informan, que 79.1% de los cerdos de la etapa de crecimiento y fi nalización fueron seropositivos.
El 29% del total de sueros analizados en este estudio fueron positivos, detectándose en la fase de destete el menor número de ellos, el cual incrementó de tres a cinco veces en las fases de crecimiento, desarrollo y fi nalización. Andreasen et al.22 para conocer los patrones de seroconversión a patógenos respiratorios en nueve granjas porcinas, encontraron que la seroconversión contra M. hyopneumoniae se dio en 100% de ellas y ocurrió en los animales localizados en las unidades de crecimiento y fi nalización. Según Ganter,24 en Alemania la frecuencia de animales seropositivos por etapa de producción fue: 81.2% en engorda, 33% en lechones, 63% en marranas de remplazo y 47% en marranas adultas.
Thacker26 y Andreasen et al.22 mencionan que los anticuerpos maternales contra M. hyopneumoniae comienzan a descender a la semana seis de vida, de aquí que los anticuerpos detectados en la fase de destete sean considerados de origen maternal.Asimismo, el incremento de anticuerpos en la fase de crecimiento, desarrollo y fi nalización posiblemente se deba a que el agente infeccioso se encuentra circulando en la población. Esto último indica que las marranas infectadas o portadoras de M. hyopneumoniae son la principal fuente de infección para los lechones, presentándose luego la transmisión entre lechones en la maternidad.27 El destete, traslado a la engorda y mezclado de animales incrementa la tasa de diseminación; esto explica en parte la frecuencia de cerdos seropositivos al aumentar la edad de los cerdos.Se conoce que los anticuerpos detectados por ELISA se encuentran en las muestras de suero de seis a ocho semanas posinfección,22,26,28 por lo que es muy probable que en este estudio la infección de los cerdos ocurrió en las salas de maternidad y al momento del destete cuando existe mezcla de animales susceptibles e infectados. Sin embargo, es difícil determinar la edad exacta en que los animales se infectan con M. hyopneumoniae, sobre todo bajo condiciones de campo. La distribución de M. hyopneumoniae sugiere que su transmisión es muy eficiente.
Pijoan y Ruiz29 señalan que en animales muestreados con la prueba de PCR en brotes de campo, gran proporción puede estar infectados antes de que se observe la diseminación rápida del organismo dentro de granja. Esto sugiere que una carga mínima del agente puede estar presente antes de que ocurra la transmisión rápida. Loanterior explica, en parte, las diferencias epidemiológicas observadas en los variados sistemas de producción.
Loeffen et al.15 señalan que M. hyopneumoniaeestá asociada con la enfermedad CRP y que M. hyopneumoniae se encontraba en los animales mucho antes de que se presentara semiótica clínica. Asimismo, es posible que los cerdos que presentan la infección subclínica sean mucho más susceptibles a patógenos que causen brotes de problemas respiratorios agudos. Una combinación de factores ambientales y el contacto con animales portadores de mayor edad, los cuales han presentado signos clínicos de neumonía, incrementa el riesgo de infección y diseminación de la neumonía micoplasmática en cerdos alojados en las áreas de fi nalización.27
Pleuroneumonía contagiosa porcina
Los resultados de seroprevalencia de granjas infectadas con A. pleuropneumoniae (100%) indican que este agente está muy difundido en la región. En Yucatán se notifi ca 96.9% de seropositividad en 33 granjas.23 La mayor frecuencia de los serotipos 1 y 7, en comparación con el serotipo 3, coincide, en parte, con los resultados de otros trabajos en Yucatán.
Huchin30 identifi có los serotipos 1, 4 y 11; Torres31 los serotipos 1, 3 y 5, y Moguel23 los serotipos 1, 3, 5 y 7. En Iowa, Estados Unidos de América, se informó que 68.8% de 597 granjas y 32.1% de 7 348 sueros analizados tuvieron anticuerpos contra A. pleuropneumoniae.32 El sistema de vigilancia de salud animal informa que en granjas de cerdos de engorda 8.1% presentaron problemas de pleuroneumonía contagiosa porcina y 3.4% en granjas de pie de cría.33 Esto indica que A. pleuropneumoniae se encuentra difundido en la Unión Americana, siendo importante debido a que es el principal origen del material genético que se introduce a Yucatán. En Estados Unidos los serotipos 1, 5, y en menor grado el 7, son los más prevalentes y responsables de 95% de los casos clínicos de pleuroneumonía, aunque se ha observado que la frecuencia del serotipo 3 está incrementándose.34 Sin embargo, la interpretación de los resultados serológicos debe ser cuidadosa, debido a que dentro de los serotipos de A. pleuropneumoniae existen grupos que comparten antígenos, originando reacción cruzada.35
En la fase de destete, los anticuerpos detectados contra esta bacteria se pueden interpretar como de origen maternal; éstos disminuyeron hasta la fase de crecimiento, lo cual concuerda con lo señalado en la literatura, que indica que a las ocho a 12 semanas los anticuerpos maternales comienzan a desaparecer.36 Posteriormente se observa un incremento de animales seropositivos, obteniéndose el máximo en la fase de fi nalización. Esto se interpreta como evidencia de que los animales estuvieron en contacto con el microorganismo. En la mayoría de las granjas infectadas endémicamente, todos los animales del hato reproductor presentan serología positiva.34 Las granjas infectadas con A. pleuropneumoniae se clasifi can en cuatro categorías donde los criterios son la presencia de signos clínicos y la detección de anticuerpos circulantes. Aunque en este estudio las granjas fueron seropositivas no se puede decir que los animales estén afectados clínicamente, debido a que existen algunas granjas que presentan signos clínicos y son serológicamente positivas y otras no. Según algunos investigadores, 80% de las granjas se encuentran con semiótica negativa y serología positiva,34 lo que concuerda con el resultado de este estudio; se detectó seropositividad, pero los síntomas clínicos característicos contra A. pleuropneumoniae no se observaron.
El serotipo 1 es de mayor riesgo para la población porcina, ya que se clasifi ca como de mayor virulencia debido a que produce la toxina Apx 1, la cual es una potente hemolisina y la Apx II, que tiene una función similar a la primera, y se encuentra controlada por el mismo grupo de genes.35,37 El serotipo 7 se considera menos virulento, aunque produce seroconversión en gran proporción de animales con sólo algunos signos clínicos.
Por otro lado, los resultados de este estudio sugieren que los sueros probados con el Pleurotest pueden aglutinar con un solo serotipo o con más de uno y los animales pudieron estar en contacto con uno o varios de ellos. Por ejemplo, con el serotipo 1 y serotipo 3 aglutinaron 17.3% de los sueros y con el serotipo 1 y 7, 29.5% de los mismos. Lo anterior coincide con lo notifi cado por Torres et al.38 en el Estado de México, México, quienes encontraron que 69.5% de los sueros aglutinaron para más de un serotipo. En Yucatán, Torres31 y Moguel23 encontraron que 54% y 37.2% de los sueros que resultaron positivos, aglutinaron con más de un serotipo de A. pleuropneumoniae. En este trabajo se encontró que en las fases de engorda y fi nalización se encontraron los mayores porcentajes (23.8 y 19.6, respectivamente) de animales que reaccionaron con más de un serotipo. Se señala que mientras más serotipos circulen en una población animal, la presentación clínica de la enfermedad es más severa y su control más difícil.
Se concluye que en este estudio existió una alta frecuencia de granjas y cerdos con el VIP, M. hyopneumoniae y A. pleuropneumoniae en Yucatán y que los agentes infecciosos se encuentran distribuidos en las diferentes etapas del periodo de engorda. Los subtipos H3N2 y H1N1 del VIP y los serotipos 1, 3 y 7 de A. pleuropneumonia fueron los más frecuentes.
Referencias
1. Dee SA. The porcine respiratory disease complex. Are subpopulations important? J Swine Health Prod 1996;4:147-149.
2. Estrada R. Latin America what is the prevalence and economical effect of respiratory disease? Pig Prog 1998;14: 6-8
3. Hill M.A. Schidt A.B., Tecalw F.R., Clark L.K., Knox E.K. Jordan M. Association between growth indicators and volume of lesions in lungs from pigs at slaughter. Am. J. Vet. Res. 1992;53: 2221-2223.
4. Hill M.A. Schidt A.B., Teclaw F.R., Clark L.K., Knox E.K. Jordan M. Relationship between the performance and the weight of pneumonia lesions from pigs at slaughter. Res Vet Sci 1994;56: 240-244.
5. Williams JJ, Torres León MA, Sansor Nah R. Prevalencia, caracterización y extensión de las lesiones en pulmones de cerdos sacrifi cados en el rastro municipal de Mérida, Yucatán, México. Rev Biomédica 2000;11:25-32.
6. Instituto Nacional de Estadística Geografía e Informática. Anuario estadístico del estado de Yucatán. INEGI, 1997.
7. Rodriguez-Buenfi l JC, Alvarez-Fleites M, Alzina-Lopez A, Arjona-Torres MG, Segura-Correa JC, Villegas- Perez S. Risk factors for Aujeszky’s disease in pig herds and detection of fi eld virus antibodies in fattening pigs in the state of Yucatan, Mexico. Prev Vet Med 2002;53:205-213.
8. Martin SW, Meek AH, Willenberg P. Veterinary Epidemiology. Ames Iowa, Iowa State University Pres. 1987.
9. Rockborn G, Klingerborn B, Juntti N. Diagnostic virology: Second Part Guidebook to Procedures, Uppsala, Sweden. Editor J. Moreno-Lopez. 1990. pp 39-43.9.
10. Rodríguez TJ, Ramírez MH, Carreón NR, Mercado GC. Muestreo serológico a nivel de rastro para detectar anticuerpos contra el virus de Infl uenza Porcina. Vet Méx 1996;27:17-21.
11. Westenbrink F, Veldhuis M A, Brinkhof J M A. An enzyme-linked immunosorbent assay for detection of antibodies to porcine parvovirus. J Virology Methods 1989;23:169-178
12. Ciprián A, Colmenares G, Mendoza S. La enfermedad de Actinobacillus pleuropneumoniae en México. Compendio de Actinobacillus pleuropneumoniae. Guadalajara, Jalisco, Editado por AMVEC. 1990; pp 29-42.
13. Colmenares G, Mendoza S, Ayala G, Ciprian A. A rapid fi eld serological test for the diagnostic of Actinobacillus pleuropneumoniae serotype 1. Proceeding of the 12th International Pig Veterinary Society Congress. 1992, July 5-9. The Hague, The Netherlands, IPVS: 1992.
14. EpiInfo (Computer Program). A word processing, database, statistics program for public health for Epidemiology Program Offi ce, Center for Disease Control and Prevention. Version 1.0 for Windows. Atlanta, 2000.
15. Loeffen W. A production balancing act. Pig Prog 2001;17:4-6.
16. Van Reeth K, Guan Y. Swine Infl uenza: an update from Europe and Asia. Disease, Pig Prog 2000;16 Supl:4-7.
17. Janke HB. Diagnostic of swine infl uenza. Swine Health Prod 2000;8:79-81.
18. Erickson GA, Swenson SL. H3N2 SIV in the USA. Pig Prog 2000;16Supl:8-9.
19. Brown IH, Alexander DJ, Chakraverty P, Harris PA, Manvell RJ. Isolation of an infl uenza A virus of unusual subtype (H1N7) from pigs in England, and the subsequent experimental transmission from pig to pig. Vet. Microbiol 1994;39:125-134.
20. Tsai CP, Cheng MC, Lin DT, Chen CM. The prevalence of hemoagglutination-inhibition (HI) antibodies to infl uenza viruses A/swine/Iowa/15/30(H1N1) and A/Swine/Obihiro/10/85 (H3N2) in Taiwan pigs. Proceedings of the 16th International Pig Veterinary Society Congress; 2000 September 17-20, Melbourne, Australia. IPVS: 2000.
21. Van Reeth K, Pensaert MB. Porcine respiratory coronavirus mediated interference against infl uenza virus replication in the respiratory tract of feeder pigs. Am J Vet Res 1994;55:1275-1281.
22. Andreasen M, Nielsen JP, Baekbo P, Willeberg P, Botner A. A longitudinal study of serological patterns of respiratory infections in nine infected Danish swine herds. Prev Vet Med 2000;45:221-235.
23. Moguel JR. Seroprevalencia y descripción de algunas variables relacionadas a la presentación de Actinobacillus pleuropneumoniae y Mycoplasma hyopneumoniae en granjas porcinas de Yucatán (tesis de maestría). Mérida (Yucatán) México: Facultad de Medicina Veterinaria y Zootecnia, Universidad Autónoma de Yucatán, 1997.
24. Yagihashi T, Kazama JY, Tajima M. Seroepidemiology of mycoplasmal pneumonia of swine in Japan as surveyed by an enzyme-linked immunosorbent assay. Vet Microbiol 1993;34:155-166.
25. Ganter M. Respiratory disease: Europe. Pig Prog 1998;14:12-16.
26. Thacker LE. Mycoplasma vaccines: what we know, what we don´t know. Proceeding of the ISU Veterinary Medicine Seminar on Mycoplasma Pneumonia in modern Swine Production Units. 1997 April 22. Ames Iowa, Iowa State University. 1997. pp 11-13.
27. Clark K, Freeman J, Scheidt A, Knox K. Investigating the transmission of Mycoplasma hyopneumoniae in a swine herd with enzootic pneumonia. Vet Med 1991;16:543-550.
28. Morris RC, Gardner AI, Hietala KS, Carpenter ET, Anderson JR, Parker MK. Seroepidemiologic study of natural transmission of Mycoplasma hyopneumoniae in a swine herd. Prev Vet Med 1995;21:323-337.
29. Pijoan C, Ruiz A. Transmission of M. hyopneumoniae. Pig Prog 2001;17Suppl:14-15.
30. Huchin AL. Serotipifi cación de Actinobacillus pleuropneumoniae por la técnica de coaglutinación en combinación con la técnica de estimación cuantitativa por dilución doble (tesis de licenciatura). Mérida (Yucatán) México: Facultad de Medicina Veterinaria y Zootecnia, Universidad Autónoma de Yucatán, 2000.
31. Torres M. Prevalencia de lesiones en pulmones y evaluación de una prueba de aglutinación en placa (Pleurotest) para la detección de anticuerpos contra Actinobacillus pleuropneumoniae en cerdos sacrifi cados en el rastro municipal de Mérida, Yucatán (tesis de maestría) Mérida (Yucatán) México: Facultad de Medicina Veterinaria y Zootecnia, Universidad Autónoma de Yucatán, 1995 .
32. Schultz RA, Young TA, Ross DF, Jeske DR. Prevalence of antibodies to Haemophilus pleuropneumoniae in Iowa swine. Am J Vet Res 1982; 43:1848-1851.
33. United States Department of Agriculture. National animal health monitoring service 2002. Part II reference of swine health and health management in USA. (serial online) Available from: URL: http:// www.Aphis.usda.gob/vs/ceah/cahm/Swine/ swinepart2.pdf.
34. Marsteller TA, Fenwick B. Actinobacillus pleuropneumoniae disease and serology. Swine Health Prod 1999;7:161-165.
35. Gottschalk M. Actinobacillus pleuropneumoniae : an update. Proceeding of the annual meeting of the American Association of Swine Practitioners. 1999, February 27-March 2. Iowa, AASV, 357-361. 1999
36. Wongnarket S, Pfeiffer DU, Morris RS, Fenwick SG. An on-farm study of the epidemiology of Actinobacillus pleuropneumoniae infection in pigs as part of a vaccine effi cacy trial. Prev Vet Med 1999;39:1-11.
37. Taylor JD. Actinobacillus pleuropneumonia. In: Disease of Swine 8TH edition. Straw, B., A´Allaires, S., Mengeling, and Taylor, D. editors. Ames, Iowa. Iowa State University Press. 1999.
38. Torres A, Carrión M, Mendoza S, Ciprián A. Estudio serológico con Pleurotest empleando los serotipos 1, 2, 3, 5, 7, 9 de Actinobacillus pleuropneumoniae relacionado con la patología y bacteriología de pulmones colectados en rastro. Memorias del XXVI Congreso Nacional AMVEC; 1991 julio 28-31; Mérida (Yucatán) México. México (DF): Asociación Mexicana de Médicos Veterinarios Especialistas en Cerdos, AC, 1991:157-159




Nettius

REALMENTE es BUENO ESTE ARTICULO,PERO DEBEN RECORDAR QUE UNA VEZ se DIO PUBLICIDAD MUNDIAL A la MAL LLAMADA PESTE PORCINA, la O.M.S. POR CONDUCTO DE su DIRECTORA la DRA. Margarita Chang, ORDENO LLAMARLA AH1-N1, PORQUE TODO se le ACAREABA A NUESTROS ANIMALES PORCINOS,
DEFINITIVAMENTE TODOS LOS PRODUCTORES PORCINOS DEBEMOS DE IMPLEMENTAR LAS MEDIDAS DE BAO-SEGURIDAD en NUESTRAS GRANJAS,HAY QUE, INVERTIR PARA NO TENER PROBLEMAS MAS ADELANTE, el BAJO en LAS VENTAS , el AÑO 2009, FUE CASI NEGATIVO,PERO A FINALES DEL ULTIMO TRIMESTRE se REACTIVARON Y HOY GOZAMOS DE MUY BUENAS VENTAS Y NUESTRO CERDITOS IGUAL.....LO DEL GOBIERNO DE EGIPTO TOMAR ESTAS MEDIDAS FUERON FUERTES PERO se HICIERON COMPAÑERO JIMENEZ, YA VEMOS A LOS LABORATORIOS COMO PFIZER ,MSD,AVENTIS,ROCHE COMERCIALIZANDO LAS VACUNAS AHI, N1 ...
CREO PERSONALMENTE TODO ESTO ES BAJO LA AYUDA Y APOPO DE LAS MULTI NACIONALES FARMACEUTICAS , COMO OCURRIO CON LA PESTE AVIAR ,se MANEJAN MUCHOS BILLONES DE DOLLARES
EN ESTE NEGOCIO.
ARGEMIRO HERNANDEZ
PRODUCTOR
BARRANQUILLA ATLANTICO


Evonik Animal Nutrition


Special Nutrients


Estados Unidos de América










