
El estrés del destete en los lechones
La adición de Enterococcus faecium aumenta la respuesta inmune intestinal en cerdos en crecimiento
El destete produce un periodo breve de ayuno y adaptación a una nueva ración sólida, la cual provoca disminución de la supervivencia de los lechones y proliferación de la microbiota patógena. Se ha propuesto la utilización de probióticos, evitando que los seres humanos consuman alimentados tratados con antibióticos. El objetivo de este trabajo fue determinar el efecto de la adición de cepas de probióticos en cerdos en crecimiento sobre las poblaciones celulares del sistema inmune (eosinófilos, basófilos, neutrófilos, monocitos y linfocitos) en intestino delgado. Se sacrificaron 35 lechones escalonadamente los días 1 (21 días de edad), 15 y 30 posdetete, y se extrajo completamente el intestino. Los animales fueron alimentados con dos dietas: dieta comercial con y sin la adición de antibiótico; a esta última se adicionaron los diferentes probióticos (Lactobacillus casei, Lactobacillus acidophilus o Enterococcus faecium) en el agua de bebida. Se utilizó un diseño de bloques al azar en un arreglo de parcelas divididas. Los aislamientos realizados a partir de las muestras intestinales de E. faecium presentaron un mayor número de poblaciones celulares del sistema inmune a nivel intestinal (p<0.01). Además, se realizó medición del pH intestinal, el cual presentó una disminución estadística significativa (p<0.01), donde los animales que consumieron E. faecium presentaron los valores más bajos de pH intestinal, frente a aquellos que consumieron la dieta con adición de antibiótico. La adición de la cepa E. faecium en el alimento de lechones recién destetados, estimula el aumento en el número de poblaciones celulares intestinales del sistema inmune y alcanzan una mayor disminución del pH intestinal.
Palabras clave adicionales Destete. Lechones. Probióticos. Sistema inmune
Addition of Enterococcus faecium increases intestinal immune response in growing pigs
SUMMARY
Weaning originates a brief period of fasting and adaptation to a new solid portion, which causes decreased survival of piglets and proliferation of pathogenic microbiota. It has proposed the use of probiotics, preventing humans consume fed treated with antibiotics. Therefore, the objective of this work was to determine the effect of the addition of probiotic strains in growing pigs on immune cell populations (eosinophils, basophils, neutrophils, monocytes and lymphocytes) in the small intestine. Thirty-five piglets stepwise days 1 (21 days old), 15 and 30 posdetete were sacrificed, and the intestine was completely removed. The animals were fed two diets: commercial diet with and without the addition of antibiotic; the latter different probiotic (Lactobacillus casei, Lactobacillus acidophilus or Enterococcus faecium) were added in the drinking water. A design randomized block was used in a split plot arrangement. Isolates obtained from the intestinal samples of E. faecium showed a greater number of immunological intestine cell populations (p<0,01). In addition, measurement of intestinal pH, which showed a statistically significant decrease (p<0,01), where the animals fed E. faecium reported lower intestinal pH values, compared to those who ate the diet with addition of antibiotic. The addition of E. faecium strain in food weaned piglets, stimulates the increase in the number of intestinal immune cell populations and achieve a further decrease intestinal pH.
Additional keywords Wean. Piglets. Probiotics, Immune system

MATERIAL Y MÉTODOS
Todos los procedimientos experimentales fueron llevados a cabo de acuerdo a las guías propuestas por The International Guiding Principles for Biomedical Research Involving Animals (CIOMS, 1985). Esta investigación fue avalada por El Comité de Ética en la Experimentación Animal de la Universidad Nacional de Colombia, Sede Medellín (CEMED- 012 del 14 de Mayo de 2012).
El trabajo de campo se realizó bajo condiciones comerciales en la Granja Caña Brava, ubicada en el municipio de Gómez Plata (Antioquia, Colombia), vereda La Bonita, localizada a 1540 metros sobre el nivel del mar (m.s.n.m), con una temperatura promedio de 21ºC, perteneciente a la zona de vida de Bosque Húmedo Premontano (bh-PM).
Se sacrificaron 35 lechones (hembras y machos) del cruce duroc x pietran, destetados exactamente a los 21 días de edad, con un peso aproximado de 6 ± 0.5 Kg. Cada una de las instalaciones o corrales estaba provista de comederos de canoa y bebedero automático con agua a voluntad, y contaba con temperatura controlada (26 ± 3°C). La dieta comercial ofrecida fue enriquecida con vitaminas, minerales y lisina HCL. Las dietas se balancearon para cumplir con todos los mínimos nutricionales requeridos y propuestos por el NRC (2012) (tabla I). La cantidad de alimento ofrecido a los lechones por jaula fue administrada de acuerdo a la tabla dietaria que corresponde para la etapa productiva (levante). Así mismo, el agua de bebida que contenía las cepas probióticas se ofreció diariamente desde el día 1 del destete hasta finalizar el experimento, el cual tuvo una duración de 30 días (correspondiente a la fase de levante). Durante la lactancia no se suministró alimento sólido a los lechones.
Las instalaciones fueron desinfectadas y encaladas para la llegada de los lechones. Los cerdos fueron alojados en corrales con suelo de cemento (1.5 x 3 metros) y desde el día 0 al 15 del experimento, los corrales estaban dotados de lechoneras y cama de viruta de madera. Para mantener la temperatura homogénea el corral estaba provisto de cortinas.
Dietas
Los animales fueron aleatorizados a una de dos dietas: dieta comercial con y sin la adición de antibiótico. Los diferentes probióticos (Lactobacillus casei ATCC393, Lactobacillus acidophilus ATCC4356 o Enterococcus faecium ATCC35667) se suministraron en el agua de bebida de los animales que consumieron la dieta comercial sin antibiótico, así:
- Dieta 1 Control (D1): Alimento comercial sin antibiótico, sin adición de cepa probiótica en el agua de bebida.
- Dieta 2 (D2): Alimento comercial con antibiótico, sin adición de cepa probiótica en el agua de bebida.
- Dieta 3 (D3): Alimento comercial sin antibiótico, con adición de la cepa comercial probiótica L. acidophilus en el agua de bebida.
- Dieta 4 (D4): Alimento comercial sin antibiótico, con adición de la cepa comercial probiótica L. casei en el agua de bebida.
- Dieta 5 (D5): Alimento comercial sin antibiótico, con adición de la cepa comercial probiótica E. faecium en el agua de bebida.
Sacrificios
Durante la fase experimental se realizó eutanasia humanitaria a 35 lechones de la siguiente forma: el día inicial, o día 1 (día del destete), se sacrificaron 5 lechones, que representaron: el grupo de referencia para verificar el estado general de salud y la evaluación macroscópica del estado de los órganos de los animales antes de suministrar las dietas experimentales, y las unidades experimentales para cada uno de los tratamientos. Los días 15 y 30 posdestete fueron sacrificados 3 lechones al azar de cada tratamiento. Todos los lechones se sacrificaron 2.5 horas después de su última comida. Los animales se sedaron con un neuroléptico (stresnil® (Azaperona)) vía intramuscular, y posteriormente se sometieron a inhalación con Nitrox®.
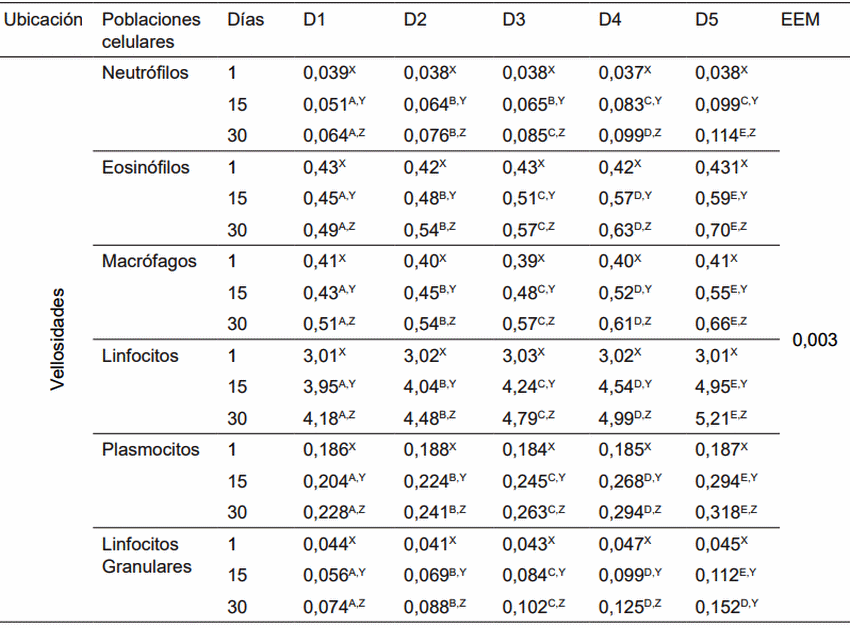
D1: Alimento comercial sin antibiótico y sin probiótico; D2: Alimento comercial + antibiótico; D3: Alimento comercial sin antibiótico + L. acidophilus; D4: Alimento comercial sin antibiótico + L. casei; D5: Alimento comercial sin antibiótico + E. faecium. A,B,C,D,E Dentro de una misma fila, medias con diferente superíndice son estadísticamente diferentes (p< 0,05).X,Y,Z Dentro de una misma columna, medias con un superíndice común (por variable en estudio) no difieren estadísticamente (p< 0,05). EEM: Error estándar de la media.
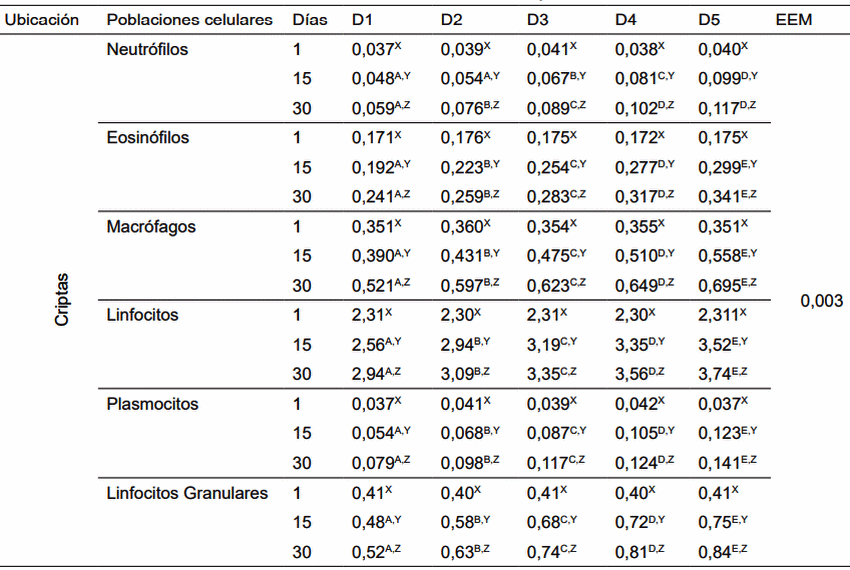
D1: Alimento comercial sin antibiótico y sin probiótico; D2: Alimento comercial + antibiótico; D3: Alimento comercial sin antibiótico + L. acidophilus; D4: Alimento comercial sin antibiótico + L. casei; D5: Alimento comercial sin antibiótico + E. faecium. A,B,C,D,E Dentro de una misma fila, medias con diferente superíndice son estadísticamente diferentes (p< 0,05). X,Y,Z Dentro de una misma columna, medias con un superíndice común (por variable en estudio) no difieren estadísticamente (p< 0,05). EEM: Error estándar de la media.
Toma de muestra y determinación del pH intestinal
Se tomó 1 g de muestra (mezcla) de contenido de duodeno, yeyuno e íleon, para luego suspenderlo en 12,5 ml de agua destilada desionizada. Esta mezcla se agitó manualmente con agitador de vidrio lavándolo en cada registro con agua destilada. Posteriormente se insertó en la mezcla un electrodo de pH y se realizaron las lecturas en un potenciómetro con precisión de tres decimales. El pH de la suspensión fue medido dentro de los 45 minutos subsiguientes al sacrificio de los lechones (Jaramillo, 2011).
Después de 24 horas de la colecta, las muestras obtenidas de duodeno, yeyuno e íleon fueron enviadas al laboratorio para ser analizadas por histopatólogos expertos.
Análisis estadístico
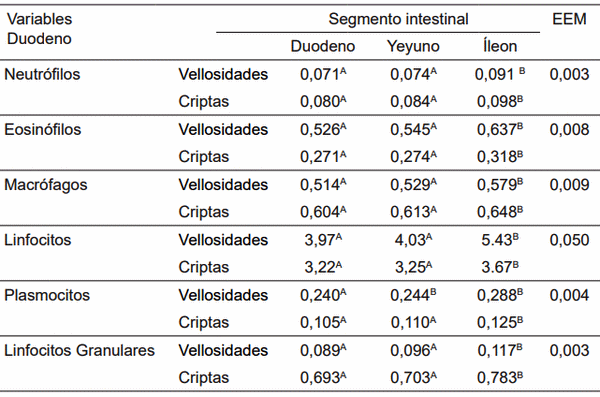
D1: Alimento comercial sin antibiótico y sin probiótico; D2: Alimento comercial + antibiótico; D3: Alimento comercial sin antibiótico + L. acidophilus; D4: Alimento comercial sin antibiótico + L. casei; D5: Alimento comercial sin antibiótico + E. faecium. A,B,C,D,E Dentro de una misma fila, medias con diferente superíndice son estadísticamente diferentes (p< 0,05). X,Y,Z Dentro de una misma columna, segmentos intestinales con un superíndice común no difieren estadísticamente (p> 0,05). EEM: Error estándar de la media.
RESULTADOS
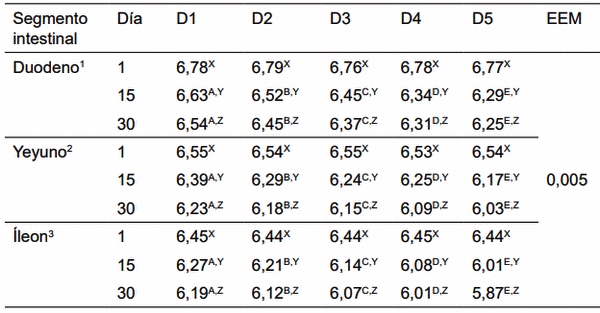
D1: Alimento comercial sin antibiótico y sin probiótico; D2: Alimento comercial + antibiótico; D3: Alimento comercial sin antibiótico + L. acidophilus; D4: Alimento comercial sin antibiótico + L. casei; D5: Alimento comercial sin antibiótico + E. faecium. A,B,C,D,E Dentro de una misma fila, medias con diferente superíndice son estadísticamente diferentes (p< 0,05). X,Y,Z Dentro de una misma columna, medias con un superíndice común (por variable en estudio) no difieren estadísticamente (p< 0.05). 1,2,3 Dentro de una misma columna con un superíndice común (por variable en estudio) no difieren estadísticamente (p< 0,05). EEM: Error estándar de la media.
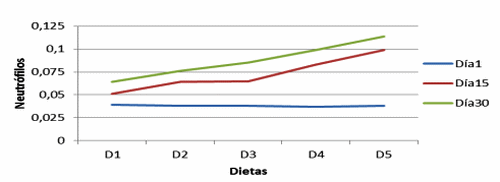
Figura 1. Neutrófilos en vellosidades de cerdos con y sin adición de cepa probiótica (Neutrophils in villi of pigs with and without adittion of probiotic strains).
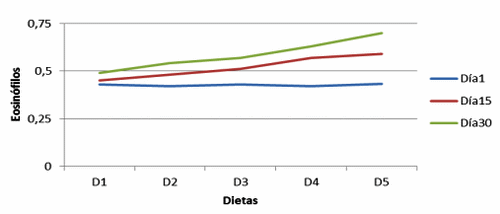
Figura 2. Eosinófilos en vellosidades de cerdos, con y sin adición de cepa probiótica (Eosinophils in villi of pigs with and without addition of probiotic strain).
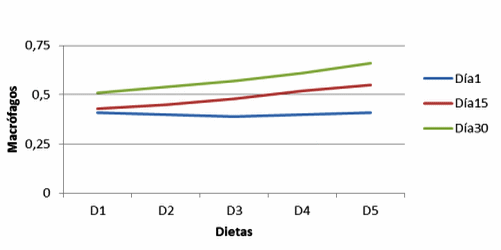
Figura 3. Macrófagos en vellosidades de cerdos, con y sin adición de cepa probiótica (Macrophages in villi of pigs with and without addition of probiotic strain).
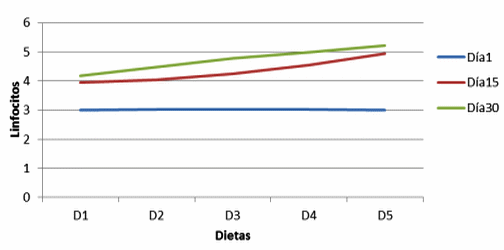
Figura 4. Linfocitos en vellosidades de cerdos, con y sin adición de cepa probiótica (Lymphocytes in villi of pigs with and without addition of probiotic strain).
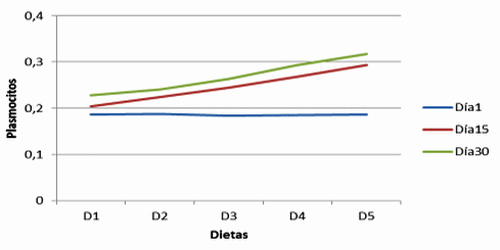
Figura 5. Plasmocitos en vellosidades de cerdos con y sin adición de cepa probiótica (Plasmocytes in villi of pigs with and without adittion of probiotic strains).
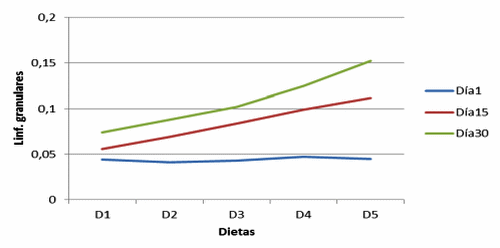
Figura 6. Linf. granulares Vellosidades de cerdos, con y sin adición de cepa probiótica (Granular lymphocytes in villi of pigs with and without addition of probiotic strain).
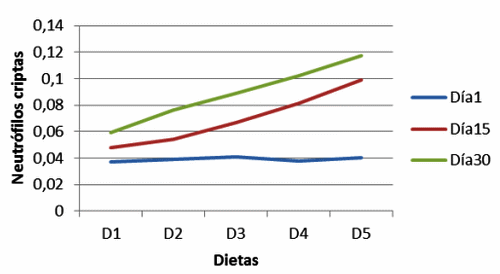
Figura 7. Neutrófilos en criptas de cerdos, con y sin adición de cepas probióticas (Neutrophil in crypts pigs with and without addition of probiotic strains).
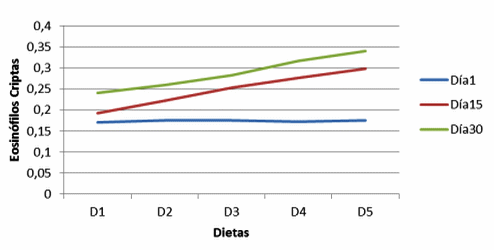
Figura 8. Eosinófilos en criptas de cerdos, con y sin adición de cepas probióticas (Eosinophils in crypts of pigs with and without addition of probiotic strains).
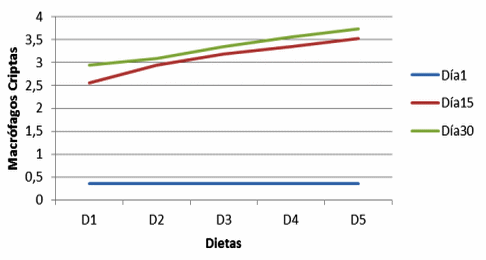
Figura 9. Macrófagos en criptas de cerdos, con y sin adición de cepas probióticas (Macrophages in crypts of pigs with and without addition of probiotic strains).
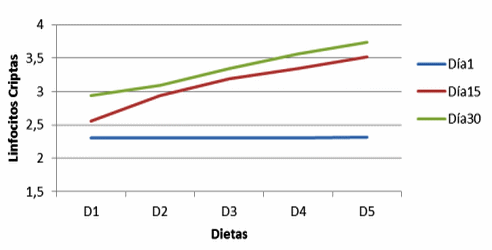
Figura 10. Linfocitos en criptas de cerdos con y sin adición de cepas probióticas (Lymphocytes in crypts of pigs with and without addition of probiotic strains).
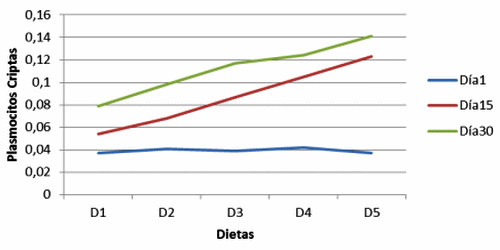
Figura 11. Plasmocitos en criptas de cerdos, con y sin adición de cepas probióticas (Plasmocytes in crypts of pig, with and without addition of probiotic strains).
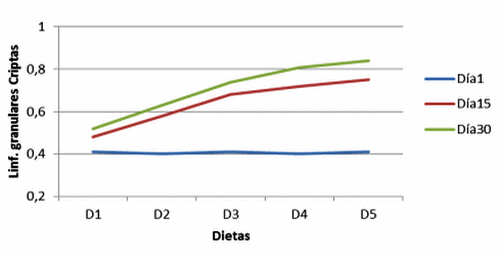
Figura 12. Linf. granulares Criptas de cerdos, con y sin adición de cepas probióticas (Granular Linf. in crypts of pigs with and without addition of probiotic strains).
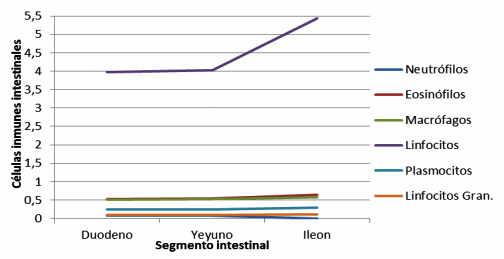
Figura 13. Células inmunes en vellosidades intestinales de cerdos, con y sin adición de cepas probióticas (Immune cells in villi of pigs with and without addition of probiotic strains).
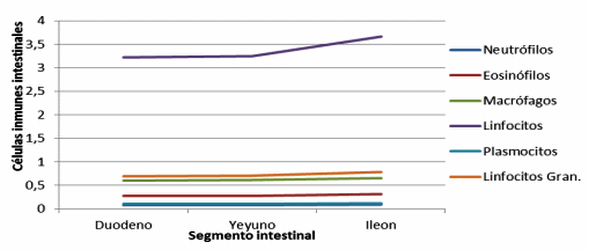
Figura 14. Células inmunes en criptas intestinales de cerdos con y sin adición de cepas probióticas (Immune cells in intestinal crypts pigs with and without addition of probiotic strains).
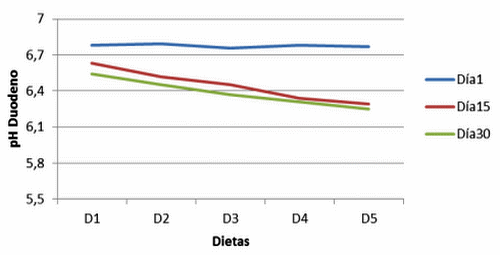
Figura 15. pH en duodeno de cerdos con y sin adición de cepas probióticas (Duodenal pH of pigs with and without addition of probiotic strains).
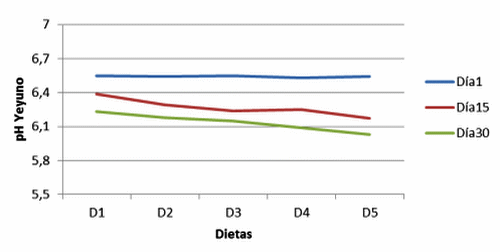
Figura 16. pH en yeyuno de cerdos con y sin adición de cepas probióticas (Jejunum pH of pigs with and without addition of probiotic strains).
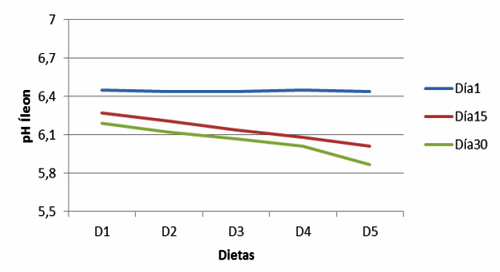
Figura 17. pH en Íleon de cerdos, con y sin adición de cepas probióticas (Ileum pH of pigs, with and without addition of probiotic strains).
CONCLUSIÓN
Abraham, C. and Medzhitov, R. 2011. Interactions between the host innate immune system and microbes in inflammatory bowel disease.
Gastroenterology, 140: 1729-1737.
Allen, H.K.; Levine, U.Y.; Looft, T.; Bandrick, M. and Casey, T.A. 2012.
Treatment, promotion, commotion: antibiotic alternatives in foodproducing animals. Trends Microbiol, 21: 114-119.
Bauer, E.; Williams, B.A.; Smidt, H.; Verstegen, M.W. and Mosenthin,
R. 2006. Influence of the gastrointestinal microbiotia on development of the immune system in young animals. Curr Issues Intest Microbiol,
7: 35-51.
Bermudez-Brito, M.; Plaza-Díaz, J.; Muñoz-Quezada, S.; GómezLlorente, C. and Gil A. 2012. Probiotic mechanisms of action. Ann
Nutr Metab, 61: 160-174.
Boehm, M.; Hoy, B.; Rohde, M.; Tegtmeyer, N.; Bæk, K.T.; Oyarzabal,
O.A.; Brøndsted, L.; Wessler, S. and Backert, S. 2012. Rapid paracellular transmigration of Campylobacter jejuni across polarized epithelial cells without affecting TER: role of proteolytic-active HtrA cleaving
E-cadherin but not fibronectin. Gut Pathog, 4: 3.
CIOMS (Council for International Organizations of Medical Sciences).
1985. International Guiding Principles for Biomedical Research Involving Animals. Geneva. 28 pp.
Deegan, L.H.; Cotter, P.D.; Hill, C. and Ross, P. 2006. Bacteriocins:
Biological tools for biopreservation and shelf-life extension. Int Dairy
J, 16: 1058-1071.
Franz, C.M.; Huch, M.; Abriouel, H.; Holzapfel, W. and Gálvezb, A.
2011. Enterococci as probiotics and their implications in food safety.
Int J Food Microbiol, 151: 125-140.
Galdeano, C.M. and Perdigon, G. 2006. The probiotic bacterium Lactobacillus casei induces activation of the gut mucosal immune system through innate immunity. CVI, 13: 219-226.
Galdeano, C.M.; Dogi, C.A.; Bibas Bonet, M.E.; de Moreno de LeBlanc,
A. and Perdigón, G. 2013. Chapter 18: Probiotic bacteria as mucosal immune system adjuvants. In: R.R. Watson and V.R. Preedy (Eds.).
Bioactive food as dietary interventions for liver and gastrointestinal disease. Elsevier Inc. Argentina.
Ghadimi, D.; d Vrese, M.; Heller, K.J. and Schrezenmeir, J. 2010. Effect of natural commensal-origin DNA on toll-like receptor 9 (TLR9) signaling cascade, chemokine IL-8 expression, and barrier integritiy of polarized intestinal epithelial cells. Inflamm Bowel Dis, 16: 410-427.
Gómez-Llorente, C.; Muñoz, S. and Gil, A. 2010. Role of toll-like receptors in the development of immunotolerance mediated by probiotics.
Proc Nutr Soc, 69: 381-389.
Gutiérrez, V.C.; Román, O.Y; Peláez, J.C.; Ciro, J.; López, H.A. y
Parra, S.J. 2012. Efecto de la adición ex vivo del lipopolisacárido de Escherichia coli sobre la absorción de lisina en cerdos destete.
Rev Fac Nal Agr Medellín, 65: 6447-6457.
Hansen, C.H.F.; Nielsen, D.S.; Kverka, M.; Zakostelska, Z.; Klimesova,
K.; Hudcovic, T.; Tlaskalova-Hogenova, H. and Hansen, A.K. 2012.
Patterns of early gut colonization shape future immune responses of the host. PLoS ONE, 7: e34043.
Heo, J.M.; Opapeju, F.O.; Pluske, J.R.; Kim, J.C.; Hampson, D.J. and
Nyachoti, C.M. 2013. Gastrointestinal health and function in weaned pigs: a review of feeding strategies to control post-weaning diarrhoea without using in-feed antimicrobial compounds. J Anim Physiol Anim
Nutr, 97: 207-237.
Jaramillo, A. 2011. Evaluación de la mezcla de un prebiótico y un
ácido orgánico en la salud intestinal y parámetros productivos de pollos de engorde. Rev Colombiana de Ciencia Animal, 5 (1): 52-66.
Jurado, G.H.; Ramírez, C. y Martínez, J. 2013. Evaluación in vivo de
Lactobacillus plantarum como alternativa al uso de antibióticos en lechones. Rev MVZ Córdoba, 18: 3648-3657.
Martin, L.; Pieper, R; Kröger, S.; Goodarzi Boroojenia, F.; Vahjen,
W.; Neumann, K.; Van Kessel, A.G. and Zentek, J. 2012. Influence of age and Enterococcus faecium NCIMB 10415 on development of small intestinal digestive physiology in piglets. Anim Feed Sci
Tech, 175: 65-75.
Mejía-Medina, J.; Rincón-Ruiz, J.; Gutiérrez-Vergara, C.; Correa, G.;
López-Herrera, A. y Parra-Suescún, J. 2012. Valoración de parámetros clínicos y lesiones en órganos de cerdos durante el período posdestete. Acta Agronómica, 61: 61-68.
Montoya, R.C.; López, H.A. y Parra, S.J. 2012. Alteraciones en la producción mRNA de enzimas intestinales de cerdos durante varios períodos posdestete. Biotecnología en el Sector Agropecuario y
Agroindustrial, 10: 126-134.
Nabuurs, G.J. and Mohren, G.M.J. 1993. Carbon fixation through forestation activities: a study of the carbon sequestering potential of selected forest types, commissioned by the Foundation Face. Institute for Forestry and Nature Research, Wageningen. IBN Research Report
93/4. 205 pp.
NRC. Nutrient Requirements Council. 2012. The nutrient requirements of swine. Eleventh Revised Edition. National Academy of Sciences.
Washington, D.C.
Ospina, D.; Ciro, J; Román, Y.; Peláez, C.; López, A. y Parra, J. 2011.
Cambios en la actividad enzimática en duodeno y yeyuno de cerdos durante varios periodos posdestete. Rev Med Vet Zoot, 58: 156-165.
Pala, V.; Sieri, S.; Berrino, F.; Vineis, P.; Sacerdote, C.; Palli, D.; Masala,
G.; Panico, S.; Mattiello, A.; Tumino, R.; Giurdanella, M.C.; Agnoli,
C.; Grioni, S. and Krogh, V. 2011. Yogurt consumption and risk of colorectal cancer in the Italian European prospective investigation into cancer and nutrition cohort. Int J Cancer, 129: 2712-2719.
Reis, S.T.C.; Guerrero, C.M.J.; Aguilera, B.A. y Mariscal, L.G. 2005.
Efecto de diferentes cereales sobre la morfología intestinal de lechones recién destetados. Téc Pecu Mex, 43: 309-321.
Saad, N.; Delattre, C.; Urdaci, M.; Schmitter, J.M. and Bressollier, P.M.
2013. An overview of the last advances in probiotic and prebiotic field. Food Sci Technol, 50: 1-16
SAS® Institute Inc. Statistical Analysis Systems Institute. 2007. SAS/
STAT User’s Guide, Version 9.1th Ed.: SAS Institute Inc. Cary, NC.
Segalés, J. y Domingo, M. 2003. La necropsia en el ganado porcino, diagnóstico anatomopatológico y toma de muestras.Boehringer
Ingelheim. Madrid (España). pp. 10-14.
Suárez-Belloch, J. and Latorre, M.A. 2014. Nutrición y salud intestinal de los lechones al destete. IVIS SUIS, 105: 14-19.
Suda, Y.; Villena, J.; Takahashi, Y.; Hosoya, S.; Tomosada, Y.; Tsukida,
K.; Shimazu, T.; Aso, H.; Tohno, M.; Ishida, M.; Makino, S.; Ikegami,
S. and Kitazawa, H. 2014. Immunobiotic Lactobacillus jensenii as immune-health promoting factor to improve growth performance and productivity in post-weaning pigs. BMC Immunology, 15: 24.
Villena, J. and Kitazaw, H. 2013. Chapter 5: Role of toll-like receptors in the modulation of intestinal inflammation by immunobiotics. In:
Kitazawa H.; Villena J. and Alvarez A. (Eds.). Probiotics: Immunobiotics and immunogenics. CRC Press. Boca Raton, FL. USA. pp. 89-127.
Villena, J.; Aso, H.; Alvarez, S. and Kitazawa, H. 2012. Chapter 2:
Porcine toll-like receptors and their crosstalk with immunobiotics: impact in the regulation of gut inflammatory immunity.In: Smith, A.;
Jones, C.J. (Eds.). Probiotics: Sources, types and health benefits.
Nova Science Publishers. New York. USA. pp. 53-84.
Walker, W.A.; Sanderson, D.J.; Churcher, C.; Parkes, C.G.; Hudspith,
N.B.; Rayment, N.; Brostoff, J.; Parkhill, J.; Dougan, G. and Petrovska,
L. 2012. High-throughput clone library analysis of the mucosaassociated microbiota reveals dysbiosis and differences between inflamed and noninflamed regions of the intestine in inflammatory bowel disease. BMC Microbiology, 11: 7.
Zacharofa, M.P. and Lovittb, R.W. 2012. Bacteriocins produced by lactic acid bacteria. A review article. APCBEE Procedia, 2: 50 - 56.
Zhu, Q.; Gao, R.; Wu, W. and Qin, H. 2013. The role of gut microbiota in the pathogenesis of colorectal cancer. Tumor Biology, 34:
1285-1300.



