Estudios de casos de Diarrea Endemica Porcina (PED) por coronavirus y su solución con el uso de la ivermectina
Publicado: 26 de enero de 2021
Por: Manuel Albetis Apolaya, Manolo Fernández Sánchez, Julio Cesar Ticona Claros y Omar Sarmiento Montes
Introducción
Desde su primera detección en mayo de 2013. El virus de la diarrea epidémica porcina (PEDv) ha causado un gran impacto en la industria porcina de EE. UU. Se espera que la producción porcina disminuya entre un 6% y un 7% en 2014 debido a una disminución en el número de cerdos que puede oscilar entre el 3% y el 11%. (Furutani, Sekiguchi, Sueyoshi, & Sasaki, 2019). El efecto devastador de PEDv se debe principalmente a la diarrea acuosa aguda inducida en cerdos infectados, lo que puede llevar a una alta mortalidad (50-80%), particularmente en lechones recién nacidos (Sato, Oroku, Ohshima, Furuya, & Sasakawa, 2018). En muchas granjas de cerdas, puede llevar al menos 12 semanas recuperar el nivel de producción de lechones de referencia, Sin embargo, si los lechones sobreviven los primeros siete días después de la infección, aumentan sus posibilidades de supervivencia. El impacto de la infección en los últimos años por PEDv en las etapas posteriores de producción (es decir, cerdos después del destete / crecimiento y finalización) de los cerdos que sobrevivieron al primer contacto con PED, son significativamente elevado, por ser un problema viral de gran impacto en la producción porcina es necesario encontrar una solución que atenué la gran mortalidad en los lechones lactantes y las secuelas que perjudican al porcicultor (Bertasio C, 2016). Dentro de los medicamentos que tiene capacidad antiviral tenemos a la ivermectina.
La ivermectina, un fármaco antiparasitario popular, este puede actuar sobre el SARS-CoV-2 (Coronavirus) evitando que las proteínas virales entren al núcleo de la célula huésped (Caly, Druce, Catton, & Jans, 2020). Un estudio observacional donde los pacientes fueron tratados con una dosis única de ivermectina y dosis múltiples de doxiciclina para el tratamiento del COVID-19 demostró mejoras considerables en los síntomas y la respuesta viral (Alam, Murshed, Bhiuyan, Saber, & Alam, 2020). Un estudio retrospectivo reciente encontró que pacientes hospitalizados cuando recibieron ivermectina con otros tratamientos tuvieron una mortalidad más baja que aquellos que no recibieron ivermectina (Rajter, y otros, 2020). Por todo esto es necesario realizar más estudios con relación a este virus y que como la especie porcina se ve afectado por dos enfermedades la Diarrea Endémica Porcina (PED) y la Gastroenteritis Porcina (GET) producidos por coronavirus y teniendo un brote de PED en una granja porcina se estudió el caso usando la ivermectina por cinco días en los lechones lactantes, recría, gorrinos, marranas lactantes y preñadas, para determinar su efectividad en la disminución de signos clínicos y la respuesta viral.
Diarrea endémica porcina PED
Etiología
Estructura y organización genómica del PEDV
Estructura y organización genómica del PEDV
El PEDV tiene una envoltura es pleomorfo y cuyo diámetro es de 95 a 190 nm de longitud. PEDV tiene un genoma de ARN monocatenario de sentido positivo de aproximadamente 28 kb de tamaño (excluyendo la cola poli A) que codifica cuatro proteínas estructurales: proteína S, envoltura, membrana (M) y nucleocápside (N), dieciséis proteínas no estructurales (nsp 1-nsp16) y una proteína accesoria ORF3 (Kocherhans, Bridgen, Ackermann, & Tobler, 2001). Varias proteínas estructurales y no estructurales inhiben in vitro las respuestas de interferón (IFN) de tipo I y II (Koonpaew, Teeravechyan, Frantz, Chailangkarn, & Jongkaewwattana, 2019). La proteína S es una de las más importantes especialmente para interacciones con el receptor especifico de la célula huésped para permitir la unión y entrada del virus y sobre todo para producir anticuerpos neutralizantes. La proteína S se divide en subunidades S1y S2. La subunidad SA2 C terminal es responsable de la fusión de la membrana (Lin, Saif, Marthaler, & Wang, 2017). La proteína ORF3 es una proteína de canal iónico y es importante para la replicación del virus intro (Wang, y otros, 2012). Figura 1
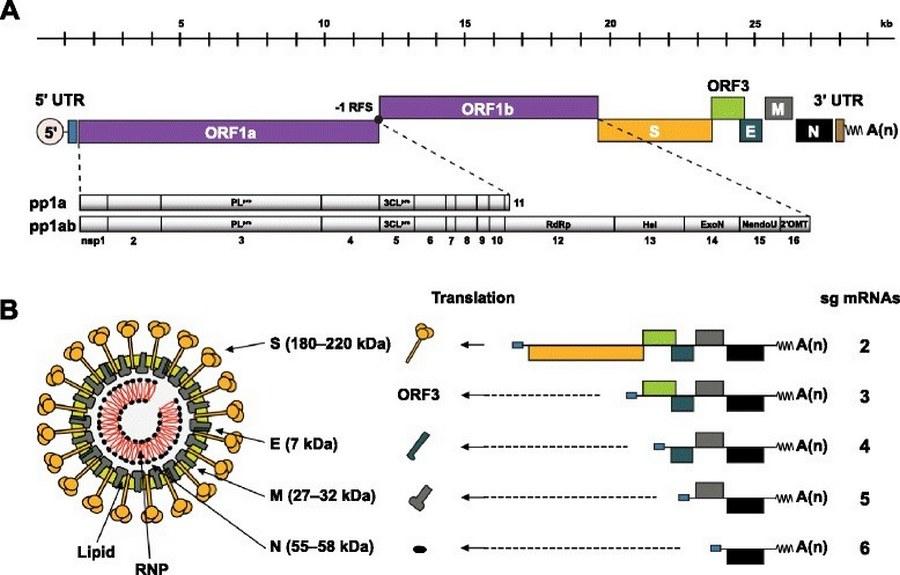
Figura 1. Representación esquemática de la organización del genoma de PEDV y la estructura del virión. Fuente: (Changhee, 2015)
Proteínas estructurales PEDV
Entre las ´proteínas estructurales virales, la proteína S del PEDV es la principal glicoproteína tipo I de la envoltura del virión, que interactúa con el receptor celular durante la entrada del virus y estimula la inducción de anticuerpos neutralizantes en el huésped natural; además , se asocia con la adaptación del crecimiento in vitro y la atenuación in vivo, por lo que se le considera como importante para relacionar la relación genética entre aislados de PEDV y también para desarrollar pruebas de diagnóstico y vacunas efectivas (Lee, Park, Kim, & C, 2010).La proteína M es la más abundante y es necesaria para el ensamblaje aunque también puede producir anticuerpos neutralizantes contra el virus. La proteína E de envoltura pequeña juega papel importante durante la gemación del coronavirus. La proteína N tiene multiples funciones en la replicación viral y patogénesis, estas interactúan con el ARN genómico viral y se asocian con otras moléculas de proteínas N para proteger el genoma viral, esta tiene una característica de perturbar las respuestas antivirales al antogonizar la producción de interferón, como parte de la estrategia de evasión inmune, y activa NF-κB (Xu, y otros, 2013) (McBride, van Zyl, & Fielding, 2014). Figura 2
Entre las ´proteínas estructurales virales, la proteína S del PEDV es la principal glicoproteína tipo I de la envoltura del virión, que interactúa con el receptor celular durante la entrada del virus y estimula la inducción de anticuerpos neutralizantes en el huésped natural; además , se asocia con la adaptación del crecimiento in vitro y la atenuación in vivo, por lo que se le considera como importante para relacionar la relación genética entre aislados de PEDV y también para desarrollar pruebas de diagnóstico y vacunas efectivas (Lee, Park, Kim, & C, 2010).La proteína M es la más abundante y es necesaria para el ensamblaje aunque también puede producir anticuerpos neutralizantes contra el virus. La proteína E de envoltura pequeña juega papel importante durante la gemación del coronavirus. La proteína N tiene multiples funciones en la replicación viral y patogénesis, estas interactúan con el ARN genómico viral y se asocian con otras moléculas de proteínas N para proteger el genoma viral, esta tiene una característica de perturbar las respuestas antivirales al antogonizar la producción de interferón, como parte de la estrategia de evasión inmune, y activa NF-κB (Xu, y otros, 2013) (McBride, van Zyl, & Fielding, 2014). Figura 2
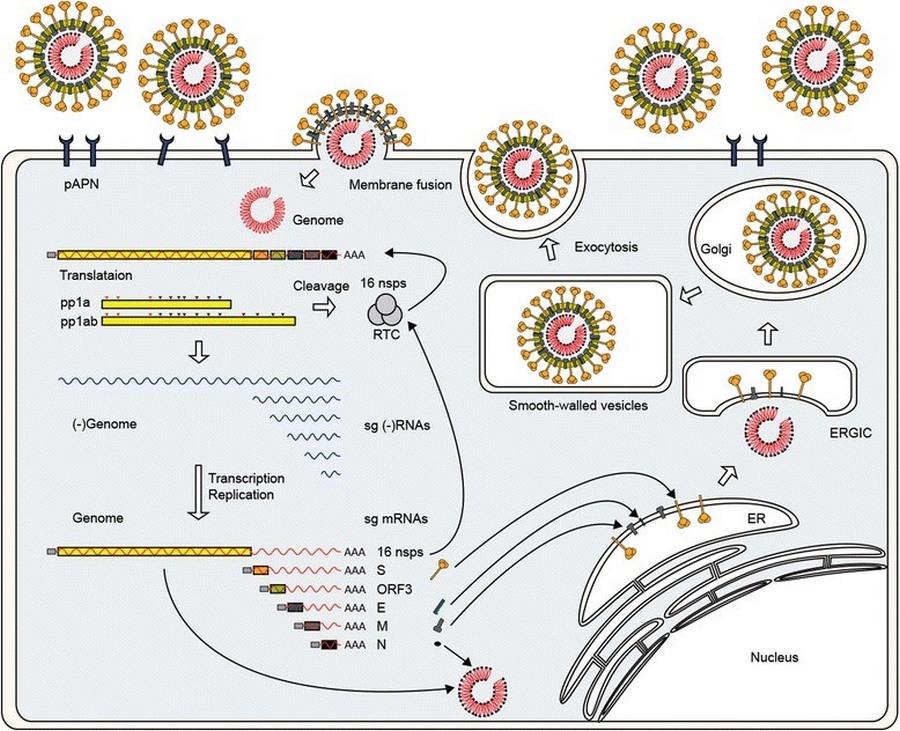
Figura 2. Descripción general del ciclo de replicación de PEDV. PEDV se une a pAPN a través de la proteína de pico. La penetración y la eliminación del recubrimiento se producen después de la fusión mediada por la proteína S de la envoltura viral con la membrane plasmática. Después del desmontaje, el genoma viral se libera en el citoplasma y se traduce inmediatamente para producir réplicas pp1a y pp1ab. (Changhee, 2015)
Transmisión
Transmisión por contacto directo o indirecto
La principal vía de transmisión directa es la Fecal-oral ya sea a través de las heces o el vómito de los cerdos enfermos. La transmisión por contacto indirecto de PEDV también es frecuente dentro y entre granjas, particularmente, con baja seguridad, a través de otros fómites contaminados que incluyen, botas, manos y ropas de trabajo de los y trabajadores, alimento; también aditivos como plasma sanguíneo porcino, envolturas de alimento balanceados, etc. (Kim, Yang, Goyal, Cheeran, & Torremorell, 2017) (Jung & Saif, Porcine epidemic diarrhea virus infection: etiology, epidemiology, pathogenesis and immunoprophylaxis, 2005)
La principal vía de transmisión directa es la Fecal-oral ya sea a través de las heces o el vómito de los cerdos enfermos. La transmisión por contacto indirecto de PEDV también es frecuente dentro y entre granjas, particularmente, con baja seguridad, a través de otros fómites contaminados que incluyen, botas, manos y ropas de trabajo de los y trabajadores, alimento; también aditivos como plasma sanguíneo porcino, envolturas de alimento balanceados, etc. (Kim, Yang, Goyal, Cheeran, & Torremorell, 2017) (Jung & Saif, Porcine epidemic diarrhea virus infection: etiology, epidemiology, pathogenesis and immunoprophylaxis, 2005)
Transmisión de aerosol (contacto indirecto)
Otra vía muy importante de trasmisión del PEDV es la Fecal-nasal, a través del aire de cerdo a cerdo o de granja a granja (hasta 16 km de distancia) a través de partículas de PEDV en aerosol que son infecciosas en los lechones. La transmisión del PEDV ocurre dentro de la sala de parto donde se encuentran los lechones recién nacidos, estos son altamente susceptibles al virus. Los cerdos sanos alojados a distancias de la maternidad donde están los lechones clínicamente enfermos, son con frecuencia positivos para ARN de PEDV. El PEDV cuando es en aerososl no solo afecta el intestino, sino también afecta el epitelio de la cavidad nasal. Se ha informado que las células dendríticas en la lámina propia de la mucosa nasal o el tejido linfoide transportan y transfieren PEDV a las células T CD3 +. Las células T cargadas con PEDV pueden llegar al intestino a través de vénulas endoteliales especializadas desconocidas durante la circulación sanguínea. El virus cargado en las células T tenía la capacidad de infectar las células epiteliales intestinales a través del contacto de célula a célula y transferir la infección.
Otra vía muy importante de trasmisión del PEDV es la Fecal-nasal, a través del aire de cerdo a cerdo o de granja a granja (hasta 16 km de distancia) a través de partículas de PEDV en aerosol que son infecciosas en los lechones. La transmisión del PEDV ocurre dentro de la sala de parto donde se encuentran los lechones recién nacidos, estos son altamente susceptibles al virus. Los cerdos sanos alojados a distancias de la maternidad donde están los lechones clínicamente enfermos, son con frecuencia positivos para ARN de PEDV. El PEDV cuando es en aerososl no solo afecta el intestino, sino también afecta el epitelio de la cavidad nasal. Se ha informado que las células dendríticas en la lámina propia de la mucosa nasal o el tejido linfoide transportan y transfieren PEDV a las células T CD3 +. Las células T cargadas con PEDV pueden llegar al intestino a través de vénulas endoteliales especializadas desconocidas durante la circulación sanguínea. El virus cargado en las células T tenía la capacidad de infectar las células epiteliales intestinales a través del contacto de célula a célula y transferir la infección.
Epidemiología de PEDV
Epidemiología de PEDV en Europa
Esta enfermedad apareció por primera vez en el Reino Unido y se extendió a otros países de Europa allá en los años 70 su significancia económica fue mínima, por lo que no se realizó grandes estudios, en las décadas de 1980m y 1990, los brotes de PEDV se volvieron poco frecuentes, y persistió en forma endémica. En el 2006 reapareció en una forma epidémica típica en cerdos de todas las edades, en el 2014, un caso de PEDV se reportó en Alemania en una granja de engorde, luego en Francia y en Bélgica. Se encontró que estas cepas genéticamente eran casi idénticas (99% de identidad). (Grasland, y otros, 2015) (Theuns, y otros, 2015)
Esta enfermedad apareció por primera vez en el Reino Unido y se extendió a otros países de Europa allá en los años 70 su significancia económica fue mínima, por lo que no se realizó grandes estudios, en las décadas de 1980m y 1990, los brotes de PEDV se volvieron poco frecuentes, y persistió en forma endémica. En el 2006 reapareció en una forma epidémica típica en cerdos de todas las edades, en el 2014, un caso de PEDV se reportó en Alemania en una granja de engorde, luego en Francia y en Bélgica. Se encontró que estas cepas genéticamente eran casi idénticas (99% de identidad). (Grasland, y otros, 2015) (Theuns, y otros, 2015)
Epidemiología de PEDV en Asia
En el continente asiático, las epidemias de PED se empezaron a producir por primera vez en 1982 en Japón y desde esa fecha ha causado epidemias graves, especialmente en China y Corea del Sur y a finales del 200 se volvió más problemático en Filipinas, Taiwán y Vietnam (Lin, y otros, 2014). Esta enfermedad entérica devastadora ha provocado graves pérdidas en China desde su primera presencia (Wentao, y otros, 201218). En la actualidad, los brotes de Diarrea Endémica Porcina (DEP) en China fueron causados tanto por variantes G1b como por cepas G2 epidémicas de campo que diferían genéticamente de la cepa prototipo CV77 que lo utilizaron para producir una vacuna (Xiao-meng, y otros, 2013), con el tiempo se determinó que una cepa G2b, AH2012, era un progenitor potencial de las cepas de PEDV estadounidenses que surgieron posteriormente durante 2013 (Huang, y otros, 2013)
En el continente asiático, las epidemias de PED se empezaron a producir por primera vez en 1982 en Japón y desde esa fecha ha causado epidemias graves, especialmente en China y Corea del Sur y a finales del 200 se volvió más problemático en Filipinas, Taiwán y Vietnam (Lin, y otros, 2014). Esta enfermedad entérica devastadora ha provocado graves pérdidas en China desde su primera presencia (Wentao, y otros, 201218). En la actualidad, los brotes de Diarrea Endémica Porcina (DEP) en China fueron causados tanto por variantes G1b como por cepas G2 epidémicas de campo que diferían genéticamente de la cepa prototipo CV77 que lo utilizaron para producir una vacuna (Xiao-meng, y otros, 2013), con el tiempo se determinó que una cepa G2b, AH2012, era un progenitor potencial de las cepas de PEDV estadounidenses que surgieron posteriormente durante 2013 (Huang, y otros, 2013)
Epidemiología de PEDV en los Estados Unidos
El PEDV ha sido una enfermedad exótica en los Estados Unidos hasta mayo del 2013, desde ahí se ha propagado en la mayoría de granjas de cerdos y causo grandes pérdidas económicas (Gregory, y otros, 2013), pero lo más importantes es que esta cepa tiene una relación estrecha con las cepas chinas, lo que sugiere su origen, especialmente de 2 cepas: AH2012 y CH/ZMDZY/11 en el sublinaje G2b mediante recombinación (Lee & Lee, 2014). En el 2014, se informaron otras cepas nuevas de PEDV de EE.UU, las nuevas variantes en este país tenían una baja identidad de nucleótidos en los primeros de la región S1 y una alta similitud en el gen S restante, en comparación con las cepas PEDV que circulan principalmente en los Estados Unidos, lo que sugiere una rápida evolución de las variantes de PEDV de EE.UU a través de posibles eventos de recombinación (Leyi, Beverly, & Yan, 2014).
El PEDV ha sido una enfermedad exótica en los Estados Unidos hasta mayo del 2013, desde ahí se ha propagado en la mayoría de granjas de cerdos y causo grandes pérdidas económicas (Gregory, y otros, 2013), pero lo más importantes es que esta cepa tiene una relación estrecha con las cepas chinas, lo que sugiere su origen, especialmente de 2 cepas: AH2012 y CH/ZMDZY/11 en el sublinaje G2b mediante recombinación (Lee & Lee, 2014). En el 2014, se informaron otras cepas nuevas de PEDV de EE.UU, las nuevas variantes en este país tenían una baja identidad de nucleótidos en los primeros de la región S1 y una alta similitud en el gen S restante, en comparación con las cepas PEDV que circulan principalmente en los Estados Unidos, lo que sugiere una rápida evolución de las variantes de PEDV de EE.UU a través de posibles eventos de recombinación (Leyi, Beverly, & Yan, 2014).
Epidemiología de PEDV en América Latina
El virus de la diarrea epidémica porcina (PEDV) fue identificado en México en 2013, esta enfermedad se caracteriza por diarrea severa y vómito que afecta a cerdos de todas las edades causando una mortalidad arriba del 90% en lechones lactantes. El aislamiento del virus se reportó por primera vez en 1988, en diferentes cultivos primarios y líneas celulares, lográndolo solo en la línea celular Vero, en presencia de Tripsina (Hofmann & Wyler, 1988).
El virus de la diarrea epidémica porcina (PEDV) fue identificado en México en 2013, esta enfermedad se caracteriza por diarrea severa y vómito que afecta a cerdos de todas las edades causando una mortalidad arriba del 90% en lechones lactantes. El aislamiento del virus se reportó por primera vez en 1988, en diferentes cultivos primarios y líneas celulares, lográndolo solo en la línea celular Vero, en presencia de Tripsina (Hofmann & Wyler, 1988).
Viremia, incubación y periodo de infección
Se estima que el período de incubación es de entre 1 y 4 días. El período infeccioso puede durar entre 6 y 35 días después de la primera aparición de los signos clínicos. Se ha detectado viremia en múltiples días en cerdos de 2 a 4 semanas de edad infectados experimentalmente con el virus PED.
Se estima que el período de incubación es de entre 1 y 4 días. El período infeccioso puede durar entre 6 y 35 días después de la primera aparición de los signos clínicos. Se ha detectado viremia en múltiples días en cerdos de 2 a 4 semanas de edad infectados experimentalmente con el virus PED.
Fuente del virus
La principal de este virus entérico son las heces.
La principal de este virus entérico son las heces.
Patogénesis
La ingestión oral da como resultado la replicación viral en las células epiteliales de las vellosidades del intestino delgado y del colon, lo que da como resultado la degeneración de los enterocitos y el acortamiento de las vellosidades. Esto causa manifestaciones clínicas de la enfermedad que incluyen diarrea acuosa (Jung & Saif, Infección por virus de la diarrea epidémica porcina: etiología, epidemiología, patogenia e inmunoprofilaxis, 2015).
La ingestión oral da como resultado la replicación viral en las células epiteliales de las vellosidades del intestino delgado y del colon, lo que da como resultado la degeneración de los enterocitos y el acortamiento de las vellosidades. Esto causa manifestaciones clínicas de la enfermedad que incluyen diarrea acuosa (Jung & Saif, Infección por virus de la diarrea epidémica porcina: etiología, epidemiología, patogenia e inmunoprofilaxis, 2015).
Diagnóstico clínico
La presentación clínica Diagnóstico clínico
La presentación clínica de la infección por el virus PED en los cerdos puede variar en su gravedad y no es distinguible de otras causas de diarrea. Los signos clínicos dependen de la edad de los cerdos. exposición previa y estado inmunológico de los cerdos, presencia de infección secundaria, etc.
Se pueden encontrar los siguientes signos en la infección por el virus PED:
• Morbilidad: hasta 100%,
• Mortalidad variable según la edad:
• Mortalidad variable según la edad:
o Lechones lactantes: hasta 100%. Figura 3
o Lechones mayores de 10 días: menos del 10%
o Porcinos adultos y de engorde: menos del 5%
o Lechones mayores de 10 días: menos del 10%
o Porcinos adultos y de engorde: menos del 5%
Figura 3 Signos clínicos y los cambios post morten en lechones que murieron por PEDv durante la primera semana.Fuente: semantics.org.
• Diarrea y vómitos Figura 4
• Deshidratación y acidosis metabólica (Gao, Zhao, Qin, Yin, & Yu, 2016).
• Deshidratación y acidosis metabólica (Gao, Zhao, Qin, Yin, & Yu, 2016).
Se puede convertirse en un problema más importante durante las coinfecciones con otros patógenos como el síndrome respiratorio y reproductivo porcino PRRSV (Jung K. R., 2009)

Figura 4. Diarrea profusa por PED. Photo credit: Andrea Ladinig, University Clinic for Swine, Vienna
Lesiones
Los hallazgos post-mortem en cerdos gravemente afectados son similares a los de gastroenteritis transmisible (TGE) y puede incluir: Figura 5
• Adelgazamiento de los intestinos, principalmente limitado al intestino delgado,
• Presencia de leche no digerida en el estómago,
• Contenido intestinal acuoso.
• Presencia de leche no digerida en el estómago,
• Contenido intestinal acuoso.
Figura 5. Post morten: siatema digestivo. Photo credit: Andrea Ladinig, University Clinic for Swine, Vienna
Diagnóstico diferencial
La DEP es clínicamente indistinguible de otras enfermedades gastroentéricas porcinas como las causadas por TGE o rotavirus, por bacterias (Clostridium spp., E. coli, Salmonella spp., Brachyspira spp., Lawsonia intracellularis, etc.) o por parásitos (Isospora suis, Cryptosporidium spp, nematodos, etc.). (Kim, Song, & Park, 2001)
Por tanto, las pruebas de laboratorio de confirmación son necesarias para hacer un diagnóstico final y definitivo.
Diagnóstico de laboratorio
Muestras
- Heces frescas,
- Fluidos orales,
- Intestino delgado,
- Puede utilizarse suero para determinar la presencia de anticuerpos. (Lee C. , 2016)
Procedimientos
Identificación del agente
Identificación del agente
- Reacción en cadena de la polimerasa con transcriptasa inversa (RT-PCR),
- Ensayos inmunoabsorbentes ligados a enzimas de antígenos (ELISA),
- Inmunohistoquímica (IHC),
- Aislamiento de virus (difícil de aislar el virus). (Lee C. , 2016)
Pruebas serológicas
- ELISA,
- Inmunofluorescencia,
- IHC,
- Neutralización del suero. (Lee C. , 2016)
Prevención y control
No existe un tratamiento específico que no sea el tratamiento sintomático de la diarrea y el control de Infecciones secundarias. La mayoría de los cerdos en crecimiento se recuperan sin tratamiento en 7-10 días a menos que ocurren infecciones secundarias. La reinfección puede ocurrir cuando la inmunidad disminuye.
No existe un tratamiento específico que no sea el tratamiento sintomático de la diarrea y el control de Infecciones secundarias. La mayoría de los cerdos en crecimiento se recuperan sin tratamiento en 7-10 días a menos que ocurren infecciones secundarias. La reinfección puede ocurrir cuando la inmunidad disminuye.
Los anticuerpos maternos a través del calostro de cerdas inmunes pueden proteger a los recién nacidos contra infecciones (Langel, Paim, Lager, Vlasova, & Saif, 2016).
Las vacunas PED están disponibles y se aplican en varios países (Gerdts & Zakhartchouk, 2017).
La bioseguridad estricta es la medida más eficaz para prevenir la introducción y propagación del virus, especialmente, introducción de cerdos de estado sanitario conocido, control del movimiento de cerdos en la explotación, material y personas, desinfección de vehículos, equipos y disposición adecuada de cerdos muertos y purines. La implementación y mantenimiento de programas de alta bioseguridad ha sido eficiente para controlar la DEP en países endémicos. Se ha demostrado que la práctica de "todo dentro-todo-fuera" es eficaz para romper el ciclo de transmisión dentro de una finca. (Furutani, Sekiguchi, Sueyoshi, & Sasaki, 2019)
Ivermectina
Ivermectina agente antiparasitario
La ivermectina (IVM) es uno de los fármacos más importantes de la medicina veterinaria y humana para el control (Yin J, 2015) de las infecciones parasitarias y fue el foco conjunto del Premio Nobel de Fisiología o Medicina 2015, unos 35 años después de su notable descubrimiento. Aunque se describe mejor por su actividad sobre los canales de cloruro activados por glutamato en nematodos parásitos, la comprensión de su modo de acción sigue siendo incompleta (Laing, Gillan, & Devaney, 2017).
Desde un descubrimiento fortuito en un campo de golf hasta un premio nobel, el impacto de la IVM en la salud humana hasta la fecha ha sido extraordinario. Curiosamente, la IVM tiene una amplia gama de efectos en muchos organismos diferentes, mucho más allá de los endoparásitos y ectoparásitos para los que se desarrolló, Por ejemplo, se ha demostrado que la IVM regula los niveles de glucosa y colesterol en ratones diabeticos (Jin, y otros, 2015). Para suprimir la proliferación de células malignas en varios canceres, para inhibir la replicación en varios flavivirus y para reducir la supervivencia en los principales insectos vectores de la malaria y tripanosomiasis (Mastrangelo, y otros, 2012) (Pooda, Mouline, De Meeûs, Bengaly, & Solano, 2013).
Composición Química
La IVM es un derivado químicamente modificado de avermectina B 1 producida naturalmente , compuesto de 80% 22,23-dihidro-avermectina B 1a y ∼20% 22,23-dihidro-avermectina B 1b (Campbell, Fisher, Albers-Schönberg, & Jacob, 983) (Figura 6 ), con potente actividad contra un amplio espectro de nematodos parásitos después de la administración tanto oral como parenteral. La IVM no es activa trematodos o tenías, pero tiene actividad contra varios artrópodos, incluidos piojos, ácaros y algunas garrapatas. La MIV tiene un amplio margen de seguridad en la mayoría de los mamíferos, aunque algunos perros son susceptibles a efectos neurológicos (Mealey, Bentjen, Gay, & Cantor, 2001).
La IVM es un derivado químicamente modificado de avermectina B 1 producida naturalmente , compuesto de 80% 22,23-dihidro-avermectina B 1a y ∼20% 22,23-dihidro-avermectina B 1b (Campbell, Fisher, Albers-Schönberg, & Jacob, 983) (Figura 6 ), con potente actividad contra un amplio espectro de nematodos parásitos después de la administración tanto oral como parenteral. La IVM no es activa trematodos o tenías, pero tiene actividad contra varios artrópodos, incluidos piojos, ácaros y algunas garrapatas. La MIV tiene un amplio margen de seguridad en la mayoría de los mamíferos, aunque algunos perros son susceptibles a efectos neurológicos (Mealey, Bentjen, Gay, & Cantor, 2001).
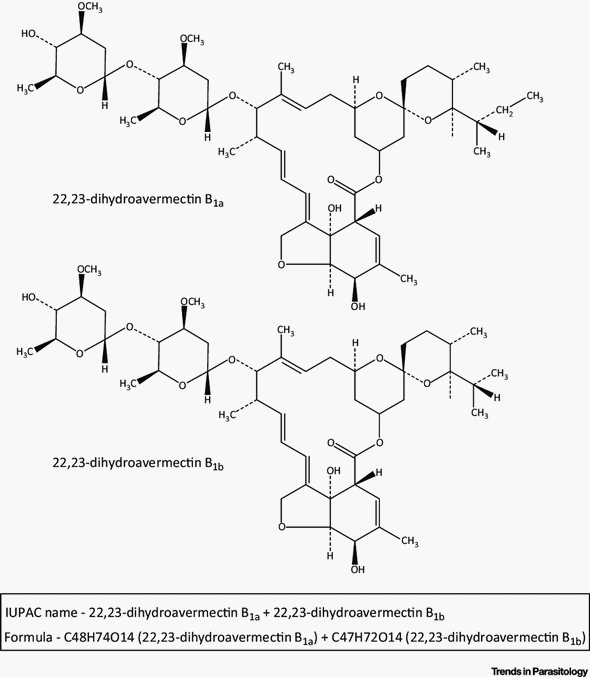
Figura 6. Estructura química de la ivermectina. La ivermectina consiste en una mezcla de dos homólogos: 5-O-dimetil-22,23-dihidroavermectina B 1a y B 1b en una proporción de 80:20.
Farmacocinética
La farmacocinética de la Ivermectina está afectada por la formulación específica usada, la ruta de administración y la especie animal a la cual es administrada. La Ivermectina presenta características lipófilas. Se considera que permanece “secuestrada” o depositada temporalmente en el tejido adiposo del cual es liberada lentamente, hecho que explica que los niveles terapéuticos se mantengan durante mínimo dos semanas y que estos sean suficientes para evitar el desarrollo de los estadios larvarios (González Canga, y otros, 2009).
La farmacocinética de la Ivermectina está afectada por la formulación específica usada, la ruta de administración y la especie animal a la cual es administrada. La Ivermectina presenta características lipófilas. Se considera que permanece “secuestrada” o depositada temporalmente en el tejido adiposo del cual es liberada lentamente, hecho que explica que los niveles terapéuticos se mantengan durante mínimo dos semanas y que estos sean suficientes para evitar el desarrollo de los estadios larvarios (González Canga, y otros, 2009).
En comparación con la aplicación oral y tópica de las formulaciones de ivermectina, se ha observado que la vía subcutánea es la vía de administración más eficaz en términos de biodisponibilidad. Después de la administración subcutánea de ivermectina, también se encontró que la tasa de absorción desde el sitio de depósito y la tasa de distribución y eliminación del fármaco eran bajas. La administración oral de ivermectina tiene una biodisponibilidad relativamente menor debido a la unión del fármaco con contenidos orgánicos en el intestino. En un estudio realizado en ganado bovino, se encontró que un gran porcentaje de la ivermectina administrada por vía oral se excreta en las heces (Alvinerie, Sutra, & Galtier, 1993) (Eraslan G, 2010). La nanotecnología avanzada también ha contribuido al desarrollo de formulaciones como las nanocápsulas lipídicas y las nanopartículas lipídicas sólidas que resultaron ser eficaces para modificar la farmacocinética de la ivermectina (Gamboa, y otros, 2016).
Farmacodinámica
Modo antiparasitario documentado de ivermectina de acción es a través de la potenciación de la neurotransmisión mediada por GABA, y mediante la unión a invertebrados glutamato Cl - canales a la parálisis efecto parásito y la muerte. La selectividad proviene del hecho de que la ivermectina no penetra fácilmente en el sistema nervioso central (SNC) de los mamíferos, donde el GABA funciona como un neurotransmisor (Loukas & Hotez, 2006).
Modo antiparasitario documentado de ivermectina de acción es a través de la potenciación de la neurotransmisión mediada por GABA, y mediante la unión a invertebrados glutamato Cl - canales a la parálisis efecto parásito y la muerte. La selectividad proviene del hecho de que la ivermectina no penetra fácilmente en el sistema nervioso central (SNC) de los mamíferos, donde el GABA funciona como un neurotransmisor (Loukas & Hotez, 2006).
Usos e Indicaciones
Desde el desarrollo de la ivermectina, se ha utilizado para tratar diversas enfermedades causadas por ectoparásitos y endoparásitos en humanos y otros animales. Sin embargo, la ivermectina muestra una eficacia limitada contra trematodos o cestodos. Tiene una alta eficacia en el control de ectoparásitos, como pulgas, moscas, garrapatas y ácaros que afectan significativamente el aumento de peso y la producción de leche en los animales (Shoop, y otros, 1995) (Camargo, Sapin, Daloz, & Maincent, 2010).
Desde el desarrollo de la ivermectina, se ha utilizado para tratar diversas enfermedades causadas por ectoparásitos y endoparásitos en humanos y otros animales. Sin embargo, la ivermectina muestra una eficacia limitada contra trematodos o cestodos. Tiene una alta eficacia en el control de ectoparásitos, como pulgas, moscas, garrapatas y ácaros que afectan significativamente el aumento de peso y la producción de leche en los animales (Shoop, y otros, 1995) (Camargo, Sapin, Daloz, & Maincent, 2010).
Efectos Adversos
Los datos de estos ensayos muestran que, en las condiciones australianas, la ivermectina aplicada a lo largo de la línea media de la espalda desde la cruz hasta la región sacra a una tasa de dosis de 500 mcg / kg de peso corporal controló eficazmente las infecciones por nematodos gastrointestinales y no produjo efectos adversos inaceptables (Eagleson & Allerton, 1992).
Los datos de estos ensayos muestran que, en las condiciones australianas, la ivermectina aplicada a lo largo de la línea media de la espalda desde la cruz hasta la región sacra a una tasa de dosis de 500 mcg / kg de peso corporal controló eficazmente las infecciones por nematodos gastrointestinales y no produjo efectos adversos inaceptables (Eagleson & Allerton, 1992).
Dosificación
En cerdos generalmente se administra en el alimento en dosis de 0.3mg/kg, pero pueden ser menores si se establece un programa profiláctico. La premezcla es útil en el tratamiento de infecciones gastrointestinales, renales y pulmonares por nematodos, con una dosis de 0.1-0,2 mg/kg/días y las formas inyectables, con una sola dosis de 0.3mg/kg por vía subcutánea (Sumano & Ocampo, 2006).
En cerdos generalmente se administra en el alimento en dosis de 0.3mg/kg, pero pueden ser menores si se establece un programa profiláctico. La premezcla es útil en el tratamiento de infecciones gastrointestinales, renales y pulmonares por nematodos, con una dosis de 0.1-0,2 mg/kg/días y las formas inyectables, con una sola dosis de 0.3mg/kg por vía subcutánea (Sumano & Ocampo, 2006).
Toxicidad
En el cerdo, una dosis subcutánea de 30 mg/kg daba lugar, en 24 horas, a ataxia y letargia, midriasis, postración y anorexia, mientras que con 15 mg/kg no se produjeron signos de toxicidad (Pulliam & Preston, 1989)
En el cerdo, una dosis subcutánea de 30 mg/kg daba lugar, en 24 horas, a ataxia y letargia, midriasis, postración y anorexia, mientras que con 15 mg/kg no se produjeron signos de toxicidad (Pulliam & Preston, 1989)
Ivermectina como agente de selección de IMPα con actividad antiviral
El transporte a través del complejo poro nuclear es importante para que los tejidos y células cumplan sus funciones adecuadamente, esta función juega un papel en la infección viral, donde una estrategia común utilizada por los virus es antagonizar la respuesta antiviral celular. Los mediadores dependientes de la señal de direccionamiento de este transporte son los miembros de la superfamilia de proteínas IMP, de las cuales existen múltiples formas α y β. La vía mediada por el heterodímero IMPα / β1 es la ruta mejor caracterizada por la cual las proteínas del huésped, incluidos los miembros de los transductores de señal y activadores de la transcripción (STAT) y el factor nuclear kappa-cadena ligera-potenciador de células B activadas (NF-κB ) familias de factores de transcripción, ingresan al núcleo a través de poros nucleares incrustados en la envoltura nuclear (Caly, Druce, Catton, & Jans, 2020) (Fulcher & Jans, 2011). (Figura 1).
Figura 7. IMPα en el transporte de proteínas virales y del huésped y el mecanismo de inhibición por ivermectina. Fuente: (Jans & Wagstaff, 2020)
La figura muestra el papel de IMPα en el transporte nuclear de proteínas virales y del huésped, y el mecanismo de inhibición por ivermectina. Las proteínas del huésped, como los miembros de las familias de factores de transcripción STAT o NF-κB, se localizan en el núcleo mediante la acción del heterodímero IMPα / β1, donde se encuentra la región "IBB" (unión a IMPβ) de IMPα (línea curva verde) está unido por IMPβ1 para permitir el reconocimiento de carga por IMPα dentro del heterodímero; IMPβ1 posteriormente media el transporte del complejo trimérico a través del poro nuclear (NPC, complejo de poro nuclear) incrustado dentro de la envoltura nuclear (NE) en el núcleo. A esto le sigue la liberación dentro del núcleo para permitir que los factores de transcripción lleven a cabo una función normal en la regulación transcripcional, incluida la respuesta antiviral. IMPα solo puede mediar la importación nuclear dentro del heterodímero con IMPβ1. (b) En la infección viral, proteínas virales específicas capaces de interactuar con IMPα utilizan el heterodímero IMPα / β1 para acceder al núcleo y antagonizar la respuesta antiviral. Esto es fundamental para permitir la producción óptima de virus, como lo demuestran los estudios mutagénicos e inhibidores. (>c ) El compuesto dirigido a IMPα ivermectina se une a IMPα (sitio de unión que se muestra como una pastilla roja) tanto dentro del heterodímero IMPα / β para disociarlo, como al IMPα libre para evitar que se una a IMPβ1, bloqueando así la importación nuclear (Yang, y otros, 2019).
Ivermectina antiviral en veterinaria
Los efectos antivirales de la ivermectina sobre los virus de ARN
Los efectos antivirales de la ivermectina sobre los virus de ARN
Virus de Newcastle
Estudios in vitro e in vivo, estudiaron la citotoxicidad de la ivermectina y su posible efecto antiviral sobre el virus Newcastle, un virus de ARN monocatenario de sentido negativo de la familia paramyxoviridae, en la línea celular de fibroblastos primarios de pollo y en embriones de pollo de 9 días, respectivamente. En este estudio, la ivermectina se probó a concentraciones de 6.25, 12.5, 25, 50, 100 y 200 μg ml -1, y los resultados revelaron que el fármaco a 100 μg ml -1 o más tenía efectos citotóxicos. Sin embargo, era seguro en concentraciones de 50 μg ml -1 o menos, no se observó citotoxicidad del fármaco y se observó una actividad antiviral de moderada a baja (Azeem S, 2015) [
Estudios in vitro e in vivo, estudiaron la citotoxicidad de la ivermectina y su posible efecto antiviral sobre el virus Newcastle, un virus de ARN monocatenario de sentido negativo de la familia paramyxoviridae, en la línea celular de fibroblastos primarios de pollo y en embriones de pollo de 9 días, respectivamente. En este estudio, la ivermectina se probó a concentraciones de 6.25, 12.5, 25, 50, 100 y 200 μg ml -1, y los resultados revelaron que el fármaco a 100 μg ml -1 o más tenía efectos citotóxicos. Sin embargo, era seguro en concentraciones de 50 μg ml -1 o menos, no se observó citotoxicidad del fármaco y se observó una actividad antiviral de moderada a baja (Azeem S, 2015) [
Virus de la encefalitis equina venezolana (VEEV)
El fármaco redujo la cápside nuclear asociada, el título del virus y los efectos citopáticos (CPE) causados por el virus. Aunque se observó una reducción limitada en la replicación del virus, esta no fue significativa (Lundberg, y otros, 2013)
El fármaco redujo la cápside nuclear asociada, el título del virus y los efectos citopáticos (CPE) causados por el virus. Aunque se observó una reducción limitada en la replicación del virus, esta no fue significativa (Lundberg, y otros, 2013)
Virus de la influenza aviar
En un estudio in vitro con células de carcinoma hepatocelular de pollo infectadas con el virus de la influenza aviar A, que es un virus de ARN segmentado, monocatenario y de sentido negativo de la familia Orthomyxoviridae, el tratamiento con ivermectina 10 µM previno por completo la transmisión nuclear de diferentes tipos de complejos de ribonucleoproteínas virales (Götz, y otros, 2016).
En un estudio in vitro con células de carcinoma hepatocelular de pollo infectadas con el virus de la influenza aviar A, que es un virus de ARN segmentado, monocatenario y de sentido negativo de la familia Orthomyxoviridae, el tratamiento con ivermectina 10 µM previno por completo la transmisión nuclear de diferentes tipos de complejos de ribonucleoproteínas virales (Götz, y otros, 2016).
Virus del síndrome reproductivo y respiratorio porcina (PRRS)
Los investigadores reconocieron que la ivermectina puede afectar la síntesis óptima de ARN viral al ejercer su efecto sobre la proteína no estructural 10 helicasa, que tiene actividad helicasa dependiente de ATP en el virus PRRSV, pero se necesitan más estudios para probar esta hipótesis (Lee & Lee, 2016).
Los investigadores reconocieron que la ivermectina puede afectar la síntesis óptima de ARN viral al ejercer su efecto sobre la proteína no estructural 10 helicasa, que tiene actividad helicasa dependiente de ATP en el virus PRRSV, pero se necesitan más estudios para probar esta hipótesis (Lee & Lee, 2016).
Los efectos antivirales de la ivermectina en los virus ADN
Herpesvirus equino tipo 1 (EHV-1)
Debido a que la ivermectina inhibe solamente la proliferación de la cepa Jan-E, se necesitan más estudios para investigar el efecto antiviral de la ivermectina de este virus. El hallazgo del estudio sugiere el papel del IMP α / β además de otros receptores implicados en la importación nuclear en el EHV-1 (Slonska, Cymerys, Skwarska, Golke, & MW, 2013).
Debido a que la ivermectina inhibe solamente la proliferación de la cepa Jan-E, se necesitan más estudios para investigar el efecto antiviral de la ivermectina de este virus. El hallazgo del estudio sugiere el papel del IMP α / β además de otros receptores implicados en la importación nuclear en el EHV-1 (Slonska, Cymerys, Skwarska, Golke, & MW, 2013).
Virus de la Pseudorrabia (PRV)
De muchos trabajos los investigadores concluyeron que la ivermectina podría usarse como fármaco antivírico potencial contra PRV. Además de la disminución de los títulos de virus en los órganos de los animales, sus puntuaciones clínicas y mortalidad disminuyeron a medida que aumentaba la concentración del fármaco (Lv, y otros, 2018).
De muchos trabajos los investigadores concluyeron que la ivermectina podría usarse como fármaco antivírico potencial contra PRV. Además de la disminución de los títulos de virus en los órganos de los animales, sus puntuaciones clínicas y mortalidad disminuyeron a medida que aumentaba la concentración del fármaco (Lv, y otros, 2018).
Circovirus porcino 2 (PCV2)
Cuando se trató lechones infectados con ivermectina mostraron una disminución significativa en la viremia y la carga viral en los tejidos. En el estudio de los ganglios linfáticos inguinales en los lechones infectados tratados con ivermectina, las lesiones observadas fueron leves y hubo una clara diferencia en el número de linfocitos en los ganglios linfáticos y la intensidad de infiltración de los histiocitos (Wang X, 2019).
Cuando se trató lechones infectados con ivermectina mostraron una disminución significativa en la viremia y la carga viral en los tejidos. En el estudio de los ganglios linfáticos inguinales en los lechones infectados tratados con ivermectina, las lesiones observadas fueron leves y hubo una clara diferencia en el número de linfocitos en los ganglios linfáticos y la intensidad de infiltración de los histiocitos (Wang X, 2019).
Virus del herpesvirus bovino 1 (BoHV-1)
En un estudio sobre células renales bovinas Madin-Darby infectadas con BoHV-1, un virus de ADN grande, envuelto y de doble hebra de la familia Herpesviridae, la ivermectina disminuyó la transmisión nuclear UL42 al inhibir la transferencia nuclear dependiente de IMP α / β y redujo el virus replicación de una manera dependiente de la dosis, lo que indica que UL42 era dependiente de IMP α / β para la transferencia nuclear. La ivermectina 25 µM redujo el título de virus en 4 logaritmos e inhibió la producción de viriones en ~ 44%, pero no tuvo efecto sobre la viabilidad celular en las dosis estudiadas. Además, la ivermectina no tuvo ningún efecto sobre la unión y entrada del virus en la célula huésped (Raza, y otros, 2020).
En un estudio sobre células renales bovinas Madin-Darby infectadas con BoHV-1, un virus de ADN grande, envuelto y de doble hebra de la familia Herpesviridae, la ivermectina disminuyó la transmisión nuclear UL42 al inhibir la transferencia nuclear dependiente de IMP α / β y redujo el virus replicación de una manera dependiente de la dosis, lo que indica que UL42 era dependiente de IMP α / β para la transferencia nuclear. La ivermectina 25 µM redujo el título de virus en 4 logaritmos e inhibió la producción de viriones en ~ 44%, pero no tuvo efecto sobre la viabilidad celular en las dosis estudiadas. Además, la ivermectina no tuvo ningún efecto sobre la unión y entrada del virus en la célula huésped (Raza, y otros, 2020).
Lista de estudios reveló efectos antivirales de la ivermectina en virus ARN y ADN
Lista de estudios reveló efectos antivirales de la ivermectina en virus ARN y ADN | ||||
Virus de ARN | Característica viral | Género | Familia | Referencia |
SARS-CoV-2 o COVID-19 | Monocatenario envuelto,de sentido positive | Betacoronavirus | Coronaviridae | |
Virus del Zika | Monocatenario envuelto,de sentido positive | Flavivirus | Flaviviridae | |
Virus del dengue | Monocatenario envuelto,de sentido positive | Flavivirus | Flaviviridae | |
Virus de la fiebre amarilla | Monocatenario envuelto, de sentido positive | Flavivirus | Flaviviridae | |
Virus del Nilo Occidental | Monocatenario envuelto, de sentido positive | Flavivirus | Flaviviridae | |
Virus Hendra | Monocatenario envuelto, de sentido negativo | Henipavirus | Paramyxoviridae | |
Virus de Newcastle | Monocatenario envuelto, de sentido negativo | Paramyxoviridae | ||
Virus de la encefalitis equina Venezolana | Monocatenario envuelto, | Alfavirus | Togaviridae | |
Virus Chikungunya | Monocatenario envuelto, de sentido positive | Alfavirus | Togaviridae | |
Virus del bosque Semliki | Monocatenario envuelto,de sentido positive | Alfavirus | Togaviridae | |
Virus Sindbis | Monocatenario envuelto, de sentido positive | Alfavirus | Togaviridae | |
Virus influenza aviar A | Monocatenario envuelto, de sentido negativo | Alfainfluenza | Ortomixoviridae | |
Virus del síndrome reproductivo y respiratorio porcino | Monocatenario envuelto, de sentido positive | Arterivirus | Arteriviridae | |
Virus inmunodeficiencia humana tipo 1 | Monocatenario envuelto, de sentido positive | Lentivirus | Retroviridae | |
Virus de AND | ||||
Herpesvirus equipo tipo 1 | Un envuelto, de doble Hebra | Varicelovirus | Herpesviridae | |
Virus de la pseudorrabia | Un envuelto, de doble Hebra | Varicelovirus | Herpesviridae | |
Poliomavirus BK | Un bicatenario sin envolver | Poliomavirus | Polyomaviridae | |
Circovirus porcino 2 | Un monocatenario no envuelto | Circovirus | Circoviridae |
Fuente: (Heidary & Gharebaghi, 2020)
Estudios de casos por Diarrea Endémica Porcina PED, producida por coronavirus
- Primer caso
En la ciudad de Ayacucho-Perú, en una granja de 100 madres se presentó el caso de diarrea endémica porcina (PED) por coronavirus
Se inició el proceso infeccioso en una marrana de gestación que presento cuadros de diarrea, anorexia sin fiebre, luego de dos días el lote de 50 madres empezó a presentar los mismos síntomas
Se inició el proceso infeccioso en una marrana de gestación que presento cuadros de diarrea, anorexia sin fiebre, luego de dos días el lote de 50 madres empezó a presentar los mismos síntomas
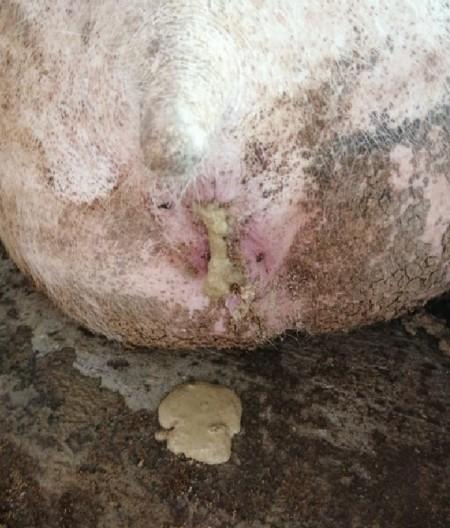
Figura 8. Cerdas en gestación con cuadros de diarrea

Figura 9. Lote de cerdas infectadas con PED con anorexia
Las cerdas fueron tratadas con antibióticos, pero no respondieron al tratamiento.
La enfermedad se expandió hacia la zona de maternidad afectando a las cerdas lactantes y su camada, con signos de diarrea, vómitos, de igual manera se trató con antibióticos y no respondieron al tratamiento; también se les cambio de alimento para descartar posible contaminación por algún insumo y la enfermedad seguía progresando rápidamente

Figura 10. Diarreas de la cerda y de su camada

Figura 11. Lechones lactantes con signo de PED antes de la ivermectina
Los lechones lactantes presentaron cuadros de diarreas, vomito, deshidratación y 100% de morbilidad.
Inmediatamente se confirmó clínicamente el cuadro de PED se inició el tratamiento solo con ivermectina al 1% en dosis de 1cc/20kg durante 5 días.

Figura 12. Lechones recuperándose a los 3 dos después de la dosis de ivermectina

Figura 13. Cerda lactante y camada completamente recuperados a los 6 días del tratamiento
Los lechones de recría recién empezaban a mostrar signos de diarrea

Figura 14. Lechones en recría con cuadros de PED

Figura 15. Lechones destetados completamente sanos del PED despues de tratamiento con ivermectina
Los gorrinos de crecimiento y acabado presentaron el cuadro de PED,

Figura 16. Presencia de PED en gorrinos

Figura 17. Gorrinos completamente recuparados despues del uso de la ivermectina
A los 3 días en el otro lote de 50 cerdas se inició el cuadro en una cerda, diarrea profusa e inapetencia, se le aplico ivermectina como profiláctico y solamente 2 mostraron signos el resto no mostraron ningún signo, demostrando su uso como preventivo. Marranas que paren y que han recibido tratamiento con ivermectina, camada presentan cuadros leves a causa del PED.
La enfermedad se llegó a controlar completamente a las 2 semanas de iniciado el tratamiento, con una baja mortalidad y rápida recuperación de los animales,

Figura 18. Cerda gestante iniciando el cuadro de PED del lote II

Figura 19. Cerdas gestante lote II que no mostraron signos por uso preventivo de la ivermectina

Figura 20. Lechones que nacen cuyas madres han recibido dosis de ivermectina, presentan cuadros muy leves de PED,
- Segundo caso:
Se presentó un brote de PED en la misma temporada en la ciudad de Lima-Perú, la granja se dedicaba a el engorde de cerdos destinados para la venta, recibieron dos lotes, el primero recién destetados de 1 mes y el segundo lote de 1 mes y medio,
Se presentó un cuadro diarrea intensa en los dos lotes con vómito y anorexia y iniciaron un tratamiento con antibióticos y pasaron 3 días y el cuadro de iba agudizando

Figura 21 Lechones con diarrea profunda a causa del brote de PED

Figura 22 Lote de destetados con complicaciones severas de diarrea y deshidratación

Figura 23 Inicio de tratamiento con ivermectina a los 2 lotes afectados

Figura 24 Animales recuperados a los 7 días post tratamiento con ivermectina

Figura 25. Segundo lote de recién destetados más afectados ya recuperados y comiendo
- Tercer caso:
En una granja en México, se inició una prueba ya que tenían problemas en lechones neonatales que presentaban cuadros de diarreas al nacimiento, presuntamente por problemas vira, se le aplico ivermectina al nacimiento y se controló el problema de diarreas en los lechones neonatos

Figura 26. Lechones neonatos con cuadros de diarrea y deshidratación compatible con diarrea viral.

Figura 27. Lechones neonatos, sin problemas de diarreas con tratamiento con ivermectina.
CONCLUSIONES
- Los cuadros clínicos presentados en el siguiente trabajo son compatibles con Diarrea Endémica Porcina PEDV, en nuestro medio no existen pruebas para confirmar el diagnóstico y el aislamiento del virus es bien complicado
- Las diarreas no respondieron a tratamiento con antibióticos y solo para este caso se usó ivermectina como tratamiento único.
- La dosis que se uso es más alta de lo recomendado según los estudios por investigadores para el uso de la ivermectina como antiviral.
- Se usó la ivermectina al 1% con una dosificación 1cc por 20 kg de peso vivo durante 5 días de tratamiento
- La morbilidad es alta en una granja afectada por PED (100%), la mortalidad en animales depende de la edad, en marranas y gorrinos es nula, en destetados puede ser hasta 30%, pero en lechones lactantes varia de 80 hasta 100%
- Si bien la mortalidad es baja en gorrinos, su recuperación es lenta y afecta los parámetros productivos de la granja
- Cuando se usó ivermectina la mortalidad en lechones lactante fue del 5%, porcentaje de una crianza normal,
- Los animales se recuperaron a los 5 días post infección sin secuelas graves que lamentar
- La granja se estabilizo completamente a las 2 semanas post infección, sin el uso de la ivermectina demora hasta 6 semanas para estabilizarse
- Cuando se usa como profiláctico en un brote los animales tratados en su gran mayoría no presentan cuadros de PED
- La madre tratada con ivermectina que están próxima al parto y que paren sus crías hacen cuadros leves de PED
- Se puede usar una dosis en lechones recién nacidos para evitar diarreas compatibles con PED
- No mostraron ningún signo de toxicidad, especialmente los lechones recién nacidos.
Recomendaciones
Debido a las evidencias del presente informe se debe establecer como protocolo el uso de la ivermectina cuando hay cuadros de diarreas por coronavirus (PED, GET).
Realizar más trabajos de investigación para confirmar estos casos, y determinar su posible toxicidad cuando se usa alta dosis y mayor frecuencia
Publicar este trabajo, para que los porcicultores de la región y a nivel mundial, se apoyen y controlen esta enfermedad mortal para los lechones
- Alam, M., Murshed, R., Bhiuyan, E., Saber, S., & Alam, R. (2020). A Case Series of 100 COVID-19 Positive Patients Treated with Combination of Ivermectin and Doxycycline. J Bangladesh Coll Physic Surg, 38, 10-15.
- Azeem S, A. M. (2015). Evaluation of cytotoxicity and antiviral activity of ivermectin against Newcastle disease virus. Pak J Pharm Sci, 28, 597-602.
- Barrows, N., Campos, R., Powell, S., Prasanth, K., Schott-Lerner, G., Soto-Acosta, R., . . . Br. (2016). A Screen of FDA-Approved Drugs for inhibitors of Zika Virus Infection. Cell host and microbe, 20(2), 259-270.
- Bertasio C, G. E. (2016). Porcine Epidemic Diarrhea Virus Shedding and Antibody Response in Swine Farms: A Longitudinal Study. Front Microbiol, 15(7), 2009.
- Caly, L., Druce, J., Catton, M., & Jans, D. (2020). "The FDA-approved Drug Ivermectin inhibits the replication of SARS-CoV-2 in vitro. Antiviral Res, 178.
- Campbell, W., Fisher, M. S., Albers-Schönberg, G., & Jacob, T. (Aug221 de 983). Ivermectin: a potent new antiparasitic agent. Science, 221(4613), 823-8.
- Changhee, L. (2015). Porcine epidemic diarrhea virus: An emerging and re-emerging epizootic swine virus. Virol J, 12(193).
- Croci, R., Bottaro, E., Chan, K., Watanabe, S., Pezzullo, M., Mastrangelo, E., & Nastruzzi, C. (8043983 de 2016). Liposomal systems as nanocarriers for the antiviral agent ivermectin. Int J Biomater, 2016.
- Furutani, A., Sekiguchi, S., Sueyoshi, M., & Sasaki, Y. (2019). Effect of intervention practices to control the porcine epidemic diarrhea (PED) outbreak during the first epidemic year (2013-2014) on time to absence of clinical signs and the number of dead piglets per sow in Japan. Prev Vet Med, 169, 104710.
- Gao, Q., Zhao, S., Qin, T., Yin, Y., & Yu, Q. Y. (2016). Gao Q, Zhao S, Qin T, Yin Y, Yu Q, Yang Q. Effects of inactivated porcine epidemic diarrhea virus on porcine monocyte-derived dendritic cells and intestinal dendritic cells. Res vet Sc1, 106, 149-58.
- Gerdts, V., & Zakhartchouk, A. (2017). Vaccines for porcine epidemic diarrhea virus and other swine coronaviruses. Vet Microbiol, 206, 45-51.
- Götz, V., Magar, L., Dornfeld, D., Giese, S., Pohlmann, A., Höper, D., . . . Schwemmle, M. (2016). Influenza A viruses escape from MxA restriction at the expense of efficient nuclear vRNP import. Sci Rep, 18(6), 23138.
- Grasland, B., Bigault, L., Bernard, C., Quenault, H., C:, T. O., & al., e. (2015). Complete genome sequence of a porcine epidemic diarrhea S gene indel strain isolated in France in December 2014. Genome Announc, 3(3).
- Gregory, W. S., Hai, H., Kent J, S., Eric R, B., Dong, S., Darin, M., . . . Kyoungjin J, Y. (2013). Emergence of Porcine epidemic diarrhea virus in the United States: clinical signs, lesions, and viral genomic sequences. J Vet Diagn Invest, 25(5), 649-54.
- Heidary, F., & Gharebaghi, R. (2020). Ivermectin: a systematic review from antiviral effects to COVID-19 complementary regimen. The Journal of antibiotics, 73(9), 593-602.
- Hofmann, M., & Wyler, R. (1988). Propagation of the virus of porcine epidemic diarrhea in cell culture. journal Of Clinical Microbiology, 26(11), 2235-9.
- Huang, Y.-W., Dickerman, A. W., Piñeyro, P., Li, L., Fang, L., Kiehne, R., . . . Menga, X.-J. (2013). Origin, evolution, and genotyping of emergent porcine epidemic diarrhea virus strains in the United States. MBio, 4(5), e000737.
- Jans, D., & Wagstaff, K. (2020). Ivermectin as a Broad-Spectrum Host-Directed Antiviral: The Real Deal? Cells, 9(9).
- Ji, W., & Luo, G. (2020). Zika virus NS5 nuclear accumulation is protective of protein degradation and is required for viral RNA replication. Virology, 541, 124-35.
- Jin, L., Wang, R., Zhu, Y., Zheng, W., Han, Y., Guo, F., . . . Li, Y. (Dic de 2015). Selective targeting of nuclear receptor FXR by avermectin analogues with therapeutic effects on nonalcoholic fatty liver disease. Sci Rep, 5, 17288.
- Jung, K. R. (2009). Porcine reproductive and respiratory syndrome virus modifies innate immunity and alters disease outcome in pigs subsequently infected with porcine respiratory coronavirus: implications for respiratory viral co-infections. J Gen Virol, 90, 2713-2723.
- Jung, K., & Saif, L. (2005). Porcine epidemic diarrhea virus infection: etiology, epidemiology, pathogenesis and immunoprophylaxis. Vet.J, 204(2), 134-143.
- Jung, K., & Saif, L. (2015). Infección por virus de la diarrea epidémica porcina: etiología, epidemiología, patogenia e inmunoprofilaxis. Veterinario. J, 204, 134-143.
- Ketkar, H., Yang, L., Wormser, G., & Wang, P. (2019). Falta de eficacia de la ivermectina para la prevención de una infección letal por el virus del Zika en un sistema murino. Diagnóstico Microbiol Infect Dis., 95, 38-40.
- Kim, S., Song, D., & Park, B. (2001). Differential detection of transmissible gastroenteritis virus and porcine epidemic diarrhea virus by duplex RT-PCR. J Vet Diagn, 13(6), 516-20.
- Kim, Y., Yang, M., Goyal, S., Cheeran, M., & Torremorell, M. (2017). Evaluation of biosecurity measures to prevent indirect transmission of porcine epidemic diarrhea virus. BMC Vet. Res, 13(1), 89.
- Kocherhans, R., Bridgen, A., Ackermann, M., & Tobler, K. (2001). Finalización de la secuencia del genoma del coronavirus de la diarrea epidémica porcina (PEDV). Genes de virus., 23(2), 137-144.
- Koonpaew, S., Teeravechyan, S., Frantz, P., Chailangkarn, T., & Jongkaewwattana, A. (2019). PEDV y PDCoV patogénesis: la interacción entre las respuestas inmunitarias innatas del huésped y los coronavirus entéricos porcinos. Virus Genes., 6(34).
- Laing, R., Gillan, V., & Devaney, E. (2017). Ivermectin – Old Drug, New Tricks? Trends Parasitol, 33(6), 463-472.
- Langel, S., Paim, F., Lager, K., Vlasova, A., & Saif, L. J. (2016). Lactogenic immunity and vaccines for porcine epidemic diarrhea virus (PEDV): Historical and current concepts. Virus Res, 226, 93-107.
- Lee, C. (2016). Porcine epidemic diarrhea virus: An emerging and re-emerging epizootic swine virus. Virol J, 8(5), 277-289.
- Lee, D., Park, C., Kim, S., & C, L. (2010). Heterogeneidad en genes de proteínas de pico de virus de diarrea epidémica porcina aislados en Corea. Virus Res, 149, 175-82.
- Lee, S., & Lee, C. (2014). Outbreak-related porcine epidemic diarrhea virus strains similar to US strains, South Korea, 2013. Emerg Infect Dis, 20(7), 1223-1226.
- Lee, Y., & Lee, C. (2016). Ivermectin inhibits porcine reproductive and respiratory syndrome virus in cultured porcine alveolar macrophages. Arch Virol, 161(2), 257-68.
- Leyi, W., Beverly, B., & Yan, Z. (2014). New Variant of Porcine Epidemic Diarrhea Virus, United States, 2014. Emerg Infect Dis, 20(5), 917-919.
- Lin, C., Chung, W., Chang, S., Wen, C., Liu, H., Chien, C., & Chiou, S. (2014). US-Like Strain of Porcine Epidemic Diarrhea Virus Outbreaks in Taiwan, 2013–2014. J Vet Med Sci., 76(9), 1297-1299.
- Lin, C., Saif, L., Marthaler, D., & Wang, Q. (2017). Porcine epidemic diarrhea virus (PEDV): An update on etiology, transmission, pathogenesis, and prevention and control. Attenuation of an original US porcine epidemic diarrhea virus strain PC22A via serial cell culture passage, 2001, 62-71.
- Lundberg, L., Pinkham, C., Baer, A., Amaya, M., Narayanan, A., Wagstaff, K., . . . Kehn-Hall, K. (2013). Nuclear import and export inhibitors alter capsid protein distribution in mammalian cells and reduce Venezuelan Equine Encephalitis Virus replication. Antiviral Res, 100(3), 662-72.
- Lv, C., Liu, W., Wang, B., Dang, R., Qiu, L., Ren, J., . . . X, W. (2018). Ivermectin inhibits DNA polymerase UL42 of pseudorabies virus entrance into the nucleus and proliferation of the virus in vitro and vivo. Antiviral Res, 159, 55-62.
- Mastrangelo, E., Pezzullo, M., De Burghgraeve, T., Kaptein, S., Pastorino, B., Dallmeier, K., . . . Milani, M. (2012). Ivermectin is a potent inhibitor of flavivirus replication specifically targeting NS3 helicase activity: new prospects for an old drug. The Journal of antimicrobial chemotherapy,, 67(8), 1884-94.
- McBride, R., van Zyl, M., & Fielding, B. (2014). The coronavirus nucleocapsid is a multifunctional protein. Viruses, 6, 2991-3018.
- Mealey, K., Bentjen, S., Gay, J., & Cantor, G. (Nov de 2001). Ivermectin sensitivity in collies is associated with a deletion mutation of the mdr1 gene. Pharmacogenetics, 11(8), 727-33.
- Pooda, S., Mouline, K., De Meeûs, T., Bengaly, Z., & Solano, P. (2013). Decrease in survival and fecundity of Glossina palpalis gambiensis vanderplank 1949 (Diptera: Glossinidae) fed on cattle treated with single doses of ivermectin. Parasit VectorsP, 6(6), 165.
- Rajter, J., Sherman, M., Fatteh, N., Vogel, F., Sacks, J., & Rajter, J. (2020). ICON (Ivermectin in COvid Nineteen) study: use of ivermectin is associated with lower mortality in hospitalised patients with COVID-19. Cofre, 159(1), 85-92.
- Raza, S., Shahin, F., Zhai, W., Li, H., Alvisi, G., Yang, K., . . . Guo, A. (2020). Ivermectin Inhibits Bovine Herpesvirus 1 DNA Polymerase Nuclear Import and Interferes with Viral Replication. Microorganisms, 409.
- Sabeena, A., Mohammad, M. K., Allen, G. R., Asma, B. A., & Wasif, A. K. (2020). A five-day course of ivermectin for the treatment of COVID-19 may reduce the duration of illness. SHORT COMMUNICATION, 103, 214-216.
- Sato, T., Oroku, K., Ohshima, Y., Furuya, Y., & Sasakawa, C. (2018). Efficacy of genogroup 1 based porcine epidemic diarrhea live vaccine against genogroup 2 field strain in Japan. Virol J, 15(1), 28.
- Slonska, A., Cymerys, J., Skwarska, J., Golke, A., & MW, B. (2013). Influence of importin alpha/beta and exportin 1 on equine herpesvirus type 1 (EHV-1) replication in primary murine neurons. Pol J Vet Sci, 16, 749-51.
- Theuns, S., C.-N. N., Christiaens, I., Zeller, M., Desmarets, L., Roukaerts ID, A. D., . . . Nauwynck, H. (2015). Complete genome sequence of a porcine epidemic diarrhea virus from a novel outbreak in Belgium, january 2015. Genome Announc, 3(3), e00506-15.
- Wagstaff, K. M., Sivakumaran, H., Heaton, S. M., Harrich, D., & Jans, D. A. (2012). Ivermectin is a specific inhibitor of importin α/β-mediated nuclear import able to inhibit replication of HIV-1 and dengue virus. The Biochemical journal, 443(3), 851–856.
- Wagstaff, K., Sivakumaran, H., Heaton, S., Harrich, D., & Jans, D. (2012). Ivermectin is a specific inhibitor of importin α/β-mediated nuclear import able to inhibit replication of HIV-1 and dengue virus. Biochem, 443(3), 851-856.
- Wang X, L. C. (2019). Ivermectin treatment inhibits the replication of Porcine circovirus 2 (PCV2) in vitro and mitigates the impact of viral infection in piglets. Virus Res, 263, 80-6.
- Wang, K., Lu, W., Chen, J., Xie, S., Shi, H., Hsu, H., . . . Fischer, W. S. (2012). PEDV ORF3 codifica una proteína de canal iónico y regula la producción de virus. FEBS Lett, 586(4), 384-391.
- Wentao, L., Heng, L., Yunbo, L., Pan, Y., Feng, D., Yanhua, S., . . . Qigai, H. (201218). New variants of porcine epidemic diarrhea virus, China, 2011. Emerg Infect, 18(8), 1350-3.
- Xiao-meng, W., Bei-bei, N., He, Y., Dong-sheng, G., Xia, Y., Lu, C., . . . Chuan-qing, W. (2013). Genetic properties of endemic Chinese porcine epidemic diarrhea virus strains isolated since 2010. Arch Virol, 158(12), 2487-2494.
- Xu, X., Zhang, H., Zhang, Q., Huang, Y., Dong, J., Liang, Y., & al, e. (2013). Porcine epidemic diarrhea virus N protein prolongs S-phase cell cycle, induces endoplasmic reticulum stress, and up-regulates interleukin-8 expression. Vet Microbiol, 164, 212-21.
- Yang, S., Atkinson, S., Fraser, J., Wang, C., Maher, B., Roman, N., . . . Jans, D. (2019). Novel Flavivirus Antiviral That Targets The Host Nuclear Transport Importin α/β1 Heterodimer. Cells, 8(3), 281.
- Yin J, P. G. (Sep de 2015). DEAD-box RNA helicase DDX23 modulates glioma malignancy via elevating miR-21 biogenesis. Brain, 138(9), 2553-70.
Temas relacionados:
Autores:



Recomendar
Comentar
Compartir
Recomendar
Responder

¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.
Usuarios destacados en Porcicultura

Luis Bellido Taber
Cobb-Vantress
MVZ. / Gerente Técnico Comercial del Pacto Andino
Estados Unidos de América
Estados Unidos de América







