Aislamiento e identificación de erysipelothrix rhusiopathiae en Guadalajara, Jalisco
Publicado: 21 de septiembre de 2015
Por: Emilio Campos Morales (Centro Universitario de Ciencias Biológicas y Agropecuarias-UDG), Gutiérrez-Paredes S., Guerra-Infante F., Maria de Jesus de Haro Cruz. (Departamento de Microbiología de la Escuela Nacional de Ciencias Biológicas-IPN). México
Introducción:
Erysipelothrix rhusiopathiae es el agente causal de la erisipela porcina, enfermedad que ocasiona pérdidas económicas importantes en las explotaciones ganaderas porcinas, el curso de la enfermedad puede ocurrir de manera aguda ocasionando septicemia o de forma crónica caracterizada por poliartritis y endocarditis (1). En México se desconoce la presencia de la infección, principalmente porque el cuadro clínico se presenta acompañado por otros patógenos, además el aislamiento es difícil por los requerimientos de la bacteria. En un rancho porcícola de Guadalajara se dieron a conocer casos de endocarditis, disminución en la producción y observación de manchas rojizas en la piel de animales jóvenes y las hembras de pie de cría, por lo que se buscó la presencia del microorganismo en la explotación.
Materiales y métodos
Muestras de elección.
Se obtuvieron muestras de corazón, amigdalas, líquido sinovial y sangre de animales con sospecha de infección con la bacteria. Las muestras de tejido se colocaron en frascos con medio de transporte de Stuart, en tanto que las muestras de sangre se obtuvieron en tubos con heparina para evitar su coagulación. Las muestras se mantuvieron en refrigeración hasta su procesamiento en el laboratorio.
Aislamiento del agente etiológico
Las muestras de órgano se maceraron y se sembraron en agar sangre, agar soya tripticaseína complementado con 3% de suero de caballo y medio de Packer modificado. Los medios de cultivo fueron incubados a 37° C durante 24-48 h. Las colonias con una morfología microscópica y colonial compatible a Erysipelothrix sp. fueron resembradas en agar soya tripticaseina con 3% de suero de caballo y agar sangre para su posterior identificación fenotípica.
Identificación fenotípica.
Las cepas sospechosas de E. rhusiopathiae fueron identificadas mediante pruebas de movilidad, producción de ácido sulfhídrico, reacción negativa a la catalasa, fermentación de glucosa, lactosa y arabinosa.
Identificación molecular.
Para el diagnóstico molecular, se realizó la extracción de DNA bacteriano por el método descrito por Yamazaki (2). Brevemente, la bacteria se re suspendió en 100 µL de proteinasa K (0.5 mg/ml) se incubo a 50°C por 30 minutos. Pasado este tiempo se adicionaron 300 µL de 1.5 mM de Tris-HCL pH 8 y se centrifugo a 20000 g por 10 minutos. El sobrenadante se separó y se trató con una mezcla de fenol-cloroformo (1:1), agitándose por 10 minutos, finalmente se centrifugo a 10000 g por 10 minutos, precipitando el DNA con etanol absoluto frío. La pastilla obtenida se resuspendio en 50 µL de agua inyectable. Los iniciadores para la amplificación del gen 16S de Erysipelothrix sp. fueron MO101 (5´- agatgcccatagaaactggta-3´) y ERS-1R (5´- ctgatccgcgattactagcgattgcg-3´), que amplifican un fragmento de 719 pb (2).
Para genotipificar los aislamientos de E. rhusiopathiae, se utilizó la secuenciación del gen spaA que codifica para proteínas de superficie. Los iniciadores utilizados fueron Erko-1F (5´-gtgaaacaccgtattttagta-3´) y Erko-2R (5’- ttcaagaagttcctgtagttt-3´) las cuales amplifican un fragmento de 432 pb (3).
La secuenciación se realizo por medio de un secuenciador ABI PRISM 310 (PE Biosystems) utilizando el kit BigDye DNA sequencing (PE Biosystems) de acuerdo a las instrucciones del proveedor.
Resultados y discusión
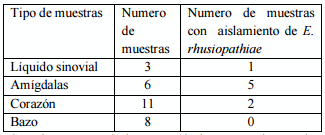
Se analizaron 28 muestras de cerdos de un rancho experimental, en el estado de Jalisco, Guadalajara (tabla 1). De líquido sinovial (1/3), amígdalas (5/6) y corazón (2/11) se aislaron 8 cepas sospechosas de Erysipelothrix sp de las cuales 5 fueron identificadas como E. rhusiopathiae de acuerdo a su perfil bioquímico.
Tabla 1. Muestras analizadas para el aislamiento de Erysipelothrix rhusiopathiae
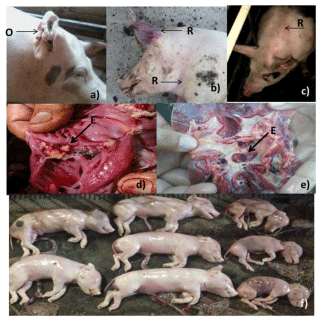
Se observaron clínicamente lesiones en las orejas (pabellón auricular y se le denomina oreja de chicharrón o acartonada), acumulación de un liquido rojo obscuro con un olor desagradable a putrefacción y que desapareció días después de que se le aplico al cerdo Penicilina, fiebre, anorexia, cianosis en las región ventral del cerdo, en dos casos se observarón manchas rojas en la piel simulando un rombo y a la necropsia se observaron en pulmones neumonía, edema en el órgano y endocarditis proliferativa en las válvulas auriculoventriculares, esplenomegalia, en articulaciones del carpo y metacarpo el liquido sinovial de color ámbar e inflamación en la superficie articular (figura 1).
La bacteria que ocasiona este cuadro clínico de erisipela en apariencia es una bacteria sin importancia en la clínica de porcinos ya que por su patogenicidad pasa desapercibida en la mayoría de los casos, sin embargo es de importancia económica ya que su efecto patológico es el de producir un retraso en el desarrollo de los cerdos, problemas reproductivos en sementales como orquitis y terminando en producir necrosis de los tejidos que conforman el testículo, y en cerdas reproductoras causa lesiones y necrosis del ovario, además de ser una bacteria que afecta a la salud pública ya que puede infectar a los trabajadores. Las perdidas económicas son cuantiosas ya que el retraso en la engorda del cerdo es de aproximadamente 28 días (6).
Figura 1. Cerdos con signos de erisipela porcina. a) Lesiones en orejas (acartonadas) (O), b) Cerdo muerto por septicemia c) Manchas rojizas en la piel del cerdo (R) características de erisipela, d) y e) Se observan lesiones de endocarditis, f) Presencia de abortos en el día 105 de la gestación
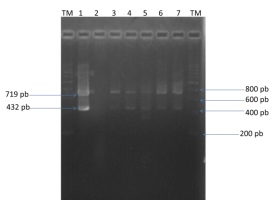
La técnica de PCR detecto que estos 5 aislamientos amplifican tanto el fragmento de 719 pb como el de 432 pb en 5 muestras. El análisis de secuenciación de dos de estos aislados nos indica que corresponde a Erysipelothrix rhusiopathiae (figura 2).
El aislamiento de E. rhusiopathiae se considera difícil, ya que la bacteria requiere de suero de caballo o sangre para su crecimiento, además que se puede encontrar a otros microorganismos que complican el cuadro y enmascaran los resultados (2).
Figura 2. Electroferograma de la PCR anidada para 5 aislamientos de cerdos sospechosos de erisipela. TM: Marcador de tamaño molecular de 200 pb. Carril 1: Cepa tipo de E. rhusiopathiae. Carril 2: Muestra negativa. Carril 3-7: Muestras positivas al gen 16S de Erysipelothrix (amplicon de 719 pb) y al gen spaA especifico de especie (amplicon de 432 pb).
La utilización de técnicas moleculares es de utilidad para poder realizar un diagnóstico temprano, con lo cual se a detectar a los animales portadores, eliminarlos o dar un tratamiento temprano para evitar la propagación y la diseminación en la granja (4,5).
En México no existen referencias de la prevalencia de la enfermedad en granjas porcícolas. En este estudio se identificó la presencia de E. rhusiopathiae en una granja de cerdos de Guadalajara, Jalisco por lo que otros estudios se tendrán que realizar para determinar su presencia en otras partes del país.
Conclusiones
De acuerdo a los datos presentados, se realizó el aislamiento e identificación bioquímica y genotípica de E. rhusiopathiae en una granja porcícola de Guadalajara, Jalisco.
Referencias bibliográficas:
- Shimoji Y, Yokomizo Y and Mori Y. (1996). Infection an Immunity. 64: 1789-1793.
- Yamazaki Y. (2006). Journal Veterinary Diagnostic Investigation. 18: 384-387.
- To H., Sato H., Tazumi A., Tsutsumi N., Nagai S., Iwata A. and Nagano T. (2012). Journal Veterinary Medical Science. 74: 949-953.
- To H. and Nagai S. (2007). Clinical Vaccine Immunology. 14: 813-820.
- Harada K., Uchiyama M., Hoshi T. and Takahashi T. (2009). Journal Veterinary Diagnostic Investigation. 21: 354-358.
- Stackenbrandt E., Reboli A.C. and Farrar E. (2006). Prokaryotes. 4:492-510.
Contenido del evento:
Temas relacionados:
Autores:
Universidad de Guadalajara
Recomendar
Comentar
Compartir

¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.






