Introducción
Numerosas comunicaciones periodísticas de carácter técnico alertaron sobre la muerte de importante cantidad de bovinos en distintas provincias de la Argentina (Buenos Aires, Entre Ríos, Corrientes y Santa Fe, entre otras) y del Uruguay debido a la intoxicación con nitratos y/o nitritos en vacunos que pastoreaban forrajes en potreros que habían sufrido una sequía importante de más de tres años y medio (según zonas) y que posteriormente recibieron precipitaciones que posibilitaron la siembra de verdeos de invierno -avena y raigrás, principalmente- (Fernández Meyer, A.; Elizalde, J.; Riffel, S. y los técnicos del INTA: Brassesco, R. de Victoria – Entre Ríos-, Bretschneider, G. de Necochea/Balcarce – Buenos Aires -, Salado, E. de Rafaela - Santa Fe- y Mattera, J. de Pergamino – Buenos Aires-, entre otros).
Fotografía 1. Gentileza del Dr. Turinetto, N., 2023. Nogoyá, Pcia. de Entre Ríos.
En la década del 40 del siglo pasado se conoció con exactitud la patogenia de esta enfermedad ya que había habido descripciones anteriores en 1895 (Tarazona Laforga, J.,1985, citado por Herrera, J., 2019), al demostrarse que el ion nitrato (NO3-) es reducido en el rumen a nitrito (NO2-) y que el paso de grandes cantidades de este ion a la sangre desencadena la enfermedad. Debido a ello es que se la llama indistintamente “intoxicación por nitrato”, “intoxicación por nitrito” o “intoxicación por nitrato - nitrito” (Parada Navarro, R., 2016, citado por Herrera, J., 2019).
Respecto a la peligrosidad, hay que tener en cuenta que, para los bovinos, los nitritos son seis a ocho veces más tóxicos que los nitratos (Wiesner, E., 1985).
Absorción de nitratos por las plantas
Los nitratos del suelo (NO3-) son una forma inorgánica de nitrógeno asimilable por las plantas. Se forman a partir de la mineralización por microorganismos de formas orgánicas de nitrógeno, por ejemplo: materia orgánica del suelo, residuos de cosecha (relación C/N de los mismos), por abonos orgánicos –distribución de estiércol vacuno, porcino o guano de aves- y por defecaciones en corrales de engorde (Tarkalson, D. et al., 2006) o en lugares habituales de descanso animal. También por cultivos previos que favorecen la fijación de nitrógeno al suelo (leguminosas en general) y por fertilizaciones nitrogenadas en forma mineral.
En los primeros estadios de desarrollo de la planta, los suelos pueden contener niveles de nitrato usualmente elevados que se incorporan al forraje. No obstante, también, pueden ser elevados en plantas adultas que vegetan en suelos ricos en materia orgánica.
Las dosis de fertilizante nitrogenado en el suelo tienen un rol importante en la acumulación de nitratos en las plantas, al igual que el tipo de fertilizante y la época de fertlización.
Según Wiesner, E., en 1985, aplicaciones de 200 kg de nitrógeno/hectárea pueden, bajo condiciones climáticas desfavorables, aumentar la concentración de nitratos al 1,5 % de la materia seca (para un vacuno puede ser tóxica una concentración del 0,5% de la materia seca). También Steger, H., en 1966, encontró concentraciones de nitrato del 0,7% en la materia seca de los vegetales después de la aplicación de 120 kg de nitrógeno/ha. Los niveles de nitrato más altos fueron detectados entre dos a tres semanas después de la fertilización (Phipps, R. H., 1975).
La fertilización orgánica en forma de purines no conduce a niveles más altos de nitratos en las plantas que la fertilización nitrogenada en forma mineral. Esto, según observó Hörnike, E. et al, en 1974, se debería a una menor eficiencia del nitrógeno orgánico, no obstante, su acumulación asume un riesgo como se mencionó en párrafos anteriores.
El peligro de una acumulación de nitratos en las plantas por una aplicación excesiva es mayor cuando se fertilizan verdeos de invierno (avena o raigrás) en otoño, debido a que en esta época disminuyen la temperatura y la luminosidad (Wiesner, E., 1985).
Asimismo, las plantas normalmente no tóxicas, pueden transformarse temporariamente en tóxicas después de la aplicación de herbicidas hormonales (2,4-D, por ejemplo), por aumento en el contenido de nitratos.
Las pulverizaciones con el herbicida hormonal selectivo 2,4-D (ácido dicloro fenoxiacético) tienen la particularidad de modificar el metabolismo vegetal favoreciendo la concentración de nitratos (Perusia, O. y Rodríguez Armesto, R., 2017, citados por Herrera, J., 2019), al alterar momentáneamente el crecimiento en los cereales o interrumpirlo en las malezas susceptibles.
Existen referencias orales de muchos casos de muerte de ganado en Brasil, producidos por pastoreo en campos sometidos al tratamiento extensivo con herbicidas hormonales (Camargo, W., 1974). Estas informaciones, sumadas a las posibilidades de un aumento del contenido de nitratos en las hojas de ciertas plantas y además teniendo en cuenta una posible ingestión de plantas tóxicas que se hicieron más apetecibles después de la aplicación de estos herbicidas, parecen desaconsejar el empleo prolongado de herbicidas hormonales en pasturas.
La velocidad de este proceso de mineralización depende de diversos factores: de la cantidad de nitrógeno orgánico, del pH edáfico (los suelos ácidos favorecen la absorción de nitratos por parte de las plantas, Fernández Meyer, A., 2023) y de las deficiencias de fósforo, hierro, cobre, azufre, magnesio, manganeso o molibdeno que actúan en las enzimas vegetales. El exceso de potasio se ha asociado con la acumulación de nitratos en el suelo. Influyen además, la aireación, el contenido de agua en el suelo (los arcillosos retienen más) y la temperatura ambiental (Vetter, H. y Steffens, G., 1977).
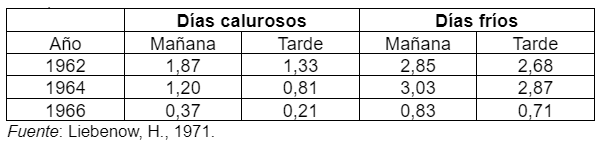
En general bajo condiciones de bajas temperaturas se han encontrado concentraciones de nitratos más altas que en días más calurosos (ver Cuadro 1).
La absorción de nitratos puede ser rápida con tiempo frío pero su conversión a aminoácidos y a proteínas es lenta. Tal situación conduce a su acumulación en el forraje (Parrada Navarro, R., 2016).
Cuadro 1. Diferencias en el contenido de nitratos (% de NO3- en la materia seca) en gramíneas entre la mañana y la tarde en días fríos y calurosos (promedio de varios años).
Los años fríos por lo general presentan una baja luminosidad que favorece a la acumulación de nitratos. Los valores más altos, tal se observa en el Cuadro 1, fueron medidos en la mañana, cuando la temperatura es más baja en estas horas del día y, además, se caracteriza por una menor luminosidad. En concordancia con esto, las plantas ubicadas en lugares sombríos (bajo árboles o en bosques) deberían tener una mayor concentración de nitratos que las ubicadas en lugares expuestos a una mayor luminosidad.
Se afirma en un trabajo publicado en “Agricultura de las Américas” que el contenido de nitratos de la avena cultivada a la intemperie sobre un lecho de arena aumenta en un 1% de la materia seca en un día nublado y que a la sombra continuada durante 70 días produce una acumulación de nitratos del 3 al 4%. Esto revela que las plantas que crecen a la sombra de los árboles pueden acumular considerables cantidades de nitratos (Ascaino, E., 1973).
La planta absorbe el nitrato edáfico del suelo por los pelos radiculares y lo utiliza para sintetizar proteína vegetal. Para ello, el nitrato absorbido tiene que ser reducido a nitrito (“nitrito preformado”) por la enzima nitrato reductasa, paso inicial en la cadena de eventos que conduce a la síntesis de compuestos orgánicos nitrogenados por el vegetal, (Fernández Meyer, A., 2023 y Klein R., F., 1988). No obstante, otros autores, Perusia, O. y Rodríguez Armesto, R., 2017, indican que esta transformación muy difícilmente puede darse en la planta, al igual que Martínez Marín, A. y Sánchez Cárdenas, J., en 2007. Del mismo modo Fernández, M. en 2011 sostiene esa tesitura.
La enzima nitrato reductasa es una flavoproteína que contiene hierro y molibdeno entre otros cofactores y está implicada en el primer paso de la asimilación del nitrato por las plantas.
La actividad de la enzima nitrato reductasa disminuye de forma lineal con el aumento de los porcentajes de sombra, lo cual indica la importancia de los altos índices de radiación luminosa para el buen funcionamiento del metabolismo del nitrógeno.
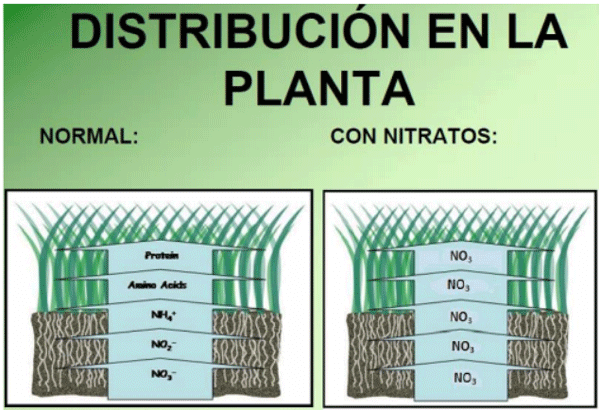
Afectadas por sequías con la consecuente deficiencia de crecimiento, ciertas plantas (avena, raigrás, sorgo, maíz y gran cantidad de malezas) pueden acumular nitratos en una concentración potencialmente tóxica, especialmente en raíces, base de los tallos y en las hojas maduras (ver Figura 1). No se acumulan en semillas.
Figura 1. Distribución del nitrógeno en la planta. Fuente: citado por Herrera, J., 2019. Ilustración didáctica.
Durante la sequía las plantas disminuyen la concentración de hidratos de carbono aumentando la susceptibilidad a la intoxicación (Maresca, S. y Rodríguez, A. 2014).
Al reiniciarse el crecimiento, luego de una precipitación importante y si persisten los días nublados (baja radiación solar, la que afecta a la fotosíntesis – Weissbach, F. y Hein, E., 1976- y disminuye la actividad de la enzima nitrato reductasa, Carriquiri, R., 2009), la velocidad de absorción de nitratos por las plantas es más rápida que la tasa de producción de materia seca, lo que produce la consecuente acumulación de los mismos. Esta acumulación de nitratos en las plantas es básica en la etiopatogenia (cubre las causas y mecanismos de cómo se produce una determinada enfermedad) de la intoxicación (Parada Navarro, R., 2016).
En América del Sur, se han registrado en algunos años numerosos casos de muertes de vacunos causadas por intoxicación de NO3-, especialmente a principio de otoño, cuando se reinician las lluvias luego de períodos importantes de sequía.
En plantas que sobreviven a la sequía, es corriente que la cantidad de nitrato permanezca elevada varios días después de ocurrida la primera lluvia.
Otro factor de incidencia es la ocurrencia de heladas tempranas o laceraciones de las hojas por granizo.
La acumulación de nitratos no es tóxica para el vegetal.
Puede manifestarse por el tamaño exuberante que adquieren (Fotografía2) y por el color azulado (Fotografía 3), aunque estos indicadores son aleatorios.
Fotografía 2. Observar el tamaño exuberante. Fuente: Ferrari, O., 2023. Gualeguay, Pcia. de Entre Ríos.
Fotografía 3. Color azulado del forraje. Fuente: Ferrari, O., 2023. Gualeguay, Pcia. de Entre Ríos.
Ante la sospecha de encontrarse con un cultivo que contiene una cantidad importante de nitratos o nitritos es conveniente hacer el test con Difenilamina.
El test de Difenilamina es una prueba colorimétrica cualitativa que puede emplearse a campo para determinar nitratos en pasturas, en agua, en el líquido ruminal, en el humor vítreo, en la sangre o en el suero sanguíneo. Indica el nivel de nitrato potencialmente peligroso (el color azul que se advierte a los dos o tres minutos, equivale a peligro). Pero solo arroja resultados confiables cuando los valores de nitrato alcanzan un nivel mínimo del 2% de la materia seca en plantas sospechosas. Por lo tanto, se sugiere confirmar con análisis cuantitativos en laboratorio.
En forrajes se realiza de la siguiente manera: se machacan hojas o tallos de las plantas sospechosas y se toman una o dos gotas del macerado en una placa de Petri o en un porta objeto o en un pequeño recipiente y se ponen en contacto con una o dos gotas del reactivo (0,5 a 1 cc3 de una solución de Difenilamina – 2 g - al 2%) más 50 cc de agua destilada y enrazar a 100 cc con ácido sulfúrico concentrado). La aparición de color azul en la zona de contacto indica positividad (Perusia, O. y Rodríguez Armesto, R., 2017). Ver Fotografía 4.
La misma prueba se puede hacer sobre los líquidos de cadáveres antes mencionados. No obstante, el suero sanguíneo es el material biológico más sensible para realizar la reacción, dando el azul más oscuro.
Fotografía 4. Test de Difenilamina. Fuente: citado por Herrera, J., 2019. Ilustración didáctica.
¿Cómo se produce la intoxicación en los bovinos?
Bajo condiciones normales, el nitrato es asimilado de manera rápida por la planta, de forma tal que se encuentra solo en cantidades trazas en los tejidos vegetales (Wright, M. y Davison, K., 1964). Como se ha mencionado, cualquier factor que limite o inhiba la velocidad de reducción del nitrato absorbido favorecerá la acumulación de este.
Al consumir los vacunos un forraje con gran cantidad de nitrato, este es reducido a nitrito por la acción de las bacterias del rumen (que poseen la enzima nitrato reductasa), que posteriormente va a ser utilizado por otras bacterias del rumen para realizar una serie de reacciones bioquímicas que finalmente resultan en la producción de amonio que es un catión poliatómico cargado positivamente, de fórmula química NH4⁺ y se forma mediante la protonación del amoníaco (NH3). El amonio es utilizado por el animal para la síntesis de proteínas y de otros compuestos nitrogenados.
Las manifestaciones clínicas y las lesiones que ocasiona el consumo de nitrato dependerán entre otros factores del compuesto que predomine en el organismo tras su ingestión y metabolismo. Es decir, nitrato, nitrito o amoníaco porque cada uno de ellos ejerce su acción perjudicial a diferente nivel. En la mayoría de las ocasiones, la clínica de la intoxicación será la suma de la acción patógena de los tres compuestos.
Intoxicación por nitratos
A pesar que el principal riesgo del consumo de nitrato es su conversión a nitrito en el rumen y el paso de este a la sangre, el nitrato puede causar trastornos por sí mismo. Cuando ocurre una acumulación de nitrato en el rumen por falta del poder reductor para su conversión a nitrito puede ocurrir que el exceso sea absorbido hacia la sangre y/o arrastrado hacia tramos posteriores del tracto digestivo. Si el nitrato pasa a la sangre, una pequeña parte se eliminará por vía renal y el resto será reciclado al rumen a través de la saliva y del epitelio ruminal. El nitrato y el nitrito en exceso son irritantes renales. Cuando el nitrato es arrastrado con la fase líquida ruminal en cantidad suficiente hacia los tramos inferiores del tracto digestivo, provoca irritación de la mucosa (gastroenteritis hemorrágica), que puede derivar en diarrea, y facilita la colonización de la misma por microorganismos patógenos que pueden causar una infección más o menos grave. Se ha comprobado que el organismo animal produce nitrato y nitrito de forma natural sobre todo cuando las bacterias liberan endotoxinas desde un foco de infección. El nitrato y nitrito endógenos se unen al nitrato y nitrito presentes en la sangre aumentando la posibilidad de intoxicación. El reciclado al rumen de nitrato procedente de la sangre, endógeno o absorbido en el tracto digestivo, puede agravar la excesiva ingestión del mismo proveniente del agua o del forraje. La reducción química ruminal de gran cantidad de nitrato puede disminuir drásticamente (desde el 10% normal al 1%) a la cantidad de ácido butírico disponible para la pared ruminal que lo utiliza como principal fuente de energía. Este fenómeno ocasiona éstasis ruminal con los trastornos fisiológicos que ello conlleva. En el contexto médico, "éstasis" puede referirse a la detención o ralentización del flujo de líquidos o sustancias en el cuerpo.
Las manifestaciones clínicas que presenta una intoxicación por nitratos son las siguientes: sialorrea (salivación excesiva), dolor y contracciones abdominales, diarrea y timpanismo. Ver Fotografías 5 y 6.
Fotografía 5. Vacuno con abundante salivación pastoreando raigrás. Fuente: Ferrari, O., 2023. Gualeguay, Pcia. de Entre Ríos.
Fotografía 6. Vacuno timpanizado por ingestión de forraje con acumulación de nitratos. Fuente: gentileza del Dr. Turinetto, N., 2003. Nogoyá, Pcia. de Entre Ríos.
Intoxicación por nitritos
Cuando la cantidad de nitrato ingerido es muy importante y/o en forma rápida, sobrepasa la capacidad reductora de la enzima para reducirlo a nitrito y luego por acción de la microbiota ruminal a amoníaco y se acumula una gran cantidad de nitrito en el líquido ruminal que difunde en la pared ruminal y pasa a la sangre.
El nitrito es un compuesto metahemoglobinizante, es decir que transforma a la hemoglobina (encargada de transportar el oxígeno desde los pulmones a los tejidos) a metahemoglobina que no tiene la capacidad de transportar al oxígeno. La metahemoglobina le confiere a la sangre un color marrón achocolatado característico (ver Fotografías 7 y 8).
Es importante hacer un diagnóstico diferencial de intoxicación por ácido cianhídrico, producida, generalmente, por el consumo de sorgo, entre otras especies. Estas plantas tienen glucósidos cianogénicos que son inofensivos, pero se vuelven tóxicos cuando se hidrolizan por una enzima que puede estar en la planta liberando el ácido cianhídrico.
Como factores predisponentes tienen importancia el rápido crecimiento, el rebrote, el pisoteo y cuanto más nitrógeno tiene el suelo, mayor es el porcentaje de cianhídrico que tienen los sorgos.
Muchas veces la intoxicación es tan aguda que mueren sin dar síntomas a minutos de ingerir el vegetal. Cuando es posible detectarla presentan un cuadro de asfixia debido a que la sangre no puede liberar el oxígeno a los tejidos, mostrando inquietud, diarrea, temblores, los vacunos caen de decúbito lateral, con convulsiones, coma y muerte. Las mucosas se encuentran con un color rojo brillante al igual que la sangre (principal signo diferencial) y presentan un olor similar a almendras de la boca.
Fotografía 7. Gentileza Dr. Turinetto, N., 2023.
Fotografía 8. Sangre extraída de la yugular. La izquierda de color chocolate es por nitratos y la derecha, color rojo brillante, es por HCN. Fuente: citado por De María, P., 2023. Ilustración didáctica.
En el caso de una intoxicación por nitritos, el hierro de la hemoglobina y de la oxihemoglobina permanece en forma ferrosa (Fe++) y por la acción oxidante del nitrito esta forma puede ser transformada a la forma férrica (Fe+++) dando origen a la metahemoglobina. La cianosis enterógena (mucosas azuladas) determina frecuentemente metahemoglobina en los rumiantes.
De acuerdo a distintos autores, si el nivel de metahemoglobina supera ciertos valores, el animal muere por hipoxia - es un estado de deficiencia de oxígeno en la sangre, células y tejidos del organismo, con compromiso de la función de los mismos-, (80%, según Martínez Marín, A y Sánchez Cárdenas, F.-2007-; Parada Navarro, R., en 2016 indica que la intoxicación aguda ocurre cuando el 40% de la hemoglobina circulante ha sido transformada en metahemoglobina y que la muerte ocurre cuando esa cifra alcanza al 70 – 80%; Pigurina, G. y Banchero, G. del INIA La Estanzuela del Uruguay menciona que con un nivel mayor al 65%, el animal no obtiene suficiente oxígeno y puede morir en pocas horas. De María, P., 2023 indica que con un nivel de metahemoglobina del 20% comienzan los signos clínicos).
Además, debido a su efecto vasodilatador periférico provoca la caída de la presión sanguínea y un choque circulatorio. Ambas circunstancias ocasionarán hipoxia celular tanto más grave cuanto mayor sea la concentración de nitritos en la sangre. Los vasos más sensibles son el cerebro y las meninges, seguidos de los coronarios. Esto es responsable del cuadro hipotensivo.
Otra de las consecuencias es la ocurrencia de abortos por hipoxia fetal (ver Fotografía 9).
Fotografía 9.Aborto producido por la ingestión de forraje contaminado con nitritos. Fuente: Herrera, J., 2019. Pcia. de Córdoba. Ilustración didáctica.
Las manifestaciones clínicas por intoxicación por nitritos son las siguientes: disnea, respiración con el cuello extendido y jadeante (ver Fotografía 10), taquicardia, cianosis, coloración de las mucosas y lengua (varían de pálidas a azuladas o amarronadas), anorexia y temblores musculares.
Fotografía 10. Respiración con cuello extendido y jadeante. Fuente: gentileza de Ghirardi, A., 2023. Gualeguay, Pcia. de Entre Ríos.
En la Fotografía 10 se observa el color azulado de la lengua.
Intoxicación por amoníaco
Los mecanismos por los cuales se puede acumular amoníaco en el rumen son muy variados y se escapan al objeto de la presente revisión. Un excesivo consumo de nitrato puede contribuir junto a otras causas a la acumulación de amoníaco en rumen.
Una concentración de amoníaco en el rumen por encima de la capacidad de utilización microbiana determinará la absorción de una elevada cantidad, que deberá ser detoxificada en el hígado por conversión a urea. La síntesis de urea en hígado supone un gasto energético adicional a las necesidades del animal. Además, el proceso de síntesis de urea compite con la síntesis de glucosa endógena (gluconeogénesis), lo que será particularmente pernicioso en condiciones fisiológicas de elevada demanda orgánica de glucosa, por ejemplo, el comienzo de la lactación y el final de la gestación. El exceso de amoníaco ruminal reduce la absorción de magnesio lo que puede ocasionar hipomagnesemia. Parecer ser que a determinados niveles de amoníaco y fósforo ruminal y con un pH oscilando entre 6,2 a 6,4 (ácido) ocurre la formación de una sal compleja que fija magnesio. Este compuesto es insoluble por lo que evita la absorción de magnesio en el intestino y ocasiona la deficiencia de este elemento, aunque los niveles de la ración sean adecuados.
Presentaciones clínicas de intoxicación en rumiantes
Hiperaguda: se produce con un nivel de metahemoglobina mayor al 90%. Los bovinos aparecen muertos sin signos previos y en la necropsia la sangre se observa de color achocolatado con hiperemia (aumento de la sangre) en las mucosas.
Aguda: se presenta con un nivel de metahemoglobina del 80 al 90% (Martínez Marín A. y Sánchez Cárdenas, J., 2007). Los cuadros agudos de la intoxicación ocurren, generalmente, con un valor de nitrato igual o mayor al 1,5 % de la materia seca de la ración total. Sin embargo, el cuadro puede aparecer con valores menores cuando la dieta es pobre en energía, o bien cuando el ganado hambriento consume vorazmente una elevada cantidad de material vegetal en tiempo breve; en tal caso, la excesiva formación de nitrito supera la posibilidad de convertirlo en amoníaco a igual ritmo, con lo cual el primero se acumula y se absorbe desde el rumen rápidamente (Parada Navarro, R. 2016).
Patogenia: la absorción digestiva del nitrito es rápida, se fija a las paredes arteriales y al glóbulo rojo y penetra al mismo. El nitrito oxida a la hemoglobina (Fe++) llevándola a metahemoglobina (Fe+++), que, como es sabido, no transporta oxígeno. Además, altos niveles circulantes de nitrito causan descenso de presión arterial. Los signos clínicos pueden aparecer precozmente (dentro de las cuatro horas en casos de consumo voraz de las plantas por los vacunos hambrientos. De María, P. menciona de una a seis horas) o tardíamente (hasta los 5 a 8 días) si el consumo ha sido pausado y las plantas contienen niveles de nitrato sólo moderadamente altos. El cuadro comienza con escasa tolerancia al ejercicio y leve disnea (dificultad respiratoria o falta de aire), fenómenos que se acentúan al transcurrir el tiempo; aparece también midriasis (expansión de la pupila como reacción a la luz tenue para intensificar la agudeza visual), a veces se produce ceguera y secreción lacrimal – Silin, F., 2023, reportó casos de ceguera temporal que se manifestaban atropellando los postes de los alambrados y excreciones purulentas en los ojos -, profuso ptialismo (aumento exagerado de la secreción salival) y aquinesia ruminal (falta, pérdida o ausencia de movimiento), micción frecuente de orina incolora y en ocasiones manifestaciones de cólico, así como meteorismo y emisión de escasas cantidades de fecas fluidas (Parada Navarro, R. 2016). Los nitratos ingeridos pueden irritar directamente a la mucosa gastrointestinal y producir dolor abdominal y diarrea (Vivas Garay, J., 2008 a), ya que, ejercen acción cáustica directa sobre la mucosa digestiva, y la ingestión de cantidades suficientemente grandes produce gastroenteritis (Blood, D. etal., 1988). El dolor se manifiesta tratando de patearse la panza. Respecto al color de la defecación hay discrepancia entre los profesionales consultados. Mientras que los autores colombianos (Guerra M., Z., 2000 y un informe del ICA, 2010, entre otros) manifiestan como una señal clínica muy importante al color café – rojizo de la materia fecal inmediatamente después de su defecación o pasados los 15 minutos, Turinetto, N. (2023) y Ferrari, O. (2023) observaron que las fecas eran de un color verde brillante (Fotografía 11) en los vacunos afectados.
Fotografía 11. Feca de color verde brillante de consistencia normal. Evacuada por un vacuno con intoxicación comprobada. Fuente: Ferrari, O., 2023. Gualeguay, Pcia. de Entre Ríos.
La apariencia específica y el color del excremento puede variar y no es un indicador confiable para diagnosticar la intoxicación.
Los signos de intoxicación por nitrito, normalmente, aparecen de manera súbita debido a la hipoxia tisular (deficiencia de oxígeno en la sangre) y a la presión arterial baja como consecuencia de la vasodilatación (Vivas Garay, J., 2008 a). El examen clínico revela taquicardia y pulso débil; las mucosas, inicialmente pálidas, se tornan paulatinamente cianóticas, pero, es posible observar una tonalidad café en las mismas, especialmente al examinar el vestíbulo vaginal (Fotografía 12).
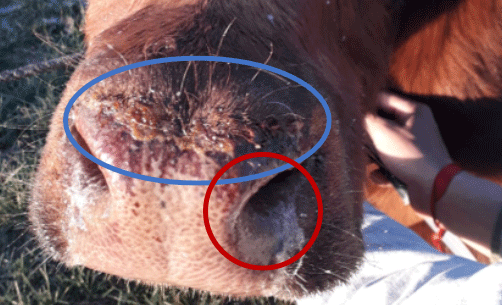
Al acentuarse el problema hay fasciculaciones (contracciones musculares menores en el área) y temblores, debilidad, ataxia, respiración a boca abierta y finalmente postración e hipotermia (disminución de la temperatura del cuerpo por debajo de lo normal) (Parada Navarro, R., 2016). Sin embargo, en numerosos casos de intoxicación por nitratos-nitritos se observaron signos de hipertermia como llagas en el morro y ubres agrietadas de color oscuro (Ferrari, O., 2023. Fotografía 13).
Fotografía 12. Vestíbulo vaginal y ubre de tonalidad oscura. Fuente: Ferrari, O., 2023. Gualeguay, Pcia. de Entre Ríos.
Fotografía 13.Llagas típicas de estado febril y mucosidad abundante. Fuente: Ferrari, O., 2023. Gualeguay, Pcia de Entre Ríos.
El ejercicio causa exacerbación de estos signos. Se producen temblores, colapso, coma y convulsiones crónicas en las fases finales de la intoxicación.
Los animales anémicos y desnutridos son más sensibles a una intoxicación aguda por nitritos, al tener menos hemoglobina disponible, esta se va a transformar mucho más rápido de metahemoglobina (Perusia, O. y Rodríguez Armesto, R., 2017). La muerte sobreviene entre 12 y 24 horas de haberse advertido los primeros signos. Los cadáveres presentan lesiones propias de la muerte por asfixia y la sangre poco coagulable (pero, según Martínez Marín, A. y Sánchez Cárdenas, J., 2007, coagula normalmente) presenta la coloración rojo - café o achocolatada que le confiere la metahemoglobina. Dicha coloración también puede observarse en la musculatura, por oxidación de la mioglobina; y en oportunidades también en órganos como el pulmón. La tonalidad de la sangre desaparece a las 5 - 6 horas de producirse la muerte y de los músculos por la reducción post - mortem espontánea del hierro de la metahemoglobina y metamioglobina (Parada Navarro, R., 2016). Además, se observa: hidrotórax, engrosamiento pleural, hemorragias, ascitis (acumulación de líquido en el espacio que existe entre el revestimiento del abdomen y los órganos abdominales), congestión en el hígado, bazo, corazón y riñones. Pueden presentarse hemorragias petequiales en el músculo cardíaco y en la tráquea, congestión vascular general con grados variables de la misma en el rumen y en el abomaso (Blood, D. et al., 1988). En el cadáver se aprecian evidencias de haberse producido profusa salivación y descargas nasales. Los pulmones están uniformemente congestivos, con abundante líquido espumoso en la tráquea y en los bronquios, y lesiones hemorrágicas de diversa magnitud en la pleura y en el peritoneo. Pueden existir zonas de hiperemia (aumento de sangre) en la mucosa ruminal, abomasal (Fotografía 14) e intestinal especialmente del duodeno (Parada, R., 1987).
Fotografía 14. Hiperemia en la mucosa del abomaso (Perusia, O. y Rodríguez Armesto, R., 2017). Fuente: Herrera, J. 2019. Ilustración didáctica.

Subaguda: la concentración de metahemoglobina se encuentra en torno al 50%. Los signos son debidos al nitrato y al nitrito, se advierte salivación, lagrimeo, rechinar de dientes, dolor producido por un cólico abdominal y diarrea. También puede observarse debilidad, ataxia (que consiste en el control muscular deficiente que provoca movimientos torpes voluntarios. Puede causar dificultades para caminar y mantener el equilibrio), temblor muscular, convulsiones, elevado ritmo cardíaco y respiración dificultosa. Pueden ocurrir abortos algunos días (de 2 a más de 21 días) después de la recuperación de los animales debido a la muerte fetal por hipoxia (es un estado de deficiencia de oxígeno en la sangre). Las hembras gestantes a término paren animales débiles (Martínez Marín, A. y Sánchez Cárdenas, J., 2007). En los casos de presentación tardía, la aparición de los signos suele ser precedida de abortos pues, siendo la hemoglobina fetal más lábil al efecto oxidante del nitrito que la hemoglobina materna, la asfixia mortal en los fetos suele presentarse antes de la aparición de los signos en la madre (Parada Navarro, R., 2016). Los nitritos, además, son vasodilatadores y ello afectaría la circulación sanguínea materna y fetal (Campero, C et al., 2017). De hecho, es posible que el aborto constituya la única evidencia de una intoxicación subclínica por nitrato. Las concentraciones superiores al 0,5% de la materia seca en el forraje y de 400 ppm en el agua pueden ser nocivas para el ganado vacuno gestante. Puede haber abortos en los casos leves o aparentemente no clínicos en el ganado vacuno a los cinco días posteriores a la exposición. El estrés hipóxico (no llega suficiente oxígeno al cerebro) en el feto puede agravar otras causas de aborto (Smith, B., 2010). Además, se ha corroborado que las raciones con elevadas concentraciones de nitratos hacen que se reduzcan los niveles de progesterona en vacas cíclicas y recién preñadas, interfiriendo con la implantación del ovocito en el útero que lleva a la pérdida embrionaria por reabsorción embrionaria. Niveles iguales o superiores al 5,5% de nitratos/nitritos en la materia seca de forrajes serían suficientes para desencadenar cuadros de abortos en gestación avanzada. Los abortos, cuando se registran en el último trimestre de la gestación, están relacionados con la severa anoxia materna (falta o disminución de oxígeno en las células, en los órganos o en la sangre) que provoca la muerte fetal. Además, los nitritos cruzan la placenta y provocan una metahemoglobinemia fetal, seguida de anoxia y muerte por hipoxia. Estos abortos luego del consumo de elevadas concentraciones de nitratos en la dieta suelen presentarse como tormentas y pueden ser difíciles de diagnosticar. En los fetos, se puede determinar la concentración de nitratos en el humor acuoso ocular (Campero, C et al., 2017).
La alta concentración de nitratos, que mediante procesos de reducción ruminal se convierten en nitritos, afecta los procesos luteolíticos generando un cuerpo lúteo persistente. Los efectos del nitrato sobre la fermentación de los carbohidratos por la flora ruminal, estimulan la producción de acetato a expensas de los ácidos grasos glucogénicos. Los nitritos afectan el intercambio gaseoso por desacople ferroso en la hemoglobina impidiendo una correcta oxigenación de los tejidos. Al no haber intercambio entre oxígeno y CO2 los tejidos retienen la forma carbonada frenando la cadena de electrones y reduciendo su pool energético, de esta manera se obstruye la irrigación en las células de la granulosa (células de soporte implicadas en el desarrollo del gameto femenino en el ovario) y la síntesis de algunas sustancias como prostaglandinas, produciéndose, en consecuencia, la retención del cuerpo lúteo. Estudios realizados por diversos investigadores han demostrado que, aunque la ingestión de nitratos sea en bajas dosis, lleva a problemas reproductivos cuando lametahemoglobinemia alcanza un 30% (Campos, R. y Hernández, E., 2008). Los terneros afectados por la intoxicación por nitrato suelen nacer 3 - 4 semanas antes de lo previsto y muchos mueren a las 18 - 24 horas del nacimiento, pudiendo manifestar convulsiones (Parada Navarro, R., 2016).
Crónica: la metahemoglobina se sitúa en torno al 10 al 20%. Tras la ingestiónprolongada de bajas cantidades de nitrato (del orden del 0,5 al 1,0% de la materia seca ofrecida) puede presentarse un descenso en la producción de leche (vacas que producían 20 litros/día de leche pueden producir de 2 a 3 litros/día). Productores lecheros sostienen que la arteria mamaria adquiere un color azulado. También se observa disminución de peso, hipotiroidismo (con o sin bocio clínico),hipovitaminosis A (que puede ser una causa de abortos -Cariola, A., 2022-). Campero, C. et al., 2017. describe “Se mencionan además en la bibliografía, reportes de hipovitaminosis A congénita en bovinos, caracterizada con altas tasas de mortalidad perinatal en sistemas de cría extensiva pastoril en Australia (Hill, B. et al., 2009). Los terneros nacidos manifestaban ataxia (consiste en el control muscular deficiente que provoca movimientos torpes voluntarios. Puede causar dificultades para caminar, para mantener el equilibrio, para tragar y en los movimientos oculares), dificultad para mamar, ceguera y depresión. Histopatológicamente se determinaron lesiones degenerativas del nervio óptico y metaplasia escamosa de los conductos interlobulares de las glándulas parótidas, descriptas como lesiones características de esta hipovitaminosis. Si bien esta presentación es infrecuente, el SDVE del INTA Balcarce registró un episodio con las mismas características durante el año 2016, en un tambo de la Provincia de Córdoba, donde el 30% de los terneros nacidos manifestaban debilidad y ceguera y morían a las 72 horas. Eran hijos de vaquillonas que no habían recibido forraje fresco desde su recría (Odriozola, E., comunicación personal). Es un dato anamnésico (recopilación de datos sobre el paciente) a tener en cuenta para relacionarlo con estos casos, ya que suele ocurrir en animales en crecimiento consumiendo raciones deficientes de vitamina A o de carotenos por un tiempo prolongado, como son las pasturas luego de períodos de sequía, forrajes conservados o dietas altas en granos (Donkersgoed J. and Clark, E., 1988)”.
Se observa, además, un aumento de la susceptibilidad a enfermedades infecciosas, subfertilidad y aborto, en distintas combinaciones clínicas. Si los vientres consumen forrajes con un nivel tóxico de nitratos pueden presentarse como tormentas (Hixon, D. 1991). Además, ocurren con frecuencia problemas reproductivos, por problemas de anidación del óvulo fecundado, por abortos o por el nacimiento de crías prematuras que mueren en alto porcentaje. Las que sobreviven tienen un tamaño mucho más pequeño que las hijas de progenitoras que no han sufrido intoxicación.
Las manifestaciones observadas se corresponden con un efecto conjunto del nitrato, nitrito y amoníaco. Los síntomas son: letargia, consumo de alimentos deprimido, pica (se manifiesta por la ingesta persistente y compulsiva de sustancias no comestibles como tierra o materia fecal), cierta coloración oscura de las mucosas, menor ritmo de crecimiento, reducción de la fertilidad (mayor número de días abiertos por fallos en la implantación embrionaria y por reabsorciones tempranas debido a la reducción del nivel de progesterona sanguínea), y menor producción de leche con alteración de su calidad físico - química. Los signos productivos y reproductivos se relacionan con una reducción del estado energético corporal por la concentración excesiva de amoníaco en el rumen (que conlleva un mayor gasto de energía para su detoxificación a urea) y la alteración de los productos finales de la digestión (acético, propiónico y butírico) (Martínez Marín, A. y Sánchez Cárdenas, J., 2007).
Recomendaciones de manejo generales
- Si no se ha sembrado aún y se sospecha que hay una alta concentración de nitratos en el suelo, hay que realizar un análisis del mismo. En caso de presentar un valor alto, no realizar una fertilización nitrogenada.
- Ante la sospecha que el forraje esté tóxico realizar el test con Difenilamina y confirmar con un análisis de laboratorio.
- Es conveniente cuidar la sanidad del forraje, ya que las enfermedades de las plantas pueden ocasionar acúmulo de nitratos por interrupción del crecimiento.
- Realizar el primer pastoreo con animales “controles”: si no existe la alternativa de monitorear la concentración de nitrato en la planta, ingresar a los forrajes riesgosos con algunos animales de bajo valor y observar su comportamiento durante las primeras seis horas de pastoreo. En muchas oportunidades dejan de pastorear ante un forraje tóxico y orinan con frecuencia. Sobre la base de su evolución se decidirá pastorear con el resto de los animales.
- Evitar el ingreso de animales “hambreados”: la intoxicación se produce más por la velocidad de consumo que por la cantidad de nitrato en la planta. Por lo tanto, es preciso evitar que los animales entren con hambre a consumir potreros problema. La conversión de nitrato a nitrito es relativamente rápida pero la del nitrito a amoníaco es lenta. Por ello, la ingestión veloz de una cantidad importante de forraje rico en nitrato eleva la concentración ruminal de nitrito con la rápida incorporación de este al torrente circulatorio con la consecuente aparición de los síntomas de intoxicación.
- Comienzo del consumo: inicialmente, realizar los pastoreos de una o dos horas durante los primeros días, aumentando las horas de pastoreo los primeros seis a ocho días, para permitir el acostumbramiento de la flora ruminal a la utilización de alta concentración de nitrato y poder metabolizarlo. El microbiota ruminal puede adaptarse en un lapso aproximado de cinco días. Ello mejora la eficiencia de conversión del nitrato en amoníaco de 3 a 5 veces sobre el valor previo.
- Es un proceso muy condicionado por las características específicas de cada individuo y de su microbiota ruminal. Debido a ello, la toxicidad de los nitratos es muy variable, existiendo una enorme susceptibilidad individual (Tarazona Laforga, J., 1985). No se han observados signos de intoxicación en terneros de muy corta edad al pie de la madre. Este hallazgo puede estar relacionado con la falta de reducción cuantitativa de nitrato a nitrito en animales no rumiantes (Elika. Alimentación animal, 2017).
- Utilización de suplementación energética al 0,5% del total de la materia seca ofrecida. Es aconsejable suplementar previamente a los animales con una fuente energética (por ejemplo, grano de maíz partido) para favorecer la acción detoxificante de la flora ruminal y poder así utilizar el exceso del nitrato presente en la ración y evitar su absorción a través de la pared ruminal. Deben tomarse las precauciones necesarias para evitar la acidosis ruminal. Cuando los nitratos se administran junto con hidratos de carbono o henos de alta calidad, se acelera el paso de nitratos a amoníaco, con lo cual la posibilidad de que se acumulen nitritos disminuye.
- Se sugiere realizar encierre nocturno dando rollo (heno) para consumo.
- No adicionar urea a la ración.
- Consumo durante la tarde. Es conveniente pastorear durante la tarde, ya que a esa hora disminuye la concentración de nitratos en la planta que se acumularon durante la noche. También aumenta la luminosidad que favorece el accionar de la enzima nitrato reductasa y el porcentaje de carbohidratos del forraje. No hay que realizar un pastoreo nocturno ni tampoco a la mañana temprano. En la región central de la Argentina (Pampa Húmeda y sur del Litoral es conveniente comenzar a pastorear después de las 10 a.m.).
- Hay que manejar a los bovinos sin causarles estrés.
- En condiciones climáticas frías, los vacunos son más susceptibles (Mieres, J. y La Manna, A., 2000)
- Evitar el ingreso inmediato después de lluvias: en ese momento suelen registrarse los mayores niveles de nitrato en las plantas. Esperar de cinco a siete días (Mieres, J. y La Manna, A., 2000).
- Evitar el sobrepastoreo como una forma de reducir el consumo de la parte más baja de los tallos, donde se encuentra la mayor concentración de nitratos.
- Posibilitar la selección del consumo. El consumo con una carga no muy elevada permitirá que los animales elijan las hojas (menor concentración de nitrato) con respecto a los tallos (mayor concentración de nitrato), aunque vaya en detrimento de la eficiencia del pastoreo. Utilizar parcelas más grandes que lo habitual. Existe la teoría que el vacuno puede llegar a distinguir de alguna manera al forraje tóxico. En laFotografía 15, se advierte que los vacunos no han pastoreado determinadas plantas al tener la posibilidad de elegir. Notar también el cambio de color, mientras que cuando el mayor tamaño se debe a una defecación, el color es verde (Fotografía 16).
Fotografía 15. Se advierte que los animales al tener opción no consumen el forraje tóxico. Fuente: Ferrari, O., 2023. Gualeguay, Pcia. de Entre Ríos.
Fotografía 16. Diferencia de tamaño y color verde más intenso (no azulado) debido al bosteo. Fuente: Ferrari, O., 2023. Gualeguay, Pcia. de Entre Ríos.

- Evitar el pastoreo por dos a tres semanas después de la aplicación de fertilizantes nitrogenados, debido a que el riesgo se puede dar en el segundo pastoreo.
- El suministro de monensina, aun a niveles recomendados, en raciones ricas en nitrato puede precipitar la intoxicación debido a que la flora microbiana ruminal cambia bruscamente favoreciendo a las bacterias productoras de nitrito.
- El ensilar el forraje baja el nivel de nitratos sustancialmente (entre un 30 a un 50%) a través de la actividad microbiana en el proceso de ensilado. No darlo hasta que se haya estabilizado el proceso. Entre sellado y suministro deben pasar al menos 17 días (de acuerdo al cultivo).De todas maneras, hay que analizar el ensilaje antes de suministrarlo. Cuando se ensilan forrajes con un alto nivel de nitratos, a las pocas horas ocurre una fermentación anaeróbica que provoca una reducción de los mismos a óxido de nitrógeno que se elimina como un gas picante de color amarillento (Fotografía 17).
Fotografía 17. Presencia de óxido de nitrógeno. Fuente: García y Santos, C. Encuentro virtual "Aspectos a tener en cuenta sobre la intoxicación por nitritos y nitratos" Ilustración didáctica.
La henificación y el oreo no reducen el nivel de contaminación. Si el forraje originario estaba contaminado, los rollos pueden liberar el 80% del nitrato al líquido ruminal en menos de 20 minutos pues las células vegetales ya están rotas.
Si se realiza corta – picado de las hojas (pastoreo mecánico o “cero pastoreo”) darlo en el mismo día. No dejarlo calentar porque aumenta la concentración de nitratos – nitritos.
Ante cualquier duda contactarse con un médico veterinario. Es importante diferenciar el cuadro de intoxicación por nitratos – nitritos de la intoxicación con ácido cianhídrico por el consumo de plantas cianogénicas (sangre de color rojo brillante), de la hipomagnesemia, de la muerte por carbunclo y por diversas enfermedades clostridiales u otras causas de muerte súbita.
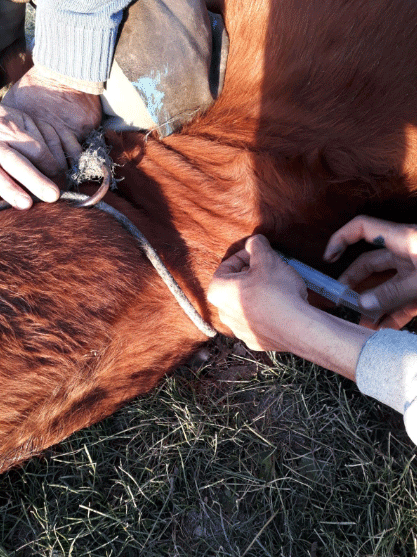
La droga de elección es el Azul de metileno al 1% (4 mg/kg de peso vivo de aplicación endovenosa lenta -recomendación de Laboratorio Azul-), junto con una sustancia cardiotónica (Fernández Meyer, A., 2023) o un antitóxico específico.
Respecto al Azul de metileno, la dosificación no tiene que exceder la dosis recomendada, ya que el Azul de metileno actúa en la misma forma que los nitritos o sea produciendo metahemoglobina. La dosis indicada provoca la reconversión rápida de la metahemoglobina en hemoglobina.
Si se considera a un antitóxico específico en la Argentina uno de los empleados es Antitóxico Azul de Río de Janeiro compuesto cada 100 ml por:
Azul de metileno 3 g, Difenilhidramina 1 g y Niketamida 10 g. Ver Fotografías 18 y 19. Generalmente es necesario dar más de un frasco.
Fotografía 18. Aplicación endovenosa de antitóxico. Fuente: Ferrari, O., 2023. Gualeguay, Pcia. de Entre Ríos.
Fotografía 19. Gentileza del Dr. Turinetto, N., 2023.
Relación de ocurrencia de casos de intoxicación asociados al consumo de avena y raigrás con exceso de nitratos. Instrumentación de posibles técnicas para evitarlos
Introducción
Durante el período otoño – invierno de 2013, luego de hacer padecido una sequía de alrededor de tres años y medio y posterior a unas lluvias ocasionales que permitieron la implantación de verdeos de invierno (avena y raigrás) prosiguieron numerosos días nublados. Estas condiciones ambientales posibilitaron el cúmulo de nitratos en el forraje en niveles de distinto grado de toxicidad.
Han demostrado distintos investigadores, que la acumulación de un nivel potencialmente tóxico es ocasional porque depende de la acción sincronizada de un conjunto de variables como son la especie del vegetal, las condiciones del ambiente, las características y la fertilidad del suelo y del estado fenológico del forraje.
En el establecimiento “La Metida”, ubicado en el 5º Distrito del Departamento Gualeguay, Pcia. de Entre Ríos (R.A.) perteneciente a Ferrari Hnos. al momento de escribir esta comunicación (fines de agosto – septiembre de 2023) se detectaron tres abortos (los vientres pastoreaban avena Elena INTA, dos hijos de vacas de primera parición, mal llamadas “vaquillonas” y con posterioridad un hijo de una vaca adulta que había sido retirada del potrero problema con anterioridad), dos terneros nacieron muy débiles imposibilitados de pararse (los vientres pastoreaban avena Elena INTA) y hubo que aplicarles 20 cc de tiamina a cada uno (vitamina B1 que ayuda a convertir los alimentos que consume el animal en energía) repartidas en dos aplicaciones (10 cc diarios) para que se pudieran parar (Fotografía 20).
Fotografía 20. Uno de los terneros imposibilitados a pararse por sí solos. Fuente: gentiliza de López, H., 2003. Capataz de “La Metida”. Gualeguay, Pcia. de Entre Ríos (R.A.).
Los terneros estaban imposibilitados de tragar, no podían mamar y no localizaban la ubre por si solos. Por lo tanto, durante varios días, hubo que ayudarlos poniéndoles los pezones de la madre en la boca y sostenerles la cabeza para que pudieran hacerlo. Al retirar la mano del operario, inmediatamente, dejaban de mamar y no buscaban o no podían localizar la ubre. No existía rechazo por parte de sus progenitoras.
Se observó que los terneros hijos de las vacas que pastorearon los forrajes con alto contenido de nitratos (sobre todo las vacas que consumían originalmente la avena Elena) tuvieron un desarrollo significativamente menor.
Una vaca de primera parición (con cría al pie) que pastoreaba raigrás anual (Bisonte) manifestó síntomas de intoxicación: babeo, agitación, nerviosismo, andar tambaleante, aislamiento voluntario y mucosas de color oscuro, la que fue tratada con antitóxico Azul de Río de Janeiro y que evolucionó favorablemente a pesar de cursar algunos días posteriores con fiebre. Otras tres pluríparas (con cría al pie) que pastoreaban raigrás anual (Jumbo) presentaron iguales síntomas y fueron tratadas de la misma manera.
“La Metida” se caracteriza por un estricto cumplimiento de un completo plan sanitario que incluye sangrados y aplicación de tres dosis anuales de vacunas reproductivas a todo el rodeo, además de tres controles sanitarios (raspajes) a los toros, siendo todos los análisis que se realizan regularmente negativos a enfermedades reproductivas.
Basándose en la literatura científica que establece que los abortos cuando se producen en el último trimestre de gestación están relacionados con una severa anoxia materna (falta o disminución de oxígeno en las células, los órganos o la sangre) que provoca la muerte fetal(Hixon, D., 1991); que los nitritos cruzan la placenta y provocan metahemoglobina fetal, seguida de anoxia y muerte fetal por hipoxia (Knight, A. and Walter, R., 2001); que los terneros nacidos manifestaban ataxia (consiste en el control muscular deficiente que provoca movimientos torpes voluntarios y puede causar dificultades para caminar, para mantener el equilibrio, para tragar y en los movimientos oculares), dificultad para mamar, ceguera y depresión (citado por Campero, C. et al., 2017) y que los animales adultos intoxicados suelen llamar la atención por su respiración dificultosa, babeo y se los observa molestos e irritables; que los dóciles suelen volverse agresivos, con dificultades de coordinación y echados con impedimento para pararse, se decidió comenzar la investigación bajo sospecha de una intoxicación por nitratos – nitritos.
Investigación
Cronología e instrumentación de medidas generales de manejo
Lo primero que ocurrió fueron los abortos de manera casi simultánea (18/6/23 y 21/6/23) de las 2 vacas de primera parición que pastoreaban la avena.
Llamó la atención el color azulado y la exuberancia de la misma. Por tal motivo se decidió realizar el test de Difenilamina, tanto en el forraje como en los fetos.
Se tomaron muestras fetales del líquido abomasal fetal, del humor vítreo, de la sangre, del líquido cefalorraquídeo en laboratorio y del forraje en el establecimiento con el test de Difenilamina, dando un resultado positivo (azul intenso).
Como este test es de orientación cualitativa, se recolectaron muestras de forraje y se enviaron al laboratorio Suelofértil dando como resultado: Nitratos (N- NO3), método Ac. Fenoldisulfónico= 4844 mg/kg.
El resultado obtenido se comparó con lo establecido por Mieres, J. y La Manna, A. en el año 2000, advirtiéndose que las vaquillonas se encontraban en el nivel de mayor peligro de toxicidad.
Cuadro 2. Interpretación y recomendación para distintos niveles de nitratos en ppm* (adaptación).
Se decidió dejar libre ese potrero a pesar que se pastoreaba según todas las recomendaciones generales mencionadas anteriormente; se llevaron los vientres a un pastizal, y aun así, el 24/7/23 se registró el tercer aborto en concordancia con lo expuesto por Martínez Marín, A. y Sánchez Cárdenas, J. en 2007. Cuya causa fue corroborada por el test de Difenilamina.
Siguiendo estrictamente las recomendaciones generales se dividió el lote de vacas con cría al pie y gestantes en los dos potreros con raigrás debido a la falta de otros recursos forrajeros, arrasados por la sequía precedente. Los mismos presentaban los siguientes valores de nitratos determinados con la misma metodología en el laboratorio Suelofértil:
- Raigrás anual Bisonte: 2160 mg/kg.
- Raigrás anual Jumbo: 1944 mg/kg.
Ambos en un nivel de riesgo que se manifestó con la sintomatología en los tres vientres restantes.
Discusión e instrumentación de posibles técnicas
Urgidos por la falta de forraje para atravesar el invierno, cuando la empresa para solventar el faltante había implantado una cantidad importante de hectáreas con avena y raigrás y ante la pérdida de eficiencia de cosecha por dejar a los vacunos seleccionar el forraje pastoreando parcelas muy extensas, donde en muchos casos comían todo el tallo se decidió emplear un pastoreo mecánico de las hojas dándolo de comer seguidamente (sin oreo previo), como se observa en la Fotografía 21.
Fotografía 21. Pastoreo mecánico de las hojas de la avena. Fuente: Ferrari, O., 2023. Gualeguay, Pcia. de Entre Ríos.
Se procedió a cortar la avena y repartirla a distintos lotes de animales teniendo el cuidado de cortar el menor porcentaje del tallo ya que la mayor concentración se encuentra en la base de los mismos (ver Fotografías 22, 23 y 24).
Fotografía 22. Despuntado mecánico de la avena. Fuente: Ferrari, O., 2023. Gualeguay, Pcia de Entre Ríos.
Fotografía 23. Altura original de la avena. Fuente: Ferrari, O., 2023.
Fotografía 24.Altura del tallo. Fuente: Ferrari, O., 2023.
El análisis del laboratorio Suelofértil empleando la misma metodología arrojó los siguientes resultados:
- Planta entera: 2993 mg/kg.
- Hoja: 1695 mg/kg.
- Tallo: 5642 mg/kg.
De acuerdo a la bibliografía consultada donde se menciona que en general el contenido de nitrato en una planta disminuye con su madurez, por lo tanto, una planta joven tiene más probabilidades de producir toxicidad (Bretschneider, G. etal., 2009), se planteó el interrogante si un rebrote podía considerarse como una planta joven o como una parte de una planta ya desarrollada.
El término rebrote se refiere al crecimiento de nuevas hojas, tallos o flores de una planta que ha sido cortada previamente No es una planta nueva ni está relacionado con el crecimiento de una planta a partir de semillas.
Cuando una planta es cortada suele mantener sus raíces intactas.
Si una planta se ha vuelto tóxica debido a la acumulación de nitratos, su rebrote, si siguen las condiciones que llevaron a la acumulación de nitratos en la planta madre siguen presentes pueden presentar los mismos riesgos de toxicidad (suceso ocurrido al Dr.Turinetto). Por tal motivo el forraje fue cortado una sola vez.
Debido que algunos profesionales plantearon el desmalezamiento casi al ras del suelo para efectuar un efecto dilución de los nitratos, los que disminuirían significativamente en la planta rebrotada, se decidió implementar dicha técnica, a modo de ensayo y como herramienta que permitiría con una mayor eficiencia de cosecha (se pasaría de un corte a tres aproximadamente).
Por otra parte, la lixiviación por precipitaciones podrían disminuir la concentración de nitratos absorbidos por las raíces, considerando algunos consultores que con el aumento de las precipitaciones primaverales disminuiría el problema. Por tal razón, las lluvias abundantes favorecerían el arrastre de NO3- hacia estratos inferiores del perfil del suelo, fuera del alcance de las raíces.
Las mayores pérdidas de nitratos, ocurren cuando hay un elevado movimiento descendente de agua en el perfil del suelo, desplazamiento que está condicionado por efectos estacionales de las precipitaciones, que a su vez determinan el volumen de drenaje. Este movimiento hacia abajo del soluto no se produce en forma homogénea, sino que siempre existe cierta dispersión de nitratos en el agua del suelo. Aunque al comienzo todo el NO3-estuviera concentrado a la misma profundidad, por ejemplo, en la superficie del suelo, al ser arrastrado por el agua tiende a dispersarse en profundidad con la misma. Sería de esperar, entonces, que cantidades relativamente pequeñas de NO3-se aprovecharán en la zona radical de un cultivo antes que el pico de concentración hubiera descendido de manera significativa.
La avena Elena INTA se implantó en un Molisol que es un suelo de color oscuro y tiene la capacidad de drenar bien.
Mientas que el raigrás Jumbo se sembró en un Argiudol vértico que se caracteriza por un alto contenido de arcilla, que le confiere una textura fina y una alta capacidad de retención de agua y nutrientes. Uno de los rasgos distintivos de este suelo es la presencia de un Horizonte B vértico caracterizado por una importante acumulación de arcilla montmorillonítica que presenta una baja tasa de infiltración en el perfil. La cantidad de arcilla puede reducir la velocidad de pasaje de agua a través del perfil a casi cero, lo que reduce la posibilidad del lavado de NO3-.
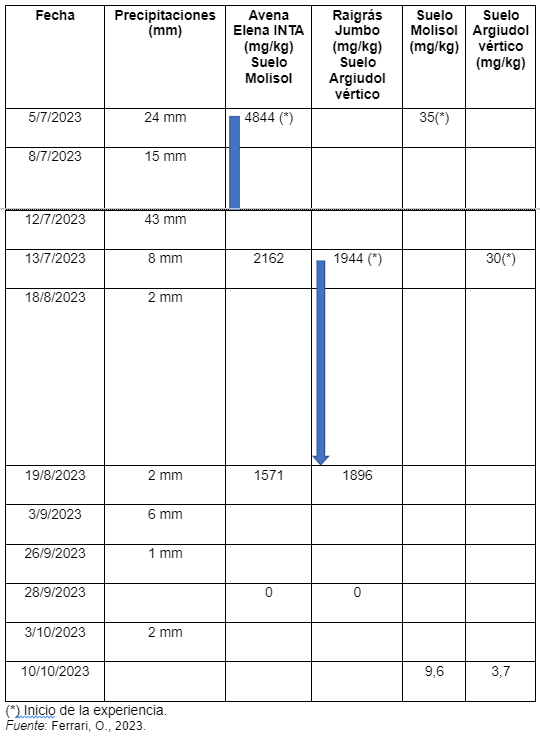
Al estar relacionada la lixiviación del nitrato edáfico con el suelo y con las precipitaciones se decidió comparar los milímetros de lluvia caídos con la concentración de nitratos que presentaba el forraje.
Para tal fin se seleccionaron las mismas plantas (marcadas con estacas) las que eran cortadas al ras y se enviaban a laboratorio para medir la concentración de nitratos.
Cuadro 3. Relación entre tipo de suelo, precipitaciones y concentración de NO3- en el forraje.
Durante la realización de la experiencia llovieron 103 mm. Es decir, continuó la sequía. Eso planteó el interrogante del descenso del nitrato en el suelo.
Consultadas distintas fuentes bibliográficas estas mencionan que la relación entre la sequía y el nivel de nitratos en el suelo es un tema complejo y puede variar dependiendo de numerosos factores, como el tipo de suelo, las prácticas agrícolas y la duración e intensidad de la sequía. En general, la sequía puede tener efectos tanto positivos como negativos en el nivel de nitratos en el suelo, y la respuesta exacta puede ser difícil de predecir.
Algunos efectos de la sequía en el nivel de nitratos edáficos incluyen:
Reducción de la lixiviación: la sequía puede reducir la cantidad de agua que se infiltra en el suelo y, por lo tanto, disminuir la lixiviación de los nitratos hacia las capas más profundas del suelo. Esto podría resultar en un aumento temporal del nivel de nitratos en los horizontes superiores del suelo.
Reducción en la mineralización: la sequía puede disminuir la actividad microbiana en el suelo debido a la falta de humedad, lo que a su vez podría disminuir la mineralización de la materia orgánica y la liberación de nitratos. Esto podría llevar a una disminución del nivel de nitratos en el suelo.
Estrés en el forraje: la sequía puede causar estrés en el forraje, lo que a su vez puede afectar su capacidad para tomar nitratos del suelo.
Probablemente estos dos últimos efectos fueron los que posibilitaron los resultados descriptos en el cuadro 3.
Conclusión
Fueron determinantes las condiciones climáticas previas a la aparición de los casos mencionados, a la inspección del ambiente y a la confirmación mediante los test de Difenilamina en las muestras fetales y en el forraje como primer indicio para confirmar la intoxicación por nitratos – nitritos cuyos valores fueron cuantificados en laboratorio.
La técnica del pastoreo mecánico suministrando el material fresco sin oreo previo fue una metodología para mitigar el problema aunque tiene la desventaja de su alto costo pero permitió demostrar que la fracción más tóxica de la planta es la base del tallo.
El desmalezado al ras para efectuar el efecto dilución de los nitratos, también se comportó como una herramienta interesante al eficientizar la cosecha pero depende de las condiciones climáticas que posibiliten los siguientes rebrotes. Si bien, la disminución de los nitratos en el suelo es un proceso natural y esencial para el ciclo del nitrógeno en los ecosistemas, la relación entre la sequía y los nitratos en el suelo depende de varios factores y los efectos pueden ser variables. En algunos casos, la sequía puede llevar a una acumulación de nitratos en el suelo, mientras que, en otros casos, podría disminuir el nivel de los mismos.
Agradecimientos
“No me avergüenza aprender, sino que me informo, pregunto y quedo muy agradecido al que me responde y nunca privé a nadie de mi agradecimiento, jamás negué haber aprendido haciendo de ello una idea original mía. Al contrario, alabo como sabio al que me ha enseñado, dando a conocer lo que aprendí de él”. Sócrates. Diálogos de Platón. Al Dr. Nicolás Turinetto por las sugerencias y el material fotográfico otorgado, a los Ings. Agrs. Marcos Cavagna y Florencia Comba por el aporte técnico suministrado y la remisión de las muestras al laboratorio y sus consecuentes resultados y al personal del establecimiento “La Metida”, Sres. Hugo López y Luciano Ántola por la vigilancia, por el tratamiento de los animales intoxicados y el cumplimiento de las tareas asignadas.