Caracterización del virus de la diarrea viral bovino subtipo 1b aislado de un caso de la enfermedad de las mucosas
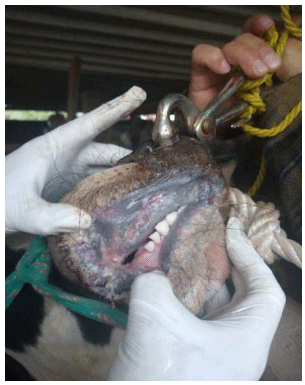
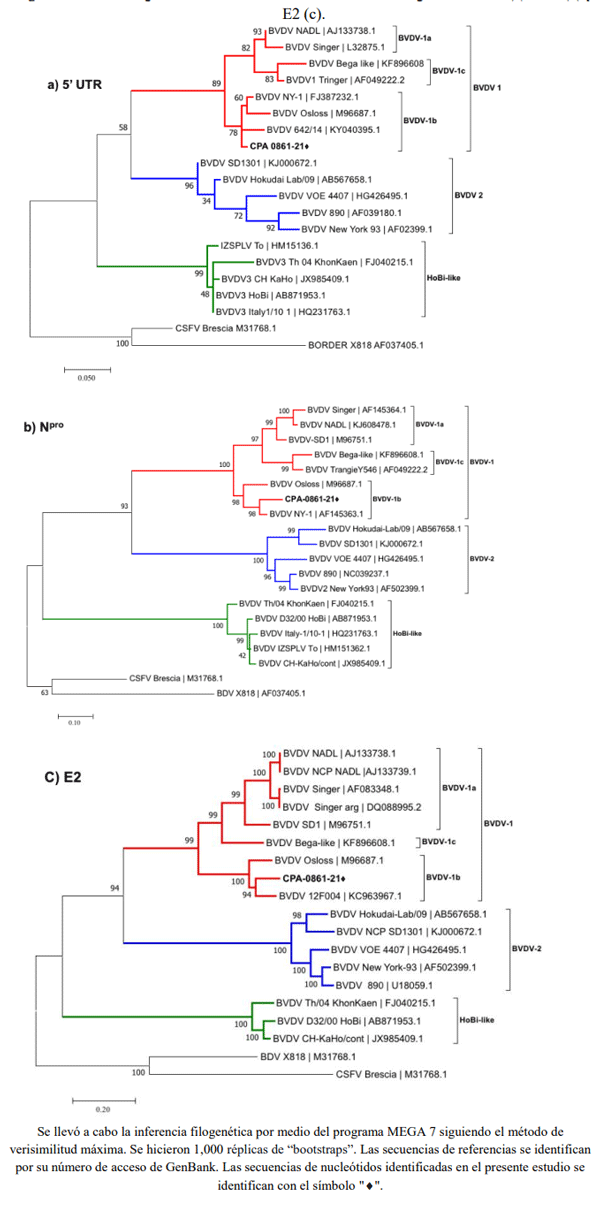
El virus de la diarrea viral bovina (VDVB) genera pérdidas significativas en la producción de bovinos. Se reporta sobre un caso fatal de la enfermedad de las mucosas en un toro de dos años. Para la detección del agente causal, se analizaron muestras de lesiones, de sangre completa y de heces mediante el RT-PCR, PCR, ELISA y aislamiento viral. Se obtuvo amplificación positiva por RT-PCR en muestras de sangre para el virus de la diarrea viral bovina (VDVB). El aislamiento viral de las muestras de las lesiones confirmó que el VDVB fue el agente causal de las manifestaciones clínicas. Una caracterización genética basada en el análisis filogenético de tres secuencias parciales identificó la presencia del subgenotipo 1b del VDVB en las muestras analizadas. El animal muestreado manifestaba signos clínicos indicando que tenía la enfermedad de las mucosas, lo cual sugiere que sufría de una infección persistente (IP) por VDVB. Este hallazgo resalta la importancia de establecer programas de control de VDVB basados en probar la presencia de IP en el ganado de México.
Palabras clave: Virus diarrea viral bovina, Ganado, Enfermedad de las mucosas, infección persistente, México.


Conflictos de interés
1. Houe H. Epidemiological features and economical importance of bovine virus diarrhoea virus (BVDV) infections. Vet Microbiol 1999;64(2-3):89-107. doi: 10.1016/s0378- 1135(98)00262-4. Erratum in: Vet Microbiol 2003;93(3):275-6.
2. Houe H. Economic impact of BVDV infection in dairies. Biologicals 2003;31(2):137- 43. doi: 10.1016/s1045-1056(03)00030-7.
3. Smith DB, Meyers G, Bukh GJ, Gould EA, Monath T, Scott-Muerhoff A, et al. Proposed revision to the taxonomy of the genus Pestivirus, family Flaviviridae. J General Virol 2017;98(8), 2106–2112. https://doi.org/10.1099/jgv.0.000873.
4. Yesilbag K, Alpay G, Becher P. Variability and global distribution of subgenotypes of bovine viral diarrhea virus. Viruses 2017;9(6):128. doi: 10.3390/v9060128.
5. Neill J. Molecular biology of bovine viral diarrhea virus. Biologicals 2013;41:2–7. doi: 10.1016/j.biologicals.2012.07.002.
6. Houe H, Lindberg A, Moenning V. Test strategies in bovine viral diarrhea virus control and eradication campaigns in Europe. J Vet Diagn Invest 2006;18(5):427-36. doi: 10.1177/104063870601800501.
7. Meyers G, Thiel HJ. Molecular characterization of pestiviruses. Adv Virus Res 1996; 47:53-118. doi: 10.1016/s0065-3527(08)60734-4.
8. Brodersen BW. Bovine viral diarrhea virus infections: manifestations of infection and recent advances in understanding pathogenesis and control. Vet Pathol 2014;51(2):453- 64. doi: 10.1177/0300985813520250.
9. Odeón AC, Leunda MR, Faverín C, Boynak N, Vena MM, Zabal O. In vitro amplification of BVDV field strains isolated in Argentina: effect of cell line and culture conditions. Rev Argent Microbiol 2009;41:79–85.
10. Uzal FA, Platnner BL, Hostetter JM. Alimentary system in pathology of domestic animals. In: Maxie, MG, editor. Jubb, Keneddy and Palmers pathology of domestic animals.;6th ed. St. Louis, Missouri: Academic Press Inc; 2016:122–130.
11. Brock KV, Grooms DL, Ridpath JF, Bolin SR. Changes in levels of viremia in cattle persistently infected with bovine viral diarrhea virus. J Vet Diagn Invest1998;10:22-26.
12. Bedekovic T, Lemo N, Lojkic I, Cvetnicz Z, Cac Z, Madic J. Bovine viral diarrhoea: A seven year old persistently infected cow - a case report. Veterinarski Arch 2012;82 (6):637-643.
13. Brownlie J. The pathways for bovine virus diarrhoea virus biotypes in the pathogenesis of disease. Arch Virol Suppl 1991;3:79-96. doi: 10.1007/978-3-7091-9153-8_10.
14. Tautz N, Thiel HJ. Cytopathogenicity of pestiviruses: cleavage of bovine viral diarrhea virus NS2-3 has to occur at a defined position to allow viral replication. Arch Virol 2003;148(7):1405-12. doi: 10.1007/s00705-003-0106-9.
15. Bolin SR, McClurkin AW, Cutlip RC, Coria MF. Severe clinical disease induced in cattle persistently infected with noncytopathic bovine viral diarrhea virus by superinfection with cytopathic bovine viral diarrhea virus. Am J Vet Res 1985;46(3):573-6.
16. Kummerer B, Tautz MN, Becher P, Thiel H, Meyers G. The genetic basis for cytopathogenicity of pestiviruses. Vet Microbiol 2000;77(1-2):117-28. doi: 10.1016/s0378-1135(00)00268-6.
17. Baker JC. The clinical manifestations of bovine viral diarrhea infection. Vet Clin North Am Food Anim Pract 1995;11(3):425-45. doi: 10.1016/s0749-0720(15)30460-6.
18. Fritzemeier J, Haas L, Liebler E, Moennig V, Greiser-Wilke I. The development of early vs. late onset mucosal disease is a consequence of two different pathogenic mechanisms. Arch Virol 1997;142(7):1335-50. doi: 10.1007/s007050050164.
19. Wilhelmsen CL, Bolin SR, Ridpath JF, Cheville NF, Kluge JP. Lesions and localization of viral antigen in tissues of cattle with experimentally induced or naturally acquired mucosal disease, or with naturally acquired chronic bovine viral diarrhea. Am J Vet Res 1991;52(2):269-75.
20. Kimura M. A simple method for estimating evolutionary rate of base substitutions through comparative studies of nucleotide sequences. J Molec Evol 1980;16:111-120.
21. Tamura K. Estimation of the number of nucleotide substitutions when there are strong transition-transversion and G + C-content biases. Molec Biol Evol 1992;9:678-687.
22. Fray MD, Paton DJ, Alenius S. The effects of bovine viral diarrhoea virus on cattle reproduction in relation to disease control. Anim Reprod Sci 2000;60-61:615-27. doi: 10.1016/s0378-4320(00)00082-8.
23. Kameyama K, Konishi M, Tsutsui T, Yamamoto T. Survey for detecting persistently infected cattle with bovine viral diarrhea in Japan J Vet Med Sci 2016;78(8):1329–31.
24. Gunn HM. Role of fomites and flies in the transmission of bovine viral diarrhoea virus. Vet Rec 1993;132(23):584-5. doi: 10.1136/vr.132.23.584.
25. Brock KV, Redman DR, Vickers ML, Irvine NE. Quantitation of bovine viral diarrhea virus in embryo transfer flush fluids collected from a persistently infected heifer. J Vet Diagn Invest 1991;3(1):99-100. doi: 10.1177/104063879100300127.
26. Lang-Ree JR, Vatn T, Kommisrud E, Loken T. Transmission of bovine viral diarrhoea virus by rectal examination. Vet Rec 1994;135(17):412-3. doi: 10.1136/vr.135.17.412.
27. Gómez-Romero N, Velázquez-Salinas L, Ridpath JF, Verdugo-Rodríguez A, BasurtoAlcántara FJ. Detection and genotyping of bovine viral diarrhea virus found contaminating commercial veterinary vaccines, cell lines, and fetal bovine serum lots originating in Mexico. Arch Virol 2021;166(7):1999-2003. doi: 10.1007/s00705-021- 05089-9.
28. Revell SC, Chasey D, Drew TD, Edwards S. Some observations on the semen of bulls persistently infected with bovine virus diarrhoea virus. Vet Rec 1988;123(5):122-5. doi: 10.1136/vr.123.5.122.
29. Grooms DL, Ward LA, Brock KV. Morphologic changes and immunohistochemical detection of viral antigen in ovaries from cattle persistently infected with bovine viral diarrhea virus. Am J Vet Res 1996;57(6):830-3.
30. Meyling A, Jensen AM Transmission of bovine virus diarrhoea virus (BVDV) by artificial insemination (AI) with semen from a persistently-infected bull. Vet Microbiol 1988;17(2):97-105. doi: 10.1016/0378-1135(88)90001-6.
31. Roeder PL, Harkness JW. BVD virus infection: prospects for control. Vet Rec 1986;118(6):143-7. doi: 10.1136/vr.119.6.143.
32. Hamers C, Lecomte C, Kulcsar G , Lambot M, Pastoret PP. Persistently infected cattle stabilise bovine viral diarrhea virus leading to herd specific strains. Vet Microbiol 1998;61(3):177-82. doi: 10.1016/s0378-1135(98)00185-0.
33. Grooms DL, Brock KV, Pate JL, Day ML. Changes in ovarian follicles following acute infection with bovine viral diarrhea virus. Theriogenology. 1998;49(3):595-605. doi: 10.1016/s0093-691x(98)00010-7.
34. Ssentongo YK, Johnson RH, Smith JR. Association of bovine viral diarrhoea-mucosal disease virus with ovaritis in cattle. Aust Vet J 1980;56(6):272-3. doi: 10.1111/j.1751- 0813.1980.tb05722.x.
35. Windsor P. Abnormalities of development and pregnancy. Noakes ED, et al, editors. England, Vet Rep Obst (Tenth ed), W.B. Saunders, 2019; ISBN 9780702072338, https://doi.org/10.1016/B978-0-7020-7233-8.00009-4.
36. Gómez-Romero N, Ridpath JF, Basurto-Alcántara FJ, Verdugo-Rodríguez A. Bovine viral diarrhea virus in cattle from Mexico: Current Status. Front Vet Sci 2021;8:673577. doi: 10.3389/fvets.2021.673577.
37. Fulton RW, Whitley EM, Johnson BJ, Ridpath JF, Kapil S, Burge LJ, Cook BJ, Confer AJ. Prevalence of bovine viral diarrhea virus (BVDV) in persistently infected cattle and BVDV subtypes in affected cattle in beef herds in south central United States. Can J Vet Res 2009;73(4):283-91.
38. Gómez-Romero N, Basurto-Alcántara FJ, Verdugo-Rodríguez A, Bauermann FV, Ridpath JF, Genetic diversity of bovine viral diarrhea virus in cattle from Mexico. J Vet Diagn Invest 2017;29(3):362-365. doi: 10.1177/1040638717690187.






