Introducción
Los últimos datos oficiales sitúan la tasa de fertilidad media en vacuno de carne en el 70,5 % en España y el 74,6 % en Castilla y León (MAPA, 2018), comunidad autónoma en la que se concentra el 27 % del censo de vacas de carne de España. Una de las bases para maximizar la eficiencia reproductiva de los rebaños de vacuno de carne es garantizar la ausencia de enfermedades reproductivas. Entre estas cabe destacar las producidas por Trichomonas foetus y Campylobacter foetus subsp. veneralis (Barth, 2018), cuya patogenia y efectos negativos sobre la productividad de los rebaños son conocidos; no obstante, es habitual que la infección curse sin signos clínicos en los machos y sin afectar a la calidad seminal (Mendoza et al., 2012; Azpilicueta, 2014; Michi et al., 2016; Ortega-Mora et al., 2021). Por otra parte, uno de los principales problemas que se encuentran los técnicos de laboratorio es la gran variabilidad en el tiem - po que transcurre desde que se obtiene la muestra hasta que llega al laboratorio y su calidad seminal es finalmente analizada.
El objetivo de este trabajo fue estudiar la incidencia de Trichomonas foetus y Campylobacter foetus subsp. veneralis en sementales de ganaderías de vacuno de carne de Castilla y León, así como la evolución de la calidad seminal en el tiempo.
Material y métodos
Obtención y análisis del semen
Entre junio de 2019 y junio de 2020 se tomaron 216 muestras de esperma de otros tantos sementales de aptitud cárnica en régimen extensivo de diferentes razas (54 % limusín, 30 % charolés, 5 % rubio de Aquitania, 5 % avileño, 2 % pardo de montaña, 2 % morucho y 2 % conjunto mestizo), con al menos 4 semanas de reposo sexual, procedentes de 35 ganaderías diferentes, distribuidas por las provincias de Salamanca, Ávila y Segovia. Las muestras fueron extraídas mediante electroeyaculación (Palmer et al., 2005) por personal entrenado y experimentado, usando un electroeyaculador controlado manualmente (Pulsator IV; Lane Manufacturing, Denver, CO, USA) con una sonda rectal de 75 mm de diámetro provista de 3 electrodos orientados ventralmente. Las muestras se trasladaron al laboratorio refrigeradas (5 °C) y diluidas (Bioxcell, IMV Technologies, l’Aigle, Francia; factor de dilución 1:2), donde se atemperaron gradualmente (2 °C/min) hasta los 37 °C antes de ser sometidas a análisis computacional utilizando el sistema C.A.S.A. (Computer Assisted Sperm Analyzer, ISAS v1.2). Se observaron 10 µL de la muestra (portaobjetos, 26×76 mm; cubreobjetos, 20×20 mm) a través del objetivo 40× en un microscopio UB 200i provisto de placa calefactora ISAS 782 M (PROiSER, Valencia, España). Se determinó la concentración esper - mática y los porcentajes de espermatozoides móviles progresivos, móviles no progresivos y estáticos (Lorton, 2014). En función del momento de llegada al laboratorio, las muestras fueron analizadas a las 0 h, 24 h, 48 h, 72 h, 96 h, 120 h y 144 h tras su obtención.
Obtención y análisis del esmegma prepucial
Se tomaron muestras de esmegma prepucial de los mismos toros introduciendo raspadores plásticos en la cavidad prepucial y realizando 20-30 movimientos en sentido anteroposterior (Mendoza-Ibarra et al., 2012). El material recogido se conservó (5 ml de tampón fosfato salino, PBS, pH 7) y envió a temperatura ambiente al laboratorio (Zootecnia, Análisis Cínicos Veterinarios, Salamanca) para su análisis mediante PCR cuantitativo en tiempo real, empleando kits comerciales para T. foetus y C. foetus veneralis (Genetic PCR Solutions, España). En función de la cantidad de material genético presente en las muestras (estimado en función del número de ciclos de PCR, de un total de 45, necesarios para que la muestra sea positiva), estas se clasificaron en grados de infección bajo (> 35 ciclos), medio (28-34 ciclos) o alto (< 28 ciclos).
Análisis estadístico
Los datos de motilidad (espermatozoides progresivos móviles) frente al tiempo desde la obtención de las muestras se ajustaron a un modelo lineal logarítmico.
Los resultados de campilobacteriosis y tricomonosis (postivo/negativo) se agruparon en función de las horas transcurridas desde la obtención del semen hasta su análisis (6 h, 18 h y 24 h), descartándose las 31 muestras que llegaron al laboratorio más de 24 h después de su obtención. Se realizaron pruebas de normalidad (Shapiro-Wilk) y homogeneidad de las varianzas (Levene) antes de llevar a cabo un ANOVA del efecto de la campilobacteriosis sobre la motilidad espermática para cada grupo de horas y de la campilobacteriosis y tricomonosis sobre el volumen de esperma recogido y la concentración esper - mática. Para todos los análisis se utilizó el programa estadístico R (R Core Team, 2019).
Resultados y discusión
Se observó una incidencia de campilobacteriosis del 35 % de los animales muestreados, que contrasta con la ausencia de positivos encontrada por Mendoza-Ibarra et al. (2012) en el norte de España. De los sementales positivos observados en el presente estudio, el 97 % presentaba un alto grado de infección, frente un 3 % que presentaba un grado bajo.
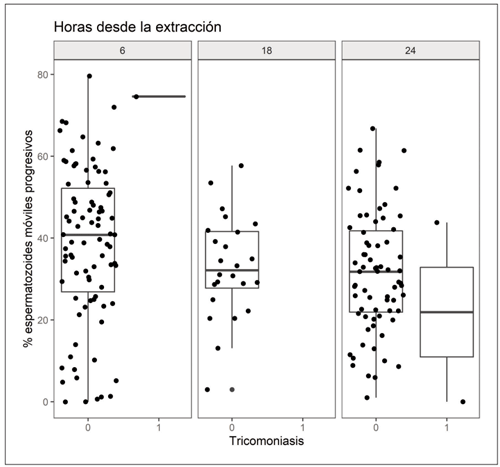
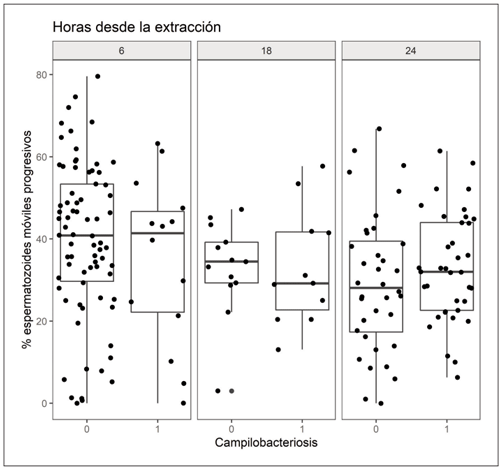
Campylobacter tiene un claro efecto negati - vo sobre el rendimiento reproductivo, ya que provoca muerte embrionaria y abortos en las vacas, dando lugar a repetición de celos (Mendoza-Ibarra et al., 2012). Sin embargo, su efecto sobre la fertilidad de los machos no es tan evidente, ya que, aunque se han descrito episodios pasajeros de infertilidad, lo más frecuente es que los toros sean portadores asintomáticos (Silveira et al., 2018). En línea con estos autores, en el presente estudio, el análisis del efecto de la positividad a Campylobacter sobre la motilidad de los espermatozoides no puso de manifiesto diferencias en el recuento de espermatozoides móviles progresivos (Tabla 1, Figura 1).
Tabla 1. Valor medio de porcentaje de espermatozoides móviles progresivos (entre paréntesis número de muestras) observados en el análisis de 185 muestras analizadas a las 6 h, 18 h y 24 h post extracción en función de la positividad a Campylobacter spp.
Figura 1. Porcentaje de espermatozoides móviles progresivos observados en muestras negativas (0) y positivas (1) a campilobacteriosis analizadas a las 6 h, 18 h y 24 h tras la extracción.
Por lo que respecta a la incidencia de tricomo - nosis, esta fue del 5 % de los animales muestreados, prevalencia inferior a la encontrada por Rojo-Montejo et al. (2014) en sementales de la raza asturiana de la montaña y Mendoza-Ibarra et al. (2012) en el norte de España. De entre los animales positivos a trico - monosis, un 83 % presentaban un alto gra do de infección y solo el 17 % un grado medio. El bajo grado de incidencia no permite extraer resultados concluyentes sobre su efecto sobre la motilidad espermática (Figura 2).
Figura 2. Porcentaje de espermatozoides móviles progresivos observados en muestras negativas (0) y positivas (1) a tricomonosis analizadas a las 6 h, 18 h y 24 h tras la extracción.
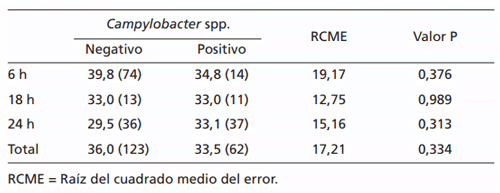
Los valores de concentración espermática y volumen de esperma recogido fueron muy variables. Así, no se observaron diferencias significativas en la concentración espermática debidas a la presencia de tricomonosis (637 y 244 × 106 espermatozoides/ml para animales negativos y positivos, respectivamente; P = 0,475; RCME = 943,2) o campilobacteriosis (580 y 733 × 106 espermatozoides/ml para animales negativos y positivos, respectivamente; P = 0,290; RCME = 941,7). Por su parte, el volumen de esperma no varió en respuesta a la tricomonosis (6,9 ml y 11,0 ml para animales negativos y positivos, respectivamente; P = 0,173; RCME = 5,10) y mostró una tendencia a disminuir en los animales positivos a campilobacteriosis (7,5 ml y 6,0 ml para animales negativos y positivos, respectivamente; P = 0,054; RCME = 5,07). No obstante, el recuento total de espermatozoides no resultó afectado de manera significativa en ningún caso (3716 y 3767 × 106 espermatozoides para animales negativos y positivos a campilobacteriosis, respectivamente; P = 0,949; RCME = 5103,6; 3758 y 2160 × 106 espermatozoides para negativos y positivos a tricomonosis, respectivamente; P = 0,588; RCME = 5099,7).
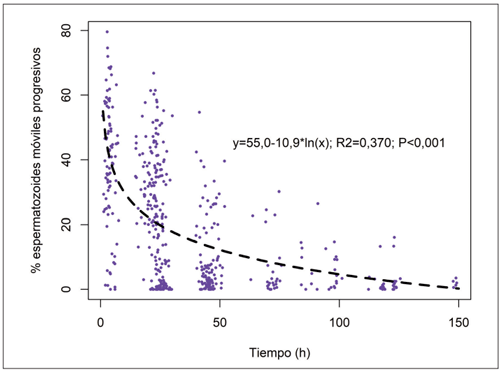
En el presente estudio se ha observado que no es infrecuente que las muestras de semen recogidas en campo para evaluar la calidad seminal lleguen al laboratorio tras un perio - do de tiempo muy variable después de obtenidas, en ocasiones más de 24 h (un 14 % de las muestras). En este sentido, resulta revelador el análisis de la evolución de la motilidad seminal frente al tiempo, sin que se hayan observado diferencias entre los animales positivos y negativos. Así, la motilidad disminuye de manera drástica en las primeras 24 h tras la extracción (Figura 3). Posteriormente sigue descendiendo de manera más moderada. Estos datos se ajustan a una ecuación logarítmica que explica cómo dismi - nuye la motilidad en función del tiempo: motilidad = 55,0 – 10,9 × ln (tiempo), [r2 = 0,370; P < 0,001), donde motilidad es el porcentaje de móviles progresivos y tiempo son las horas transcurridas desde la extracción. El valor de 55,0 se aproxima a la motilidad inicial me - dia para todas las muestras, aceptable [el porcentaje mínimo de motilidad para considerar a un toro apto se sitúa en el 30 % (Chenoweth y McPherson, 2016)], susceptible de mejorar y que muestra el margen de mejora para llegar a valores óptimos y lograr ganaderías más competitivas. Evidentemente, este valor depende en gran medida de factores como la edad, la actividad reproductiva previa, el proceso de obtención de la muestra y su potencial contaminación, así como las condiciones de conservación y análisis.
Figura 3. Representación del porcentaje de espermatozoides móviles progresivos frente al tiempo (h) transcurrido desde la obtención de las muestras.
Los animales considerados como reproductores no aptos suponen un gasto en alimentación, cuidados y tratamientos, pero resultan completamente improductivos dentro de la granja. Asimismo, los animales positivos a campilobacteriosis o tricomonosis actúan como reservorios dentro del rebaño, contribuyendo a que la enfermedad y sus efectos negativos (síntomas, riesgo sanitario, pérdidas de producción) persistan en la explotación.
La tasa de incidencia de campilobacteriosis observada en el presente estudio (35 %) hace pensar que la prevalencia de esta infección en los rebaños puede ser todavía más alta, lo que puede suponer un grave problema sanitario a tener en cuenta.
La drástica disminución de la calidad seminal con el paso del tiempo pone de manifiesto la necesidad de examinar la motilidad espermática en los momentos inmediatamente posteriores a la obtención de las muestras. Por otra parte, los valores de motilidad observados apuntan a la existencia de un gran número de toros no aptos para la reproducción en las ganaderías muestreadas. Finalmen - te, se evidencia la necesidad de realizar evaluaciones sistemáticas de la aptitud de los sementales, además de implementar programas sanitarios en las ganaderías para reducir la dispersión de estas enfermedades.
Conclusiones
Se han observado tasas de incidencia de campilobacteriosis y tricomonosis del 35 % y 5 %, respectivamente, en sementales de vacuno de carne de Castilla y León, sin que tengan una relación con la motilidad progresiva.
Agradecimientos
Al proyecto REPROVAC (“Incremento de la fertilidad de las explotaciones de ganado vacuno de carne de Castilla y León”), financiado con el Fondo Europeo Agrícola de Desarrollo Rural (Europa invierte en las zonas rurales).
A las entidades participantes [ITACyL, ASOPROVAC, AVIGASE, COBADU, COPASA, DE HEUS, GEPISA, MSD-MERCK, NANTA, NUTRIGANSE, IGM (CSIC-ULE)], y a las ganaderías que ha colaborado en el proyecto REPROVAC.
Publicado originalmente en ITEA, información técnica económica agraria: revista de la Asociación Interprofesional para el Desarrollo Agrario ( AIDA ), ISSN 1699-6887, Vol. 119, Nº. 1, 2023, págs. 54-61






.jpg&w=3840&q=75)