Introducción
Recientemente, diversos estudios han mos- trado una disminución en la capacidad repro- ductiva de los animales domésticos y de vida salvaje. Los efectos en la reproducción son debidos a condiciones ambientales (calor), con efectos económicos negativos y consecuen- cias dramáticas en la producción de alimentos (Chirault et al. 2015).
La mayor parte de los tejidos, tipos celu- lares, señales metabólicas y reacciones bio- químicas se ven afectados en mayor o menor medida por el estrés calórico. Sin embargo, hay algunos tipos celulares especialmente termo sensibles como las células germinales masculinas de los mamíferos (Salce-Ortiz et al. 2015). La exposición al calor de los ani- males domésticos resulta en un incremento de la temperatura escrotal en los machos y puede verse afectada por una diversidad de factores externos como la postura, la época del año y la desregulación de factores térmicos, los cuales han sido implicados en la patogénesis y la in- fertilidad del macho (Nezhad et al. 2013). Por otra parte, también se han considerado algunas otras causas que afectan la temperatura escro- tal como el criptorquidismo, el varicocele y la fiebre crónica (Palmer et al. 2012).
Aunque los testículos están suspendidos por el escroto fuera del cuerpo en algunas especies animales (verraco, toro, borrego y humano), la espermatogénesis puede verse alterada por la exposición a altas temperaturas debilitando la capacidad del sistema de termorregulación al inducir una mayor temperatura en los testícu- los provocando una disminución en la calidad de semen en el cerdo, toro, ratón y el humano (Wechalekar et al., 2010; Nezhad et al. 2013). Esto es debido en parte a que la mayor parte de células del testículo, son células de Sertoli y que gran parte de ellas se ven alteradas como resultado del estrés calórico, que resulta dele- téreo en dichas células. Por lo que la determi- nación del número células de Sertoli mediante la proteína de unión a andrógenos, inhibina B, factor inhibidor de Mülleriano y otros polipép- tidos que constituyen marcadores de la función de la célula de Sertoli vivas sería un buen cri- terio de evaluación del impacto perjudicial del estrés calórico en el testículo (Nezhad et al. 2013).
Estudios recientes han reportado que el es- trés calórico escrotal induce estrés oxidativo severo en algunas especies animales lo cual causa muerte de las células germinales (Li et al. 2013). El estrés oxidativo puede conducir a la infertilidad por medio de dos mecanismos: en primer lugar se produce un daño en los lípi- dos y proteínas la membrana del espermatozoi- de, provocando una reducción de la motilidad y de la capacidad de fusionarse con el ovocito y, en segundo lugar, daña el DNA del esper- ma que disminuye el desarrollo embrionario temprano, aumenta la incidencia de aborto in- voluntario y reduce la fertilidad en animales domésticos (Aitken et al. 1998; Aitken y De Luliis, 2010; Tremellen, 2008).
Con el inicio de la reproducción asistida hace aproximadamente un cuarto de siglo, surgió la necesidad desarrollar técnicas sofis- ticadas para separar espermatozoides por mo- tilidad, viabilidad y características morfológi- cas, como piedra angular en la evaluación de la fertilidad animal, aunque las tasas de éxito de estos procedimientos siguen siendo subóp- timas (Paasch et al. 2007). Inicialmente las técnicas de separación consistían en un simple lavado; técnicas de separación basadas en di- ferentes principios como migración, filtración o centrifugación en gradientes de densidad, para separar espermatozoides funcionales, ca- paces de moverse y con capacidad de fecun- dar ovocitos (Vasan, 2011). Sin embargo, estas técnicas tienen limitaciones que las hacen no siempre predecir con exactitud la fertilidad. Las técnicas de análisis seminal necesitan ser completadas con pruebas funcionales, las cua- les indirectamente miden la habilidad de que un espermatozoide esté en buenas condiciones para fecundar un ovocito. Se ha descrito que existe una asociación muy importante entre calidad espermática y el estrés oxidativo, en los mamíferos, pero rara vez se piensa en tratar el estrés oxidativo y dar un tratamiento para mejorar esta condición. Recientemente se ha visto que la selección de los espermatozoides depende de la calidad del eyaculado y esto in- cluye la determinación de especies reactivas de oxigeno (ERO), en los espermatozoides y en los leucocitos (Henkel and Schill, 2003; Oborna et al., 2009; Vasan, 2011; Alves et al. 2015). El método de quimioluminiscencia es la técnica más comúnmente empleada como una medición directa de la generación de ERO por parte de los espermatozoides. Este ensayo es capaz de cuantificar ERO tanto intracelula- res como extracelulares (Kashou et al. 2013).
Por lo que el objetivo del presente traba- jo es mostrar una visión general de los riesgos de la temperatura ambiental elevada, el estrés oxidativo y los mecanismos por los cuales se produce la infertilidad en el macho.
Efecto de la temperatura de los testículos
La literatura internacional ha reportado que la elevación de la temperatura intratesticular tiene un efecto adverso sobre la espermato- génesis, provocando la alteración de los pa- rámetros espermáticos y la apoptosis (Jung y Schuppe, 2007). Las causas principales de esta alteración son la formación de ERO que proveen cambios moleculares en el ADN, pro- teínas, lípidos y otras moléculas biológicas que contribuyen a la baja fertilidad en los ani- males (Shekarriz et al. 1995; Jung y Schuppe, 2007; El-Tohamy, 2012). Investigaciones pre- vias usando modelos animales, han sugerido que las alteraciones en las espermatogénesis debidas a la exposición de los testículos a al- tas temperaturas provocan un incremento en el metabolismo, causando en el testículo una alta demanda de oxígeno. Por lo que el flujo sanguíneo del testículo será naturalmente bajo y por consiguiente causará estrés hipóxico en las células del parénquima activando el proce- so de degeneración testicular (Galil y Setchell, 1988; Setchell, 2006; Ramires et al. 2013). El estrés calórico en los testículos de los bovinos altera él porcentaje de motilidad espermática al largo de las estaciones del año (39.15±1.98, 41.25±1.79, 33.80±2.06 y 37.30±2.02, en invierno, primavera, verano y otoño, respectiva- mente). Siendo el verano la estación del año con mayor temperatura ambiental y menor motilidad espermática (Perumal et al. 2017). En bovinos (Braford) criados en regiones tro- picales, los días calurosos aumentan la tempe- ratura testicular y pone en riesgo la espermato- génesis y la calidad seminal. Esto debido a que las altas temperaturas interfieren con el meta- bolismo oxidativo de la glucosa en las células espermáticas como resultado de la disfunción mitocondrial y la generación de ERO (Oliveira et al. 2014; Hamilton et al. 2016).
En otro estudio se determino la influencia de la estación en la obtención de semen en to- ros Bos taurus (Simmental) y concluyo que el estrés calórico del verano afectó los paráme- tros de calidad y esto podría estar relacionado con la alta peroxidación de lípidos. También se ha observado que cuando se obtiene semen de toros jóvenes en verano hay un daño oxidativo más intenso de las proteínas (Balic et al. 2012). Los aminoácidos contienen puentes disulfuro y grupos tiol que son sensibles al estrés oxida- tivo lo que conduce a la escisión de la cadena de proteínas (Jahanian et al. 2014).
En otras especies como en porcino también se ha demostrado que cuando son expuestos a estrés calórico a temperaturas en torno a 42 °C durante seis horas, se inducen cambios impor- tantes en la motilidad espermática, disminu- yéndola hasta en un 32% (Gong et al. 2017). En el ratón la hipertermia testicular transitoria también causa muerte de las células germina- les y demuestra que temperaturas elevadas (40 a 42 °C), provocan estrés y por consecuencia la inducción de genes asociados con el estrés oxidativo y la hipoxia (Catriona et al. 2009).
Existen otras causas que afectan la esper- matogénesis y la calidad espermática como son los trastornos clínicos tales como criptor- quidia y el varicocele que están implicados en la fisiopatología de la espermatogénesis, mediante la alteración del flujo de sangre tes- ticular, la hipertermia y en consecuencia es- trés oxidativo e hipoxia (Mieusset et al. 1987; Fretz y Sandlow, 2002). Existen evidencias de que el calentamiento escrotal activa las res- puestas del estrés testiculares al igual que en otros tejidos tales como: (a) la expresión de la subunidad α del factor inducible por hipoxia 1 (HIF-1α), un factor de transcripción cuyos ge- nes diana están involucrados en la vasodilatación, la angiogénesis y la glicólisis (Shweiki et al. 1992; Wenger, 2002); (b) el HIF-1α induce la expresión génica del factor de crecimiento del endotelial vascular (VEGF), un potente es- timulador de la angiogénesis y del crecimiento endotelial (Schweiki et al. 1992; Forsythe et al. 1996; Paul et al. 2009), actuando a través de la interacción con sus respectivos recepto- res: el dominio de inserción de cinasa (KDR) y la tirosina cinasa tipo fms 1 (FLT1) (Ferrara, 2004) y, (c) la activación de las proteínas de choque térmico (HSP), que son a su vez regu- ladas por factores de choque térmico (HSFs) (Feder y Hofmann, 1999). Las HSPs se des- criben como chaperoninas con funciones de protección y antiapoptóticas, involucradas en el proceso de asistencia en el plegamiento co- rrecto de proteínas mal plegadas por el estrés oxidativo y la prevención de su agregación en respuesta a la tensión térmica y oxidativa. Las HSP han sido identificadas por inmunofluores- cencia en la superficie del esperma del ratón, rata, toro, verraco y al parecer son accesibles para el marcado de las proteínas de la superfi- cie espermática con biotina y yodo radiactivo (Naaby-Hansen y Herr, 2010).
Otro factor que tiene un papel importante en la regulación de la temperatura escrotal ha sido estudiado mediante el efecto de la ener- gía en la dieta y la raza, en bovinos Angus, Simmental x Angus y Simmental, o Herford x Simmental, en donde se ha descrito que la die- ta puede afectar la termorregulación escrotal o testicular mediante la reducción de la cantidad de calor que puede ser radiada desde el cuello del escroto. Diferencias de 0.5 ºC, afectan a la calidad espermática (Coulte et al. 1988). Ade- más, se ha observado que los animales alimen- tados con dietas moderadas en energía (100% forraje; 9.110 MJ/kg) tuvieron un 52 % más de reservas espermáticas en el epidídimo y un 12% más de producción diaria de espermatozoi- des en comparación con los toros alimentados con dietas altas en energía (80% grano + 20% forraje; 13.064 MJ/kg). También se ha descri- to que los cruzamientos de Simmental tuvie- ron más reservas espermáticas en epidídimo 29.9±3.6 que la raza Angus 18.4±2.2 (Coul- ter et al. 1997). Otro estudio similar realizado con bovinos Bos indicus y Bos taurus también muestra que la disminución de la calidad es- permática está asociada con la temperatura de la superficie escrotal y la longitud del cuello escrotal (Brito et al. 2004). Estos mismos auto- res mencionan que los Bos indicus mostraron una reducción de la temperatura en la superfi- cie escrotal y por consecuencia mejor calidad de semen con respecto a la motilidad y la mor- fología normal de los espermatozoides.
Algunas de las posibles explicaciones es que la raza de toros Bos indicus tiene una ar- teria testicular con mayor longitud en propor- ción al volumen testicular y un menor espesor en la pared de la arteria testicular que pueden ser responsables de un mayor enfriamiento de sangre arterial en el cordón espermático com- parado con el Bos taurus (Brito et al. 2004; Setchell, 2006; Oliveira et al. 2014).
Las especies reactivas de oxígeno y la peroxidación de lípidos de la membrana plasmática del espermatozoide
El proceso de lipoperoxidación (LPO) en los espermatozoides ocurre durante el proceso de almacenamiento (congelación y descongela- ción) y el estrés calórico. Durante estos even- tos se produce estrés oxidativo, que conduce a la LPO de la membrana de los espermatozoi- des, resultando en una mayor permeabilidad, pérdida de la integridad de la membrana y re- ducción intracelular de enzimas antioxidantes. Causando una mayor susceptibilidad al daño oxidativo (Ross et al. 2010; Kadirvel et al. 2014).
Es conocido que los espermatozoides de los mamíferos son susceptibles a perder la moti- lidad debido a los oxidantes endógenos como una consecuencia de la LPO, que culmina en la generación de aldehídos citotóxicos como el malondialdehido y 4-hidroxinonenal (Aitken et al. 2012). En un estudio, se observó que los niveles de aldehídos registrados después de la adición de un ión ferroso a los espermatozoi- des, estaba altamente correlacionado con la competencia funcional de estas células, ya que redujo la motilidad, la viabilidad, la capacidad de los espermatozoides para una prolongada supervivencia in vitro y la competencia del es- perma para fusionarse con el ovocito (Aitken y Curry, 2011; Aitken et al. 2012).
La susceptibilidad de los espermatozoides de los rumiantes, al estrés oxidativo es una consecuencia de la abundancia de ácidos gra- sos poliinsaturados (PUFAs) en la membrana plasmática de los espermatozoides, son sensi- tivos al daño inducido por el oxígeno media- do por la LPO y la rápida pérdida de ATP que conduce al daño del axonema, principal pieza motora del flagelo de los espermatozoides y por lo tanto la motilidad espermática se ve disminuida (Bansal y Bilaspuri, 2010; Hamil- ton et al. 2016). Los PUFAs le proporcionan fluidez y flexibilidad a la membrana ayudando al espermatozoide en el acoplamiento en los eventos de fusión membranal durante la fecun- dación. Desafortunadamente, la presencia de dobles enlaces en estas moléculas las hace vul- nerables al ataque de los radicales libres y a la iniciación de la cascada de LPO. Dando como resultado la pérdida de la membrana y la inte- gridad morfológica, dañando las funciones ce- lulares y la motilidad espermática (Bansal and Bilaspuri, 2010; Bucak et al. 2009; Jahanian et al. 2014). La vitamina E es un antioxidante extracelular y es capaz de disminuir los efec- tos negativos sobre los PUFAs de los esperma- tozoides de los mamifieros, dicha vitamina es utilizada como suplemento alimenticio (Aba- visani et al. 2013).
En algunas especies animales como el macho cabrio se ha observado que la produc- ción espermática disminuye con el estrés ca- lórico y es atribuido a la interacción directa que ejerce el estrés calórico y las ERO a la membrana de las células espermáticas. Lo cual resulta en el deterioro de la fluidez, la permeabilidad de la membrana y el daño de las células germinales y los espermatozoides maduros (El-Tohamy et al. 2012a). Kadirvel et al. (2014), estudiaron la actividad enzimá- tica antioxidante y su relación con la LPO en semen de Búfalo (Bubalus bubalis), los resultados mostraron una disminución en la actividad de la super oxido dismutasa (SOD), Glutation peroxidasa (GSHPx) y glutatión (GSH). Estas enzimas forman parte del sis- tema antioxidante de la célula, y reaccionan contra los hidroperóxidos contribuyendo a la protección de los espermatozoides del daño oxidativo. La actividad de estas enzimas tuvo fuerte asociación con motilidad, integridad de la membrana y una correlación negativa con las ERO y la LPO.
Se sabe que la albúmina sérica bovina (BSA) puede sustituir a la yema de huevo en el diluyente del semen de carnero, para elimi- nar los radicales libres generados por el estrés oxidativo y protegiendo así la integridad de la membrana de los espermatozoides del choque térmico durante la congelación-descongela- ción del semen canino. Los carotenoides como beta-caroteno y licopeno también son compo- nentes importantes de la defensa antioxidante contra la peroxidación de lípidos de los esper- matozoides de la rata (Uysal y Bucak, 2007).
Para prevenir la LPO en los espermato- zoides como consecuencia del estrés calóri- co, se debe hacer un esfuerzo para desarrollar combinaciones óptimas de antioxidantes en la alimentación de los animales que refuercen la defensa antioxidante, y así prevenir la ex- cesiva generación de ERO en los espermato- zoides que esta principalmente inducida por diversos factores como: el desacoplamiento de la fosforilación oxidativa en la mitocondria, el ciclo Redox de los xenobioticos y la excesi- va actividad de NADPH oxidasa. Además las deficiencias de la dieta, la edad o los factores genéticos son factores predisponentes (Aitken et al. 1998).
Papel fisiológico de las especies reactivas de oxígeno en el sistema reproductivo del macho
Las ERO presentan efectos benéficos y dañi- nos en la función espermática, dependiendo de la naturaleza, la concentración, localización y el tiempo de exposición (Chandra et al. 2012). Durante su camino por el epidídimo el esper- matozoide adquiere la habilidad de moverse progresivamente. Sin embargo, ellos adquie- ren la habilidad para fecundar, en el tracto de la hembra a través de una serie de cambios fisio- lógicos conocidos como “capacitación”, que comprende cambios en la membrana plasmáti- ca de los espermatozoides necesarios para que se fusione con él ovocito. Durante este proce- so, los niveles de calcio intracelular, las ERO y la tirosina cinasa aumentan, dando lugar a un aumento de Monofosfato de Adenosina cíclico (AMPc). El aumento de AMPc facilita la hipe- ractivación de los espermatozoides condición por la cual son altamente móviles (Aitken, 1995). En condiciones fisiológicas, los esper- matozoides producen pequeñas concentracio- nes de ERO, las cuales son necesarias para la capacitación y la reacción acrosomal, hiperac- tivación, motilidad y fertilización (Agarwal et al. 2004; Agarwal y Sekhon, 2010).
En un estudio se reportó que co-incubando espermatozoides con bajas concentraciones de H2O2 (peróxido de hidrógeno), se estimuló la capacitación espermática, la hiperactivación y la fusión con el ovocito (Griveau et al. 1994). Estos autores confirmaron lo anterior con la adición de catalasa al inicio del proceso de capacitación y reportaron la disminución de hi- peractivación e inducción de la reacción acro- somal normal. De acuerdo con otro estudio, el anión superóxido y la generación de oxido ní- trico durante la capacitación de los espematozoides también toman parte en estos procesos (Francavilla et al. 2000). Además, la bajas con- centraciones de peroxido de hidrógeno causa fosforilación de tirosina, (este efecto parece ser general en todas las especies de mamífe- ros incluyendo al hombre), la cual resulta en la unión de las proteínas de la membrana del espermatozoide con las glicoproteínas ZP-3 en la zona pelúcida y posteriormente la fusión del espermatozoide con el ovocito (Aitken et al. 1995; Makker et al. 2009).
Los embriones producidos por fecundación de ovocitos de la raza Brahman con semen de Angus fueron más resistentes a choque térmico que los embriones producidos por fecundación de los ovocitos de Holstein con semen Angus (Block et al. 2002). En el mismo experimento, no hubo diferencias en la termotolerancia de embriones de Brahman x Holstein y Angus x Holstein. Una explicación para este fenómeno es que los transcritos acumulados en el ovoci- to son los responsables de la termotolerancia y que las diferencias en la expresión génica es probable que ocurran en las primeras etapas del desarrollo (Hansen, 2013).
Además, las ERO también juegan un papel importante en la compactación de la cromatina espermática durante la maduración del esper- matozoide a lo largo del epidídimo, formándo- se puentes disulfuro que le otorgan al núcleo espermático una estructura altamente compac- ta. Esta proteína lleva un extremo N-terminal como señal única de localización nuclear, lo que le permite desempeñar un doble papel, fa- cilitar condensación espermática de la croma- tina y al mismo tiempo proporcionar protec- ción al ADN contra el daño oxidativo (Pfeifer et al. 2001; Aitken et al. 2012).
Fuentes de especies reactivas de oxígeno en el semen
Las fuentes principales de ERO en los esper- matozoides son: células germinales inma- duras, las que presentan alguna anormalidad morfológica, células epiteliales, espermatozoi- des con residuos citoplasmáticos y las produ- cidas por contaminaciones con leucocitos (leu- cocitoespermia >106 leucocitos/ml de semen), particularmente neutrofilos y macrófagos (Ja- hanian et al. 2014). Los leucocitos activados son una fuente muy importante de ERO. Fisio- lógicamente producen hasta 1000 veces más ERO que los mismos espermatozoides, debido a la necesidad fisiológica de liberar grandes cantidades de superóxido para el ataque de patógenos, lo que desencadena una gran toxi- cidad hacia los espermatozoides (Ford, 2004; Henkel, 2011). Además, existe una correlación positiva entre la producción de ERO y citoci- nas proinflamatorias en el plasma seminal, ta- les como Interleucina IL-, IL-8 y Factor de ne- crosis tumoral-α (TNF-α) (Tremellen, 2008).
Otra fuente principal de ERO es la reduc- ción de oxígeno por el sistema Redox (reaccio- nes de reducción y oxidación), de la membrana plasmática, destinado a reducir el potencial de transporte a través de la membrana plasmática de la célula (de Grey, 2003). La generación de ERO por los espermatozoides ocurre mediante dos vías: i.) el sistema Nicotinamida Adenina Dinucleótido Fosfato (NADPH)-oxidasa, a ni- vel de la membrana plasmática de los esper- matozoides, que genera anión superoxido y, ii.) la oxido-reductasa NADPH-dependiente a nivel mitocondrial (Makker et al. 2009).
El análisis de semen es un componente esencial en la fertilidad del macho. Para su es- tudio existen técnicas: manuales, automáticas y asistidas por computadora (sistema CASA para análisis de esperma automático). Una parte inherente dentro de estos estudios es la determinación de leucocitos mediante Espec- troscopia de Resonancia Paramagnética Elec- trónica que puede detectar concentraciones su- peróxido generadas hasta por 2000 leucocitos activados/ml. Además, existen otros métodos de detección de ERO por luminiscencia e in- munocitoquímica (Ford, 2004). También, los leucocitos puedes ser removidos de la muestra espermática usando perlas de magnéticas recu- biertas con anticuerpos contra el antígeno leu- cocitario común CD45, frecuentemente com- binado con anti-CD15 para una mayor eficacia contra neutrófilos y monocitos (Richer y Ford, 2001; Ford, 2004).
Estrés oxidativo en espermatozoides
La gran paradoja de la respiración aeróbica es que el oxígeno, es esencial para la produc- ción de energía en muchos tipos de células in- cluyendo los gametos. Sin embargo, también es dañino debido a que produce ERO, en los espermatozoides cuando son manipulados en condiciones in vitro durante las técnicas de reproducción asistida, estas células corren el riesgo de generar y ser expuestas a altos nive- les de ERO (Du Plessis et al. 2008).
En investigaciones anteriores, no había pruebas de que el sexado de espermatozoides tenía cualidades de hiperactivación, una ca- racterística de la capacitación que podría pro- mover la fecundación del ovocito. Además, en ese mismo estudio, se demostró de que la mo- tilidad espermática del semen de la raza cebú (Bos indicus) tuvo un efecto negativo menor por el proceso de sexado en comparación con el semen sexado de toros Bos taurus (López et al. 2015).
Durante el proceso de sexado de esperma- tozoides con citometría de flujo se provoca un estrés en los espermatozoides que causa un au- mento en la peroxidación de lípidos de la mem- brana. La defensa natural contra la oxidación proporcionada por plasma seminal se pierde por la alta dilución que hay que realizar duran- te la clasificación. Esto puede ser más evidente cuando los espermatozoides son procesados para su almacenamiento en nitrógeno líquido que aumenta la peroxidación de lípidos de la membrana. La manipulación de espermatozoi- des como el enfriamiento, preservación líquida a largo plazo y su congelación causan daños en la estructura y a fisiología y por consecuencia la LPO (Castro et al. 2016; Hu et al. 2016). Una de las principales razones en la reducción de la supervivencia de los espermatozoides es la presencia de ERO. Las ERO son conocidas por causar una disminución de la motilidad e inducir pre- capacitación, así como dañar al sistema de membrana por oxidación de los lí- pidos, especialmente cuando el contenido de plasma seminal se reduce después de extensa de dilución y lavado de los espermatozoides. Varios pasos en el proceso de clasificación de los espermatozoides llevan a la producción de las ERO, pero su efecto negativo sobre la pe- roxidación de lípidos se puede minimizar por la suplementación de medio con sustancias an- tioxidantes como con el pretratamiento esper- mático con glutatión (GSH) que mantiene la viabilidad y la fertilidad al reducir la apoptosis mejorando el desarrollo embrionario (Espino- sa y Córdova, 2013; Hu et al. 2016).
La espermatogénesis es un proceso suma- mente activo, capaz de generar aproximada- mente 1.000 espermatozoides por segundo.
Las altas tasas de división celular inherente a este proceso implican correspondientemente altas tasas de consumo de oxígeno mitocon- drial por el epitelio germinal. Sin embargo, la vascularización de los testículos es reducida lo que provoca que la concentración de oxígeno en este tejido sea baja. Por lo que la baja con- centración de oxígeno que caracteriza a este tejido, podría ser un componente importante del mecanismo por el cual el testículo se prote- ge de los daños que causan los radicales libres (Aitken and Roman, 2008).
Estudios previos han demostrado que las células espermáticas tienen menor frecuencia de mutaciones en comparación con las células somáticas. Sin embargo, las células germina- les están continuamente afectadas de forma negativa por factores endógenos y exógenos como las ERO afectando al ADN (Celino et al. 2011). También, se menciona que los esper- matozoides son altamente sensibles a daños inducidos por las ERO, mientras que las esper- matogonias son consideradas como tolerantes a las ERO. Se ha descrito que cuando se expo- nen ratones a estrés calórico leve puede pro- vocar estrés oxidativo, con un gran numero de células germinales apoptóticas, mientras que en las espermatogonias la apoptosis es poco frecuente (Paul et al. 2009).
Efecto de las especies reactivas de oxígeno en la motilidad espermática
La patología que subyace detrás de la capaci- dad de las ERO para reducir la motilidad del esperma fue informada por Jones et al. (1979), él menciona que las ERO inducen peroxida- ción de la membrana de esperma, disminuyen- do la flexibilidad y por lo tanto el movimiento de la cola. La membrana del esperma es vul- nerable a este tipo de daño, ya que contienen grandes cantidades de ácidos grasos insatura- dos. Las ERO dañan directamente a las mito- condrias, disminuyendo la energía disponible e impidiendo la movilidad del espermatozoide. Por cualquier mecanismo, el estrés oxidativo afecta la motilidad del esperma y como resul- tado una menor cantidad de esperma alcanza- ran el ovocito para la fecundación (Kao et al. 2008; Tremellen, 2008).
El vínculo entre las ERO y su efecto so- bre la motilidad espermática es debido a una cascada de eventos que resultan en una dismi- nución en la fosforilación de las proteínas del axonema y por consecuencia la inmoviliza- ción del espermatozoide, ambos procesos es- tán asociados con la reducción en la fluidez de membrana (El-Tohamy, 2012). Otra hipótesis es que el H2O2 puede difundirse a través de las membranas en las células e inhibir la activi- dad de algunas enzimas tales como la glucosa-6-fosfato-deshidrogenasa (G6PD). Esta enzi- ma controla la velocidad de flujo de la glucosa a través de la vía hexosa monofosfato que a su vez, controla la disponibilidad intracelular de fosfato de dinucleótido de nicotinamida y adenina (NADPH). Esto a su vez es utiliza- do como una fuente de electrones por los es- permatozoides para la generación de la ERO por un sistema de enzima conocida como la NADPH oxidasa (Aitken, 1997). La inhibición de la G6PD conduce a una disminución en la disponibilidad de NADPH y una acumulación concomitante de glutatión oxidado y glutatión reducido. Esto puede reducir las defensas an- tioxidantes de los espermatozoides y aumentar la peroxidación de los fosfolípidos de la mem- brana (El-Tohamy, 2012).
En algunos estudios se ha propuesto que las ERO afectan negativamente la función esper- mática, tanto in vivo como in vitro. Como es el caso de las técnicas de preparación de es- permas para las tecnologías de reproducción asistida (TRA), son causas potenciales para la producción de ERO. Algunos estudios han relacionado la concentración de H2O2 exógeno con los parámetros de motilidad espermática de los niveles de las ERO y de óxido nítrico (NO) para reiterar la importancia de reducir al mínimo los niveles de ERO en TRA. Los resultados mostraron que el H2O2 afectó los parámetros del esperma. El H2O2 fue perjudi- cial para la motilidad y resultó en un aumento significativo en la generación de ERO y los ni- veles de NO. Además, se observo un aumento significativo en células estáticas. Aunque este experimento demostró la necesidad de reducir los niveles de ERO exógeno durante TRA, no ilustran la relación causa-efecto de las ERO intracelulares y los niveles de NO con la moti- lidad de los espermatozoides. Por lo que es de vital importancia realizar investigaciones adi- cionales para definir un nivel patológico de las ERO (Du Plessis et al. 2010).
Para confirmar los efectos negativos de las ERO en la motilidad espermática en Brasil, se llevó a cabo un estudio bajo condiciones tropicales con toros Bradford (5/8 Hereford x 3/8 Nelore), en donde se evaluó el efecto estacional del medio ambiente en la calidad espermática de los sementales. Este estudio mostró que el gradiente de temperatura (0,9 °C), tuvo una correlación positiva entre moti- lidad y vigor (espermático), con valores 0,36 y 0,35 respectivamente. Mientras que el pro- medio de motilidad masal fue de (2,58) y una motilidad de (52,64 %) y un vigor de (2,7) del semen disminuyo en el verano cuando fue comparado con otras estaciones (Oliveira et al. 2014). En otro estudio Coulther (1988), reporto una motilidad espermática del 42 % y a un gradiente de temperatura de 2 a 4 °C. Fuerst-Waltl et al. (2006), también reportan en toros Simmental australianos un prome- dio de motilidad espermática de 66,6% y un vigor de 2,93 después de tres colecciones de semen, las cuales corresponden a el periodo de maduración espermática en el epidídimo. En las regiones con valores altos de índice de temperatura y humedad, los testículos tienden a estar más afectados, debido a los largos pe- riodos de tiempo que pasan los animales du- rante el día. Las altas temperaturas provocan dificultad para disipar el calor corporal duran- te la noche.
El uso de modelos experimentales que ajus- tan la radiación y la velocidad del viento son fundamentales para gestionar la mitigación ambiental y proteger a los animales, garanti- zando el confort térmico (Mader et al. 2010).
Daño del ADN por las especies reactivas de oxígeno
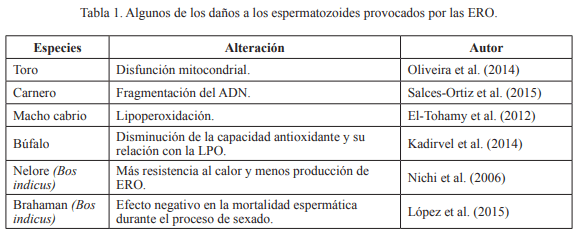
Los radicales libres tienen la capacidad de dañar directamente el ADN del esper- ma al atacar las bases púricas y pirimidi- cas y el esqueleto de la desoxirribosa. Nor- malmente, el ADN del esperma está es- trechamente empaquetado por protaminas que lo protegen del ataque de los radicales li- bres. Sin embargo, los machos infértiles a me- nudo muestran deficiencias de protaminación, dejando el ADN del esperma particularmente vulnerable al ataque de las ERO (Oliva, 2006). Alternativamente, los radicales libres pueden iniciar la apoptosis dentro del esperma, que conduce a la degradación enzimática del ADN mediado por las caspasas (Tabla 1) (Kao et al. 2008).
Existen dos factores por los cuales el ma- terial genético está protegido del daño oxi- dativo: empaquetamiento muy característico del ADN, y los antioxidantes presentes en el plasma seminal. Los antioxidantes se cla- sifican en enzimáticos y no enzimáticos. Su mecanismo de acción es mediante la depen- dencia de iones y metales (Cu, Mn, Se y Zn) como el superóxido dismutasa (SOD), catala- sa (CAT), glutatión peroxidasa (GPx) y gluta- tión reductasa (GR), mientas que el control no enzimático incluye a los antioxidantes como el glutatión, ácido ascórbico y ácido úrico, así como compuestos hidrosolubles y la vitami- na E y los carotenos como liposolubles. El mecanismo de los antioxidantes se clasifica en tres vías; defensas primarias (previenen la formación de radicales libres), defensas secundarias (inactivan o barren los radicales libres) y defensas terciarias (reparan el daño oxidativo en el ADN) (Gutteridge y Michell, 1999; Perumal, 2014).
Estudios en los que los espermatozoides fue- ron expuestos a ERO artificialmente, resulto en un aumento significativo de daño al ADN, cau- sando modificaciones a las bases, produciendo deleciones, cambios en el marco de lectura y reor- denamientos cromosómicos. El estrés oxidativo también se ha correlacionado con alta frecuencia de rompimientos de las cadenas dobles y sencillas del ADN (El-Tohamy, 2012).
La confirmación de la relación entre el estrés oxidativo y el daño al ADN de los espermatozoi- des se ha realizado mediante diversas técnicas como; marcaje de los cortes finales con dUTP me- diado por la deoxinucleotidil transferasa terminal (TUNEL), ensayo de la estructura de la cromatina espermática (SCSA) y determinación de subpro- ductos de la oxidación del ADN, 8-hidroxideoxi- guanosina (8-OHdG), (Tremellen, 2008).
En un trabajo reciente se ha observado que la fragmentación del ADN del esperma de carnero aumenta a una temperatura de 30 °C y a un índice de temperatura-humedad >22, en algunas etapas de la espermatogénesis en los animales que llevan el genotipo GG-660 de la -660G/C SNP (polimorfismo de un solo nucleótido) (Rs397514116). Como el genotipo GG- 660 ha sido asociado con niveles bajos de expre- sión las proteínas de choque calórico HSP90AA1en condiciones de estrés calórico, se ha sugerido que cantidades subóptimas de ARNm de HS- P90AA1 provocan en el ADN de estos animales mayor susceptibilidad a ser fragmentado (Salces- Ortiz et al. 2015).
La evaluación anticipada del estrés oxidativo y el daño del ADN espermático haría una contri- bución sólida al perfil de análisis seminal estándar y se convertiría en herramientas diagnósticas para la evaluación de la infertilidad del macho, espe- cialmente de origen idiopático, que deben tenerse en cuenta durante el estudio andrológico.
Conclusiones
El estrés térmico provoca alteraciones en el espermatozoide durante el ciclo espermático debido al estrés oxidativo. Este estrés puede ser causado por una alteración mitocondrial, además del daño en la protección antioxidante iniciado por las deficiencias de la dieta, la edad o por factores genéticos.
La susceptibilidad de los espermatozoi- des a los efectos del estrés calórico puede ser debida al hecho de que la meiosis impli- ca cambios estructurales y bioquímicos muy marcados, tales como la recombinación ho- móloga, el montaje complejo sinaptonémi- co, y entrecruzamiento cromosómico a una temperatura inferior. Aunque la respuesta fisiológica y celular para tratar el estrés ca- lórico de los testículos ha sido documentada, los mecanismos moleculares específicos en respuesta al estrés calórico aún no han sido establecidos. Por lo que el establecimiento y la validación de las ERO sobre la capacidad espermática bajo condiciones tropicales o de países con alta temperatura ambiental puede ser de suma importancia en vista de que no es una metodología que requiera equipo sofisti- cado para realizarla. Otro punto a considerar, es que estableciendo los valores de referencia para las ERO determinaría el nivel de anti- oxidantes necesarios en la alimentación para los animales bajo condiciones tropicales o de alta temperatura y de esa manera disminuir los problemas que afecta la capacidad re- productiva de los machos como: disfunción mitocondrial, la fragmentación del ADN, la lipoperoxidación, la disminución de la capa- cidad antioxidante, mas resistencia al calor de los espermas y el efecto negativo en los pro- cedimientos de reproducción asistida.









