Calcio, Fósforo, Vitamina D y Parathormona.
Publicado: 1 de enero de 1900
Por: Leonardo De Luca (Burnet Laboratorios S.A.)
I) METABOLISMO DEL CALCIO Y FÓSFORO INORGÁNICO
Más del 70% de las cenizas del cuerpo consisten en Ca y PO4. Más del 99% del total de Ca, y 80-85% del P están contenidos en el esqueleto y muelas. La menor proporción presente en los fluidos corporales juega un rol extremadamente importante en el mantenimiento de las funciones corporales. El Ca en el fluido extracelular es crítico para:
• normal excitabilidad neuromuscular
• permeabilidad capilar y de las membranas celulares
• contracción muscular
• transmisión normal del impulso nervioso
• coagulación sanguínea normal
El fósforo fuera del esqueleto juega a menudo un rol fascinante. El mismo está comprometido en la estructura celular normal y sirve en la degradación y síntesis de numerosos compuestos de carbono.
En las uniones de alta energía juega un rol fundamental en el depósito, liberación y transferencia de energía.
Finalmente, la habilidad del fósforo para ser excretado como H2PO4- o HPO42, proporciona un margen amplio para regular el metabolismo ácido-base.
A - CALCIO Y FÓSFORO EN COMPOSICIÓN Y FORMACIÓN DEL HUESO
El hueso adulto normal está compuesto por 45% de agua, 25% de cenizas, 20% de proteínas y 10% de grasas. En el mamífero las cenizas están compuestas por 36% de Ca, 17% de PO4 y 0.8% de Mg.
El calcio se encuentra en el hueso en parte como fosfato tricálcico y parte como carbonato, en una compleja estructura de apatita (hidroxiapatita) y cuya fórmula se escribe CaCO3xnCa3(PO4)2.
Sin embargo, el hueso no parece tener una composición constante. Los cristales aparentemente absorben y admiten varios grupos de iones sin carga con una geometría de cristales enrejados. De aquí que el hueso contenga, a parte de Ca y PO4, proporciones variables de carbonato, fluoruro, citrato, N+, K+, y Mg++.
Hay una clara diferencia entre el hueso de un animal joven y uno adulto, la sal que determina la solubilidad en el hueso joven es el fosfato octocálcico, y en el adulto el hueso está formado por hidroxiapatita. Esta diferencia explica la alta concentración de fósforo inorgánico (Pi) en animales jóvenes.
Los minerales del hueso están dispuestos para ser movilizados rápidamente y mantener el nivel de Ca sérico, pero menos lo están para mantener el nivel de fósforo, de forma tal que una disminución en el nivel de fósforo sérico es el primer signo de la deficiencia de consumo de este mineral.
Osificación: Fisiología Ósea
El hueso está formado por los osteoblastos, células que sintetizan la matriz proteica primero, y posteriormente regulan la mineralización primaria responsable del 75-85 % de la mineralización total del hueso.
Los osteoclastos los cuales efectúan la resorción ósea, proceso en el cual se remueve simultáneamente la fase mineral y se digiere la porción orgánica del hueso.
Los osteoblastos activos cubren el 5% de la superficie ósea, el 10% lo ocupan los osteoblastos en reposo. El 80% restante de la superficie ósea está cubierta por unas células aplanadas, los osteocitos superficiales. Los osteoblastos que quedan incluidos en el tejido óseo se denominan osteocitos profundos, y forman a su alrededor un tejido óseo metabólicamente muy activo y que pueden variar rápidamente su contenido mineral en respuesta a las necesidades.
En el hueso coexisten dos procesos:
A) Modelamiento óseo, que incluye el crecimiento longitudinal que se detiene después de la pubertad y las modificaciones del diámetro transversal que son continuas y se efectúan por aposición perióstica y por resorción endostal. En este caso la formación y la resorción ocurren en diferentes superficies óseas.
B) Remodelamiento óseo, que ocurre en el hueso trabecular y cortical. Este proceso ocurre de la siguiente manera: un grupo de osteoclastos excava el hueso cortical longitudinalmente, este frente osteoclástico avanza en forma centrífuga (resorción), lo sigue una zona de transición y luego una capa de osteoblastos avanzando en sentido centrípeto forma tejido óseo que va cerrando radialmente el túnel excavado (deposición). Este sistema completo se denomina Unidad Cortical de Remodelamiento Óseo (UCRO).
Intercambio de Ca entre el líquido extracelular óseo y el sistémico
El líquido extracelular óseo (LECO) está en contacto con los cristales óseos de los canalículos, lagunas y entre los osteocitos de superficie y tejido óseo. Tiene una composición iónica diferente al líquido extracelular sistémico (LECS). Los osteocitos profundos y los de superficie facilitan el pasaje del Ca iónico del líquido extracelular óseo al sistémico. Este fenómeno resulta de la producción de un diferente gradiente de concentración entre sangre y hueso. El Ca pasa continuamente hacia el LEC óseo por diferencia en el gradiente de concentración, y sería a su vez removido activamente por los osteocitos. La magnitud de este flujo depende de la diferencia de concentración generado por los osteocitos. Este sistema de intercambio de Ca entre el LEC óseo y el sistémico permite mantener una concentración de Ca plasmático de aproximadamente 6 mg/% aún en ausencia completa de PTH.
B - ABSORCIÓN DE CALCIO Y FÓSFORO
El Ca contenido en la dieta per se determinaría la cantidad absorbida desde el tracto gastrointestinal, y el nivel de Ca sérico tiende a aumentar o disminuir con el nivel de Ca en la dieta.
Esto es verdad en ovinos, pero en la vaca es difícil provocar una disminución de Ca por ingerir una dieta deficiente en Ca. Pero dietas con relación Ca/PO4 elevadas pueden causar un leve aumento en el nivel de Ca sérico.
La eficiencia de la absorción de Ca puede aumentar en condiciones que causan aumentos de la demanda (preñez y lactancia).
La absorción de Ca es pasiva en parte “adaptativa”, es decir, en crisis hipocalcémicas se pone en juego una secuencia de eventos desencadenados por la acción de la Vitamina D activa o 17 OH – Colecalciferol la cual eleva la síntesis a nivel intestinal de una proteína transportadora de Ca denominada PB-Ca esta toma el elemento de la luz intestinal volcándola al torrente circulatorio.
La formación de compuestos insolubles a nivel intestinal reduce la absorción de Ca. Se demostró que el oxalato puede reducir la absorción del mineral formando oxalato de Ca insoluble que se pierde en heces. En rumiantes el oxalato se descompone por acción microbiana.
La degradación del oxalato puede resultar en alcalosis, entonces, indirectamente afecta el metabolismo del Ca. Algunos subproductos como la remolacha forrajera y la alfalfa en ciertos momentos de maduración contiene más del 7% de oxalato de Ca.
Esto puede alterar la capacidad del rúmen para metabolizar el oxalato, inmoviliza el Ca en el tracto digestivo y contribuye a desarrollar una hipocalcemia.
En monogástricos los fitatos presentes en altas concentraciones en cereales tienen una considerable importancia en el metabolismo del Ca y del PO4. El PO4 unido de esta manera no es movilizable por los monogástricos ya que estos no contienen las hidrolizas específicas denominadas fitasas intestinales.
Si esto no ocurre el cuerpo no sólo es despojado de PO4, sino también de Ca. Esto es debido a que las fitasas (Acido Inositol Hexa Fosfórico) a pH 5-7 forman compuestos muy insolubles en el intestino.
La velocidad de absorción del Ca depende, como ya se ha mencionado, de los requerimientos totales del organismo y la absorción es máxima durante el crecimiento.
Durante los períodos de rápido crecimiento, las cantidades absorbidas son grandes pero la relación Calcio retenido/Peso ganado puede no ser óptima y entonces, el cociente Ca/Masa corporal es bajo y el resultado es un esqueleto mal calcificado.
Esto puede presentarse en animales alimentados a leche de vaca con índices de crecimiento altos como cachorros de perro y cerdo. Los terneros crecen relativamente despacio, como la leche de vaca tiene baja concentración de Ca respecto a los nutrientes responsables del crecimiento la fracción Calcio retenido/ Crecimiento total es baja y puede aparecer raquitismo fundamentalmente cuando la alimentación es exclusivamente láctea.
Es lógico suponer que a un pH intestinal bajo aumenta la proporción de PO4HCa soluble y se incrementaría su disponibilidad; al contrario, al aumentar el pH se forma (PO4)2Ca2 insoluble y la proporción de Ca absorbible disminuye.
La acidificación aumenta la fracción urinaria de Ca (Ca ultrafiltrable). Ciertos ácidos retrasan o impiden la absorción intestinal de Ca.
La presencia de AG no absorbibles en el intestino forma jabones cálcicos no absorbibles.
El fosfato influye de una manera notable sobre la absorción de Ca. Es importante la relación Ca/PO4- a nivel del intestino delgado, ya que una intensa elevación del Fósforo forma fosfatos insolubles no absorbibles.
El Ca es absorbido principalmente en la porción anterior del intestino delgado, donde juega un rol fundamental el pH pues cuanto mayor es la acidez, la absorción es mayor.
El Fósforo se absorbe en dos sitios: rúmen e intestino delgado, aunque el rúmen es bastante impermeable para el ion fosfato.
C - VITAMINA D
La vitamina D es un factor muy importante en la regulación de la absorción de Ca; tiene un efecto directo sobre la mineralización del hueso, como también en la absorción intestinal de Ca.
Esta vitamina está involucrada en el mecanismo que balancea el Ca esquelético y sanguíneo.
La vitamina D se puede considerar una Pre-Hormona que origina una hormona renal, la 1,25 Di-Hidroxi-Vitamina D3 [1,25 (OH)2-D3]. Otro metabolito de la Vitamina D, la 24,25 Di-Hidroxi-Vitamina D3 [24,25 (OH)2-D3], podría así mismo ser otra hormona renal derivada de la vitamina D.
Estructura química y síntesis
Bajo la acción de los rayos ultravioletas, el precursor 7-di-hidroxi-colesterol sufre una alteración de su estructura: la apertura del anillo B del núcleo. Luego bajo la acción de la temperatura aparece otra doble ligadura, lo cual concluye con el proceso de formación de Vitamina D endógena.
Rutas Metabólicas de la Vitamina D3
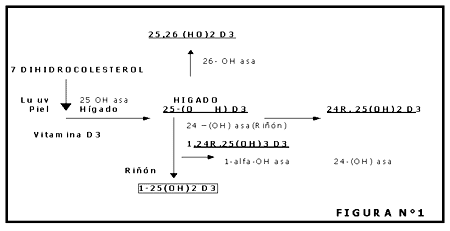
Metabolismo de la Vitamina D
Sea el origen exógeno o endógeno, la Vitamina D circula en plasma y es captada rápidamente por el hígado donde sufre su primera transformación que la convierte en 25 OH-D3, la forma circulatoria predominante, incluidos la vitamina D y sus metabolitos.
Esta reacción es catalizada por la enzima 25-Hidroxilasa presente en la fracción microsómica del hígado.
La conversión de vitamina D a 25-HO D3 carece prácticamente de sistema de regulación, por lo que la administración de vitamina D en dosis farmacológicas produce incrementos anormales en la tasa de circulante de 25-HO-D3.
La 25-OH-D3 es transportada por una alfaglobulina de Peso Molecular 52.000, el mismo sistema se utiliza para el transporte de la Vitamina D y todos sus metabolitos, pero la 25-OH-D3 tiene la mayor afinidad.
Metabolismo renal de la 25-OH-D3
En concentraciones fisiológicas la 25-OH-D3 no actuaría sobre ningún proceso fisiológico. Para ello debe ser activada lo que ocurre en el riñón a nivel mitocondrial, bajo la acción de la enzima 25-OH-D3 – 1-°-hidroxilasa (1-°-Hasa). En este sistema enzimático, una flavoproteína, una proteína ferrosulfurada y el Citocromo P-450, participan en la hidroxilación del sustrato.
La 1,25 (OH)2-D3 satisface todos los requerimientos para ser considerada una hormona. Se origina a partir del sistema Pre-Hormona Vitamina D - 1,25 (OH)2-D3 en un órgano específico: el riñón.
La velocidad de síntesis está regulada por un complejo mecanismo en el que participan iones y hormonas, como se verá más adelante. Una vez formada la 1,25 (OH)2-D3, la misma ejerce sus efectos a nivel intestinal, renal y óseo.
Otro sistema enzimático, presente en el riñón, convierte a la 25-OH-D3 en otro esteroide: la 24,25 (OH)2-D3. La enzima que actúa en esta OH transformación es la 25-OH-D3 – 24 Hidroxilasa (24-OHasa), que se encuentra en el riñón, intestino y cartílago. La hidroxilación en la posición 24 sería el paso inicial en la inactivación del sustrato 25-OH-D3, y también en la inactivación de la 1,25 (OH)2-D3, ya que este esteroide se hidroxila asimismo en el trihidroxilado 1,24,25 (OH)3-D3.
Regulación del Metabolismo de la Vitamina D
El organismo carece de mecanismos de regulación de la síntesis endógena de vitamina D o de su aporte exógeno. Por lo tanto un ingreso elevado por dieta o inyección, inducen, sin mecanismos que se opongan, una elevación en la tasa circulante de la vitamina.
Ya hemos mencionado antes que el primer paso en el metabolismo de la vita-mina D, la hidroxilación hepática que produce la 25-HO-D3, se produce sin control humoral u hormonal. En síntesis, la cantidad de 25-HO.D3, en el plasma es una función directa del aporte exógeno o endógeno de la vitamina.
Como este aporte fluctúa a lo largo del año significativamente y de las distintas estaciones y se trata de una vitamina que regula una función orgánica de primordial importancia (el nivel de calcio en el líquido extracelular), no es extraño que 25-HO-D3 tenga una acción débil o nula sobre los tejidos efectores.
La acción biológica es ejercida por los productos renales, la 1,25 (OH)2-D3 y posiblemente también, la 24,25 (OH)2-D3. Es a este nivel que se ha hallado un complejo sistema de regulación que permitiría al organismo contar con las cantidades necesarias de estas hormonas renales, y regulan así, eficazmente el metabolismo del Ca y PO4.
FIGURA N° 2
Rutas Metabólicas de la Vitamina D
Inactivación de la 25(HO)2D3
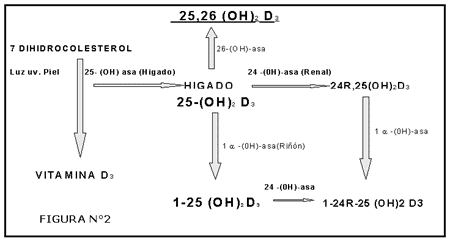
Regulación de la 1-°-HOasa renal
Un aporte exógeno deficiente de Ca o niveles disminuidos de Ca circulante, aumentan la síntesis de 1,25 (OH)2-D3. El nivel de Ca controla la síntesis renal de la 1,25 (OH)2-D3 en conjunción con la Paratohormona (PTH). Esta hormona provoca un aumento en la actividad de la 1-a-OHasa renal.
Otro importante factor de regulación es el fosfato. Si la concentración de PO4 aumenta considerablemente, la síntesis de 1,25 (OH)2-D3 está disminuida, aún cuando la PTH se encuentra elevada. Una disminución de la fosfatemia estimu-la la 1-a-OHasa renal y aumenta la secreción de 1,25 (OH)2-D3.
Por lo tanto, la hipocalcemia estimula la síntesis de 1,25 (OH)2-D3 solo en presencia de hormona Paratiroidea.
La Prolactina y los estrógenos aumentan la actividad de la 1-a-ohasa, como así también la Somatotrofina y el cortisol.
Regulación de la enzima 24-HOasa renal
En todos los casos en que se inhibe o estimula la síntesis de 1,25 (OH)2-D3 se observa inmediatamente un efecto inverso sobre la producción de 24,25 (OH)2-D3. Tanto la hipercalcemia, como la hiperfosfatemia, aumenta la síntesis de 24,25 (OH)2-D3. Si estos mecanismos son los que corresponden a la regulación de una hormona o son solo producto de la degradación de la 25-(HO)-D3 cuando no existen necesidades sistémicas de 1,25-(OH)2-D3 es un tema que será motivo de nuevas investigaciones, pero más adelante comentaremos el papel fisiológi-co de este metabolito.
Acción biológica de la vitamina D y sus metabolitos.
Este compuesto aumenta la absorción intestinal de Ca y PO4, consecuentemente aumenta la concentración sistémica y promueve la mineralización de la sustancia osteoide recién formada. A grandes rasgos se pueden mencionar dos interpretaciones: la primera sugiere que la vitamina D origina la hormona renal 1,25(HO)-D3, que sería la única encargada de producir el efecto biológico de-seado. La segunda, en cambio, sostiene que los diferentes metabolitos, de la vitamina D tendrían acciones biológicas independientes y que su interdependencia tendería a una mejor regulación del metabolismo óseo y mineral.
(VER FIGURA N° 2)
Efecto intestinal
La 1,25 (OH)2-D3 estimula la absorción de Ca actuando en forma directa sobre las células del epitelio intestinal. El transporte de Ca estimulado por la 1,25 (OH)2-D3 se produce a través de un proceso activo que requiere gasto de energía contra un gradiente electroquímico.
El sitio principal de acción es el duodeno y la primera porción del yeyuno. El tiempo entre la administración de 1,25 (OH)2-D3 y el aumento de la calcemia es de 3 a 4 horas, en contraposición a la administración de vitamina D cuyo intervalo es mayor (de 8 a 10 horas).
Además, la 1,25 (OH)2-D3 estimula el transporte de fosfato. Esta acción es independiente del transporte de Ca, y se produce por un mecanismo de transporte activo dependiente del Na. El sitio principal de acción es a nivel de yeyuno e íleon. En alta dosis la 25-OH-D3 también es capaz de estimular la absorción de Ca y PO4.
Efecto óseo
La 1,25 (OH)2-D3 produce una elevación de la calcemia muy importante, trabajando a nivel de osteclastos, aumentando el número y actividad y estimulando la totalidad de la superficie de resorción. La 25-OH-D3 es el compuesto más potente para estimular la mineralización ósea.
La 1,25 (OH)2-D3 sería en principio un metabolito sintetizado ante un estrés hipocalcémico y su papel fisiológico sería (junto con la PTH) el restablecimiento rápido de la calcemia estimulando la absorción intestinal y actuando directamente sobre el hueso para promover la resorción del tejido óseo, con liberación de Ca y otros minerales al LEC. Una vez restablecida la calcemia cesa la síntesis de 1,25 (OH)2-D3, y comienza la producción de 24,25 (OH)2-D3, facilitando esta el pasaje de Ca del LEC sistémico al LEC óseo, promoviendo la calci-ficación del hueso.
La acción de la 25- (HO)- D3 se explica en principio por su conversión a 1,25 (OH)2-D3 con recuperación de la calcemia, estimulando luego activamente la mineralización del hueso por intermedio de la 24,25-(OH)2-D3.
Esta teoría, ya fundamentada por experiencias recientes explicaría por una parte, el reconocido efecto de la vitamina D sobre la calcificación ósea, por vía de la síntesis de 25-(HO)-D3 y 24,25-(OH)2-D3- y por otra parte, la evidente estimulación de la resorción ósea inducida por la 1,25-(OH)2-D3
Efecto renal
Tanto la 1,25 (OH)2-D3 como la 25-OH-D3 aumentan la resorción de Ca y PO4. La 1,25 (OH)2-D3 es sinérgica a la PTH con respecto al Ca y antagónica con respecto al PO4.
La administración de vitamina D eleva la calcemia, ésta disminuye la concentración de Paratohormona, y de esta forma se reduce la acción de esta hormona sobre el riñón con aumento de la calciuria y disminución de la fosfaturia.
Por lo tanto la vitamina D actúa sobre la regulación renal del calcio por dos vías:
1. facilitando su reabsorción
2. incrementando la respuesta del túbulo a la PTH
La administración de vitamina D induce la síntesis de una proteína ligadora del calcio en el túbulo contorneado distal y en el túbulo colector, puntos de acción de la PHT.
En el riñón, la 1,25-(OH)2-D3 inhibe la actividad de la 25-HO-D-1a-hidroxilasa, y estimula la actividad de la 25-HO-D-24-hiroxilasa, con la consiguiente forma-ción de 24,25-(OH)2-D3.
Mecanismo de acción de 1,25 (OH)2-D3
Como otras hormonas esteroides, la 1,25 (OH)2-D3 actúa a través de la estimulación nuclear de la síntesis de ARNm y la inducción de proteínas que influyen sobre la función renal.
El primer paso es la unión de la 1,25 (OH)2-D3 a un receptor específico del citosol. Una vez ligado a su receptor, bajo la acción de la temperatura emigra al núcleo donde aumenta la síntesis de ARN.
La 1,25-(HO)2D3 estimula la actividad de la ARN polimerasa II, enzima responsable de la formación de ARNm. Los nuevos mensajes inducirían en el polisoma la traslación de proteínas que alterarían la función celular aumentando su capacidad para transportar calcio y fósforo.
Entre las proteínas que se forman bajo la acción de la 1,25-(HO)-D3 la que ha merecido mayor atención es la proteína ligadora de calcio(CaBP), ausente en los animales con carencia de vitamina D, que aparece después de la administración de la misma, y que se correlaciona con las modificaciones en la absorción intestinal de calcio.
La CaBP no es la única proteína que se sintetiza en el intestino en respuesta a la 1,25-(HO)2 D3, se han identificado una fosfatasa alcalina que podría favorecer la traslación de fosfato y otras sintetizadas en las membranas del ribete en cepillo que aparecen más precozmente que la CaBP.
FIGURA N°3
MECANISMO INTRACELULAR DE ACCION DEL 1,25 DIHIDROXICOLECALCIFEROL
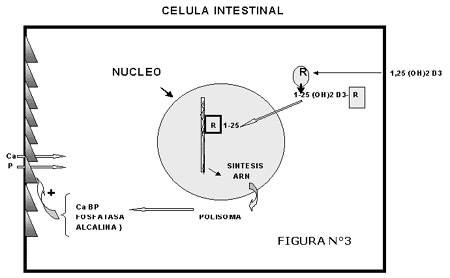
El primer paso es la unión de la 1,25-(OH)2-D3 a un receptor específico en el citosol. Una vez ligado a su receptor, la 1,25-(OH)2-D3 emigra al núcleo donde aumenta la síntesis nuclear de ARN. Esta vitamina eleva la actividad de la ARN polimerasa II, enzima responsable de la formación de ARNm. Los nuevos mensajes inducirán en el polisoma la traslación de proteínas que alterarían la función celular aumentando su capacidad para transportar Calcio y Fosfato. Entre las proteínas que se forman bajo la acción de la 1-25(OH)2-D3 la que merece mayor atención es la proteína ligadora de Calcio (Ca BP), encontrándo-se otra importante como la Fosfatasa alcalina, esta favorece la traslocación de fosfato en la membrana del ribete en cepillo y es sintetizada mas precozmente que la Ca BP.
D - EXCRECIÓN DE CALCIO Y FÓSFORO
Más del 70% de las cenizas del cuerpo consisten en Ca y PO4. Más del 99% del total de Ca, y 80-85% del P están contenidos en el esqueleto y muelas. La menor proporción presente en los fluidos corporales juega un rol extremadamente importante en el mantenimiento de las funciones corporales. El Ca en el fluido extracelular es crítico para:
• normal excitabilidad neuromuscular
• permeabilidad capilar y de las membranas celulares
• contracción muscular
• transmisión normal del impulso nervioso
• coagulación sanguínea normal
El fósforo fuera del esqueleto juega a menudo un rol fascinante. El mismo está comprometido en la estructura celular normal y sirve en la degradación y síntesis de numerosos compuestos de carbono.
En las uniones de alta energía juega un rol fundamental en el depósito, liberación y transferencia de energía.
Finalmente, la habilidad del fósforo para ser excretado como H2PO4- o HPO42, proporciona un margen amplio para regular el metabolismo ácido-base.
A - CALCIO Y FÓSFORO EN COMPOSICIÓN Y FORMACIÓN DEL HUESO
El hueso adulto normal está compuesto por 45% de agua, 25% de cenizas, 20% de proteínas y 10% de grasas. En el mamífero las cenizas están compuestas por 36% de Ca, 17% de PO4 y 0.8% de Mg.
El calcio se encuentra en el hueso en parte como fosfato tricálcico y parte como carbonato, en una compleja estructura de apatita (hidroxiapatita) y cuya fórmula se escribe CaCO3xnCa3(PO4)2.
Sin embargo, el hueso no parece tener una composición constante. Los cristales aparentemente absorben y admiten varios grupos de iones sin carga con una geometría de cristales enrejados. De aquí que el hueso contenga, a parte de Ca y PO4, proporciones variables de carbonato, fluoruro, citrato, N+, K+, y Mg++.
Hay una clara diferencia entre el hueso de un animal joven y uno adulto, la sal que determina la solubilidad en el hueso joven es el fosfato octocálcico, y en el adulto el hueso está formado por hidroxiapatita. Esta diferencia explica la alta concentración de fósforo inorgánico (Pi) en animales jóvenes.
Los minerales del hueso están dispuestos para ser movilizados rápidamente y mantener el nivel de Ca sérico, pero menos lo están para mantener el nivel de fósforo, de forma tal que una disminución en el nivel de fósforo sérico es el primer signo de la deficiencia de consumo de este mineral.
Osificación: Fisiología Ósea
El hueso está formado por los osteoblastos, células que sintetizan la matriz proteica primero, y posteriormente regulan la mineralización primaria responsable del 75-85 % de la mineralización total del hueso.
Los osteoclastos los cuales efectúan la resorción ósea, proceso en el cual se remueve simultáneamente la fase mineral y se digiere la porción orgánica del hueso.
Los osteoblastos activos cubren el 5% de la superficie ósea, el 10% lo ocupan los osteoblastos en reposo. El 80% restante de la superficie ósea está cubierta por unas células aplanadas, los osteocitos superficiales. Los osteoblastos que quedan incluidos en el tejido óseo se denominan osteocitos profundos, y forman a su alrededor un tejido óseo metabólicamente muy activo y que pueden variar rápidamente su contenido mineral en respuesta a las necesidades.
En el hueso coexisten dos procesos:
A) Modelamiento óseo, que incluye el crecimiento longitudinal que se detiene después de la pubertad y las modificaciones del diámetro transversal que son continuas y se efectúan por aposición perióstica y por resorción endostal. En este caso la formación y la resorción ocurren en diferentes superficies óseas.
B) Remodelamiento óseo, que ocurre en el hueso trabecular y cortical. Este proceso ocurre de la siguiente manera: un grupo de osteoclastos excava el hueso cortical longitudinalmente, este frente osteoclástico avanza en forma centrífuga (resorción), lo sigue una zona de transición y luego una capa de osteoblastos avanzando en sentido centrípeto forma tejido óseo que va cerrando radialmente el túnel excavado (deposición). Este sistema completo se denomina Unidad Cortical de Remodelamiento Óseo (UCRO).
Intercambio de Ca entre el líquido extracelular óseo y el sistémico
El líquido extracelular óseo (LECO) está en contacto con los cristales óseos de los canalículos, lagunas y entre los osteocitos de superficie y tejido óseo. Tiene una composición iónica diferente al líquido extracelular sistémico (LECS). Los osteocitos profundos y los de superficie facilitan el pasaje del Ca iónico del líquido extracelular óseo al sistémico. Este fenómeno resulta de la producción de un diferente gradiente de concentración entre sangre y hueso. El Ca pasa continuamente hacia el LEC óseo por diferencia en el gradiente de concentración, y sería a su vez removido activamente por los osteocitos. La magnitud de este flujo depende de la diferencia de concentración generado por los osteocitos. Este sistema de intercambio de Ca entre el LEC óseo y el sistémico permite mantener una concentración de Ca plasmático de aproximadamente 6 mg/% aún en ausencia completa de PTH.
B - ABSORCIÓN DE CALCIO Y FÓSFORO
El Ca contenido en la dieta per se determinaría la cantidad absorbida desde el tracto gastrointestinal, y el nivel de Ca sérico tiende a aumentar o disminuir con el nivel de Ca en la dieta.
Esto es verdad en ovinos, pero en la vaca es difícil provocar una disminución de Ca por ingerir una dieta deficiente en Ca. Pero dietas con relación Ca/PO4 elevadas pueden causar un leve aumento en el nivel de Ca sérico.
La eficiencia de la absorción de Ca puede aumentar en condiciones que causan aumentos de la demanda (preñez y lactancia).
La absorción de Ca es pasiva en parte “adaptativa”, es decir, en crisis hipocalcémicas se pone en juego una secuencia de eventos desencadenados por la acción de la Vitamina D activa o 17 OH – Colecalciferol la cual eleva la síntesis a nivel intestinal de una proteína transportadora de Ca denominada PB-Ca esta toma el elemento de la luz intestinal volcándola al torrente circulatorio.
La formación de compuestos insolubles a nivel intestinal reduce la absorción de Ca. Se demostró que el oxalato puede reducir la absorción del mineral formando oxalato de Ca insoluble que se pierde en heces. En rumiantes el oxalato se descompone por acción microbiana.
La degradación del oxalato puede resultar en alcalosis, entonces, indirectamente afecta el metabolismo del Ca. Algunos subproductos como la remolacha forrajera y la alfalfa en ciertos momentos de maduración contiene más del 7% de oxalato de Ca.
Esto puede alterar la capacidad del rúmen para metabolizar el oxalato, inmoviliza el Ca en el tracto digestivo y contribuye a desarrollar una hipocalcemia.
En monogástricos los fitatos presentes en altas concentraciones en cereales tienen una considerable importancia en el metabolismo del Ca y del PO4. El PO4 unido de esta manera no es movilizable por los monogástricos ya que estos no contienen las hidrolizas específicas denominadas fitasas intestinales.
Si esto no ocurre el cuerpo no sólo es despojado de PO4, sino también de Ca. Esto es debido a que las fitasas (Acido Inositol Hexa Fosfórico) a pH 5-7 forman compuestos muy insolubles en el intestino.
La velocidad de absorción del Ca depende, como ya se ha mencionado, de los requerimientos totales del organismo y la absorción es máxima durante el crecimiento.
Durante los períodos de rápido crecimiento, las cantidades absorbidas son grandes pero la relación Calcio retenido/Peso ganado puede no ser óptima y entonces, el cociente Ca/Masa corporal es bajo y el resultado es un esqueleto mal calcificado.
Esto puede presentarse en animales alimentados a leche de vaca con índices de crecimiento altos como cachorros de perro y cerdo. Los terneros crecen relativamente despacio, como la leche de vaca tiene baja concentración de Ca respecto a los nutrientes responsables del crecimiento la fracción Calcio retenido/ Crecimiento total es baja y puede aparecer raquitismo fundamentalmente cuando la alimentación es exclusivamente láctea.
Es lógico suponer que a un pH intestinal bajo aumenta la proporción de PO4HCa soluble y se incrementaría su disponibilidad; al contrario, al aumentar el pH se forma (PO4)2Ca2 insoluble y la proporción de Ca absorbible disminuye.
La acidificación aumenta la fracción urinaria de Ca (Ca ultrafiltrable). Ciertos ácidos retrasan o impiden la absorción intestinal de Ca.
La presencia de AG no absorbibles en el intestino forma jabones cálcicos no absorbibles.
El fosfato influye de una manera notable sobre la absorción de Ca. Es importante la relación Ca/PO4- a nivel del intestino delgado, ya que una intensa elevación del Fósforo forma fosfatos insolubles no absorbibles.
El Ca es absorbido principalmente en la porción anterior del intestino delgado, donde juega un rol fundamental el pH pues cuanto mayor es la acidez, la absorción es mayor.
El Fósforo se absorbe en dos sitios: rúmen e intestino delgado, aunque el rúmen es bastante impermeable para el ion fosfato.
C - VITAMINA D
La vitamina D es un factor muy importante en la regulación de la absorción de Ca; tiene un efecto directo sobre la mineralización del hueso, como también en la absorción intestinal de Ca.
Esta vitamina está involucrada en el mecanismo que balancea el Ca esquelético y sanguíneo.
La vitamina D se puede considerar una Pre-Hormona que origina una hormona renal, la 1,25 Di-Hidroxi-Vitamina D3 [1,25 (OH)2-D3]. Otro metabolito de la Vitamina D, la 24,25 Di-Hidroxi-Vitamina D3 [24,25 (OH)2-D3], podría así mismo ser otra hormona renal derivada de la vitamina D.
Estructura química y síntesis
Bajo la acción de los rayos ultravioletas, el precursor 7-di-hidroxi-colesterol sufre una alteración de su estructura: la apertura del anillo B del núcleo. Luego bajo la acción de la temperatura aparece otra doble ligadura, lo cual concluye con el proceso de formación de Vitamina D endógena.
Rutas Metabólicas de la Vitamina D3

Metabolismo de la Vitamina D
Sea el origen exógeno o endógeno, la Vitamina D circula en plasma y es captada rápidamente por el hígado donde sufre su primera transformación que la convierte en 25 OH-D3, la forma circulatoria predominante, incluidos la vitamina D y sus metabolitos.
Esta reacción es catalizada por la enzima 25-Hidroxilasa presente en la fracción microsómica del hígado.
La conversión de vitamina D a 25-HO D3 carece prácticamente de sistema de regulación, por lo que la administración de vitamina D en dosis farmacológicas produce incrementos anormales en la tasa de circulante de 25-HO-D3.
La 25-OH-D3 es transportada por una alfaglobulina de Peso Molecular 52.000, el mismo sistema se utiliza para el transporte de la Vitamina D y todos sus metabolitos, pero la 25-OH-D3 tiene la mayor afinidad.
Metabolismo renal de la 25-OH-D3
En concentraciones fisiológicas la 25-OH-D3 no actuaría sobre ningún proceso fisiológico. Para ello debe ser activada lo que ocurre en el riñón a nivel mitocondrial, bajo la acción de la enzima 25-OH-D3 – 1-°-hidroxilasa (1-°-Hasa). En este sistema enzimático, una flavoproteína, una proteína ferrosulfurada y el Citocromo P-450, participan en la hidroxilación del sustrato.
La 1,25 (OH)2-D3 satisface todos los requerimientos para ser considerada una hormona. Se origina a partir del sistema Pre-Hormona Vitamina D - 1,25 (OH)2-D3 en un órgano específico: el riñón.
La velocidad de síntesis está regulada por un complejo mecanismo en el que participan iones y hormonas, como se verá más adelante. Una vez formada la 1,25 (OH)2-D3, la misma ejerce sus efectos a nivel intestinal, renal y óseo.
Otro sistema enzimático, presente en el riñón, convierte a la 25-OH-D3 en otro esteroide: la 24,25 (OH)2-D3. La enzima que actúa en esta OH transformación es la 25-OH-D3 – 24 Hidroxilasa (24-OHasa), que se encuentra en el riñón, intestino y cartílago. La hidroxilación en la posición 24 sería el paso inicial en la inactivación del sustrato 25-OH-D3, y también en la inactivación de la 1,25 (OH)2-D3, ya que este esteroide se hidroxila asimismo en el trihidroxilado 1,24,25 (OH)3-D3.
Regulación del Metabolismo de la Vitamina D
El organismo carece de mecanismos de regulación de la síntesis endógena de vitamina D o de su aporte exógeno. Por lo tanto un ingreso elevado por dieta o inyección, inducen, sin mecanismos que se opongan, una elevación en la tasa circulante de la vitamina.
Ya hemos mencionado antes que el primer paso en el metabolismo de la vita-mina D, la hidroxilación hepática que produce la 25-HO-D3, se produce sin control humoral u hormonal. En síntesis, la cantidad de 25-HO.D3, en el plasma es una función directa del aporte exógeno o endógeno de la vitamina.
Como este aporte fluctúa a lo largo del año significativamente y de las distintas estaciones y se trata de una vitamina que regula una función orgánica de primordial importancia (el nivel de calcio en el líquido extracelular), no es extraño que 25-HO-D3 tenga una acción débil o nula sobre los tejidos efectores.
La acción biológica es ejercida por los productos renales, la 1,25 (OH)2-D3 y posiblemente también, la 24,25 (OH)2-D3. Es a este nivel que se ha hallado un complejo sistema de regulación que permitiría al organismo contar con las cantidades necesarias de estas hormonas renales, y regulan así, eficazmente el metabolismo del Ca y PO4.
FIGURA N° 2
Rutas Metabólicas de la Vitamina D
Inactivación de la 25(HO)2D3

Regulación de la 1-°-HOasa renal
Un aporte exógeno deficiente de Ca o niveles disminuidos de Ca circulante, aumentan la síntesis de 1,25 (OH)2-D3. El nivel de Ca controla la síntesis renal de la 1,25 (OH)2-D3 en conjunción con la Paratohormona (PTH). Esta hormona provoca un aumento en la actividad de la 1-a-OHasa renal.
Otro importante factor de regulación es el fosfato. Si la concentración de PO4 aumenta considerablemente, la síntesis de 1,25 (OH)2-D3 está disminuida, aún cuando la PTH se encuentra elevada. Una disminución de la fosfatemia estimu-la la 1-a-OHasa renal y aumenta la secreción de 1,25 (OH)2-D3.
Por lo tanto, la hipocalcemia estimula la síntesis de 1,25 (OH)2-D3 solo en presencia de hormona Paratiroidea.
La Prolactina y los estrógenos aumentan la actividad de la 1-a-ohasa, como así también la Somatotrofina y el cortisol.
Regulación de la enzima 24-HOasa renal
En todos los casos en que se inhibe o estimula la síntesis de 1,25 (OH)2-D3 se observa inmediatamente un efecto inverso sobre la producción de 24,25 (OH)2-D3. Tanto la hipercalcemia, como la hiperfosfatemia, aumenta la síntesis de 24,25 (OH)2-D3. Si estos mecanismos son los que corresponden a la regulación de una hormona o son solo producto de la degradación de la 25-(HO)-D3 cuando no existen necesidades sistémicas de 1,25-(OH)2-D3 es un tema que será motivo de nuevas investigaciones, pero más adelante comentaremos el papel fisiológi-co de este metabolito.
Acción biológica de la vitamina D y sus metabolitos.
Este compuesto aumenta la absorción intestinal de Ca y PO4, consecuentemente aumenta la concentración sistémica y promueve la mineralización de la sustancia osteoide recién formada. A grandes rasgos se pueden mencionar dos interpretaciones: la primera sugiere que la vitamina D origina la hormona renal 1,25(HO)-D3, que sería la única encargada de producir el efecto biológico de-seado. La segunda, en cambio, sostiene que los diferentes metabolitos, de la vitamina D tendrían acciones biológicas independientes y que su interdependencia tendería a una mejor regulación del metabolismo óseo y mineral.
(VER FIGURA N° 2)
Efecto intestinal
La 1,25 (OH)2-D3 estimula la absorción de Ca actuando en forma directa sobre las células del epitelio intestinal. El transporte de Ca estimulado por la 1,25 (OH)2-D3 se produce a través de un proceso activo que requiere gasto de energía contra un gradiente electroquímico.
El sitio principal de acción es el duodeno y la primera porción del yeyuno. El tiempo entre la administración de 1,25 (OH)2-D3 y el aumento de la calcemia es de 3 a 4 horas, en contraposición a la administración de vitamina D cuyo intervalo es mayor (de 8 a 10 horas).
Además, la 1,25 (OH)2-D3 estimula el transporte de fosfato. Esta acción es independiente del transporte de Ca, y se produce por un mecanismo de transporte activo dependiente del Na. El sitio principal de acción es a nivel de yeyuno e íleon. En alta dosis la 25-OH-D3 también es capaz de estimular la absorción de Ca y PO4.
Efecto óseo
La 1,25 (OH)2-D3 produce una elevación de la calcemia muy importante, trabajando a nivel de osteclastos, aumentando el número y actividad y estimulando la totalidad de la superficie de resorción. La 25-OH-D3 es el compuesto más potente para estimular la mineralización ósea.
La 1,25 (OH)2-D3 sería en principio un metabolito sintetizado ante un estrés hipocalcémico y su papel fisiológico sería (junto con la PTH) el restablecimiento rápido de la calcemia estimulando la absorción intestinal y actuando directamente sobre el hueso para promover la resorción del tejido óseo, con liberación de Ca y otros minerales al LEC. Una vez restablecida la calcemia cesa la síntesis de 1,25 (OH)2-D3, y comienza la producción de 24,25 (OH)2-D3, facilitando esta el pasaje de Ca del LEC sistémico al LEC óseo, promoviendo la calci-ficación del hueso.
La acción de la 25- (HO)- D3 se explica en principio por su conversión a 1,25 (OH)2-D3 con recuperación de la calcemia, estimulando luego activamente la mineralización del hueso por intermedio de la 24,25-(OH)2-D3.
Esta teoría, ya fundamentada por experiencias recientes explicaría por una parte, el reconocido efecto de la vitamina D sobre la calcificación ósea, por vía de la síntesis de 25-(HO)-D3 y 24,25-(OH)2-D3- y por otra parte, la evidente estimulación de la resorción ósea inducida por la 1,25-(OH)2-D3
Efecto renal
Tanto la 1,25 (OH)2-D3 como la 25-OH-D3 aumentan la resorción de Ca y PO4. La 1,25 (OH)2-D3 es sinérgica a la PTH con respecto al Ca y antagónica con respecto al PO4.
La administración de vitamina D eleva la calcemia, ésta disminuye la concentración de Paratohormona, y de esta forma se reduce la acción de esta hormona sobre el riñón con aumento de la calciuria y disminución de la fosfaturia.
Por lo tanto la vitamina D actúa sobre la regulación renal del calcio por dos vías:
1. facilitando su reabsorción
2. incrementando la respuesta del túbulo a la PTH
La administración de vitamina D induce la síntesis de una proteína ligadora del calcio en el túbulo contorneado distal y en el túbulo colector, puntos de acción de la PHT.
En el riñón, la 1,25-(OH)2-D3 inhibe la actividad de la 25-HO-D-1a-hidroxilasa, y estimula la actividad de la 25-HO-D-24-hiroxilasa, con la consiguiente forma-ción de 24,25-(OH)2-D3.
Mecanismo de acción de 1,25 (OH)2-D3
Como otras hormonas esteroides, la 1,25 (OH)2-D3 actúa a través de la estimulación nuclear de la síntesis de ARNm y la inducción de proteínas que influyen sobre la función renal.
El primer paso es la unión de la 1,25 (OH)2-D3 a un receptor específico del citosol. Una vez ligado a su receptor, bajo la acción de la temperatura emigra al núcleo donde aumenta la síntesis de ARN.
La 1,25-(HO)2D3 estimula la actividad de la ARN polimerasa II, enzima responsable de la formación de ARNm. Los nuevos mensajes inducirían en el polisoma la traslación de proteínas que alterarían la función celular aumentando su capacidad para transportar calcio y fósforo.
Entre las proteínas que se forman bajo la acción de la 1,25-(HO)-D3 la que ha merecido mayor atención es la proteína ligadora de calcio(CaBP), ausente en los animales con carencia de vitamina D, que aparece después de la administración de la misma, y que se correlaciona con las modificaciones en la absorción intestinal de calcio.
La CaBP no es la única proteína que se sintetiza en el intestino en respuesta a la 1,25-(HO)2 D3, se han identificado una fosfatasa alcalina que podría favorecer la traslación de fosfato y otras sintetizadas en las membranas del ribete en cepillo que aparecen más precozmente que la CaBP.
FIGURA N°3
MECANISMO INTRACELULAR DE ACCION DEL 1,25 DIHIDROXICOLECALCIFEROL

El primer paso es la unión de la 1,25-(OH)2-D3 a un receptor específico en el citosol. Una vez ligado a su receptor, la 1,25-(OH)2-D3 emigra al núcleo donde aumenta la síntesis nuclear de ARN. Esta vitamina eleva la actividad de la ARN polimerasa II, enzima responsable de la formación de ARNm. Los nuevos mensajes inducirán en el polisoma la traslación de proteínas que alterarían la función celular aumentando su capacidad para transportar Calcio y Fosfato. Entre las proteínas que se forman bajo la acción de la 1-25(OH)2-D3 la que merece mayor atención es la proteína ligadora de Calcio (Ca BP), encontrándo-se otra importante como la Fosfatasa alcalina, esta favorece la traslocación de fosfato en la membrana del ribete en cepillo y es sintetizada mas precozmente que la Ca BP.
D - EXCRECIÓN DE CALCIO Y FÓSFORO
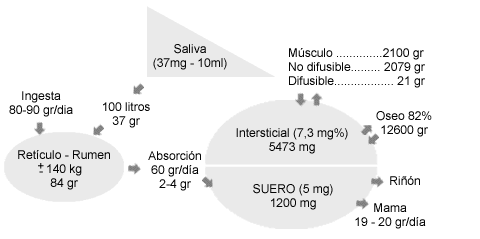
Excreción Fecal
El Ca fecal, fundamentalmente de origen dietario, puede estar dividido como exógeno o endógeno. El Ca exógeno es el Ca no digerido del alimento. El Ca endógeno es la fracción de Ca derivada de la secreción de Ca hacia el intestino, fundamentalmente hacia yeyuno.
El Ca fecal, fundamentalmente de origen dietario, puede estar dividido como exógeno o endógeno. El Ca exógeno es el Ca no digerido del alimento. El Ca endógeno es la fracción de Ca derivada de la secreción de Ca hacia el intestino, fundamentalmente hacia yeyuno.
El conocimiento del Ca y PO4 fecal endógeno es importante para la determinación de la digestibilidad verdadera del Ca y PO4 del alimento. La digestibilidad aparente (Ca fecal en alimento/Ca en alimento) tiene una base válida para estimar la digestibilidad verdadera solo cuando el Ca y PO4 endógeno tiene muy poca importancia y constituye una pequeña parte de Ca y PO4 fecal.
En la vaca el Ca fecal ha sido estimado en 4-7 gr./día, es directamente proporcional al Peso corporal y poco influenciado por cambios dietéticos de corta duración. Este valor es mayor en los animales adultos.
El fósforo fecal endógeno fue estimado en vacas lactantes con valores de 10-14 gr./día, o sea, dos veces la cantidad del Ca endógeno.
Excreción urinaria
La excreción es regulada por PTH y Vitamina D. Parte del Ca y PO4 filtrado es reabsorbido en los túbulos renales. El fósforo se reabsorbe en la porción final del túbulo contorneado proximal debido a una actividad enzimática.
Excreción urinaria
La excreción es regulada por PTH y Vitamina D. Parte del Ca y PO4 filtrado es reabsorbido en los túbulos renales. El fósforo se reabsorbe en la porción final del túbulo contorneado proximal debido a una actividad enzimática.
El Ca tiene umbral de excreción y este oscila entre 6 a 8 mg%. Las dietas ácidas aumentan la excreción urinaria de Ca.
En la vaca el rango de excreción urinaria de fósforo es solo una fracción del 1% del rango de excreción de fósforo en heces; esto es debido a la orina alcalina de los bovinos, pues con pH alcalino se encuentra limitada la secreción simultánea de calcio y fósforo.
Secreción mamaria
En vacas lactando, grandes cantidades de Ca y PO4 son secretadas en la leche, por ello muchas veces estos minerales son hallados en concentración más alta que en el plasma, el Ca 12 veces, el PO4 7 veces y el Mg 6 veces.
FIGURA N°4
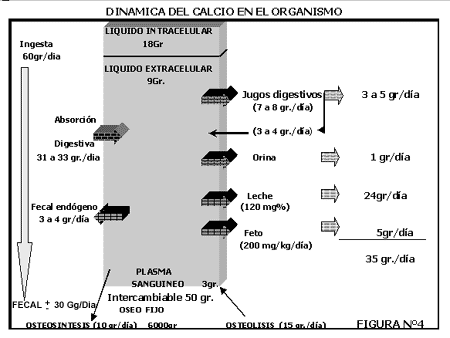
II- NIVELES DE CALCIO Y FÓSFORO SÉRICO
Casi la totalidad del Ca que contiene la sangre se encuentra en el plasma; el PO4 y el Mg están localizados tanto en plasma como en los eritrocitos.
El Ca y el Mg se encuentran:
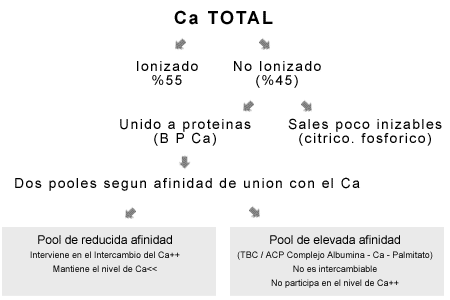
A- Ionizados: forma fisiológicamente activa, siendo más o menos el 40 a 60 % del total.
B- No ionizados: en estado de unión con proteínas o como sales poco ionizables de ácidos como cítrico y fosfórico.
La relación entre estas dos formas responde a la Ley de Acción de las Masas:

La proporción de Ca y Mg ligado a las proteínas depende de la concentración de las mismas, en particular de la albúmina, pues esta presenta una elevada capacidad de fijación para ambos iones. También influye la concentración de ambos iones y el pH del plasma. Si disminuye el pH la proporción de las formas iónicas aumenta.Además, está comprobado que el Ca unido a proteínas (BP-Ca) está formado por dos pooles que se distinguen por diferentes capacidades de unión con el Ca. El pool de reducida afinidad, interviene en el intercambio con el Ca++ iónico, por lo tanto, participa en el mantenimiento del nivel de Ca ionizado. El pool de elevada afinidad (TBC, Calcio Fuertemente Unido, o ACP, Complejo Albúmina-Calcio-Palmitato) no es intercambiable y no participa en el nivel de Ca++. Este último grupo tiene un importante rol en el transporte de Ca a través de la membrana, y en la captación de Ca por las células ósea, en el hueso hay una captación preferencial del Ca cuando es presentado como TBC ante el Ca iónico).
FIGURA N° 5
El Fósforo se encuentra en el plasma en tres formas:
• Iones inorgánicos: PO4H21- y PO4H3-.
• Unido a lípidos (30%).
• Formando ésteres fosfóricos orgánicos.
Las relaciones entre estas tres formas son consecuencia de otros factores aparte de simples equilibrios (como Ca y PO4). El pH tiene una gran influencia sobre la proporción en que se encuentran las dos formas de fosfato inorgánico en el plasma. Dicha relación es:
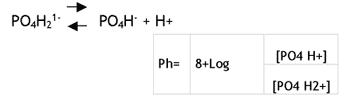
6.8 es el valor de pK para la disociación del PO4H21- bajo las condiciones que imperan en el suero. Al pH normal del plasma:
[PO4H2-] = 4 x [PO4H2-]
FIGURA N° 6
(DINAMICA DEL FÓSFORO EN EL ORGANISMO)
A - Hormona Paratiroidea
La PTH es un polipéptido de 84 aminoácidos. Sin embargo, no es necesaria la hormona intacta para que ejerza su actividad biológica. Los fragmentos amino terminales 1-34 tienen la misma actividad que la hormona intacta, en cambio, los fragmentos con menos de 34 aminoácidos pierden esa actividad.
Las células paratiroides sintetizan primero un precursor Pro-PTH con 6 aminoácidos adicionales amino terminales. La Pro-PTH es convertida en PTH en aproximadamente 24 minutos, tiempo que requiere su transporte por el Retículo Endoplasmático al Aparato de Golgi.
Existe un depósito muy pequeño de PTH dentro de la célula. Apenas un 7% de este depósito de hallaría en forma de pro-PTH y normalmente no es liberada a la circulación; la pro-PTH carece de actividad biológica.
Recientemente se ha descubierto que el mensajero ARN de la PTH modula la síntesis de un polipéptido mas largo que la pro-PTH, la pre-pro-PTH, del que 25 aminoácidos adicionales son hidrolizados pocos segundos después de su síntesis.
Una vez sintetizada la PTH se acumula en los gránulos de secreción que atraviesan la célula, se unen a la membrana celular y liberan su contenido a la circulación.
Este proceso de acumulación en gránulos secretorios hasta la liberación demora unos 30 minutos, pero posiblemente no sea imprescindible para la secreción de PTH, ya que la hormona podría ser secretada sin previa acumulación en gránu-los. (VER FIGURA N°7.)
REGULACIÓN DE LA FUNCIÓN INTRACELULAR POR EL CALCIO
El Calcio en sí tiene un pequeño efecto sobre el rango de síntesis de la Pro-PTH misma. El Calcio iónico regula el rango de degradación del péptido hormonal nuevo (Pro-PTH, PTH, o ambas) en la glándula durante la síntesis.
La hipocalcemia es el principal estímulo para la secreción de PTH, el Ca a una concentración en suero, mayor a 2,5 mM (1,25 mM ionizado) inhibe la secreción de la hormona (2,5mM equivale a 10mg%).
En la vaca el rango de excreción urinaria de fósforo es solo una fracción del 1% del rango de excreción de fósforo en heces; esto es debido a la orina alcalina de los bovinos, pues con pH alcalino se encuentra limitada la secreción simultánea de calcio y fósforo.
Secreción mamaria
En vacas lactando, grandes cantidades de Ca y PO4 son secretadas en la leche, por ello muchas veces estos minerales son hallados en concentración más alta que en el plasma, el Ca 12 veces, el PO4 7 veces y el Mg 6 veces.
FIGURA N°4

II- NIVELES DE CALCIO Y FÓSFORO SÉRICO
Casi la totalidad del Ca que contiene la sangre se encuentra en el plasma; el PO4 y el Mg están localizados tanto en plasma como en los eritrocitos.
El Ca y el Mg se encuentran:
A- Ionizados: forma fisiológicamente activa, siendo más o menos el 40 a 60 % del total.
B- No ionizados: en estado de unión con proteínas o como sales poco ionizables de ácidos como cítrico y fosfórico.
La relación entre estas dos formas responde a la Ley de Acción de las Masas:

La proporción de Ca y Mg ligado a las proteínas depende de la concentración de las mismas, en particular de la albúmina, pues esta presenta una elevada capacidad de fijación para ambos iones. También influye la concentración de ambos iones y el pH del plasma. Si disminuye el pH la proporción de las formas iónicas aumenta.Además, está comprobado que el Ca unido a proteínas (BP-Ca) está formado por dos pooles que se distinguen por diferentes capacidades de unión con el Ca. El pool de reducida afinidad, interviene en el intercambio con el Ca++ iónico, por lo tanto, participa en el mantenimiento del nivel de Ca ionizado. El pool de elevada afinidad (TBC, Calcio Fuertemente Unido, o ACP, Complejo Albúmina-Calcio-Palmitato) no es intercambiable y no participa en el nivel de Ca++. Este último grupo tiene un importante rol en el transporte de Ca a través de la membrana, y en la captación de Ca por las células ósea, en el hueso hay una captación preferencial del Ca cuando es presentado como TBC ante el Ca iónico).
FIGURA N° 5

El Fósforo se encuentra en el plasma en tres formas:
• Iones inorgánicos: PO4H21- y PO4H3-.
• Unido a lípidos (30%).
• Formando ésteres fosfóricos orgánicos.
Las relaciones entre estas tres formas son consecuencia de otros factores aparte de simples equilibrios (como Ca y PO4). El pH tiene una gran influencia sobre la proporción en que se encuentran las dos formas de fosfato inorgánico en el plasma. Dicha relación es:
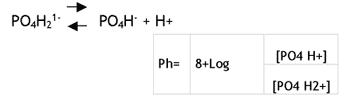
6.8 es el valor de pK para la disociación del PO4H21- bajo las condiciones que imperan en el suero. Al pH normal del plasma:
[PO4H2-] = 4 x [PO4H2-]
FIGURA N° 6
(DINAMICA DEL FÓSFORO EN EL ORGANISMO)

A - Hormona Paratiroidea
La PTH es un polipéptido de 84 aminoácidos. Sin embargo, no es necesaria la hormona intacta para que ejerza su actividad biológica. Los fragmentos amino terminales 1-34 tienen la misma actividad que la hormona intacta, en cambio, los fragmentos con menos de 34 aminoácidos pierden esa actividad.
Las células paratiroides sintetizan primero un precursor Pro-PTH con 6 aminoácidos adicionales amino terminales. La Pro-PTH es convertida en PTH en aproximadamente 24 minutos, tiempo que requiere su transporte por el Retículo Endoplasmático al Aparato de Golgi.
Existe un depósito muy pequeño de PTH dentro de la célula. Apenas un 7% de este depósito de hallaría en forma de pro-PTH y normalmente no es liberada a la circulación; la pro-PTH carece de actividad biológica.
Recientemente se ha descubierto que el mensajero ARN de la PTH modula la síntesis de un polipéptido mas largo que la pro-PTH, la pre-pro-PTH, del que 25 aminoácidos adicionales son hidrolizados pocos segundos después de su síntesis.
Una vez sintetizada la PTH se acumula en los gránulos de secreción que atraviesan la célula, se unen a la membrana celular y liberan su contenido a la circulación.
Este proceso de acumulación en gránulos secretorios hasta la liberación demora unos 30 minutos, pero posiblemente no sea imprescindible para la secreción de PTH, ya que la hormona podría ser secretada sin previa acumulación en gránu-los. (VER FIGURA N°7.)
REGULACIÓN DE LA FUNCIÓN INTRACELULAR POR EL CALCIO
El Calcio en sí tiene un pequeño efecto sobre el rango de síntesis de la Pro-PTH misma. El Calcio iónico regula el rango de degradación del péptido hormonal nuevo (Pro-PTH, PTH, o ambas) en la glándula durante la síntesis.
La hipocalcemia es el principal estímulo para la secreción de PTH, el Ca a una concentración en suero, mayor a 2,5 mM (1,25 mM ionizado) inhibe la secreción de la hormona (2,5mM equivale a 10mg%).
El Mg++ (Mg iónico) elevado inhibe y la disminución estimula la secreción de PTH. Esto ocurre en estado fisiológico normal, pero se observó que la administración de Mg ** produce en la glándula hiperactiva un aumento importante de la secreción.
De todas maneras el ion Mg no ejerce un papel fisiológico en la regulación de la secreción de PTH.
CONTROL DE LA SECRECIÓN.
Las paratiroides deben aumentar rápidamente la concentración de PTH en res-puesta a la disminución de la concentración de calcio circulante, e inversamente, inhibir la liberación de hormona en respuesta en respuesta a un aumento indebido de la calcemia.
La concentración extracelular de calcio iónico controla todos los pasos de síntesis y liberación hormonal. Uno de los más importantes sería la degradación intracelular de la hormona sintetizada. Una elevación del calcio iónico extracelular estimula y una disminución inhibe la degradación de PTH. Este mecanismo sería el responsable del rápido incremento de hormona liberada en respuesta a una hipocalcemia aguda, ya que la síntesis hormonal solo aumenta varias horas después del comienzo del estímulo.
De todas maneras el ion Mg no ejerce un papel fisiológico en la regulación de la secreción de PTH.
CONTROL DE LA SECRECIÓN.
Las paratiroides deben aumentar rápidamente la concentración de PTH en res-puesta a la disminución de la concentración de calcio circulante, e inversamente, inhibir la liberación de hormona en respuesta en respuesta a un aumento indebido de la calcemia.
La concentración extracelular de calcio iónico controla todos los pasos de síntesis y liberación hormonal. Uno de los más importantes sería la degradación intracelular de la hormona sintetizada. Una elevación del calcio iónico extracelular estimula y una disminución inhibe la degradación de PTH. Este mecanismo sería el responsable del rápido incremento de hormona liberada en respuesta a una hipocalcemia aguda, ya que la síntesis hormonal solo aumenta varias horas después del comienzo del estímulo.
FIGURA N°7
(RUTAS DE BIOSÍNTESIS DE PTH Y CONTROL DE SECRECION DE PTH)
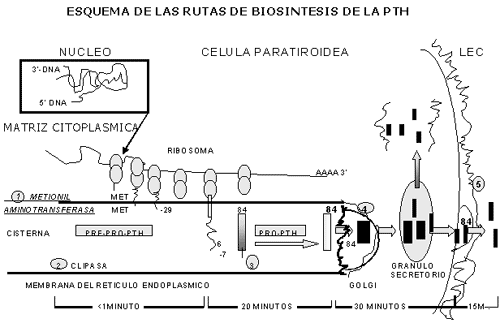
· La Pre-Pro-PTH es convertida en Pro-PTH por remoción del residuo metionil de NH2 terminal 1 por la Metil Aminotrasferasa, luego, la secuencia NH2 terminal (-29 a –7) de 23 aminoácidos es hidrolizada en segundos después de la síntesis 2.
· Esta conversión ocurre durante el transporte del polipéptido dentro de la cisterna del Retículo Endotelial Rugoso.
Veinte minutos después de la síntesis, la Pro-PTH llega a la región del Aparato de Golgi y es convertida en PTH por remoción del residuo NH2 terminal hexa-peptido, 3
La PTH es depositada en el gránulo secretorio y parcialmente degradada en la célula. 4 cuando la secreción es suprimida por un aumento en la concentración de Ca++, o 5 descargada en el LEC en respuesta a una disminución en la con-centración de Ca++.
FIGURA N° 8
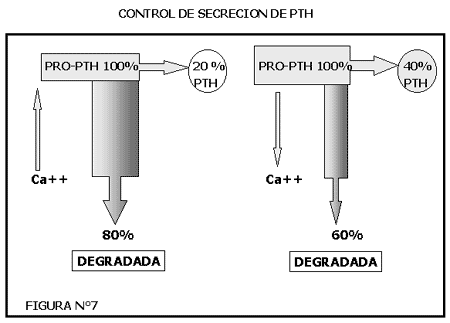
*La concentración de Ca++(iónico), controla tanto los pasos de síntesis como de liberación. Uno de los más importantes sería la degradación intracelular de la hormona sintetizada. Una disminución de Ca++ inhibe la degradación, mien-tras que una elevación la aumenta.
Las variaciones en la secreción de PTH en respuesta a los cambios de la concen-tración de calcio no son lineales sino que representan una función sigmoidea de la calcemia.
Dentro de lo que puede considerarse como los límites de concentración normal del calcio circulante (9 a 10,5 mg/100ml) la variación en la secreción de PTH es relativamente reducida. En cambio, la velocidad de secreción aumenta con rapidez al disminuir la calcemia por debajo de 9,0 mg/100ml. El ritmo máximo de secreción de PTH se logra al alcanzar la calcemia un nivel de alrededor de 6 mg/100ml, no obteniéndose mayor respuesta aunque la disminución de calcio continúe disminuyendo.
FIGURA N°9
RELACION ENTRE LA CALCEMIA Y LA SECRECION DE PTH
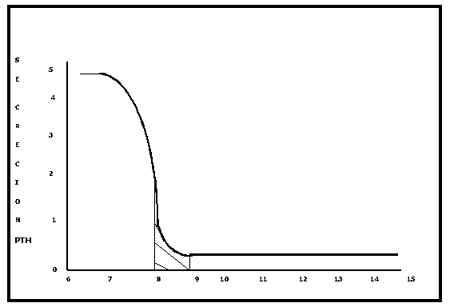
*El ritmo máximo de secreción de PTH se obtiene al alcanzar la calcemia un nivel de 6 mg/100 ml y no se obtiene mayor respuesta aunque la concentración de calcio continúe disminuyendo. En el otro extremo de la curva puede observarse que a partir de 11 mg/100 ml se obtiene la máxima inhibición en la secreción de PTH, sin embargo, esta inhibición máxima no alcanza nunca a suprimir por completo la secreción de hormona.
La regulación ejercida por el calcio iónico sobre la secreción de PTH tiende a preservar, junto con otros mecanismos, los niveles de calcio extracelular.
La curva de regulación descripta tiene una significación directa en las patologías de las glándulas paratiroides. En vacas con Hipoparatiroidismo nutricional la calcemia no desciende por debajo de los 5-6 mg/100 ml. Este nivel de calcio extracelular puede ser mantenido indefinidamente por el calcio liberado de la enorme reserva del organismo que es el esqueleto, sin necesidad de ningún estímulo hormonal. En síntesis, el estímulo para una mayor secreción de PTH inducida por la hipocalcemia alcanza un nivel máximo en un punto (alrededor de 6 mg/100ml) en el cual una mayor concentración hormonal no serviría para ningún fin específico.
Por otra parte, la incapacidad del calcio iónico de suprimir por completo la secreción de PTH explica la fisiopatología del Hiperparatiroidismo con hipercalcemia.
HORMONA PARATIROIDEA CIRCULANTE Y METABOLISMO PERIFÉRICO
Desde a que se pudo medir PTH por radioinmunoanálisis se han identificado por lo menos tres fracciones diferentes de esta hormona, por lo tanto ahora sabe-mos que la misma no es homogénea en su composición química.
La primera fracción o Pico I es una PTH de peso molecular de alrededor de 9.500 presumiblemente con la secuencia de aminoácidos 1-84. Esta fracción es biológicamente activa; su vida media en la circulación es muy corta, solo de unos pocos minutos, y contiene tanto el extremo NH2 como el COOH terminal.
El pico II tiene un peso molecular de 7.500 aproximadamente, contiene solo el extremo COOH terminal, es biológicamente inactiva y su vida media en la circulación es de una hora.
El pico III, con un peso molecular aproximado de 3.500, contiene principalmente el fragmento NH2 terminal biológicamente activo y con una vida media en la circulación de apenas 2 a 4 minutos.
La presencia de los mencionados fragmentos de PTH en la circulación se debe al metabolismo periférico de la hormona que se efectúa en el hígado y en el riñón. La glándula secreta predominantemente la hormona intacta con la secuencia 1-84 de aminoácidos, aunque se admite que en determinadas circunstancia, principalmente en una hipercalcemia, puede liberar fragmentos a la circulación.
La hormona intacta es metabolizada en el riñón, responsable del 60% de su destrucción, en el hígado también ocurre esta degradación. En este órgano se encuentran receptores que reconocen la zona 24-48 de aminoácidos intactos. Por lo tanto, el hígado extrae de la circulación solamente la hormona intacta, a partir de la cual forma el fragmento 1-34 o 1-37 NH2 terminal biológicamente activo y el fragmento 34-84 COOH terminal carente de actividad. Este proceso se produce en las células de Kupffer, ya que la vida media de la PTH intacta es sólo 12 minutos en estas células, mientras que es de 80 minutos en los hepatocitos.
El hígado no extrae los fragmentos una vez que estos están en la circulación. Y lo más interesante es que la velocidad de conversión de la hormona intacta en sus fragmentos derivados depende de la concentración de Calcio en el medio de perfusión. Cuando la concentración disminuye a menos de 5 mg/100ml, la conversión se acelera, e inversamente por encima de 11 mg/100ml esa conversión se retarda.
El riñón en cambio es capaz de metabolizar tanto la PTH intacta como sus fragmentos.
Existen dos mecanismos distintos de degradación renal.
1. Por filtración glomerular y posterior reabsorción tubular y degradación intracelular, el riñón es capaz de metabolizar tanto la PTH intacta como sus fragmentos NH2 o COOH terminales.
2. Por extracción peritubular, las células peritubulares del riñón tienen receptores para la hormona para la hormona intacta y para el fragmento NH2 terminal - es necesaria la secuencia 25-34 -, los que serían metalizados y producirían los efectos renales de la hormona. No hay extracción renal peritubular de los fragmentos inactivos.
El hueso, uno de los principales efectores de la hormona, no ejerce ninguna función en su metabolismo periférico. El tejido óseo se limita a extraer el fragmento NH2 terminal, que es el único con actividad biológica sobre aquel, pero no extrae de la circulación la hormona intacta, ni los fragmentos COOH terminales.
En síntesis, la hormona intacta secretada por la glándula es hidrolizada en el hígado y en el riñón con formación de dos fragmentos, el NH2 terminal, con actividad biológica sobre todos los efectores y vida media muy breve, y el CO-OH terminal biológicamente inactivo, con vida media prolongada y solo degradable por filtración glomerular y reabsorción tubular en el riñón. La concentración de Calcio regularía la formación periférica de los fragmentos activos.
La concentración de PTH biológicamente activa, es de alrededor de 11 pg/ml, con un rango de 3 a 29 pg/ml.
FUNCION DE LA HORMONA PARATIROIDEA
El papel fisiológico fundamental de la PTH es el de mantener un tenor adecuado de Calcio en el compartimento extracelular. Para cumplir esta función la PTH actúa.
1. sobre el esqueleto, a través de una serie de mecanismos complejos que efectúan el Modelamiento y Remodelamiento óseo y el pasaje de Calcio a través de la membrana ósea.
2. Sobre el riñón aumentando la resorción tubular de Calcio y disminuyendo la de Fósforo.
3. Sobre el metabolismo de la vitamina D, estimulando la síntesis del 1,25(OH)2 D3 y secundariamente, la absorción intestinal de Calcio.
ACCION SOBRE EL HUESO
Debemos repasar la fisiología ósea ( ya descripta) para comprender la acción de la hormona sobre el hueso.
La PTH actuaría sobre tres procesos óseos:
a) Sobre los osteocitos de superficie y el intercambio de Calcio entre el Líquido Extracelular Óseo (LEC) y el sistémico.
b) Sobre los osteocitos de profundidad.
c) Sobre el remodelamiento y Modelamiento óseos a través de los osteo-clastos y osteoblastos.
La PTH aumenta el pasaje de Calcio del LEC óseo al sistémico. Esto podría producirse por el aumento en la producción de ácidos orgánicos que induce la PTH en los osteocitos, lo que a su vez aumenta la solubilidad del mineral y permite una mayor disponibilidad para su posterior liberación.
Independientemente o asociado a este mecanismo la PTH aumenta la actividad de la bomba de Calcio, a través de la cual los osteocitos incrementan la salida de este mineral hacia el LEC sistémico. La PTH es, asimismo, por lo menos en dosis farmacológicas un activo vasodilatador arterial, de esta manera que aumenta el flujo arterial del hueso. Este efecto de la PTH podría ser necesario para asegurar un correcto flujo circulatorio del hueso en el momento en que se produce una mayor salida de Calcio a través de la membrana formada por los osteocitos de superficie.
Alrededor de los osteocitos profundos existe un tejido óseo perilacunar poco estructurado y metabólicamente activo. Este metabolismo está regulado por los niveles de PTH. Un aumento rápido en la concentración de esta hormona determina una resorción de la matriz y disolución mineral. El incremento sostenido de la secreción de PTH lleva a aumentar el espacio perilacunar, con posibilidad de que estos espacios confluyan entre sí.
Siempre se generalizó la idea de que las respuestas bioquímicas ocurren principalmente en los osteoclastos, en la actualidad se considera que no siempre es así, puesto que datos histológicos muestran que los osteocitos tienen aún una mayor participación en la osteólisis, sobre todo en las etapas tempranas.
La respuesta mas temprana de las células óseas a la PTH es una entrada de los iones Ca++ y una activación de la adenilciclasa de la membrana.
El Ca++ que entra actúa como segundo mensajero en la respuesta Osteolítica. (elevando la concentración de Ca++ en la célula se activa la osteólisis). Se aprecia incremento en la síntesis de RNA en el hueso, salida de enzimas lisosómicas y aumento de la actividad de esas enzimas en solución.
También hay evidencias que la PTH estimula la formación de 3’-5’ AMPc en las células óseas y que éste es también un segundo mensajero en la respuesta Osteolítica. Este mensajero proviene de la activación de la adenilciclasa de la membrana.
Se comprobó que el Ca++ y el AMPc desempeñan papeles independientes en la respuesta celular a la PTH. La concentración aumentada de Ca++ en el medio no estimula sino que inhibe la actividad de la adenilciclasa y el AMPc no induce al aumento de la permeabilidad al calcio, ya sea in vivo o en células aisladas.
Un efecto conocido es la acción inhibitoria de la osteólisis ejercida por la calcitonina. Los últimos trabajos demuestran que la calcitonina no interviene en la entrada inicial de Ca++ o en la respuesta adenilciclásica de las membranas y tampoco en el bloqueo de la eliminación o activación de las enzimas Osteolítica.
El mecanismo propuesto por Rasmussen es que la calcitonina puede disminuir la concentración de Ca++ activo no por interferencia en la entrada sino por estímulo de la toma del Ca++ mitocondrial
Se ha comprobado que algunas quinasas - fosforiladas son totalmente independientes de la presencia del Ca++ iónico. Algunas de las fosforilaciones activan enzimas almacenadas en formas precursoras; otras probablemente liberan y activan enzimas hidrolíticas de los lisosomas.
Estos efectos bioquímicos acompañan a la osteólisis inducida por la PTH. Así se ve; síntesis acelerada de hialuronatos, Mucopolisacáridos sulfatados, acumulación de citratos y lactato, liberación de enzimas lisosómicas, activación de la anhidrasa carbónica y activación de fosfatasa ácida. Esta actividad se ha observado en los sitios de resorción activa.
La vitamina D (1-25 (OH)2 D3) que actúa en el control de la absorción intestinal es muy activa también para inducir osteólisis.
ACCION ARMONICA DE LA PTH EN EL REMODELAMIENTO OSEO
Como ya desarrollamos en Fisiología ósea los osteoblastos y osteoclastos actúan armónicamente en el proceso de remodelamiento del hueso, al punto que han sido en conjunto denominados Unidad Cortical de Remodelamiento.
Esta unidad actúa de la siguiente manera; los osteoclastos producen en la zona cortical túneles longitudinales que avanzan en sentido centrífugo y frente a los cuales los osteoblastos que forman la capa ósea van cerrando dichos conductos actuando en sentido centrípeto.
El equilibrio armónico entre la destrucción y el crecimiento está regulado por el intercambio del líquido extracelular del hueso y el líquido extracelular sistémico. El pasaje del Ca++ se produciría desde este último al óseo por un proceso activo y los osteocitos se encargarían del proceso inverso.
La existencia de este proceso activo, energéticamente dependiente, asegura, aún en ausencia de PTH una concentración de Ca++ de 6 mg/100ml en la circulación.
La PTH actúa sobre los osteocitos de superficie obrando entonces en la modulación del intercambio del Ca++ entre los líquidos extracelulares. Provoca el au-mento del pasaje del Ca++ óseo a la circulación. Claro está que para que el Ca++ pueda realizar este pasaje debe generarse ácidos orgánicos en los osteocitos, inducido por la PTH.
Baja concentración de PTH activa los osteoclastos que están en reposo. Si dicha concentración aumenta hay mayor diferenciación de las células progenitoras a osteoclastos. Pero al mismo tiempo la PTH actúa sobre el proceso de la formación ósea. A dosis mayores disminuye el número de osteoblastos y por lo tanto la síntesis de colágeno, pero luego de unos días aumenta el número de osteoblastos y aquella síntesis.
La consecuencia de todos estos procesos es que los osteocitos de superficie aumentan su transferencia de Ca++ desde el líquido extracelular del hueso hasta la circulación, que los osteocitos profundos provocan la resorción del tejido óseo perilacunar y que las células progenitoras se transforman en osteoclastos provocando el aumento de unidades de remodelamiento y el incremento de la velocidad de recambio del hueso.
Por eso se produce, en última instancia, aumento de la resorción en la superficie endostal y estímulo de la formación a nivel perióstico.
B) Tirocalcitonina
La PTH es depositada en el gránulo secretorio y parcialmente degradada en la célula. 4 cuando la secreción es suprimida por un aumento en la concentración de Ca++, o 5 descargada en el LEC en respuesta a una disminución en la con-centración de Ca++.
FIGURA N° 8

*La concentración de Ca++(iónico), controla tanto los pasos de síntesis como de liberación. Uno de los más importantes sería la degradación intracelular de la hormona sintetizada. Una disminución de Ca++ inhibe la degradación, mien-tras que una elevación la aumenta.
Las variaciones en la secreción de PTH en respuesta a los cambios de la concen-tración de calcio no son lineales sino que representan una función sigmoidea de la calcemia.
Dentro de lo que puede considerarse como los límites de concentración normal del calcio circulante (9 a 10,5 mg/100ml) la variación en la secreción de PTH es relativamente reducida. En cambio, la velocidad de secreción aumenta con rapidez al disminuir la calcemia por debajo de 9,0 mg/100ml. El ritmo máximo de secreción de PTH se logra al alcanzar la calcemia un nivel de alrededor de 6 mg/100ml, no obteniéndose mayor respuesta aunque la disminución de calcio continúe disminuyendo.
FIGURA N°9
RELACION ENTRE LA CALCEMIA Y LA SECRECION DE PTH

*El ritmo máximo de secreción de PTH se obtiene al alcanzar la calcemia un nivel de 6 mg/100 ml y no se obtiene mayor respuesta aunque la concentración de calcio continúe disminuyendo. En el otro extremo de la curva puede observarse que a partir de 11 mg/100 ml se obtiene la máxima inhibición en la secreción de PTH, sin embargo, esta inhibición máxima no alcanza nunca a suprimir por completo la secreción de hormona.
La regulación ejercida por el calcio iónico sobre la secreción de PTH tiende a preservar, junto con otros mecanismos, los niveles de calcio extracelular.
La curva de regulación descripta tiene una significación directa en las patologías de las glándulas paratiroides. En vacas con Hipoparatiroidismo nutricional la calcemia no desciende por debajo de los 5-6 mg/100 ml. Este nivel de calcio extracelular puede ser mantenido indefinidamente por el calcio liberado de la enorme reserva del organismo que es el esqueleto, sin necesidad de ningún estímulo hormonal. En síntesis, el estímulo para una mayor secreción de PTH inducida por la hipocalcemia alcanza un nivel máximo en un punto (alrededor de 6 mg/100ml) en el cual una mayor concentración hormonal no serviría para ningún fin específico.
Por otra parte, la incapacidad del calcio iónico de suprimir por completo la secreción de PTH explica la fisiopatología del Hiperparatiroidismo con hipercalcemia.
HORMONA PARATIROIDEA CIRCULANTE Y METABOLISMO PERIFÉRICO
Desde a que se pudo medir PTH por radioinmunoanálisis se han identificado por lo menos tres fracciones diferentes de esta hormona, por lo tanto ahora sabe-mos que la misma no es homogénea en su composición química.
La primera fracción o Pico I es una PTH de peso molecular de alrededor de 9.500 presumiblemente con la secuencia de aminoácidos 1-84. Esta fracción es biológicamente activa; su vida media en la circulación es muy corta, solo de unos pocos minutos, y contiene tanto el extremo NH2 como el COOH terminal.
El pico II tiene un peso molecular de 7.500 aproximadamente, contiene solo el extremo COOH terminal, es biológicamente inactiva y su vida media en la circulación es de una hora.
El pico III, con un peso molecular aproximado de 3.500, contiene principalmente el fragmento NH2 terminal biológicamente activo y con una vida media en la circulación de apenas 2 a 4 minutos.
La presencia de los mencionados fragmentos de PTH en la circulación se debe al metabolismo periférico de la hormona que se efectúa en el hígado y en el riñón. La glándula secreta predominantemente la hormona intacta con la secuencia 1-84 de aminoácidos, aunque se admite que en determinadas circunstancia, principalmente en una hipercalcemia, puede liberar fragmentos a la circulación.
La hormona intacta es metabolizada en el riñón, responsable del 60% de su destrucción, en el hígado también ocurre esta degradación. En este órgano se encuentran receptores que reconocen la zona 24-48 de aminoácidos intactos. Por lo tanto, el hígado extrae de la circulación solamente la hormona intacta, a partir de la cual forma el fragmento 1-34 o 1-37 NH2 terminal biológicamente activo y el fragmento 34-84 COOH terminal carente de actividad. Este proceso se produce en las células de Kupffer, ya que la vida media de la PTH intacta es sólo 12 minutos en estas células, mientras que es de 80 minutos en los hepatocitos.
El hígado no extrae los fragmentos una vez que estos están en la circulación. Y lo más interesante es que la velocidad de conversión de la hormona intacta en sus fragmentos derivados depende de la concentración de Calcio en el medio de perfusión. Cuando la concentración disminuye a menos de 5 mg/100ml, la conversión se acelera, e inversamente por encima de 11 mg/100ml esa conversión se retarda.
El riñón en cambio es capaz de metabolizar tanto la PTH intacta como sus fragmentos.
Existen dos mecanismos distintos de degradación renal.
1. Por filtración glomerular y posterior reabsorción tubular y degradación intracelular, el riñón es capaz de metabolizar tanto la PTH intacta como sus fragmentos NH2 o COOH terminales.
2. Por extracción peritubular, las células peritubulares del riñón tienen receptores para la hormona para la hormona intacta y para el fragmento NH2 terminal - es necesaria la secuencia 25-34 -, los que serían metalizados y producirían los efectos renales de la hormona. No hay extracción renal peritubular de los fragmentos inactivos.
El hueso, uno de los principales efectores de la hormona, no ejerce ninguna función en su metabolismo periférico. El tejido óseo se limita a extraer el fragmento NH2 terminal, que es el único con actividad biológica sobre aquel, pero no extrae de la circulación la hormona intacta, ni los fragmentos COOH terminales.
En síntesis, la hormona intacta secretada por la glándula es hidrolizada en el hígado y en el riñón con formación de dos fragmentos, el NH2 terminal, con actividad biológica sobre todos los efectores y vida media muy breve, y el CO-OH terminal biológicamente inactivo, con vida media prolongada y solo degradable por filtración glomerular y reabsorción tubular en el riñón. La concentración de Calcio regularía la formación periférica de los fragmentos activos.
La concentración de PTH biológicamente activa, es de alrededor de 11 pg/ml, con un rango de 3 a 29 pg/ml.
FUNCION DE LA HORMONA PARATIROIDEA
El papel fisiológico fundamental de la PTH es el de mantener un tenor adecuado de Calcio en el compartimento extracelular. Para cumplir esta función la PTH actúa.
1. sobre el esqueleto, a través de una serie de mecanismos complejos que efectúan el Modelamiento y Remodelamiento óseo y el pasaje de Calcio a través de la membrana ósea.
2. Sobre el riñón aumentando la resorción tubular de Calcio y disminuyendo la de Fósforo.
3. Sobre el metabolismo de la vitamina D, estimulando la síntesis del 1,25(OH)2 D3 y secundariamente, la absorción intestinal de Calcio.
ACCION SOBRE EL HUESO
Debemos repasar la fisiología ósea ( ya descripta) para comprender la acción de la hormona sobre el hueso.
La PTH actuaría sobre tres procesos óseos:
a) Sobre los osteocitos de superficie y el intercambio de Calcio entre el Líquido Extracelular Óseo (LEC) y el sistémico.
b) Sobre los osteocitos de profundidad.
c) Sobre el remodelamiento y Modelamiento óseos a través de los osteo-clastos y osteoblastos.
La PTH aumenta el pasaje de Calcio del LEC óseo al sistémico. Esto podría producirse por el aumento en la producción de ácidos orgánicos que induce la PTH en los osteocitos, lo que a su vez aumenta la solubilidad del mineral y permite una mayor disponibilidad para su posterior liberación.
Independientemente o asociado a este mecanismo la PTH aumenta la actividad de la bomba de Calcio, a través de la cual los osteocitos incrementan la salida de este mineral hacia el LEC sistémico. La PTH es, asimismo, por lo menos en dosis farmacológicas un activo vasodilatador arterial, de esta manera que aumenta el flujo arterial del hueso. Este efecto de la PTH podría ser necesario para asegurar un correcto flujo circulatorio del hueso en el momento en que se produce una mayor salida de Calcio a través de la membrana formada por los osteocitos de superficie.
Alrededor de los osteocitos profundos existe un tejido óseo perilacunar poco estructurado y metabólicamente activo. Este metabolismo está regulado por los niveles de PTH. Un aumento rápido en la concentración de esta hormona determina una resorción de la matriz y disolución mineral. El incremento sostenido de la secreción de PTH lleva a aumentar el espacio perilacunar, con posibilidad de que estos espacios confluyan entre sí.
Siempre se generalizó la idea de que las respuestas bioquímicas ocurren principalmente en los osteoclastos, en la actualidad se considera que no siempre es así, puesto que datos histológicos muestran que los osteocitos tienen aún una mayor participación en la osteólisis, sobre todo en las etapas tempranas.
La respuesta mas temprana de las células óseas a la PTH es una entrada de los iones Ca++ y una activación de la adenilciclasa de la membrana.
El Ca++ que entra actúa como segundo mensajero en la respuesta Osteolítica. (elevando la concentración de Ca++ en la célula se activa la osteólisis). Se aprecia incremento en la síntesis de RNA en el hueso, salida de enzimas lisosómicas y aumento de la actividad de esas enzimas en solución.
También hay evidencias que la PTH estimula la formación de 3’-5’ AMPc en las células óseas y que éste es también un segundo mensajero en la respuesta Osteolítica. Este mensajero proviene de la activación de la adenilciclasa de la membrana.
Se comprobó que el Ca++ y el AMPc desempeñan papeles independientes en la respuesta celular a la PTH. La concentración aumentada de Ca++ en el medio no estimula sino que inhibe la actividad de la adenilciclasa y el AMPc no induce al aumento de la permeabilidad al calcio, ya sea in vivo o en células aisladas.
Un efecto conocido es la acción inhibitoria de la osteólisis ejercida por la calcitonina. Los últimos trabajos demuestran que la calcitonina no interviene en la entrada inicial de Ca++ o en la respuesta adenilciclásica de las membranas y tampoco en el bloqueo de la eliminación o activación de las enzimas Osteolítica.
El mecanismo propuesto por Rasmussen es que la calcitonina puede disminuir la concentración de Ca++ activo no por interferencia en la entrada sino por estímulo de la toma del Ca++ mitocondrial
Se ha comprobado que algunas quinasas - fosforiladas son totalmente independientes de la presencia del Ca++ iónico. Algunas de las fosforilaciones activan enzimas almacenadas en formas precursoras; otras probablemente liberan y activan enzimas hidrolíticas de los lisosomas.
Estos efectos bioquímicos acompañan a la osteólisis inducida por la PTH. Así se ve; síntesis acelerada de hialuronatos, Mucopolisacáridos sulfatados, acumulación de citratos y lactato, liberación de enzimas lisosómicas, activación de la anhidrasa carbónica y activación de fosfatasa ácida. Esta actividad se ha observado en los sitios de resorción activa.
La vitamina D (1-25 (OH)2 D3) que actúa en el control de la absorción intestinal es muy activa también para inducir osteólisis.
ACCION ARMONICA DE LA PTH EN EL REMODELAMIENTO OSEO
Como ya desarrollamos en Fisiología ósea los osteoblastos y osteoclastos actúan armónicamente en el proceso de remodelamiento del hueso, al punto que han sido en conjunto denominados Unidad Cortical de Remodelamiento.
Esta unidad actúa de la siguiente manera; los osteoclastos producen en la zona cortical túneles longitudinales que avanzan en sentido centrífugo y frente a los cuales los osteoblastos que forman la capa ósea van cerrando dichos conductos actuando en sentido centrípeto.
El equilibrio armónico entre la destrucción y el crecimiento está regulado por el intercambio del líquido extracelular del hueso y el líquido extracelular sistémico. El pasaje del Ca++ se produciría desde este último al óseo por un proceso activo y los osteocitos se encargarían del proceso inverso.
La existencia de este proceso activo, energéticamente dependiente, asegura, aún en ausencia de PTH una concentración de Ca++ de 6 mg/100ml en la circulación.
La PTH actúa sobre los osteocitos de superficie obrando entonces en la modulación del intercambio del Ca++ entre los líquidos extracelulares. Provoca el au-mento del pasaje del Ca++ óseo a la circulación. Claro está que para que el Ca++ pueda realizar este pasaje debe generarse ácidos orgánicos en los osteocitos, inducido por la PTH.
Baja concentración de PTH activa los osteoclastos que están en reposo. Si dicha concentración aumenta hay mayor diferenciación de las células progenitoras a osteoclastos. Pero al mismo tiempo la PTH actúa sobre el proceso de la formación ósea. A dosis mayores disminuye el número de osteoblastos y por lo tanto la síntesis de colágeno, pero luego de unos días aumenta el número de osteoblastos y aquella síntesis.
La consecuencia de todos estos procesos es que los osteocitos de superficie aumentan su transferencia de Ca++ desde el líquido extracelular del hueso hasta la circulación, que los osteocitos profundos provocan la resorción del tejido óseo perilacunar y que las células progenitoras se transforman en osteoclastos provocando el aumento de unidades de remodelamiento y el incremento de la velocidad de recambio del hueso.
Por eso se produce, en última instancia, aumento de la resorción en la superficie endostal y estímulo de la formación a nivel perióstico.
B) Tirocalcitonina
La calcitonina o Tirocalcitonina es un Polipéptido compuesto por 32 Aminoácidos con un puente disulfuro en la posición 1-7, con un peso molecular (PM) de 3.600.
Se produce en las células parafoliculares del tiroides, en las cuales se sintetiza la Pre-Pro-CalciTonina un Polipétido de 141 AA, que da lugar a la Pro-CT de 11 AA. Finalmente la Pro-CT. es procesada a Calcitonina de 32 AA y Catacalcina de 21 AA
El metabolismo se lleva a cabo en el hígado y riñón. La pérdida de un solo AA produce la anulación de gran parte de su actividad biológica.
Regulación de la secreción
El principal estímulo es el aumento del tenor de Calcio en el Líquido extracelular (LEC).
El Magnesio tiene un efecto similar, aunque en condiciones fisiológicas tiene poca acción.
La Gastrina, Pentagastrina, Secretina, Glucagón, estimulan la secreción de TC.
El alcohol es un potente estímulo, la respuesta es rápida y se produce tanto al ser administrado por vía endovenosa como oral.
Los estrógenos estimulan la secreción de TC durante la preñez y alcanza un nivel máximo en el último tercio y en el post parto inmediato.
Después de la ingestión de pastos ricos en Calcio, se produce una elevación momentánea de este mineral en plasma.
La CT secretada en respuesta a la Hipercalcemia Post Prandial “facilita” la transferencia neta de Calcio al riñón y suprime transitoriamente la resorción del hueso.
Esta acción sería necesaria en los estados del crecimiento (desarrollo post natal, crianza). Como la absorción de Calcio intestinal es la única ruta neta de entrada de Calcio al organismo y es durante el crecimiento cuando se necesita acumular gran parte del calcio que entra por esa vía, para soportar el crecimiento del esqueleto la, la CT juega en este punto un rol fundamental.
Es sabido que la CT posee valores altos en la circulación fetal y que su secreción es más efectiva en los jóvenes para disminuir en el envejecimiento.
Efectos de la calcitonina (ct) sobre el hueso
Se produce en las células parafoliculares del tiroides, en las cuales se sintetiza la Pre-Pro-CalciTonina un Polipétido de 141 AA, que da lugar a la Pro-CT de 11 AA. Finalmente la Pro-CT. es procesada a Calcitonina de 32 AA y Catacalcina de 21 AA
El metabolismo se lleva a cabo en el hígado y riñón. La pérdida de un solo AA produce la anulación de gran parte de su actividad biológica.
Regulación de la secreción
El principal estímulo es el aumento del tenor de Calcio en el Líquido extracelular (LEC).
El Magnesio tiene un efecto similar, aunque en condiciones fisiológicas tiene poca acción.
La Gastrina, Pentagastrina, Secretina, Glucagón, estimulan la secreción de TC.
El alcohol es un potente estímulo, la respuesta es rápida y se produce tanto al ser administrado por vía endovenosa como oral.
Los estrógenos estimulan la secreción de TC durante la preñez y alcanza un nivel máximo en el último tercio y en el post parto inmediato.
Después de la ingestión de pastos ricos en Calcio, se produce una elevación momentánea de este mineral en plasma.
La CT secretada en respuesta a la Hipercalcemia Post Prandial “facilita” la transferencia neta de Calcio al riñón y suprime transitoriamente la resorción del hueso.
Esta acción sería necesaria en los estados del crecimiento (desarrollo post natal, crianza). Como la absorción de Calcio intestinal es la única ruta neta de entrada de Calcio al organismo y es durante el crecimiento cuando se necesita acumular gran parte del calcio que entra por esa vía, para soportar el crecimiento del esqueleto la, la CT juega en este punto un rol fundamental.
Es sabido que la CT posee valores altos en la circulación fetal y que su secreción es más efectiva en los jóvenes para disminuir en el envejecimiento.
Efectos de la calcitonina (ct) sobre el hueso
La CT inhibe la resorción, acción que lleva a cabo reduciendo el número de Osteoclastos.
Ellos se retraen y se separan de la superficie ósea, disminuyendo el número de sus núcleos. En los Osteoclastos existen millones de receptores a la CT en una magnitud 2 a 3 veces superior a la existente en otro tipo de células.
En las vacas adultas donde la tasa de recambio es moderada la CT no produce una marcada hipocalcemia.
La CT provoca una disminución en el tamaño de los Osteoclastos de profundidad, los núcleos se hacen picnóticos, de esta manera disminuye la actividad Osteocítica Periostiocitaria.
La CT estimula el desarrollo del cartílago de crecimiento, aumenta la producción de glucoproteína y de Colágeno óseo en los Osteoblastos.
Efectos de la calcitonina sobre el riñón
La hormona aumenta la eliminación de calcio y Fósforo contribuyendo a la Hipocalcemia e Hipofosfatemia.
Por lo tanto su acción es semejante a la PHT con respecto al Fósforo y antagónica con el Calcio.
Aumenta la excreción renal de Na+, K+ y Mg++. La CT aumenta la captación de Fosfatos por los tejidos blandos, especialmente hígado.
Integración de la regulación hormonal en el control del metabolismo del calcio y fósforo
Una disminución en la Calcemia provoca un aumento de la liberación y síntesis de PTH. Esta actúa en forma medianamente rápida sobre la resorción tubular, disminuyendo la excreción de Calcio y aumentando la de Fosfatos.
La PHT actúa también sobre el hueso aumentando el pasaje de Calcio a través de la membrana que separa el LEC óseo del sistémico, incrementando la Osteólisis alrededor de los Osteocitos.
Esta respuesta “combinada” sería suficiente para que la Calcemia retornara a su nivel normal, ante estímulos “poco intensos y prolongados”.
En caso contrario continúa la secreción de PHT y se ponen en juego mecanismos que prolongan y acentúan la acción hormonal.
Sobre el hueso se produce un aumento de la actividad del número de Ostoclastos con activación de nuevas Unidades Corticales de Remodelamiento Óseo (UCR), a su vez comienzan a aparecer los efectos de la 1-25(OH)2 D3, aumentando la resorción intestinal de Calcio, reforzando también la activación de la PHT sobre la resorción Ósea.
Ellos se retraen y se separan de la superficie ósea, disminuyendo el número de sus núcleos. En los Osteoclastos existen millones de receptores a la CT en una magnitud 2 a 3 veces superior a la existente en otro tipo de células.
En las vacas adultas donde la tasa de recambio es moderada la CT no produce una marcada hipocalcemia.
La CT provoca una disminución en el tamaño de los Osteoclastos de profundidad, los núcleos se hacen picnóticos, de esta manera disminuye la actividad Osteocítica Periostiocitaria.
La CT estimula el desarrollo del cartílago de crecimiento, aumenta la producción de glucoproteína y de Colágeno óseo en los Osteoblastos.
Efectos de la calcitonina sobre el riñón
La hormona aumenta la eliminación de calcio y Fósforo contribuyendo a la Hipocalcemia e Hipofosfatemia.
Por lo tanto su acción es semejante a la PHT con respecto al Fósforo y antagónica con el Calcio.
Aumenta la excreción renal de Na+, K+ y Mg++. La CT aumenta la captación de Fosfatos por los tejidos blandos, especialmente hígado.
Integración de la regulación hormonal en el control del metabolismo del calcio y fósforo
Una disminución en la Calcemia provoca un aumento de la liberación y síntesis de PTH. Esta actúa en forma medianamente rápida sobre la resorción tubular, disminuyendo la excreción de Calcio y aumentando la de Fosfatos.
La PHT actúa también sobre el hueso aumentando el pasaje de Calcio a través de la membrana que separa el LEC óseo del sistémico, incrementando la Osteólisis alrededor de los Osteocitos.
Esta respuesta “combinada” sería suficiente para que la Calcemia retornara a su nivel normal, ante estímulos “poco intensos y prolongados”.
En caso contrario continúa la secreción de PHT y se ponen en juego mecanismos que prolongan y acentúan la acción hormonal.
Sobre el hueso se produce un aumento de la actividad del número de Ostoclastos con activación de nuevas Unidades Corticales de Remodelamiento Óseo (UCR), a su vez comienzan a aparecer los efectos de la 1-25(OH)2 D3, aumentando la resorción intestinal de Calcio, reforzando también la activación de la PHT sobre la resorción Ósea.
Es de primordial importancia para el mantenimiento de la acción de la PHT la existencia de un nivel adecuado de “mineralización ósea”, de allí que si no existe actividad de Vitamina D no hay acción de PHT.
Fundamentales son entonces los efectos combinados de 1-25(OH)2D3 y PHT.
La Figura N°9 nos demuestra la integración del mecanismo hormonal, allí podemos ver como la regulación de la Calcemia es un mecanismo estrechamente ligado al equilibrio de dichas hormonas.
Siendo el Calcio un mineral estrechamente regulado, se puede predecir una futuro desequilibrio cuando los valores de este mineral varían ampliamente de un animal a otro.
Las figuras 10 y 11 muestran la integración de la Vitamina D y sus metabolitos con la PTH y Tirocalcitonina i en la regulación de la Calcemia.
La Figura N°9 nos demuestra la integración del mecanismo hormonal, allí podemos ver como la regulación de la Calcemia es un mecanismo estrechamente ligado al equilibrio de dichas hormonas.
Siendo el Calcio un mineral estrechamente regulado, se puede predecir una futuro desequilibrio cuando los valores de este mineral varían ampliamente de un animal a otro.
Las figuras 10 y 11 muestran la integración de la Vitamina D y sus metabolitos con la PTH y Tirocalcitonina i en la regulación de la Calcemia.
FIGURA N° 10
Consecuencias de una Hipocalcemia
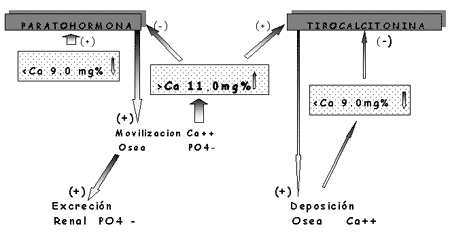
FIGURA N°11
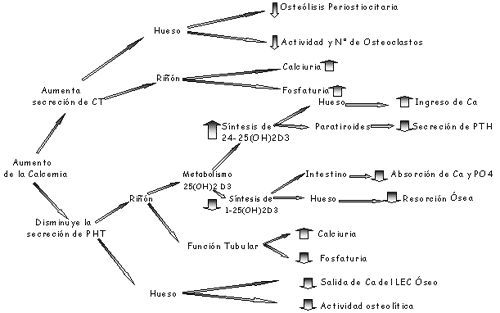
FIGURA N°11
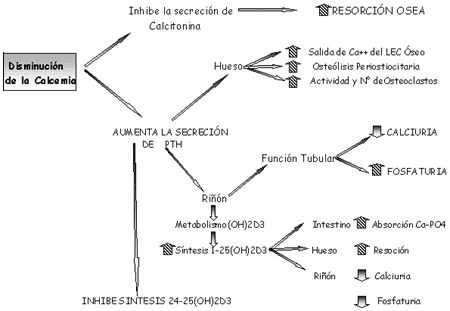
Consecuencias de una Hipocalcemia

FIGURA N°11

FIGURA N°11

Temas relacionados:
Autores:
Laboratorios Burnet
Recomendar
Comentar
Compartir
6 de agosto de 2021
que opinon me dan el mes pasado se me murio una trenera de 22 dias de nacida , estaba mamando bien , al dia siguiente amanecio tirada en el suelo y tiraba la cabeza hacia atras y sin fuerzas patas y manos la pude levantar , y volvio a a normalidad , a los ocho dias volvio con los sintomas y tirada en el piso y las extrmidadas como tiesas y la cabeza hacia atras , y no la pude salvar murio, que me recomienda deficiencia de la vaca , le dio un tetano, le dio un derrame cerebral, o nacio con problenas congenitos
Recomendar
Responder
22 de marzo de 2018
Con una dieta alcalina bajarían los niveles de fósforo y parathormona ,en pacientes ERC????
Recomendar
Responder
27 de agosto de 2015
Hola. Qué sucede cuando existe un nivel muy bajo de PTH? Me hicieron una paratiroidectomia y ahora mi nivel de PTH es muy bajo: <3 .
Existe un medicamento que pueda ayudar a subir el nivel?
Recomendar
Responder
2 de agosto de 2015
Las hormonas que regulan la Hipercalcemia, son las mismas que regulan Hipocalcemia ? En que difieren cuando hay un alto o bajo de calcio?
Recomendar
Responder
26 de agosto de 2013
buenos dias
me podrian proporcionar los valores normales de calcio, fosforo y magnesio en cerdos? o donde puedo buscar por que no hay referencias bibliograficas recientes. muchas gracias de antemano
Recomendar
Responder
Recomendar
Responder
Recomendar
Responder
20 de noviembre de 2012
Buenos días, quería saber dónde puedo conseguir información respecto al consumo de diversos cítricos con productos lácteos para la mejor asimilación del calcio
Recomendar
Responder
5 de junio de 2012
quisiera saber si el calcio y el fosforo presentes en el calfos y/o roca fosforica es absorbido por el intestino de los rumiantes y en que porcentaje?
Recomendar
Responder


Evonik Animal Nutrition
Evonik Nutrición Animal es una empresa global con origen en Alemania que provee productos y servicios tales como aminoacidos y probióticos para aves y cerdo
Enlace recomendado
27 de octubre de 2008
que calcio me recomienda para becerro de 4 meses,otra pregunta porque el becerro amanecio con su cuello torcido es normal? a que se debe esta torcedura
Recomendar
Responder

¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.










