Absorción y depósito de xantofilas en pollos de engorda desafiados con tres diferentes niveles de ooquistes de Eimeria acervulina
Publicado: 1 de junio de 2021
Por: Xóchitl Hernández Velasco (Depto. Medicina y Zootecnia de Aves. Facultad de Medicina Veterinaria y Zootecnia, Universidad Nacional Autónoma de México); Benjamin Fuente Martínez (CEIEPAv, FMVZ, UNAM. México); Manuel Quiroz Pesina (Industrias Vepinsa S.A. de C.V.); Chapman DH, Owens CM, Kuttappan VA, , Latorre JD, Kallapura G, Lisa RB, Rathinam T, Hargis BM, Dr. Guillermo Tellez (Department of Poultry Science, University of Arkansas. EE.UU.)
Introducción
Una gran cantidad de aves se comercializan como canales completas o en piezas con piel (Sirri, et al., 2010). La preferencia por el color amarillo de la piel del pollo de engorda depende de factores culturales, históricos y tipos de cultivos regionales (Heffner et al., 1964; Fletcher, 1999) y es asociado con un buen estado de salud del ave, mayor frescura de la canal y mejor sabor de la carne (Breithaupt, 2007; Liu et al., 2008). En México los productores identifican la marca comercial con base en el grado de amarilleamiento cutáneo de su producto. Esta competencia y el ciclo de producción cada vez más corto de pollo actual requieren la adición de altas concentraciones de pigmento a la dieta llegando a representar del 8 al 10 % de su costo total (Muñoz et al., 2012). Además, recientemente se han atribuido ventajas adicionales de la inclusión de Xa a la dieta de animales destinados a la alimentación humana (Baker y Günther, 2004; Kijlstra et al., 2012), por lo que seguramente seguirá adicionándose pigmento a la dieta de las aves comerciales.
La coccidiosis aviar (CA) puede ocasionar pérdida de peso, disminución en la conversión alimenticia y causar mala digestión debido al daño físico y a los cambios fisiológicos y químicos relacionados a la invasión de los enterocitos por parte del parásito (McDougald y Fitz-Coy, 2008; Assis et al., 2010). La severidad de éste efecto varía de acuerdo con la especie de Eimeria, el nivel de desafío; así como, el estado inmunológico del ave y los factores complicantes que se presenten. En países como China, Perú, Italia y México, donde es importante la pigmentación amarilla de la piel del pollo, la CA puede reducir la absorción intestinal y depósito de xantofilas (Xa) en piel (Ruff y Fuller, 1975; Mc Dougald y Fitz-Coy, 2008). Dentro de las especies de eimerias que comúnmente afectan al pollo de engorda, E. acervulina y E. maxima provocan una importante reducción en los carotenoides plasmáticos (Ruff y Fuller, 1975; Sharma y Fernando, 1975; Ogbuokiri y Edgar 1986), debido a que estas especies causan descamación y acortamiento de las vellosidades de la mucosa intestinal y parasitan los sitios de mayor absorción de pigmento en el intestino del pollo (Littlefield et al., 1972; Tyczkowski y Hamilton, 1986; Allen 1989), esta reducción en la absorción de Xa se correlaciona con una reducción del depósito de pigmento en la piel (Dua et al., 1967; Mc Dougald y Fitz-Coy, 2008).
La detección de un problema de CA en campo se lleva a cabo mediante la evaluación de la apariencia de las heces, severidad de las lesiones macroscópicas en intestino y evaluación de registros productivos. Sin embargo, cuando se detectan cambios en estas variables ya se han generado daños graves en el tejido intestinal y en su capacidad funcional. Además de que no siempre se correlacionan a la severidad de la infección. Además, a pesar de la importancia económica que tiene el pigmento en algunos países y que comúnmente es afectado en el campo por Eimeria spp no hay estudios que evalúen el efecto del nivel de la infección de E. acervulina en la absorción de Xa y en el depósito de pigmento en la piel de pollo de engorda al final de su ciclo productivo, ni del efecto que tiene el sexo del ave en esta respuesta. Por lo anterior, en este estudio, fue investigado el efecto de diferentes niveles de ooquistes esporulados de E. acervulina en la absorción y depósito de Xa en la piel de pollos de engorda cuando son es adicionado en la dieta pigmento natural de flor de Cempasuchil (Tagetes erecta).
Materiales y Métodos
Aves de experimentación. 192 pollitos de engorda sexados (96 hembras y 96 machos) de un día de edad, Cobb 500 broiler fueron identificados individualmente y distribuidos aleatoriamente en 16 corrales en una unidad experimental con ambiente controlado del Poultry Health Laboratory, University of Arkansas, Fayetteville AR, 72701, U.S.A. Todos los manejos efectuados en las aves experimentales estuvieron de acuerdo con el Institutional Animal Care and Use Committee of the University of Arkansas.
Alimento. Todas las aves fueron alimentadas ad libitum con una dieta en harina a base de maíz y pasta de soya cubriendo los requerimientos nutricionales recomendados por la estirpe (Cobb-Vantress Inc, 2012). Las aves del grupo testigo recibieron en el alimento 60ppm de salinomicina en el alimento iniciador (1-20 días de edad) y alimento finalizador (21-42 días de edad); mientras que las aves inoculadas con E. acervulina sólo recibieron salinomicina en el alimento iniciador del día 1 al 14 de edad. Todos los grupos recibieron 74 ppm de Xa naturales de flor de Cempasuchil (Tagetes erecta).en el alimento finalizador.
Inóculo. La cepa de Eimeria acervulina US-AR-05-01 fue aislada de una granja comercial en el noroeste de Arkansas y fue donada por el Dr. David Chapman. Las aves de los grupos 2, 3 y 4 fueron desafiadas individualmente por medio de una sonda esofágica a los 21 días de edad con 1X102, 1X104, y 1X105 ooquistes esporulados de E. acervulina/1 ml de PBS.
Xantofilas plasmáticas. Al día 21 de edad y semanalmente, se tomaron individualmente de tres aves por réplica 2 ml de sangre con 1mg of EDTA/ml de sangre. Las muestras fueron conservadas en hielo y protegidas de la luz para su procesamiento. El plasma fue obtenido por centrifugación y la concentración de Xa plasmáticas fue determina por espectrofotometría. de acuerdo con Allen, P. C., H. D. Danforth, V. C. Morris, and O. A. Levander. 1996. Association of lowered plasma carotenoids with protection against cecal coccidiosis by diets high in n-3 fatty acids. Poultry Science 75:966–972. Allen, P. C., H. D. Danforth, V. C. Morris, and O. A. Levander. 1996. Association of lowered plasma carotenoids with protection against cecal coccidiosis by diets high in n-3 fatty acids. Poultry Science 75:966–972. Allen (1989).
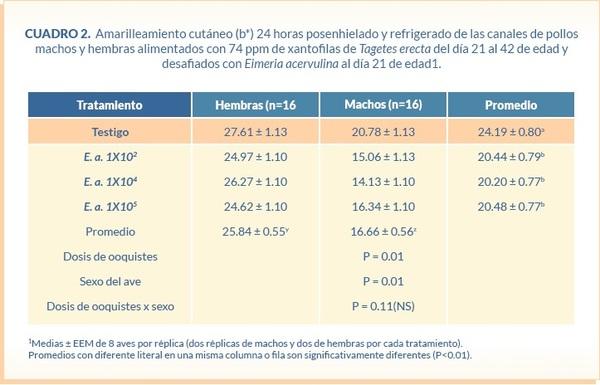
Pigmento cutáneo. A los días 21, 28, 35 y 42 de edad se midió el amarilleamiento cutáneo (b*) in vivo en la zona aptérica lateral derecha de todas las aves utilizando el sistema CIE (1978), con un colorímetro de reflectancia. Al día 42 de edad se evaluó el pigmento cutáneo (b*) en la piel de la pechuga y de la región abdominal en las canales después de pasar por el tanque de enfriamiento y en la piel de la pechuga 24 h después de su enhielado y refrigeración.
Parámetros productivos. Se registró el peso corporal de las aves al inicio y al final de la prueba. Se llevaron registros de consumo de alimento (g), ganancia de peso (g) y conversión alimenticia (kg: kg).
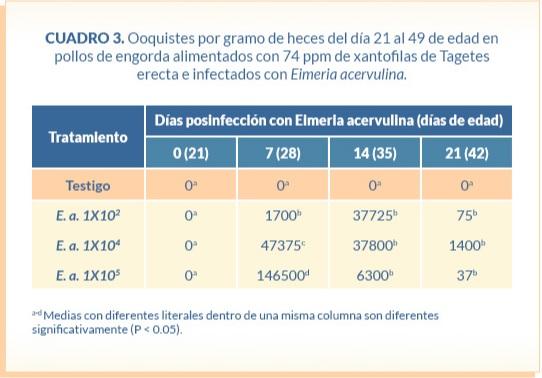
Número de ooquistes en heces. Se colectaron muestras de heces frescas a partir de 5 aves por réplica (corral) a los 21 días de edad para (muestreo basal), y posteriormente cada semana a lo largo del estudio, empleando la técnica de McMaster (Hodgson, 1970).
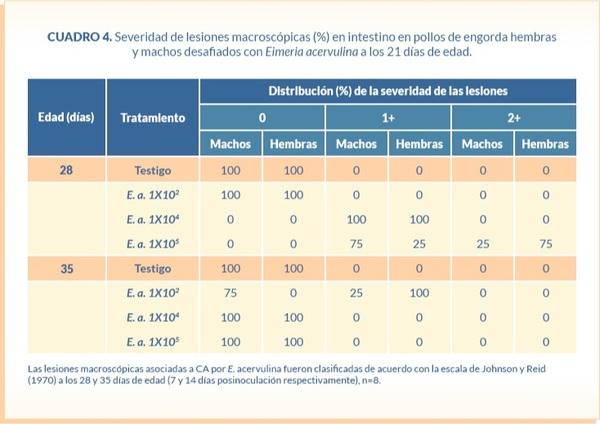
Severidad de lesiones macroscópicas en intestino. Dos aves por réplica fueron sacrificadas de acuerdo con la American Veterinary Medical Association Guidelines for the Euthanasia of Animals (AVMA, 2013) a los 7 y 14 días posinfección (DPI) para evaluar la severidad de las lesiones macroscópicas en duodeno asociadas a E. acervulina de acuerdo con la escala de Johnson y Reid (1970).
Análisis estadístico. Las variables productivas: consumo de alimento (g), ganancia de peso (g) y conversión alimenticia (kg:kg), además del pigmento cutáneo (b*) en aves vivas y en canal fueron evaluadas por un ANOVA en un diseño completamente al azar con un arreglo factorial 4x2 donde el primer factor fueron los tratamientos (1X102, 1X104, y 1X105 ooquistes esporulados de E. acervulina) y el segundo factor fue el sexo del ave (hembra o macho). La diferencia de medias entre tratamientos fue analizada con la prueba de Tukey. Los valores fueron considerados diferentes estadísticamente a una significancia de P<0.05.
A los datos de la pigmentación cutánea y plasmática se les realizó una regresión múltiple, las variables independientes fueron el tiempo de consumo de pigmento y los tratamientos, y la variable indicadora el sexo del ave (Neter y Wasserman, 1996; Kuehl, 2001); donde 1= hembras y 0= machos. Además, se realizó una matriz de correlación del grado de amarilleamiento en piel de la pechuga y de la región abdominal.
La cantidad de ooquistes por gramo de heces se evaluó con la prueba de Kruskal-Wallis y la diferencia entre las medianas de los tratamientos se analizó con la prueba U de Mann-Whitney por medio del Stadistical Program Social Science (SPSS).
Resultados
Al inicio de la prueba (día 21 de edad) los pesos de las aves fueron similares entre grupos, las hembras pesaron en promedio 668 ± 10g y los machos 841 ± 10g. Al final de la prueba los parámetros productivos del día 21 al 42 de edad (consumo acumulado de alimento, índice de conversión, ganancia de peso) fueron similares (P>0.05) en todos los tratamientos (Cuadro 1).
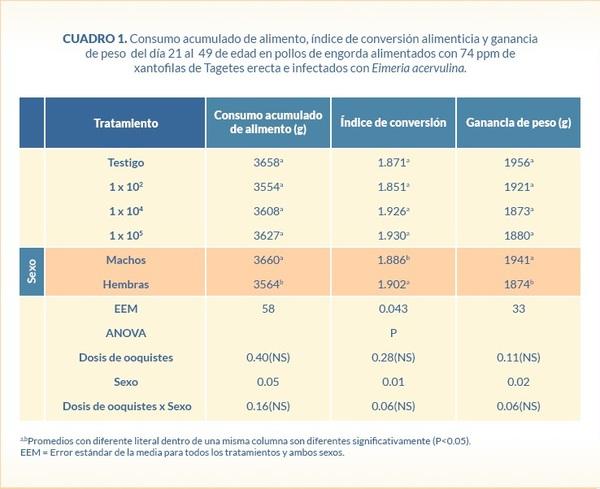
Por cada día de consumo de pigmento se incrementaron las Xa plasmáticas en 1.26 µg/ml y por cada 1,000 ooquistes administrados de E. acervulina se redujo la concentración de Xa en plasma en 0.02 µg/ml (R2=61.60%) (P<0.01). Esto es explicado por la siguiente ecuación: Y= 11.105 - 0.02 (número de ooquistes X103) + 1.26 (días posinfección) - 0.04 (días posinfección)2 + 5.15 (sexo) (Figura 1).
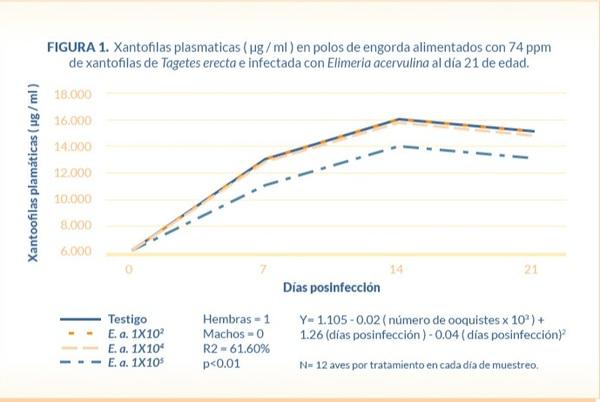
En relación con el depósito de pigmento cutáneo in vivo en los pollos de ambos sexos se observó una respuesta lineal (R2=85.95%) (P<0.01), donde en promedio por cada día que las aves consumieron el alimento adicionado con 74 ppm de Tagetes erecta la coloración de la piel se incrementó en 0.57 b*. Además, se observó una diferencia en la capacidad de pigmentación cutánea de acuerdo con el sexo del ave, pues las hembras pigmentaron 6.17 b* más que los machos. Sin embargo; en las aves que fueron desafiadas con Eimeria acervulina, por cada 1X103 ooquistes esporulados de E. acervulina que les fueron administrados vía oral se redujo el amarilleamiento cutáneo en 0.019 b*. Este efecto es explicado por la siguiente ecuación: b*=4.43 - 0.019 (número de ooquistes X 103) - 6.17 (sexo) + 0.57 (días posinfección) - 0.011*(días posinfección)2 (Figura 2).
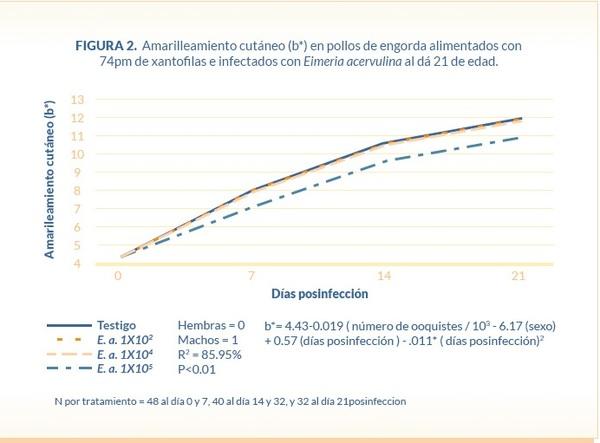
El amarilleamiento cutáneo (b*) en abdomen y pechuga de las canales de pollo después del chiller estuvieron correlacionados significativamente (r = 0.76; P<0.01), lo cual indica que el nivel de amarilleamiento (b*) en la piel de la región abdominal es igual a: b*= 8.58+0.78*unidades de amarilleamiento (b*) en la piel de la pechuga después del tanque de enfriamiento con una P<0.01 (Figura 3).
Después de 24 horas de enhielado y refrigerado, el amarilleamiento cutáneo (b*) en la piel de la pechuga de las canales fue mayor en el grupo control en comparación con el resto de los grupos (P<0.01). No se observó diferencia estadística entre los grupos infectados con E. acervulina. Además, en todos los tratamientos los valores de amarilleamiento en la piel de la hembra fueron mayores (P<0.01) en comparación con los del macho (Cuadro 2).
El grupo control se mantuvo negativo en los conteos de ooquistes en heces así como a las lesiones macroscópicas asociadas a E. acervulina durante toda la prueba. El número de ooquistes excretados por gramo de heces se relacionó a la dosis de ooquistes inoculados a los 7 días posinfección (DPI), posteriormente fueron similares entre los grupos desafiados (Cuadro 3).
La severidad de las lesiones macroscópicas en el duodeno atribuibles a E. acervulina fueron leves siendo en su mayoría de 1+, solamente se observaron lesiones 2+ en el grupo desafiado con 1X104 ooquistes de E. acervulina y disminuyeron rápidamente después del día 28 de edad (7 días PI) en todos los grupos (Cuadro 4), por lo que después del día 35 de edad (14 días PI) no se sacrificaron más aves.
Discusión
En estudios previos, la inoculación de pollos de engorda con 5X105 ooquistes de E. acervulina por ave resultó en un decremento en la ganancia de peso, peso de la canal y de la pechuga a los 6 DPI (Fetterer y Allen, 2000). Así como la ganancia de peso y el consumo de alimento se afectaron negativamente a los 5 DPI con 105 y 106 ooquistes en aves de 9 días de edad (Conway et. al., 1993). En el presente estudio, el peso corporal se evaluó solo al inicio y al final del experimento y no se encontraron diferencias entre los tratamientos. Una significativa reducción en la absorción de nutrientes, capacidad para metabolizar energía y depósito de nutrientes en los tejidos corporales de machos Leghorn al día 16 de edad fue reportado por Sharma y Fernando (1975), durante la fase aguda de la infección usando 1x105 ooquistes de E. acervulina. Ellos reportaron una marcada disminución en la absorción de nutrientes, en la capacidad para metabolizar energía, y en el depósito de estos nutrientes en los tejidos corporales de machos Leghorn de 38.5 semanas de edad durante la fase aguda de la infección (de 0 a 4 DPI) con 1X105 de E. acervulina y lo correlacionaron a la reducción en la composición química y nutricional de la canal; asimismo, mencionan una fase de recuperación (de los 9 a 14 DPI). Ellos consideran que este fue tiempo suficiente para que se presentara una fase compensatoria o de recuperación de peso. Esto puede explicar porque en este estudio no se encontró diferencia entre los tratamientos desafiados y el testigo al día 42 de edad de las aves (21 DPI).
Muy pocos trabajos han evaluado el efecto de la infección por E. acervulina en la absorción o en el depósito de pigmento en la piel del pollo de engorda. Tyczowski et al., 1991 evaluaron la respuesta a la infección con 1.5X105 de E. acervulina en pollos machos jóvenes (de 15 días de edad) alimentados con maíz amarillo y encontraron a los 4, 6 y 10 DPI niveles de 1.91, 1.12 y 2.42 µg/ml de luteína en el suero respectivamente en comparación con el día 0 (9.18 µg/ml). Por su parte Conway et. al., (1993) reportaron una disminución severa del nivel de carotenoides en plasma al inocular pollitos de 9 días de edad desde 102 a 106 ooquistes por ave a los 5 DPI. En trabajos previos los niveles de carotenoides en plasma han sido identificados como un buen indicador de la integridad fisiológica del intestino y también cono una alternativa rápida y sensible para medir el efecto de las infecciones por Eimeria en pollos de engorda (Ruff y Fuller, 1975; Conway et al., 1993).
En este estudio se observó que por cada 1,000 ooquistes de E. acervulina administrados se redujo 0.02µg/ml la concentración de Xa en plasma (R2=61.60%; P<0.01). Solo se observó diferencia en la cantidad de Xa plasmáticas entre el grupo testigo y el grupo infectado con la dosis más alta (1X105 ooquistes esporulados de E. acervulina), lo que sugiere que las dosis de 1X102 y 1X104 ooquistes de E. acervulina fueron muy bajas o bien la cepa utilizada en este estudio fue de baja virulencia.
En relación con el pigmento cutáneo in vivo Ogbuokiri y Edgar (1986) reportaron que la infección con 6 X 105 ooquistes de E. acervulina en pollos de engorda de 6 semanas que recibieron 13.55 ppm de Xa en el alimento, redujo significativamente la pigmentación de los tarsos a los 4, 7 y 14 DPI, utilizando el abanico de Roche. En el presente estudio se observó que por cada 1,000 ooquistes de E. acervulina administrados en las aves el amarilleamiento cutáneo disminuyó 0.019 unidades (b*).
Además, se encontró una respuesta lineal (R2=85.95%) del pigmento cutáneo in vivo que se incrementó 0.57 unidades de amarilleamiento (b*) por cada día que el pollo consumió el pigmento. Las hembras mostraron una mayor capacidad de pigmentación (6.17 b*) con respecto al macho (P<0.01) aún cuando consumieron menor cantidad de alimento y por lo tanto de pigmento (Cuadro 1). Estos resultados concuerdan con estudios anteriores donde el amarilleamiento cutáneo en pechuga, muslo o tarsos fue mayor (P ? 0.01) en hembras que en machos (Sirri et al., 2010); así como, en la piel de la pechuga de pollos alimentados con 75ppm de Xa del día 21 al 49 de edad, las hembras tuvieron una mayor pigmentación cutánea (3.77 b*; P<0.01) que los machos al día 49 de edad (Muñoz et al., 2012). El mayor grado de amarilleamiento cutáneo en la hembra se atribuye a una mayor cantidad de grasa en el tejido subcutáneo, lo cual está relacionado a la genética y factores hormonales (Le Bihan-Duval et al., 1998; Rance et al. 2002; Sirri et al., 2010).
Se observó también una correlación lineal significativa (r=0.76; P<0.01) entre el grado de amarilleamiento cutáneo (b*) en la pechuga y en el abdomen de las canales de pollo después de pasar por el tanque de enfriamiento, lo que concuerda con lo reportado por Sirri et al., (2010) quienes encontraron que el amarilleamiento cutáneo en pechuga y muslos estuvieron significativamente correlacionados (r = 0.85; P < 0.01). Sugiriendo que la evaluación del pigmento cutáneo se puede realizarse en cualquiera de estos.
En relación con la severidad de las lesiones macroscópicas en intestino, Ruff y Fuller (1975), inocularon pollos Cobb con 1 X 106 E. acervulina a los 14 y 21 días de edad, obtuvieron un promedio de severidad de las lesiones de 3.8. En el presente estudio solamente se observaron grados de severidad de lesiones 1+ y 2+ con la dosis de 1X105 ooquistes de E. acervulina por ave. El nivel de desafío, la virulencia de la cepa y su capacidad de replicación en el intestino son algunos de los factores más comúnmente relacionados a la severidad del daño en el tejido y afectación a la fisiología intestinal en las infecciones por Eimeria. Sin embargo, el comportamiento de la infección y la respuesta a esta son variables entre individuos y entre pruebas, aún bajo las mismas condiciones de experimentación con la misma cepa (Williams, 2006). Los niveles de carotenoides en el plasma han sido utilizados como indicadores de la severidad de la infección con eimerias (Conway et al., 1993; Fetteren y Allen, 2000), en comparación con otras variables como el peso corporal, severidad de lesiones macroscópicas intestinales y número de ooquistes (Conway et. al., 1990). Las mediciones de Xa en plasma en respuesta a los niveles de infección con E. acervulina pueden ser una herramienta que contribuya a determinar la virulencia de las cepas de Eimeria. Es necesario hacer más estudios que evalúen el efecto de esta variable con otras cepas de Eimeria acervulina y otras especies de Eimeria en la concentración de Xa plasmáticas para determinar las limitaciones o beneficios de éste y otros parámetros que comúnmente se usan para evaluar los efectos patológicos y económicos de las infecciones por eimerias.
Referencias
- Allen P.C. 1987. Physiological responses of chicken gut tissue to coccidial infection: comparative effects of E. acervulina and E. mitis on mucosal mass, carotenoid content, and brush border enzyme activity. Poult. Sci. 66:1306-1315.
- Allen, P. C. 1989. Biochemical aspects of carotenoid malabsorption during coccidiosis in chickens, a review. Pages 193-203 in Coccidia and intestinal coccidiomorphs, Vth international coccidiosis conference, Les Colloques I’INRA. P. Yvore, ed. INRA, Paris.
- American Veterinary Medical Association. 2013. The American Veterinary Medical Association Guidelines for the Euthanasia of Animals. 1931 N. Meacham Road Schaumburg, IL.
- Assis, R., F. Luns, M. Beletti, R.L. Assis, N.M. Nasser, E.S. M. Faria, M.C. Cury. 2010. Histomorphometry and macroscopic intestinal lesions in broilers infected with E. acervulina. Vet. Parasitol. 168:185–189.
- Baker, R.,C. Günther. 2004. The role of carotenoids in consumer choice and the likely benefits from their inclusion into products for human consumption. Trends Food Sci. Technol.15:484-488.
- Breithaupt, D.E. 2007. Modern application of xanthophylls in animal feeding. Trends Food Sci. Technol. 18:501-506.
- CIE. (1978) Recommendations on Uniform Colour Spaces, Colour Difference Equations, Psychometric Colour Terms. CIE Publication No. 15 (E-1.3.1) 1971/ (TO-1.3). Suppl. 15. CIE, Paris, France.
- Conway, D.P., M.E. McKenzie, A.D. Dayton. 1990. Relationship of coccidial lesion scores and weight gain in infections of E. acervulina, E. maxima, and E. tenella in broilers. Avian Pathol. 19:489-496.
- Conway, D., K. Sasai, S.M. Gaafarr, C. Smothers. 1993. Effect of different levels of oocysts inocula of E. acervulina, E. tenella, and E. maxima on plasma constituents, packed cell volume, lesion scores, and performance in chickens. Avian Dis. 37:118-123.
- Fetterer, R. H., and Allen P.C. 2000. Eimeria acervulina infection elevates plasma and muscle 3-methylhistidine levels in chickens. J. Parasitol. 86:783-791.
- Fletcher, D. L. 1999. Poultry meat color. Pages 159-174 in Poultry Meat Science. R. I. Richardson and G. C. Mead, ed. CAB International, Oxon, UK.
- Hadden, W.L., Watkins, R.H., Levy, L.W., Regalado, E., Rivadeneira, D.M., Van Breemen, R.B. and Schwartz, S.J. (1999) Carotenoid composition of marigold (Tagetes erecta) flower extract Used as Nutritional Supplement. J. Agricult. Food Chem. 47:4189-4194.
- Heffner, J. E., P. Roy, B. H. Davis, and W. B. Hilton. 1964. Consumer preference for broiler pigmentation in New Orleans, Louisiana. Agr. Exp. Stat. Bull. 586. La. State Univ., Baton Rouge, LA.
- Hodgson, J. 1970. Coccidiosis: oocyst counting technique. Exp. Parasitol. 28:99-102.
- Johnson, J., and W. M. Reid. 1970. Anticocciddial drugs: lesion scoring techniques in battery and floor–pen experiments with chickens. Exp. Parasitol. 28:30-36.
- Kijlstra A., Y. Tian, R. Kelly, T. Berendscot. 2012. Lutein: more than just a filter for blue light. Poultr. Sci. 31:303-315.
- Kotake-Nara E., Nagao, A. 2011. Absorption and metabolism of xanthophylls. Marine Drugs, 9:1024-1037.
- Kuehl, R. O. 1999. Design of Experiments: Statistical Principles of Research Design and Analysis. 2th ed. Book News, Inc., Portland, OR.
- Kuttappan, V., V. Brewer, A. Mauromoustakos, S. McKee, J. Emmert, J. Meullenet. 2013. Estimation of factors associated with the occurrence of white striping in broiler breast fillets. Poult. Sci. 92:811-819
- Le Bihan-Duval, E., S. Mignon-Grasteau, N. Millet & C. Beaumont. 1998. Genetic analysis of a selection experiment on increased body weight and breast muscle weight as well as on limited abdominal fat weight. Br. Poult. Sci. 39:346–353.
- Littlefield, L.H., J.K. Bletner, H.V. Shirley, O.E. Goff. 1972. Locating the site of absorption of xanthophylls in the chicken by surgical technique. Poult. Sci. 51:1721-1725.
- Liu G.D., G. Hou, D.J. Wang, S.J. Lv, X.Y. Zhang, W.P. Sun, Y. Yang. 2008. Skin pigmentation evaluation in broilers fed different levels of natural okra and synthetic pigments. J Appl Poult Res 17:498-504.
- Long P.L., Millard, B.J., Joyner, L.P. and Norton, C.C. 1976. A guide to laboratory techniques used in the study and diagnosis of avian coccidiosis. Folia Vet. Lat. 6: 201-217.
- McDougald, L. and S. Fitz-Coy. 2008. Coccidiosis. Pages 1068-1085 in Diseases of Poultry. Y. M. Saif, A. M. Fadly, J. R. Glisson, L. R. McDougald, L. K. Nolan, D. E. Swayne, ed. Blackwell Publishing, Ames, IA.
- Muñoz-Díaz, J.I., B. Fuente-Martínez, X. Hernández-Velasco, E. Ávila-González. 2012. Skin pigmentation in broiler chickens fed various levels of metabolizable energy and xanthophylls from Tagetes erecta. J. Appl. Poult. Res. 21:788-796.
- NRC. Nutrient Requirements of Poultry, 9th rev. ed. Washington, DC: National Academy Press, 1994.
- Neter J., M. Kutner, W. Wasserman. 1996. Applied Linear Statistical Models. 4th ed. Irwin, Chicago.
- Ogbuokiri, U. D. E., and S. A. Edgar. 1986. Effect of mild infections with six species of Eimeria on skin pigmentation of broiler chickens. Poult. Sci. 65:1816-1818.
- Rance, K. A., G. M. McEntee, & R. M. McDevitt. 2002. Genetic and phenotypic relationships between and within support and demand tissues in a single line of broiler chicken. Br. Poult. Sci. 43:518-527.
- Reid W., Johnson J. 1970. Pathogenicity of E. acervulina in coccidial infections. Avian Dis. 14:166-177.
- Ruff M.D., H.L. Fuller. 1975. Some mechanisms of reduction of carotenoid levels in chickens infected with Eimeria acervulina or E. tenella. J. Nutr. 105:1447-56.
- Sharma, V., M. Fernando. 1975. Effect of Eimeria acervulina infection on nutrient retention with special reference to fat malabsorption in chickens. Can. J. Comp. Med. 39:146-154.
- Sirri, F., M. Petracci, M. Bianchi, and A. Meluzzi. 2010. Survey of skin pigmentation of yellow-skinned broiler chickens. Poult. Sci. 89:1556-1561.
- Tyczkowski, J., B. Hamilton. 1986. Absorption, transport and deposition in chickens of lutein diester, a carotenoid extracted from Marigold (Tagetes erecta). Poult. Sci. 65:1526-1531.
- Tyczkowski, J. P. Hamilton. 1991. Altered metabolism of carotenoids during pale-bird syndrome in chickens infected with Eimeria acervulina. Poult. Sci. 70:2074-2081.
Temas relacionados:
Autores:
Asociacion Nacional de Especialistas en Ciencias Avícolas de Mexico (ANECA)
UNAM - Universidad Nacional Autónoma de México
University of Arkansas (USA)
Industrias Vepinsa
Mostrar más
Recomendar
Comentar
Compartir

¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.








