Bases de la reproduccion aviar
Publicado: 19 de septiembre de 2017
Por: Dra Mag. Lic.María Fernanda Peralta (Trabajo de Revisión bibliográfica sirve de apoyo para los alumnos de Medicina Veterinaria y de Ingeniería Agronómica que cursan Producción Avícola en la Facultad de Agronomía y Veterinaria de la Universidad Nacional de Rio Cuarto. Cordoba. Argentina)
1. Aparato reproductor
1.1. Generalitades
El aparato reproductor de las aves presenta la estructura básica de los mamíferos, aunque tiene ciertas particularidades que los diferencia de aquellos. Las investigaciones de la anatomía aviar datan de mucho tiempo atrás, pero los mecanismos de acciones hormonales, que regulan la madurez y el funcionamiento de los órganos reproductivos y de la postura en el caso de la hembra, aún son motivos de investigaciones.
1.2. Anatomía del aparato reproductor femenino:
En las aves, el aparato reproductor femenino está compuesto por dos partes esenciales: ovario y oviducto izquierdos, encontrándose atrofiados los órganos del lado derecho. Si bien ambos órganos están presentes apenas nace la pollita, luego de las primeras semanas el ave sufre atrofia tanto del ovario como del oviducto derecho, siendo esto una adaptación de las aves al vuelo. Luego del oviducto, desde el interior al exterior, encontramos la vagina, y luego la última porción del aparato reproductor, que es común al aparato urinario, que es el urodeum, orificio en la cloaca por donde sale el huevo (Etches, 1992, Sauveur, et al., 1992, Johansen,H., 2012)
En la formación del huevo, intervienen dos estructuras anatómicas diferentes: el ovario, para la yema, y el oviducto, para la clara y la cáscara. La ovulación es la que permite el paso de una estructura a la otra. El proceso se completa (cuando se trata de huevos para incubar) con la necesaria fecundación del óvulo, la cual, se produce en el interior de la hembra (fecundación interna) (Figura 1)
Figura 1: esquema del aparato reproductor de la gallina, sus funciones y el tiempo en que tarda en formarse el huevo.
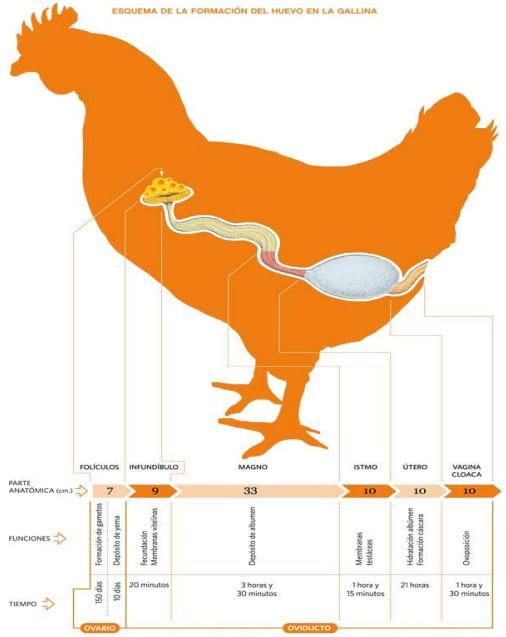
- Ovario: el ovario está situado en la parte superior de la cavidad abdominal, debajo de la arteria aorta y de la vena cava posterior. Se apoya sobre el riñón, el pulmón y por la parte interior, sobre el saco aéreo abdominal izquierdo. La gónada adulta muestra el aspecto de un racimo de uvas, debido a la presencia de 7 a 10 folículos portadores de yemas que se encuentran en fase de crecimiento acelerado. Junto a ellos se encuentran folículos más pequeños, y folículos vacíos, que regeneran rápidamente. La mayoría de los componentes de la yema provienen de precursores sintetizados por el hígado, unos 10 días antes de la ovulación, estimulados por los estrógenos. Cada folículo está unido al ovario por un pedicelo, por donde penetran arterias, el sistema venoso y fibras nerviosas. En el momento de la ovulación, las arterias dejan de nutrir al folículo seleccionado para desprenderse, con lo cual el pedicelo se rompe y la yema cae al oviducto (Figura 2) (Etches, 1992, Johansen,H., 2012)
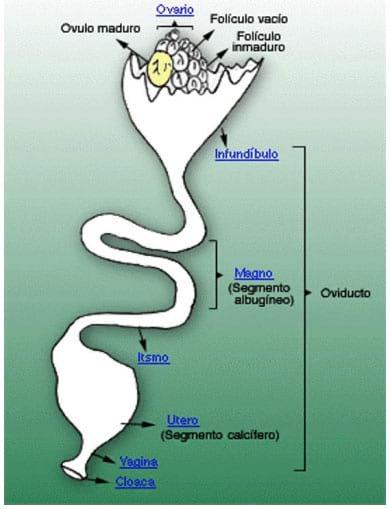
- Oviducto: se presenta como un tubo de color rosa pálido, que se extiende desde la región del ovario a la cloaca. Este órgano puede ser dividido en 4 partes, fisiológicamente diferentes una de otra, que son: infundíbulo, magnum, istmo y útero. (Figura 2)
Figura 2: Esquema del aparato reproductor de la gallina, donde puede apreciarse el ovario y el oviducto, con sus distintas partes, vagina y cloaca.
- Infundíbulo: con forma de embudo, presenta repliegues en su mucosa interna y es el encargado de captar la yema del huevo, comienza a secretarse una porción del albumen. En esta zona se produce el almacenamiento de espermatozoides y la fertilización, si es una reproductora. Las contracciones de sus músculos hacen avanzar la yema hacia el magnum. Si se coloca un cuerpo extraño del tamaño aproximado de la yema cerca del infundíbulo, como un anillo, lo más probable es que sea transportado por el oviducto y quede procesado como si fuera un huevo. Luego, si se casca el huevo, se encuentra el anillo rodeado por la clara, membranas y cáscara.
- Magnum: es la parte más larga. Su pared es muy elástica, y presenta grandes pliegues. Contiene gran cantidad de glándulas secretoras, que por contacto con la yema van a liberar en sus gránulos ovoalbúmina, lisozima, ovotransferrina y ovomucoide, que componen alrededor del 80 % de la clara ó albumen.
- Itsmo: presenta un diámetro más reducido que el magnum, con repliegues de la mucosa menos acentuados, aquí comienza la secreción de las membranas testáceas (interna y externa) y se inicia la base de la cáscara, formada a partir de los núcleos de calcita.
- Utero: tiene forma de bolsa, con paredes musculares gruesas, aquí se produce la formación de la cáscara, formada básicamente por CO3Ca. El huevo permanece entre 18 y 22 hs, absorbe 15 g de agua, intercambiando varios electrolitos, incluyendo Na+ , K+ y Cl- , con el líquido de la glándula y recibe su recubrimiento de CO3Ca, proteína, pigmento y cutícula, constituída básicamente por lisozima. Al final de su estancia en este lugar, el huevo es expelido con fuerza por la musculatura lisa que rodea a la mucosa (Etches, 1992, Johansen,H., 2012).
- Vagina: parte estrecha y muscular, separada del anterior por la conjunción úterovaginal, su pared tiene repliegues longitudinales, y en esa zona se produce la rotación del huevo, que se venía desarrollando con el polo agudo, y luego de la rotación en la vagina, sale por el polo romo (Etches, 1992, Robinson et al., 1986, Sauveur, et al., 1992, Johansen,H., 2012)
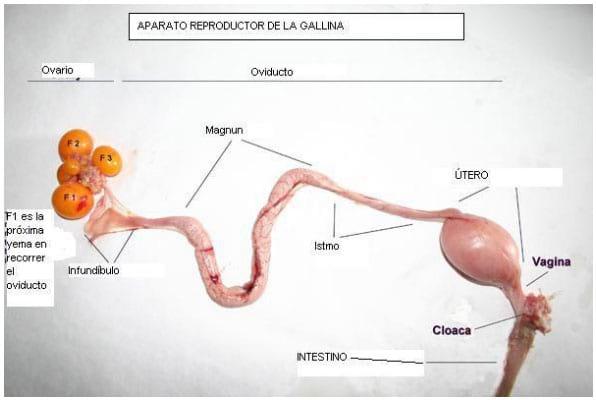
- Urodeum en la cloaca: zona ubicada en la mitad izquierda de la cloaca, común al aparato reproductor y el urinario, por donde sale el huevo, cuando se produce la postura (Figura 3) ( Etches, 1992, Robinson et al., 1986, Sauveur, et al., 1992, Johansen,H., 2012).
Figura 3: fotografía del aparato reproductor de la gallina.
1.2.1 Actividad ovárica: oogénesis:
Las oogonias sufren repetidas divisiones mitóticas, dando lugar a los oocitos primarios, que son células diploides, estando en profase meiótica en el momento de la eclosión, y 24 hs antes de la ovulación, ocurre la división reduccional dando lugar al oocito secundario y a la expulsión del corpúsculo polar (Etches, 1992, Johansen,H., 2012).
- Formación de la yema del huevo (vitelogénesis)
La deposición de la yema del huevo en el interior del folículo ovárico, se inicia en la pollita cuando es muy joven y concluye justo antes de la ovulación. Para ello, el ave recurre a elementos aportados por vía sanguínea. Este proceso, puede dividirse en 3 fases principales:
- Fase inicial de crecimiento lento: apenas ecolosiona la pollita, cada uno de los óvulos contenidos en su ovario comienzan su crecimiento, depositándose en dichos óvulos unas gotitas de lípidos y luego se frena su crecimiento.
- Fase intermedia: se produce un incremento importante (400 %) en el tamaño de un folículo, que ha sido “elegido” entre todos los folículos indiferenciados. Ese aumento se debe, principalmente, a la deposición de proteína y un poco de lípidos, constituyendo el vitelo blanco.
- Fase de gran crecimiento: durante 8-10 días que preceden a la ovulación, el crecimiento del óvulo es muy rápido, produciéndose la migración del oocito hacia la superficie folicular (Sauveur, S., 1992, Johansen,H., 2012).
1.2.2. Formación del huevo en el oviducto:
La ovulación propiamente dicha ocurre con la apertura del folículo a nivel del estigma, que será captado por el infundíbulo. Posteriormente se suceden una serie de etapas, que son :
- Conclusión de la membrana vitelina en el infundíbulo
- Secreción de las proteínas del albumen en el magnum.
- Secreción de las membranas testáceas en el istmo.
- Hidratación del albumen y secreción de la cáscara en el útero
- Oviposición
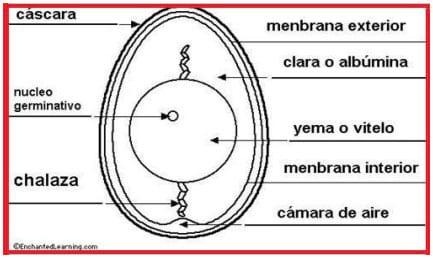
En término medio, unas 25-27 hs después de la captación por el infundíbulo, el huevo, totalmente formado, como puede verse en la figura 4, es expulsado por la cloaca (Etches, 1992, Sauveur et al., 1992).
Figura 4: esquema de un huevo
1.3. Anatomía del aparato reproductor masculino
En las aves, el aparato reproductor masculino está constituído por tres unidades morfofuncionales: los testículos, las vías deferentes y el órgano copulador.
- Testículos: son órganos pares, de forma arriñonada, internos, situados entre la base de los pulmones y el segmento intermediario de los riñones. Aunque están próximos a los sacos aéreos, su temperatura es la misma que la temperatura corporal del ave (41-43 °C). En consecuencia, la espermatogénesis tiene lugar a esa temperatura y no a una inferior, como ocurre en los mamíferos domésticos. (Figura 5 y 6)
Figura 5: situación del aparato reproductor masculino
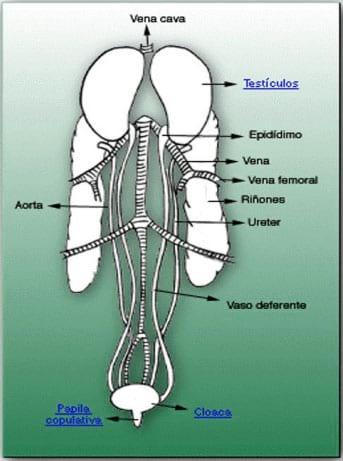
Figura 6: fotografía de aparato reproductor del gallo
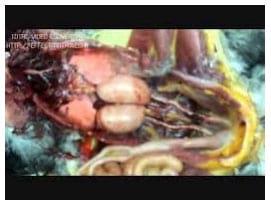
Estructura: el parénquima testicular no está tabicado, a diferencia de lo que ocurre en algunos mamíferos. Está compuesto por:
- Un compartimento tubular (que abarca aproximadamente el 85-95 % del volumen testicular), constituído por los tubos seminíferos. En el epitelio de estos túbulos se efectúa la espermatogénesis.
- Un compartimento intertubular, que incluye algo de tejido conjuntivo, una red arteriovenosa y linfática y una red nerviosa, adrenérgica y colinérgica. Contiene además, las células de Leydig, que secretan los andrógenos, dentro de los cuales se destaca la testosterona. (Figura 6)
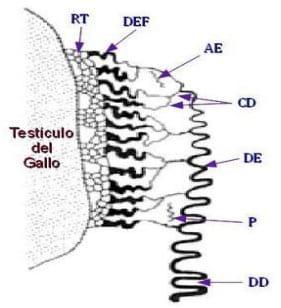
- Vías deferentes: los túbulos seminíferos se terminan en la proximidad inmediata del cordón testicular, donde se conectan con los túbulos de la rete testis, que se comunican a su vez con los conductos eferentes, que desembocan lateralmente en el canal del epidídimo. Este último se prolonga en el conducto deferente, muy replegado, donde se realiza la maduración y el almacenamiento de los espermatozoides, y puede ser comparado con el epidídimo de mamíferos. Este desemboca, a través de la vesícula espermática ó vesícula deferente, en el urodeo . (Figura 7)
Figura 7: Vías deferentes del gallo (Sauveur, 1992). Los túbulos seminíferos del testìculo se interconectan con la Rete Testis (RT), la cual a la vez se conecta con finos canalillos (DEF) para desembocar en el canal del Epidídimo (DE), que se prolonga en el Conducto Deferente(CD)
Como se mencionó anteriormente, las aves carecen de glándulas accesorias, entonces, la vesícula espermática ó deferente, sólo serviría como reservorio del semen. Este sólo recibiría la adición de algunas sustancias secretadas por los repliegues linfáticos, órgano par que integra el órgano copulador.
- Organo copulador: esta denominación abarca tres órganos, que son: los cuerpos vasculares paracloacales, el falo y los repliegues linfáticos de la cloaca. Los primeros, son pares y de forma ovoide, incrustados en la pared de la cloaca, que se llenan de linfa en el momento de la erección. Dicha linfa transuda en la cloaca, a través de los repliegues linfáticos, en forma de un fluido transparente, que puede mezclarse con el semen. En el momento de la erección, los repliegues redondeados de la cloaca se hinchan, formando una ligera protuberancia hacia el exterior de la cloaca y constituyen un pequeño canal por donde se evacúa el esperma. (Figura 8)
Figura 8: órgano copulador del gallo
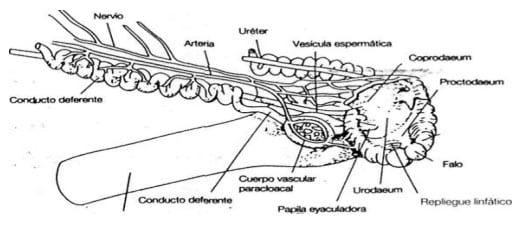
El órgano copulador propiamente dicho, vestigial en el gallo y el pavo está bien desarrollado y provisto de un canal de forma espiral en las palmípedas. En el momento de la cópula, solamente hay un contacto entre las cloacas del macho y la hembra en el primer caso, mientras que en el segundo, hay una verdadera penetración (Etches, 1992, Johansen, H., 2012)
1.3.1. Actividad testicular: espermatogénesis:
Este proceso es muy importante, ya que nos permite evaluar y utilizar los machos reproductores y poner a punto métodos de cría y recría, mediante la evaluación y el control de la producción testicular. Sin embargo, existen diferencias de producción en función de la edad, el individuo, el origen genético, las condiciones del medio.
1.3.1.1. Organización de los tubos seminíferos:
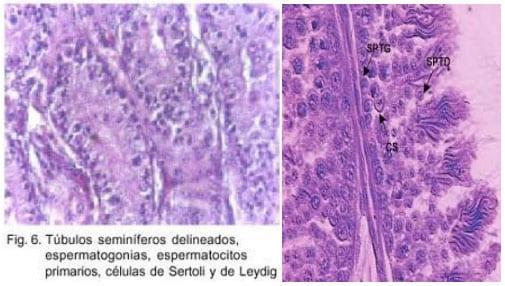
Los túbulos seminíferos están limitados por túnica propia, que aísla el epitelio seminífero del compartimiento intertubular y por lo tanto, de la red arterio-venosa del testículo. Esta pared, responsable de los intercambios entre los compartimientos, está formada por dos capas: externa, que colabora en el transporte de los espermatozoides hacia la salida del testículo, e interna, ó membrana basal, que regula los intercambios extra e intratubulares de esta gónada.
El epitelio seminífero propiamente dicho, está formado por las células de Sértoli y las células germinales, con sus tres categorías principales: espermatogonias, espermatocitos I y espermátides. (Figura 6)
Podemos definir espermatogénesis como el conjunto de transformaciones sufridas por las células germinales desde las espermatogonias hasta los espermatozoides, procesos que ocurren en el epitelio seminífero. Estas transformaciones se efectúan en estrecha relación con las células somáticas del epitelio seminífero, las células de Sértoli y están bajo el control de las hormonas gonadotropas hipofisarias.
Brevemente, la espermatogénesis tiene lugar en 3 fases consecutivas: divisiones espermatogoniales, meiosis y mitosis. Durante estas fases, las espermatogonias producen varias generaciones de espermatogonias, de la última de ellas se originan los espermatocitos que, a su vez, se transforman en espermátides, para finalmente dar origen a las gametas masculinas, los espermatozoides.
La organización de las diferentes células germinales en capas concéntricas, que se extienden desde la membrana basal hasta la luz central, llamada ciclo del epitelio seminífero, que ha sido perfectamente delimitado en las distintas especies de mamíferos, no ha podido ser demostrado en aves, a pesar de las numerosas investigaciones (Tiba et al., 1993 a y b)
1.3.1.2.Transporte, maduración y supervivencia de los espermatozoides en las vías deferentes:
Cuando los espermatozoides son liberados al lumen de los túbulos seminíferos, van a la rete testis. Parecería que el mecanismo que ayuda al avance del semen son las células ciliadas presentes en la pared de las vías deferentes, por un lado, y las células musculares que se contraerían, ayudando al avance del mismo hacia el órgano copulador (Etches, R., 1992).
Los espermatozoides testiculares no son móviles ni tienen poder fecundante, esta “maduración” la adquieren en las vías deferentes. Además, en las aves, estas vías elaboran el plasma seminal, transformando el fluido testicular y añadiéndole sus propias secreciones, ya que las aves carecen de glándulas anexas (Sauveur, 1992).
La vesícula espermática se comportaría como un reservorio del semen antes de la eyaculación. El esperma puede alcanzar la parte inferior de los vasos deferentes, desde el epidídimo, en 24 hs, y la mayor parte del esperma en el epidídimo se habrá transportado en 72 hs (Etches, R., 1992, Johansen, H., 2012).
El control de las vías deferentes lo ejercen los esteroides testiculares, como lo prueba su regresión después de la castración y el mantenimiento de su actividad si la castración va seguida de androgenoterapia (Sauviers, 1992).
1.3.1.3. Principales características del semen.
Volumen y contenido de los eyaculados: el volumen de los eyaculados, su contenido en espermatozoides y en consecuencia el número total de espermatozoides por eyaculado varían considerablemente en función de:
- La especie y la estirpe.
- El individuo y su estado fisiológico
- Las condiciones y el método de recolección: éste último puede ser por masaje abdominal, con “ordeño” de la cloaca, o por interrupción de la cópula natural. Hasta el 87 % de la producción diaria puede recogerse por masaje abdominal (Peralta, M. F., 1999)
2. Principales hormonas relacionadas con la reproducción:
2.1. Eje hipotálamo hipófiso gonadal:
El estímulo luminoso es esencial para la producción de las hormonas reproductivas, que producen la maduración de las gónadas y la producción de las gametas reproductivas (espermatozoides, si son machos y ovocitos si son hembras).
Sintetizando el funcionamiento del eje, podemos decir lo siguiente: el fotoperíodo (la longitud del día) es captado por los receptores intracraneales y receptores oculares en el ave (Ubaka y col., 2005, Dawson y Sharp, 2007, Tsutsui y col., 2007). Esa información es traducida a señales que involucran la producción de Melatonina y de Tirotrofina, cuyo órgano blanco es el hipotálamo. Este último órgano produce factores liberadores de las gonadotrofinas, que en las aves se denominan LHRH I y II, que se van a producir y liberar según la edad del ave, uno ó el otro. Su órgano blanco es la pituitaria (ó hipófisis), donde produce la liberación de las gonadotrofinas, LH y FSH. Estas gonadotrofinas son liberadas a la circulación sistémica y su órgano blanco son las gonadas. Las gonadotrofinas tienen una acción diferente según se trate de los machos o de las hembras, induciendo tanto la maduración de las gónadas como la liberación de los esteroides sexuales. Finalmente, los esteroides sexuales mantienen la función gonadal, e inducen las características sexuales secundarias y producen una retroalimentación negativa a nivel del factor liberador de gonadotrofinas. También hay otra retroalimentación negativa a nivel de LHRH y éstos tienen efecto inhibidor sobre la producción de melatonina y Tirotrofina. (Figura 9)
Figura 9: Esquema del funcionamiento del eje hipotálamo-hipófiso-gonadal.
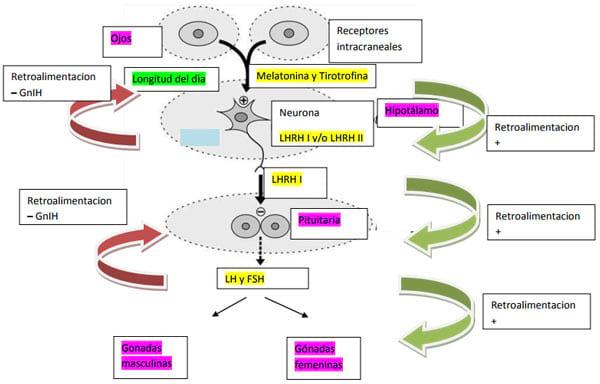
2.1.1. Estímulo para iniciar la respuesta del eje
La luz es receptada por los fotoreceptores oculares y los intracraneales, y esa información de la longitud del día se traduce en señales que, dependiendo de la edad del ave, es decir, del estatus reproductivo, se transmiten a un reloj biológico, usando un mecanismo circadiano. La información integrada de ese reloj biológico es transmitida a las neuronas, sintetizando neuropéptidos, y otras hormonas, como la Melatonina y la Tirotrofina (Ubaka, y col., 2005, Dawson y Sharp, 2007, Tsutsui y col., 2007, Kang y col., 2007, Madineni, S., 2008 y Kuenzel y col., 2015). Un aumento en los niveles de la Tiroitrofina y un descenso en los niveles de Metalonina, liberarían neuropéptidos cuyo blanco sería el hipotálamo.
2.1.2. Hormona Liberadora de gonadotrofinas (LHRH)
En aves, se ha detectado la presencia de tres factores liberadores de gonadotrofinas, LHRH I, II y el recientemente descubierto LHRH III (Luteinizing Hormone Releasing Hormone), presente en las aves silvestres. Estos factores se liberan uno a la vez, ejerciendo su acción sobre la hipófisis que liberaría las gonadotrofinas. En las aves domésticas, sólo se ha detectado la presencia de la LHRH I y II. La LHRH I tiene una estructura molecular semejante al GnRH de los mamíferos, los otros factores liberadores presentan más diferencias que su homólogo de mamífero. Debido a que se estudiaron midiendo la liberación de LH, en la gallina, y para diferenciarla del factor liberador de mamífero, reciben diferentes siglas.
En cuanto a su ubicación, también es diferente: la LHRH I se encuentra en la eminencia media y su producción es liberada en el sistema porta, en el hipotálamo. En cambio las neuronas de LHRH II se encuentran en el mesencéfalo de las aves y en el complejo oculomotor. De acuerdo a diferentes estudios, parecería que la LHRH II estimula el comportamiento sexual en las gallinas, relacionándose al estatus reproductivo del ave. En contraste, la LHRH I se relacionaría con eventos neuroendocrinos precedentes a la ovulación y producción de semen. En aves silvestres, se ha visto que la LHRH III afecta el comportamiento reproductivo (Bédecarrats et al., 2006, 2009; Guemené et al., 1992; Joseph, N. et al., 2009 y Madineni, S. et al., 2009)
2.1.3. Gonadotrofinas pituitarias:
FSH y LH son las gonadotrofinas pituitarias (ó hipofisarias), que en las aves se producen por dos grupos diferentes de poblaciones celulares. En las hembras, la LH regula la producción de los Estrógenos y la Progesterona en el ovario, mientras que en los machos, la LH es responsable de la producción de Testosterona en las células de Leydig. Por su parte, la FSH promueve la maduración gonadal y la selección folicular en las gallinas y el crecimiento gonadal y la secreción de los Estrógenos en las células de Sértoli en los gallos.
La secreción de estas gonadotrofinas es regulado positivamente, por la interacción de LHRH con el receptor específico, que genera la secreción de LH y FSH, en presencia del fotoperíodo positivo, y sobre todo a partir de las semanas 15-16, preparando fisiológicamente al ave durante la postura.
Ambas gonadotrofinas son reguladas negativamente (es decir, se inhibe su secreción) por un aumento en los niveles de esteroides y péptidos, por un lado, y por la acción de GnIH, por otro, que es secretada por un aumento en los niveles de melatonina, durante el fotoperíodo negativo (Ubaka, T., 2005, Tsutsui, K., 2007).
Además, distintas investigaciones afirman que el comportamiento sexual influye en la secreción de estas hormonas (Madineni, S., 2008, Burns y Matzuk, 2002).
2.1.4. Esteroides sexuales:
En la gallina, el ovario, al igual que en los mamíferos, secreta 3 tipos de esteroides sexuales principales: estrógenos, andrógenos y progesterona.
Por su parte, en el testículo del gallo, se secretan básicamente andrógenos, siendo la Testosterona el más importante.
2.2. Hormonas reproductoras femeninas:
Luego de recibir el estímulo correspondiente, uno de los factores liberadores (LHRH I, II ó III) es secretado a la circulación hipotálamo-hipofiso-portal, en la eminencia media, y distribuída luego a la hipófisis, donde se une a receptores específicos en las células pituitarias y estimula la producción de gonadotrofinas. Luego, LH y FSH son secretadas a la circulación sistémica y se une a receptores en el ovario de la gallina. Específicamente, la LH es la responsable del desarrollo del ovario, de la secreción ovárica de los esteroides sexuales, y sobre todo, de la ovulación. Por su parte, la FSH regula el desarrollo de los folículos del ovario y la actividad secretora de éste, es decir, producción de Estrógenos en los folículos pequeños y Progesterona (P4), en los folículos maduros. (Madineni, S., 2008)
En las aves, el ovario completamente desarrollado, en una gallina de 15-16 semanas de vida, contiene numerosos folículos, en distintos estadíos, siendo el folículo elegido para ovular, el que genera la mayor cantidad de P4, mientras que los otros folículos prejerárquicos son los que secretan Estrógenos y Andrógenos (Bédecarrats, et al., 2009, Etches, R., 1992).
La secreción es cíclica, es decir: la producción de estrógenos disminuye cuando el folículo comienza a formar la yema, y llega al mínimo con la ovulación, mientras que la producción de Andrógenos y P4 aumenta después de que el folículo entra en el proceso de jerarquización y alcanza el máximo nivel hormonal previo a la ovulación. Cuando se elevan los niveles plasmáticos de P4 se elevan a su vez los niveles de uno de los factores liberadores, lo que inicia la secreción de un pico de LH que irriga al folículo elegido para liberarse, lo que estimula a la vez la secreción de más P4 y más LH. Esta retroalimentación positiva entre P4 y LH continúa hasta generar la oleada preovulatoria que produce la ruptura del folículo.
Las funciones de los estrógenos son muy importantes (figura 10), puesto que participan prácticamente en el control de la formación del huevo. Dichas funciones son:
- Crecimiento del oviducto
- Síntesis de las proteínas y de los lípidos de la yema en el hígado
- Transporte sanguíneo de las proteínas de la clara en el magnum.
- Formación del hueso medular, junto con Parathormona y aumento de la retención fosfo-cálcica al inicio de la postura.
- Aparición de los caracteres sexuales secundarios y separación de huesos pelvianos
Figura 10: resumen de las principales funciones de las hormonas esteroides del ovario (Sauveur, 1992)
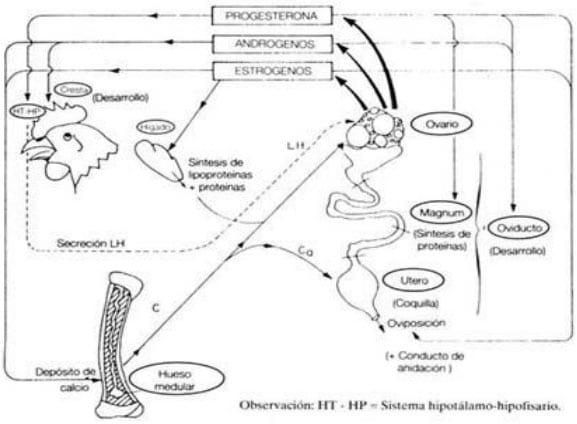
Los Andrógenos, por su parte, actúan estimulando el crecimiento de la cresta y otros caracteres secundarios, como ensanchamiento y suavidad de los huesos púbicos y deposición de pigmentos en el pico, por ejemplo.
Finalmente, la P4, que es secretada por las células de la granulosa del folículo preovulatorio, y en menor medida por el postovulatorio, es esencial para la ovulación, pues controla los ritmos de ovulación (Etches, R., 1992, Onagbsan, O., et al., 2009)
2.2.1. Oviposición:
La expulsión del huevo desde el sistema reproductor, requiere la coordinación de la actividad muscular del útero y el comportamiento de buscar y seleccionar un nidal. En los últimos minutos antes de la oviposición, la intensidad y la frecuencia de las contracciones musculares aumentan, y están asociados a Prostaglandinas secretadas por el ovario y Arginina-Vasotocina y la Oxitocina. Este comportamiento previo a la oviposición, parecería que está controlado a nivel neuronal, aunque aún es motivo de estudios (Etches, R., 1992)
2.3. Hormonas reproductivas masculinas:
El desarrollo testicular y la espermatogénesis se realiza en dos etapas del ave: la prepúber y la púber. Las edades en que tiene lugar una y otra etapa, sin embargo, depende de varios factores: las condiciones del medio (especialmente la iluminación), el origen genético de los gallos, presentándose además variaciones entre uno y otro individuo.
Durante el período prepúber, que dura 8-10 semanas, el acontecimiento más importante es la proliferación activa de las células de Sértoli, que a su vez tiene una activa intervención en la línea germinal, generando divisiones celulares, llegando a advertirse sólo espermatocitos I. En este momento, se produce un importante aumento en el peso testicular.
Durante el período púber, aparecen el resto de las células de la línea germinal, pudiendo advertirse espermatozoides, también produciéndose un gran aumento en el peso gonadal. Esta etapa dura en promedio 10 semanas.
Durante la madurez sexual, el peso testicular y el número de espermatozoides están en su apogeo, produciéndose paralelamente una evolución en la calidad de las gametas (su capacidad de fecundación, la motilidad, y la duración de la supervivencia in vitro son mayores). Esta etapa corresponde aproximadamente a las 20 semanas de vida del gallo.
Dentro de las gonadotrofinas, en el macho, la LH controla la producción de esteroides en las células de Leydig, alcanzándose las concentraciones más altas en la madurez sexual, mientras que la FSH modula la función de las células de Sértoli, interviniendo indirectamente en la maduración de la línea germinal (Peralta, M. F., 1999) Entre las hormonas testiculares, la Testosterona es la más importante, y junto con otros Andrógenos tiene su acción en el epitelio seminífero, función que culmina con la producción de los espermatozoides. A la vez, los Andrógenos regulan la secreción de gonadotrofinas hipofisarias, mediante mecanismos de retroalimentación negativos, así como la actividad de los órganos del aparato copulador, y los caracteres sexuales secundarios del macho (crecimiento de la cresta y gárgolas en los gallos, canto típico del macho) (Etches, 1992, Peralta, M. F., 1999, Kuenzeel, W., 2000, .Ball, G y Balthazart, J., 2004)
3. Bibliografía:
- Ball, G. y Balthazart, J. 2004. Hormonal regulation of brain circuits mediating male sexual behavior in birds. Phys. And behavior: 329-346.
- Bédécarrats, G., Shimizu, M. y Guemené, 2006. Gonadotropin Releasing Horrmones and their receptors in Avian Species. J. of Poultry Sci: 43: 199-214.
- Bédécarrats, G., McFarlane, H., Maddineni, S., Ramachandran, R. 2009. Gonadotropin-inhibitory hormone receptor signaling and its impacts on reproduction in chickens. Gen. And Comp. Endocr. 163: 7-11.
- Burns, K. y Matzuk, M. 2002. Minireview: Genetic Models for the study of Gonadotropin Actions. Endocr. 143 (8): 2823-2835.
- Dawson, A. y Sharp, P. 2007. Photorepractoriness in birds-photoperiodic and nonphotoperiodic control. Gen. and Comp. Endocr. 153: 378-384.
- Etches, R. 1992. Reproducción Aviar. Cap 2: 11-30, Cap. 4: 79-105, Cap. 5:113- 131, Cap. 6: 133-175, Cap. 7: 177-218, Cap. 8: 221-247. Ed. Acribia, Zaragoza, España.
- Guemené, D. y J. Williams. 1992. In vitro and in vivo responses to chicken Luteinizing Hormone Releasing Hormone I and chicken Luteinizing Hormone Releasing Hormone II in male turkeys (Meleagris gallopavo). J. Endocrinol. 132:387- 393.
- Johnason, A. L. 2012. Reproduction in the hen. Cap. 18 y Reproduction in the male. Cap. 19 in Avian Physiology. Ed. By P. Sturkie.
- Joseph, N., Morgan, K., Sellar, R., Mc Bride, D., Millar, R., 2009. The Chicken type III GnRH receptor homologue is predominantly expressed in the pituitary, and exhibits similar ligand selectivity to the type I receptor. J. of Endocr. 202: 179-190.
- Khan, S., Thayananupath, A., Bakken, T., El Halawani, E. 2007. Dopaminmelatonin neurons in the avian hypothalamus controlling seasonal reproduction. Neuroscience 150:223-233.
- Kuenzel, W. 2000. Central Nervous System Regulation of Gonadal Development in the Avian Male. Poultry Sci: 79: 1679-1588.
- Kuenzel,W., Kang, S. y Zhou, J. 2015. Exploring avian Deep-brain photoreceptors and their role in activating the neurocrine regulation of gonadal development. Poultry Sci 94: 786-798.
- Madineni, S, Oco´n-Grove, O., Krzysik-Walker, S., Hendricks III, W. y Ramachandran, R. 2008. Gonadotropin-inhibitory hormone (GnIH) receptor gene is expressed in the chicken ovary: potential role of GnIH in follicular maturation. Reproduction (135) 267–274
- Onagbesan, O., Bruggeman, V. y Decuypere, E. 2009. Intra ovarian growth factors regulating ovarian function in avian species: a review. An. Reprod. Sci 111: 121-141.
- Peralta, M. F., 1999. Efecto de la furazolidona sobre el eje hipotálamo hipófiso gonadal en pavos machos (Meleagris gallipavo). Tesis Magister. Universidad Nacional de Rio Cuarto, Río Cuarto, Córdoba, Argentina, 120 p.
- Sauveur, B; de Riviers, M. 1992. Reproducción en Aves. Cap. I: 18-77, Cap. II: 80-125, Cap. VII: 192-238. Ed. Mundi Prensa, Madrid, España.
- Tiba, T., Yoshida, M., Miyake, K., Kita, I. y T. Tsubota. 1993 a. Regularities and irregularities in the structure of the seminiferous epithelium in the domestic fowl (Gallus domesticus) I. Sugestion of the presence of the seminiferous epithelial cycle. Anat. Hist. Embryol. 21: 241-253.
- Tiba, T., Yoshida, M., Miyake, K., Kita, I. y T. Tsubota. 1993 b. Regularities and irregularities in the structure of the seminiferous epithelium in the domestic fowl (Gallus domesticus) II. Co-ordination between germ cell associations. Anat. Hist. Embryol. 21: 254-263.
- Ubaka, T., Bentley, G., Ukena, K., Winfield, J., Tsutsui, K. 2005. Melatonin induce the expression of gonadotropin-inhibitory hormone in the avian brain. PNAS 102(8): 3052-3057.
Temas relacionados:
Autores:
Universidad Nacional de Rio Cuarto - UNRC
Recomendar
Comentar
Compartir
29 de septiembre de 2020
En las gallinas ponedoras hy line Brown le puse un gallo de Roshe Islam red cuál sera la cría que puede nacer también tengo el gallo de isa Brown ? Esta bien la manera q estoy haciendo ?
Recomendar
Responder

¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.
Usuarios destacados en Avicultura

Lorena Ramos
Cargill
Nutricionista Senior en Cargill Protein, América Latina
Estados Unidos de América
Estados Unidos de América







