
Contaminación de huevos en la incubadora
Diseminación en la sala de incubación de clones de escherichia coli: aislamiento a partir de médula ósea y resistencia a gentamicina
En una integración de pollos de engorde se registraron en diferentes lotes brotes de cojeras con alta morbilidad a partir de la segunda semana de vida. Las lesiones que se encontraron fueron principalmente osteomielitis y sinovitis, siendo Escherichia coli el agente infeccioso implicado. Se investigó la fuente de infección, aislando diferentes clones de Escherichia coli a partir de saco vitelino y médula ósea de pollitos de un día de edad. Pollitos procedentes de distintos lotes de reproductoras se infectaron con los mismos clones, lo que indica una diseminación de los mismos en la sala de incubación y tras la eclosión. Además, la administración a estos pollitos de gentamicina junto con la vacunación, seleccionó un clon resistente a este antibiótico y con especial tropismo de la médula ósea.
Palabras Clave: Broilers, Cojera, Incubadora, E. coli.
La condronecrosis bacteriana con osteomielitis da lugar a cojeras que originan retraso en el crecimiento, mala calidad de pollito y decomisos en matadero, produciendo pérdidas económicas importantes para la industria avícola. Aunque otras bacterias, principalmente Staphylococcus aureus, producen un cuadro similar, Escherichia coli también se ha descrito como una causa importante de estos problemas (McNamee & Smith, 2000).
El objetivo de este estudio fue determinar si Escherichia coli era el agente infeccioso implicado en el proceso, estudiar el perfil de sensibilidad antibiótica de los aislados e investigar los clones circulantes así como el posible origen y diseminación de los mismos.
Materiales & Métodos
Las muestras que se analizaron fueron saco vitelino y médula ósea del fémur, siguiendo el método descrito por McNamee et al. (1998). Las muestras se cultivaron en agar sangre, agar MacConkey, agar sal manitol, agar Enterococcosel y en el caso de los huesos en caldo infusión cerebro corazón. En este último caso, tras 24 horas de enriquecimiento a 37º C, se sembraron los caldos en los medios sólidos citados anteriormente.
Los aislados de Escherichia coli obtenidos se examinaron para determinar su sensibilidad a diferentes antimicrobianos por el método de difusión en disco. Además, se caracterizaron por electroforesis en campo pulsante (PFGE) siguiendo el protocolo descrito por Pulsenet (Ribot et al., 2006).
Resultados & Discusión
Muestra | Lote A1 | Lote A2 | Lote B1 | Lote B2 | Lote C1 | Lote C2 | Total lotes sin vacunar | Total lotes vacunados |
Vitelo | 0% | 0% | 80% | 0% | 40% | 20% | 40% | 7% |
Hueso | 80% | 0% | 70% | 50% | 80% | 80% | 76,5% | 43,3% |
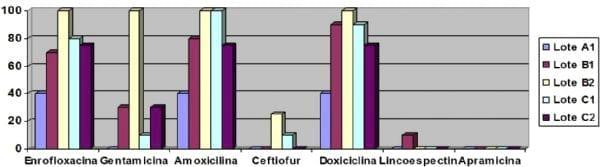
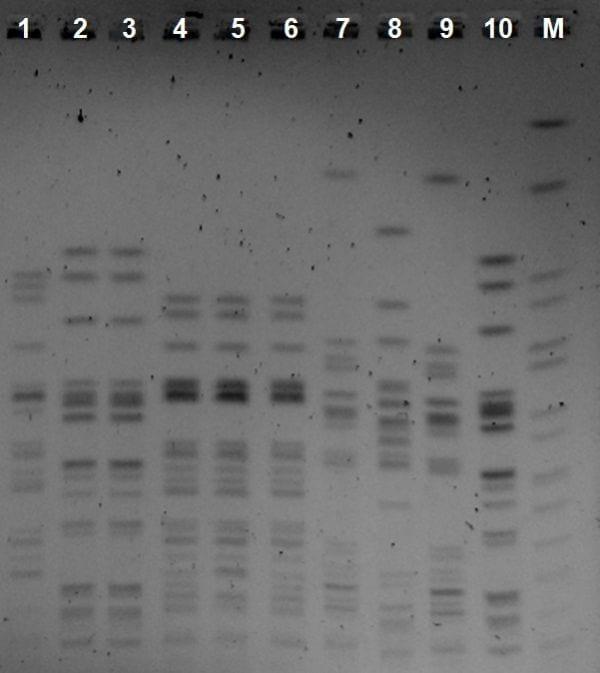
El primer punto destacable es el elevado porcentaje de aislamientos de Escherichia coli a partir de vitelo y hueso de pollitos no vacunados, lo cual ha sido observado en otras integraciones con problemas de mortalidad elevada en primeras semanas de vida (García Peña et al., 2009a). Este hecho, unido al aislamiento de cepas de un mismo pulsotipo en pollitos procedentes de distintas granjas de reproductoras, hace pensar que la entrada de estas cepas en la cadena productiva se produjo por huevos contaminados y posterior difusión en el momento de la eclosión (García Peña et al., 2009b). Así, la transmisión vertical de cepas de un mismo clon de Esherichia coli resistente a fluoroquinolona ha sido descrita. Asimismo, este clon produjo poca mortalidad embrionaria, aunque posteriormente dio lugar a problemas de colibacilosis en la granja (Petersen et al., 2006). Sería necesario analizar hisopos cloacales de las reproductoras de las tres granjas para confirmar si hay transmisión vertical y determinar el origen de las cepas.
La osteomelitis por Escherichia coli se produce normalmente tras una infección generalizada (Hofacre, 2003). Sin embargo, la clínica observada en los broilers consiste en la aparición de cojeras a partir de la segunda semana de vida, sin observarse problemas en el arranque de los pollitos ni otras patologías como pericarditis, perihepatitis, etc.. Esto podría deberse a que estas cepas tengan un tropismo particular por la médula ósea, lo que explicaría que haya un porcentaje de aislamientos mayor en hueso que en vitelo de pollitos sin vacunar. También, los pollitos se tratan con antibiótico cuando comienzan los síntomas y se elimina la infección generalizada, pero probablemente el antibiótico no alcanza la concentración adecuada ni se administran el tiempo suficiente para eliminar la infección en el tejido óseo.
Otro aspecto importante es el elevado porcentaje de cepas multirresistentes. Así, un 30% de las cepas son resistentes a enrofloxacina, amoxicilina y doxiciclina y otro 33% tenían ese mismo perfil de resistencia pero añadiendo además la gentamicina. Los antibióticos frente a los que se observan menor porcentaje de resistencias y por tanto los más aconsejables para el tratamiento serían la lincoespectinomicina y la apramicina.
Conclusiones
En este estudio se seleccionó un clon resistente a la gentamicina con especial tropismo por la médula ósea, provocando un brote de osteomielitis de difícil tratamiento tanto por el elevado porcentaje de cepas resistentes a varios antibióticos de uso frecuente en avicultura, como por la dificultad que tienen los antibióticos en llegar al tejido óseo.
El uso indiscriminado de antibióticos tiene como consecuencia la selección de cepas multirresistentes que dan lugar a que sea muy complicado el tratamiento de brotes de colibacilosis y que además suponen un riesgo para la salud pública.
Bibliografía
- Barnes HJ, Vaillancourt JP, Gross WB. 2003. Colibacillosis. pp. 631-657. In Diseases of poultry. Saif YM, Barnes HJ, Glisson JR, Fadly AM, McDougald LR (Eds). Blackwell Publishing, Ames, Iowa (USA).
- Dhillon AS & Jack OK. 1996. Two outbreaks of colibacillosis in commercial caged layers. Avian Dis. 40:742-746.
- García Peña FJ, Abad Moreno JC, Serrano T, Jimenez C, Herrero A. 2009a. Estudio de un caso de colibacilosis en una integración avícola. Simposium WPSA/AECA. Zaragoza (España).
- García Peña FJ, Abad Moreno JC, Herrera S, Echeita A, Serrano T, Jimenez C, Herrero A. 2009b. Investigación de un caso de colibacilosis en una integración de pollos de engorde. XVI Congress of the World Veterinary Poultry Association. Marrakech (Marruecos).
- Hofacre CH. 2003. Colibacilosis aviar: patogénesis y epidemiología. Mundo Ganadero: 48-49.
- McNamee PT & Smith JA. 2000. Bacterial chondronecrosis with osteomyelitis ("femoral head necrosis") of broiler chickens: a review. Avian Pathol. 29:253-270.
- McNamee PT, McCullagh JJ, Thorp BH, Ball HJ, Graham D, McCullough SJ, McConaghy D, Smyth JA. 1998. Study of leg weakness in two commercial broiler flocks. Vet. Rec. 143(5):131-135.
- Petersen A, Christensen JP, Kuhnert P, Bisgaard M, Olsen JE. 2006. Vertical transmission of a fluoroquinolone-resistant Escherichia coli within an integrated broiler operation. Vet. Microbiol. 116:120-128.
- Ribot EM, Fair MA, Gautom R, Cameron DN, Hunter SB, Swaminathan B, Barrett TJ. 2006. Standardization of Pulsed-Field Gel Electrophoresis Protocols for the Subtyping of Escherichia coli O157:H7, Salmonella, and Shigella for PulseNet. Foodbourne Pathog. Dis. 3:59-67.


