Del comensalismo a la patogenicidad: E.coli patogénica aviar (APEC) y su importancia en la era de retiro de antibióticos
Publicado: 29 de julio de 2022
Por: Luis-Miguel Gómez-Osorio, PhD, Country Manager Huvepharma, Colombia
Mensajes claves:
1. E.coli y APEC son diferentes.
2. APEC es una bacteria causante de una enfermedad reemergente en avicultura y algunos autores consideran que se podría catalogar como una enfermedad transmitida por alimentos (foodborne disease).
3. Las cepas APEC son altamente resistentes a los antibióticos y a los desinfectantes
4. Un aislamiento, diagnóstico preciso y confiable, son la clave para manejar el problema
2. APEC es una bacteria causante de una enfermedad reemergente en avicultura y algunos autores consideran que se podría catalogar como una enfermedad transmitida por alimentos (foodborne disease).
3. Las cepas APEC son altamente resistentes a los antibióticos y a los desinfectantes
4. Un aislamiento, diagnóstico preciso y confiable, son la clave para manejar el problema

Introducción
La bacteria Escherichia coli (E.coli) es gram negativa y habitante normal del tracto gastrointestinal (TGI) de las aves, ya que juega un papel positivo en la digestión y absorción de nutrientes (bacteria comensal) (1). Sin embargo, esta puede ganar genes de virulencia, los cuales se encuentran en el ambiente, cambiando la bacteria de comensal a patógena y la cual se denomina E.coli patogénica aviar o APEC (2) (Figura 1). Se cree que otras enfermedades en humanos ocasionadas en por esta misma bacteria están estrechamente relacionadas como la meningitis neonatal humana en bebes y la infección en el tracto urinario en adultos ya que comparten algunos genes de virulencia con las cepas uropatogénicas de E.coli o UPEC (3) (Figura 1 y 2). Últimamente, se han descrito más casos de APEC los cuales, al menos en gran parte, se asocian con el retiro o uso limitado de antibióticos como sistemas ABF (antibiotic-free), NAE (Non-antibiotic ever) o RWA (raise without antibiotics), en donde su prevalencia es mayor comparado con lotes “tradicionales” o con uso de promotores de crecimiento antibióticos (AGP) (4). A pesar de que el uso de AGP puede reducir las cepas de E.coli APEC, se necesitan nuevos métodos de control que sean precisos, específicos y que generen menor chance de resistencia, ya que no existe aún la forma de eliminar cepas tipo APEC sin matar las E.coli comensales (2). También, las cepas APEC son resistentes a la mayoría de los desinfectantes que se usan en la limpieza de los galpones (5).
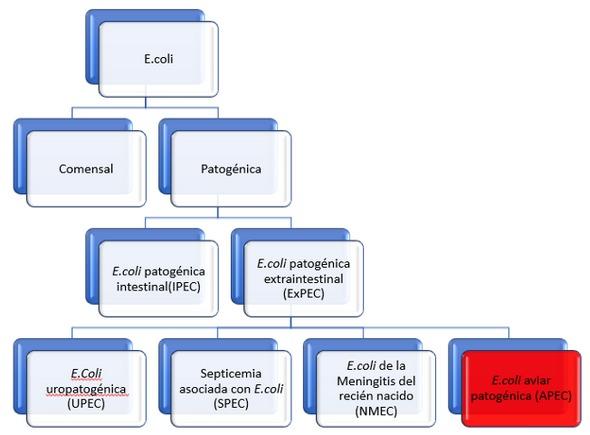
Figura 1. Clasificación de las infecciones por E.coli. Adaptado de Mellata, 2013 (6)
Patogénesis: La forma sistémica y respiratoria severa o también denominada infecciosa extraintestinal de esta enfermedad se conoce como colibacilosis y en muchas ocasiones está asociada con la presencia de otras enfermedades respiratorias como Mycoplasma gallisepticum o el virus de la bronquitis infecciosa (IBR) ya que le abren la puerta de entrada a la APEC (7). La bacteria puede venir a través del tracto respiratorio e infectar otros órganos como el corazón, hígado y bazo. También, puede afectar la piel ya que los rasguños le abren la puerta a APEC la cual se encuentra principalmente en el ambiente, causando celulitis (8,9).
Signos
Se puede presentar letargia, disminución en el consumo y picos de mortalidad inusuales. Se presenta en pollos de engorde entre la cuarta y sexta semana de vida. También afecta pavos y patos (4). La infección conocida como colibacilosis incluye septicemia, perihepatitis, aerosaculitis, neumonía, pericarditis, peritonitis, salpingitis, coligranuloma, infección del saco vitelino, onfalitis, celulitis, osteomielitis, artritis, y el síndrome de cabeza hinchada(8).
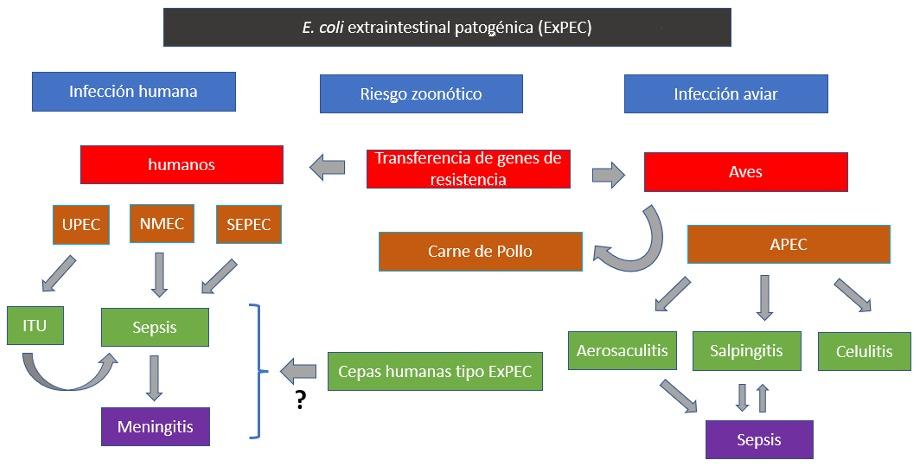
Figura 2. Relación entre E.coli aviar y humana de tipo patogénica extraintestinal (ExPEC), sus infecciones y potencial zoonótico (6). Se ilustra los principales patotipos ExPEC y las infecciones que causan tanto en humanos como en aves. ExPEC puede ocasionar infecciones localizadas que se pueden volver sistémicas como la infección en el tracto urinario (ITU) en humanos y la aerosaculitis en aves. También, infecciones sistémicas (meningitis en humanos y salpingitis en aves) y locales (celulitis en aves). También se ilustra el potencial que podrían tener los productos avícolas (carne) para transferir genes de resistencia tipo ATB y las ExPEC que potencialmente causarían enfermedades zoonóticas (10). UPEC: E. coli uropatogénica, NMEC: E. coli de meningitis neonatal, SEPEC: E. coliséptica, APEC: E. coli patogénica aviar.
Serotipos y factores de virulencia
A la fecha se han descrito 6 serogrupos como O1, O2, O5, O8, O18, O78 siendo los más famosos o más frecuentemente aislados en aves, los O1, O2 y O78. Se han agrupado según el modo de acción, 5 grupos de factores de virulencia en cepas APEC los cuales se muestran en la Figura 3.
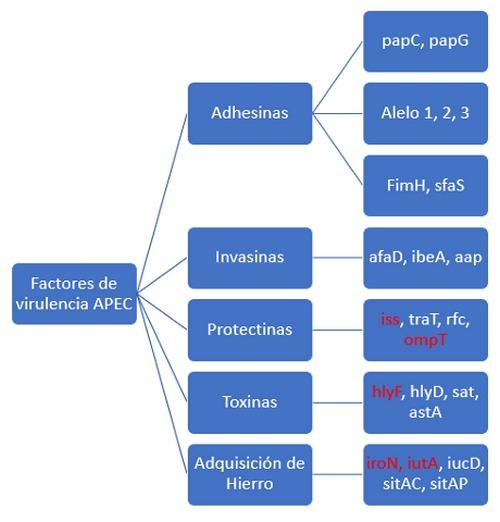
Figura 3. Principales factores de virulencia de las cepas APEC (1). En rojo se resaltan cinco genes (ironN, ompT, iss, iutA, hlyF, los cuales se han encontrado en el plásmido de gran virulencia colV y bastante asociado con las cepas APEC (3,11).
Respuesta Inmune contra APEC
Inicia con la inhalación de partículas de aerosol contaminadas y que contienen APEC y que a su vez logran interactuar con las células epiteliales en la tráquea (2). Una infección previa bacteriana (M.gallisepticum) o viral (IBV), puede dañar la mucosa respiratoria previamente y facilitar la colonización de APEC. Las células residentes como las epiteliales y macrófagos en pulmones y sacos aéreos se convierten en la primera línea de defensa a través del reconocimiento de patrones moleculares asociados a patógenos (PAMPs) por los receptores tipo Toll (TLRs) o de bacterias fagocitadas (2). Esta respuesta desencadena la producción de citoquinas proinflamatorias y quimioquinas que reclutan más células del sistema inmune. La inflamación ocasiona un daño en el tejido y una falla en la función respiratoria solo si la colonización persiste. Los heterófilos podrían ser las primeras células en llegar desde la circulación al sitio infectado y a las pocas horas de haberse establecido la infección. En una segunda onda de células, llegan los monocitos desde la periferia a los pulmones para limpiar, fagocitar heterófilos muertos y así contribuir a la reparación del tejido (12).
Diagnóstico
Se debe realizar aislamiento de APEC por medio de cultivo selectivo como agar McConkey (las colonias se vuelven rojas), agar EMB (azul de metileno de eosina) con fermentación de lactosa, identificación bioquímica con inclusión de lactosa, rojo metilo, sorbitol, citrato, lisina, entre otros. La serotipificación de cepas APEC determina los 6 serotipos más importantes (O1, O2, O5, O8, O18, O78) y la detección de factores de virulencia se debe llevar a cabo por PCR para cada grupo “O”. Todas estas técnicas en conjunto, son claves en la diferenciación entre cepas comensales y patógenas.
Tratamiento y prevención
Se lleva a cabo con antibióticos tradicionales de amplio espectro o algunas intervenciones preventivas con compuestos naturales entre los que se pueden mencionar probióticos, fagos, fitobióticos, ácidos grasos esterificados de cadena media, entre otros (13).
Referencias
1. Dziva F, Stevens MP. Colibacillosis in poultry: Unravelling the molecular basis of virulence of avian pathogenic Escherichia coli in their natural hosts. Avian Pathol (2008) 37:355–366. doi: 10.1080/03079450802216652
2. Guabiraba R, Schouler C. Avian colibacillosis: Still many black holes. FEMS Microbiol Lett (2015) 362: doi: 10.1093/femsle/fnv118
3. Johnson TJ, Kariyawasam S, Wannemuehler Y, Mangiamele P, Johnson SJ, Doetkott C, Skyberg JA, Lynne AM, Johnson JR, Nolan LK. The genome sequence of avian pathogenic Escherichia coli strain O1:K1:H7 shares strong similarities with human extraintestinal pathogenic E. coli genomes. J Bacteriol (2007) 189:3228–3236. doi: 10.1128/JB.01726-06
4. Fancher CA, Zhang L, Kiess AS, Adhikari PA, Dinh TTN, Sukumaran AT. Avian pathogenic Escherichia coli and clostridium perfringens: Challenges in no antibiotics ever broiler production and potential solutions. Microorganisms (2020) 8:1–27. doi: 10.3390/microorganisms8101533
5. Kathayat D, Lokesh D, Ranjit S, Rajashekara G. Avian pathogenic escherichia coli (Apec): An overview of virulence and pathogenesis factors, zoonotic potential, and control strategies. Pathogens (2021) 10:1–32. doi: 10.3390/pathogens10040467
6. Mellata M. Human and avian extraintestinal pathogenic escherichia coli: Infections, zoonotic risks, and antibiotic resistance trends. Foodborne Pathog Dis (2013) 10:916–932. doi: 10.1089/fpd.2013.1533
7. Lutful Kabir SM. Avian colibacillosis and salmonellosis: A closer look at epidemiology, pathogenesis, diagnosis, control and public health concerns. Int J Environ Res Public Health (2010) 7:89–114. doi: 10.3390/ijerph7010089
8. Nolan L. Colibacillosis in Poultry. MSD Man Merck (2019) https://www.msdvetmanual.com/poultry/colibacillosis/colibacillosis-in-poultry
9. Smith JL, Fratamico PM, Gunther NW. Extraintestinal pathogenic Escherichia coli. Foodborne Pathog Dis(2007) 4:134–163. doi: 10.1089/fpd.2007.0087
10. Poolman JT, Wacker M. Extraintestinal pathogenic Escherichia coli, a common human pathogen: challenges for vaccine development and progress in the field. J Infect Dis (2016) 213:6–13. doi: 10.1093/infdis/jiv429
11. Mellata M, Touchman JW, Curtis R. Full sequence and comparative analysis of the plasmid pAPEC-1 of avian pathogenic E. coli χ7122 (O78:k80:H9). PLoS One (2009) 4: doi: 10.1371/journal.pone.0004232
12. Alber A, Stevens MP, Vervelde L. The bird’s immune response to avian pathogenic Escherichia coli. Avian Pathol (2021) 50:382–391. doi: 10.1080/03079457.2021.1873246
13. Gomez-Osorio, LM; Logue, CM; Barbieri N. Assessing the Effect of a Blend of Alpha-Monoglicerydes (Fractal®) through Minimum Inhibitory Concentration (MIC) analysis against Salmonella serotypes and Avian Pathogenic E. coli (APEC) Strains. 7th International Conference on Poultry Intestinal Health. (2022). p. Abstract ID-129 doi: 10.1016/0032-5910(90)80057-6
2. Guabiraba R, Schouler C. Avian colibacillosis: Still many black holes. FEMS Microbiol Lett (2015) 362: doi: 10.1093/femsle/fnv118
3. Johnson TJ, Kariyawasam S, Wannemuehler Y, Mangiamele P, Johnson SJ, Doetkott C, Skyberg JA, Lynne AM, Johnson JR, Nolan LK. The genome sequence of avian pathogenic Escherichia coli strain O1:K1:H7 shares strong similarities with human extraintestinal pathogenic E. coli genomes. J Bacteriol (2007) 189:3228–3236. doi: 10.1128/JB.01726-06
4. Fancher CA, Zhang L, Kiess AS, Adhikari PA, Dinh TTN, Sukumaran AT. Avian pathogenic Escherichia coli and clostridium perfringens: Challenges in no antibiotics ever broiler production and potential solutions. Microorganisms (2020) 8:1–27. doi: 10.3390/microorganisms8101533
5. Kathayat D, Lokesh D, Ranjit S, Rajashekara G. Avian pathogenic escherichia coli (Apec): An overview of virulence and pathogenesis factors, zoonotic potential, and control strategies. Pathogens (2021) 10:1–32. doi: 10.3390/pathogens10040467
6. Mellata M. Human and avian extraintestinal pathogenic escherichia coli: Infections, zoonotic risks, and antibiotic resistance trends. Foodborne Pathog Dis (2013) 10:916–932. doi: 10.1089/fpd.2013.1533
7. Lutful Kabir SM. Avian colibacillosis and salmonellosis: A closer look at epidemiology, pathogenesis, diagnosis, control and public health concerns. Int J Environ Res Public Health (2010) 7:89–114. doi: 10.3390/ijerph7010089
8. Nolan L. Colibacillosis in Poultry. MSD Man Merck (2019) https://www.msdvetmanual.com/poultry/colibacillosis/colibacillosis-in-poultry
9. Smith JL, Fratamico PM, Gunther NW. Extraintestinal pathogenic Escherichia coli. Foodborne Pathog Dis(2007) 4:134–163. doi: 10.1089/fpd.2007.0087
10. Poolman JT, Wacker M. Extraintestinal pathogenic Escherichia coli, a common human pathogen: challenges for vaccine development and progress in the field. J Infect Dis (2016) 213:6–13. doi: 10.1093/infdis/jiv429
11. Mellata M, Touchman JW, Curtis R. Full sequence and comparative analysis of the plasmid pAPEC-1 of avian pathogenic E. coli χ7122 (O78:k80:H9). PLoS One (2009) 4: doi: 10.1371/journal.pone.0004232
12. Alber A, Stevens MP, Vervelde L. The bird’s immune response to avian pathogenic Escherichia coli. Avian Pathol (2021) 50:382–391. doi: 10.1080/03079457.2021.1873246
13. Gomez-Osorio, LM; Logue, CM; Barbieri N. Assessing the Effect of a Blend of Alpha-Monoglicerydes (Fractal®) through Minimum Inhibitory Concentration (MIC) analysis against Salmonella serotypes and Avian Pathogenic E. coli (APEC) Strains. 7th International Conference on Poultry Intestinal Health. (2022). p. Abstract ID-129 doi: 10.1016/0032-5910(90)80057-6
Publicación del Dr. Luis Miguel Gómez-Osorio en su perfil de la red profesional LinkenIn (Junio, 2022) y reproducido en engormix por gentileza del autor
Temas relacionados:
Autores:
AMEVEA Colombia
Recomendar
Comentar
Compartir

¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.





.jpg&w=3840&q=75)