El proceso evolutivo del Virus de Bronquitis Infecciosa Aviar y su relación con las vacunas atenuadas.
Publicado: 26 de agosto de 2022
Por: MVZ. Karina Gaviña Morales. Maestra en Ciencias, UNAM - Universidad Nacional Autónoma de México
La Bronquitis Infecciosa Aviar (BIA) es una enfermedad de distribución mundial, altamente contagiosa que se caracteriza por un cuadro respiratorio, aunque también puede afectar al sistema reproductor, digestivo y a los riñones ocasionando importantes pérdidas económicas a la industria avícola, pues afecta los parámetros productivos (AAAP, 2013; Shan, 2018).
El Virus de Bronquitis Infecciosa Aviar (VBIA) pertenece al orden Nidovirales, familia Coronaviridae, subfamilia Coronavirinae y género Gammacoronavirus. El virión es envuelto, pleomórfico y de aproximadamente 120 nm de diámetro. Su genoma es ácido ribonucleico (ARN) de cadena sencilla, en sentido positivo y de 27.6 kb, que codifica para dos poliproteínas (1ay 1ab), las cuales están sujetas a un procesamiento posterior para dar lugar a 15 proteínas no estructurales (nsp, por sus siglas en inglés) nsp 2-16, para las proteínas accesorias 3a, 3b, 5a y 5b, y para cuatro proteínas estructurales: la proteína de la nucleocápside (N), la glicoproteína de membrana (M), la proteína de envoltura (E) y la proteína Spike (S) conformada por la sub-unidad 1 (S1) que lleva a cabo la unión al receptor celular y que contiene 3 regiones híper-variables (RHV) (Mandary, 2019; Bande, 2016) y por la sub-unidad 2 (S2), responsable de realizar la fusión de la envoltura viral con la membrana celular y del tropismo celular in vitro (Bickerton, 2018; Promkuntod, 2013).
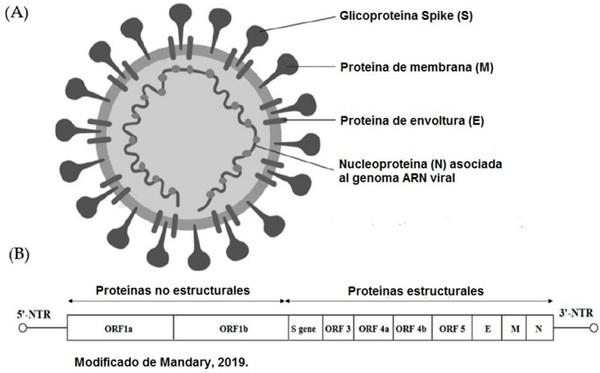
Figura 1. (A) Representación e s q u e m á t i c a d e l V B I A . Pueden apreciarse las 4 proteínas estructurales. (B) Organización del genoma del VBIA. Se observan los marcos de lectura abiertos (ORF) 1a y 1b que codifican para las nsp, los ORF 3, 4a, 4b y 5 codifican para las proteínas accesorias y los genes que codifican para las proteínas estructurales.
El VBIA se puede clasificar en serotipos empleando inhibición de la hemaglutinación (IH) y la técnica de seroneutralización, de esta manera se identificaron los primeros serotipos: Massachusetts (Mass) y Connecticut (Conn) (de Fraga, 2018). Por otro lado, el virus también se puede genotipificar mediante la caracterización del genoma viral, particularmente de la sub-unidad S1, por biología molecular (RT-PCR y secuenciación).
Las secuencias de las RHV de la sub-unidad S1 generalmente pueden correlacionarse con el serotipo, ya que, los virus con > 95% de similitud en su secuencia se agrupan dentro del mismo serotipo, mientras que los virus con < 85% de similitud corresponden a diferentes serotipos (Jordan, 2017). También se ha propuesto una clasificación para el VBIA en 6 genotipos que se subdividen en 32 linajes (Valastro, 2016).
Se ha intentado prevenir esta enfermedad usando vacunas atenuadas, sin embargo, los coronavirus son conocidos por su gran capacidad para generar cambios en su genoma, pues se ha observado mediante pruebas moleculares, la aparición de sub-poblaciones a partir de virus silvestres o incluso vacunales. En esta revisión se discuten los factores que favorecen la rápida evolución del VBIA y el papel que desempeña la vacunación en este proceso.
1. La acumulación de mutaciones y la recombinación genera diversidad en las poblaciones del VBIA.
a) Mutaciones.
Son las sustituciones, deleciones e inserciones que se producen debido a los errores cometidos por la ARN polimerasa-ARN dependiente viral durante la replicación, pues posee una baja fidelidad (capacidad de incorporar la base correcta durante la síntesis de ácidos nucléicos) y por la menor capacidad de los virus con genoma de ARN para corregir dichos errores, dando lugar a una tasa alta de mutaciones (Sanjuán, 2016). Cabe mencionar que, a diferencia del resto de los virus ARN, la ARN polimerasa de los coronavirus presenta un dominio exonucleasa 3’ que posee una función correctora de errores y se ha propuesto que ayuda a alcanzar un balance entre fidelidad y diversidad facilitando la adaptación viral a la presión de selección ambiental (Mandary, 2017). Las mutaciones en las RHV de la subunidad S1 son las más importantes, pues el cambio de un pequeño porcentaje de aminoácidos puede dar lugar a un cambio de serotipo (Cavanagh, 2003).
b) Recombinación.
Se lleva a cabo cuando al menos dos genomas virales co-infectan la misma célula y durante la replicación la ARN polimerasa cambia entre los diferentes genomas (moldes) presentes, formando una nueva secuencia de ARN (Pérez-Losada, 2015; Sanjuán, 2016). Las recombinaciones en el gen de la proteína S son de importancia pues pueden resultar en la aparición de nuevas cepas capaces de causar enfermedad en otras especies, cómo fue el caso del surgimiento del coronavirus de pavo a partir del VBIA (Jackwood, 2012; Lin, 2017). La recombinación también se ha asociado con un incremento en la virulencia, la modificación del tropismo celular y de la patogénesis, así como evasión del sistema inmune del hospedero y resistencia a antivirales (Pérez-Losada, 2015).
2. Factores dentro del hospedero que favorecen la selección de poblaciones.
Una vez que se ha generado diversidad, las variantes serán sometidas a un proceso de selección de la sub-población viral más apta, para asegurar su supervivencia a largo plazo dentro de las células (Domingo, 1998). Cómo los virus son parásitos obligados, existen diversos factores dentro del hospedero que actúan sobre los virus generando presiones de selección, por ejemplo:
El sistema immune: Cuando una sub-población viral predominante se vuelve blanco de la respuesta immune del hospedero, es negativamente seleccionada para dar lugar a la dominancia de la subpoblación para la cual el sistema immune tiene menos afinidad (Toro, 2012a).
Inmunodeficiencia en la parvada: Los virus ARN evolucionan aún en ausencia de una efectiva respuesta inmune, incluso se ha encontrado una mayor divergencia viral en individuos inmunodeficientes, prueba de ello es el incremento en el aislamiento de la cepa variante tipo Arkansas Delmarva Poultry Industry (ArkDPI) del VBI asociado a parvadas inmunodeficientes (Toro, 2012a).
Variación de receptores celulares entre tejidos: Se puede generar debido a un splicing pre-ARN mensajero alternativo para producir proteínas variantes o por glicosilación alternativa, dando origen a una variación en la afinidad de la proteína S hacia los receptores celulares (Toro, 2012b).
El micro-ambiente: La diferencia en la temperatura, pH, nivel de oxígeno y concentración de enzimas entre los diferentes tejidos del hospedero puede alterar la sub-población viral predominante por presión selectiva. La incidencia del fenotipo vacunal disminuye a través de los tejidos más alejados del sitio inicial de inoculación (Gallardo, 2010).
La vacunación. La evidencia científica ha demostrado que la presión que se genera por la vacunación es una fuerza importante que acelera el proceso de selección.
La evolución viral resulta de la combinación entre la generación de diversidad y de las fuerzas que promueven la selección de poblaciones, cómo se esquematiza en la figura 2:
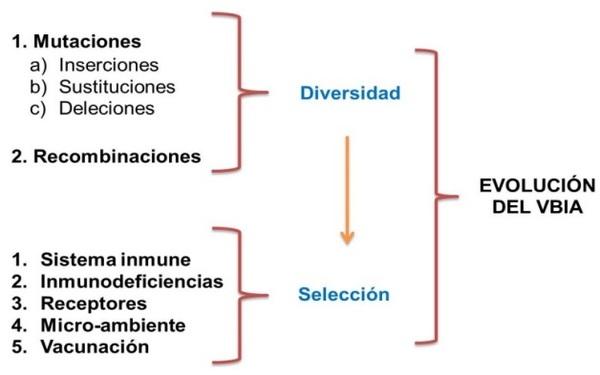
Figura 2 .Proceso mediante el cual se lleva a cabo la evolución del VBIA.
3. La vacunación contra la BIA es una fuerza de selección que promueve la rápida evolución viral.
Las vacunas atenuadas son ampliamente utilizadas en la industria avícola, sin embargo, no confieren una protección cruzada sólida contra los diferentes serotipos del VBIA. Los virus vacunales atenuados al ser activos tienen la capacidad de replicarse dentro de las aves, las cuales al no estar completamente protegidas permiten que dichos virus sean sometidos a todos los procesos previamente descritos, es decir, generan diversidad de sub-poblaciones íntimamente relacionadas entre sí que posteriormente serán rápidamente seleccionadas, acelerando también la evolución viral después de un sólo ciclo de replicación en el hospedero (Wickramasinghe, 2014). Es por ello que las vacunas atenuadas se consideran de las principales causas del surgimiento de las denominadas cepas variantes (Lin, 2017).
Los investigadores han reportado que en ausencia de la presión selectiva por la vacunación la tasa de mutación evaluada en las RHV de la sub-unidad S1 del VBIA es de 3 x 10-3 sustituciones/sitio/año, mientras que la tasa en presencia de vacunación es de 1.5 x 10-2 sustituciones/sitio/año, de hecho, cuando se analizan las lágrimas de aves infectadas con el VBIA éstas muestran la misma secuencia genética que el virus con el que se inocularon, por otro lado, cuando las aves son vacunadas con virus atenuado, las lágrimas de estas aves ya presentan sub-poblaciones diferentes del virus vacunal, con mutaciones y recombinaciones en el gen S (Toro, 2012b).
Al producirse varias sub-poblaciones virales, las vacunas contra el VBIA pueden ser inestables, cómo es el caso del serotipo Arkansas (Ark), en donde se ha observado un problema de persistencia del VBIA en parvadas vacunadas contra éste serotipo en particular. En los últimos años, los investigadores han descubierto diferencias en la secuencia de la proteína S dentro del mismo serotipo vacunal, es decir, diversas sub-poblaciones que se encuentran en diferentes proporciones en vacunas de diferentes fabricantes y entre diferentes lotes de vacunas del mismo fabricante, las cuales a su vez son seleccionadas de diversas maneras dentro de las aves, produciendo variaciones en el resultado de la vacunación (McKinley, 2008; Ndegwa, 2012; Ndegwa, 2014). Por ello, se considera que las vacunas que contienen el serotipo Ark son heterogéneas, y si bien, algunos autores lo consideran benéfico para el hospedero pues argumentan que podrían conferir una protección vacunal más amplia, también se ha advertido del riesgo que conlleva, pues dichas sub-poblaciones heterogéneas proveen más material genético, mediante ciclos virales adicionales, para la generación de nuevos virus de campo por los mecanismos de mutación y recombinación (Van Santen, 2008). De hecho, una vez que las subpoblaciones del serotipo Ark vacunales están dentro del hospedero se seleccionan dentro de los primeros 3 días después de la vacunación, volviéndose más aptas, pues son capaces de adaptarse a los cambios en el hospedero, lo cual incrementa su habilidad para infectar diferentes tejidos e incluso su virulencia (Ndegwa, 2012).
A nivel de campo se realiza la combinación de serotipos vacunales para ampliar el rango de protección. Por ejemplo, la combinación del serotipo Mass al día de edad y el serotipo 793/B catorce días después ha mostrado buenos resultados (Karimi, 2018). Sin embargo, en varios países sólo se permite la vacunación con el serotipo Mass, y a su vez, la combinación de serotipos aunado a la rápida evolución, pueden dar lugar a virus más virulentos y a la introducción de nuevos patógenos virales (Jordan, 2017).
La vacunación al día de edad con vacunas atenuadas en pollo de engorda, y en aves de vida larga la revacunación con cepas activas o inactivas del serotipo Mass antes del inicio de la postura es un esquema utilizado comúnmente para proteger contra desafíos de campo (Sjaak de Wit, 2019). Debido a la importancia de generar una mayor protección, además del serotipo a emplear, también se deben tomar en cuenta otros factores, por ejemplo:
El método de vacunación y cobertura de vacunación: Es importante asegurar, en la medida de lo possible, que las aves queden efectivamente inmunizadas, debido a que aquellas no inmunizadas pueden favorecer la persistencia y reversión a la virulencia exacerbando el problema en la parvada (Sjaak de Wit, 2011).
La edad de las aves: El programa de vacunación contra el VBIA al primer día de edad puede favorecer el problema de persistencia viral debido a que el sistema inmune de los pollitos aún es inmaduro, por lo tanto, menos efectivo en la eliminación del virus vacunal; esto permite un incremento en los ciclos replicativos, por ende, se incrementa el riesgo de mutaciones/recombinaciones y el surgimiento de nuevas cepas variantes (Zagpi, 2019). La glándula de Harder se considera el principal proveedor de IgA a las lágrimas, sin embargo, éste órgano linfoide madura completamente semanas después de la eclosión, por ello, la vacunación temprana genera retraso y/o disminución en la respuesta inmune humoral local por IgA. También se ha reportado una baja avidez de IgG, mayor daño traqueal y signos clínicos después del desafío en comparación con aves vacunadas al día 7 y 14 de edad (Eldemery 2019). La re-vacunación para potencializar la pobre respuesta inmune inicial podría no compensar e incluso enmascarar la prematura vacunación al primer día de edad (van Ginkel, 2015). Tomando en cuenta que la respuesta inmune primaria es dominada por IgA, se destaca la importancia de aplicar la primera vacuna cuando el ave pueda montar una mejor respuesta inmune y así evitar la vulnerabilidad de las células epiteliales a un proceso infeccioso y/o promover la persistencia viral (Orr-Burks,2014).
La inmunogenicidad a la vacuna: Las vacunas atenuadas generan una respuesta inmune de moderada, por ello se recurre a la combinación de serotipos. Por otro lado, las vacunas inactivas por si solas inducen una respuesta inmune pobre y no proporcionan una protección efectiva contra el daño traqueal ni contra la disminución en la producción de huevo causadas por desafíos de campo, debido a ello se utilizan después de haber inmunizado con una vacuna activa atenuada (dos Santos, 2019).
La inmunidad materna: Los anticuerpos maternos, predominantemente IgG, persisten en los pollitos de 4 a 7 días, durante este periodo previenen la activación de su sistema immune aún incapaz de generar una respuesta immune completa, por lo tanto, suprimen la producción de anticuerpos por parte de los pollitos en respuesta a cualquier tipo de vacuna, e incluso cuando el título de anticuerpos maternos es bajo y no protector, siguen inhibiendo la protección por vacunación, dando la oportunidad de infección por virus de campo (Niewiesk, 2014; Van Ginger, 2015).
La dosis vacunal: Una dosis vacunal más alta puede resultar en sub-poblaciones más aptas que sean capaces de replicarse en un mayor número de aves vacunadas, esto le permite al virus balancear los efectos negativos de la presión inmune del hospedero (Ndegwa, 2014). En contraste, la sub-dosificación conlleva mayor daño traqueal, menor nivel de producción de anticuerpos y deficiente respuesta inmune mediada por células, en comparación con las aves vacunadas con la dosis adecuada (Okino, 2013).
CONCLUSIÓN
El VBIA es un patógeno de distribución mundial que produce una de las enfermedades más importantes que afecta a las aves de producción, pues presenta diversos cuadros clínicos y genera pérdidas millonarias. El VBIA tiene la capacidad de adaptarse rápidamente a situaciones adversas para su replicación, por lo tanto, el reto que enfrentan los avicultores es la prevención, pues se ha demostrado que la vacunación promueve el cambio genético del virus, lo que puede contribuir al surgimiento de las cepas variantes, complicando aún más el panorama, pues al no haber protección cruzada entre serotipos se generan respuestas inmunes intermedias que representan una ventaja para los virus, debido a que aseguran su permanencia dentro de la parvada, ya que las aves quedan expuestas a desafíos de campo, o incluso a las variantes generadas por la misma vacunación no exitosa. Diversas estrategias se han propuesto, sin alcanzar un éxito absoluto. Por ello, es primordial conocer las cepas circulantes en cada región y así actualizar continuamente las vacunas (en los países donde esté permitido el uso de cepas variantes), re-vacunar a las aves de vida larga, en la medida de lo posible retrasar el inicio del programa de vacunación después del séptimo día para permitir una mayor maduración del sistema immune y evitar la inhibición de la vacunación por los anticuerpos maternos. Tener excelentes medidas de bioseguridad, proveer confort, y una buena alimentación para las aves también ayuda en la prevención de esta enfermedad.
- Asociación Americana de Patólogos Aviares (AAAP). Bronquitis infecciosa. Manual de enfermedades de las aves. 2013; 7a ed: 55-57.
- Bande F, Arshad SS, Omar Ar, Bejo MH, Abubakar MS, Abba Y. Pathogenesis and diagnostic approaches of avian infectious bronchitis. Adv Virol. 2016: 1-11.
- Bickerton E, Maier HJ, Stevenson-Legget P, Armesto M, Britton P. The S2 subunit of infectious bronchitis virus Beaudette is a determinant of cellular tropism. J Virol. 2018; 92(9): 1-18.
- Cavanagh D. Severe acute respiratory syndrome vaccine development: experiences of vaccination against avian infectious bronchitis coronavirus. Avian Pathol. 2003; 32(6): 567-82.
- Domingo E, Baranowski E, Ruiz-Jarabo CM, Martín-Hernández AM, Sáiz JC. Quasispecies structure and persistence of RNA viruses. Emerg Infect Dis. 1998; 4(4): 521-27.
- Gallardo RA, van Santen VL, Toro H. Host intraspatial selection of infectious bronchitis virus populations. Avian Dis. 2010; 54(2): 807-813.
- Jackwood MW, Hall D, Handel A. Molecular evolution and emergence of avian gammacoronaviruses. Infec Genet Evol. 2012; 12:1305-1311.
- Jordan B. Vaccination against infectious bronchitis virus: A continuous challenge. Vet Microbiol. 2017; 206: 137-43.
- Karimi V, Mohammadi P, Ghalyanchilangeroudi A, Ghafouri SA, Hashemzadeh M, Farahani RK,
- Maghsouldoo H, Isakakroudi N. Including 793/B type avian infectious bronchitis vaccine in 1-day-old chicken increased the protection against QX genotype. Trop Anim Health Prod. 2019; 51: 629-35.
- Lin SY, Chen HW. Infectious bronchitis virus variants: Molecular analysis and pathogenicity investigation. Int J Mol Sci. 2017; 2030(18): 1-17.
- Mandary MB, Masomian M, Poh CL. Impact of RNA virus evolution on quasispecies formation and virulence. Int J Mol Sci. 2019; 20: 1-33.
- McKinley ET, Hilt DA, Jackwood MW. Avian coronavirus infectious bronchitis attenuated live vaccines undergo selection of subpopulations and mutations following vaccination. Vaccine. 2008; 26: 1274-84.
- Ndegwa EN, Joiner KS, Toro H, van Ginkel FW, van Santen VL. The proportion of specific viral subpopulations in attenuated Arkansas Delmarva Poultry Industry infectious bronchitis vaccines influences vaccination outcome. Avian Dis. 2012; 56(4): 642-53.
- Ndegwa EN, Toro H, van Santen VL. Comparison of vaccine subpopulation selection, viral loads, vaccine virus persistence in trachea and cloaca, and mucosal antibody responses after vaccination with two different Arkansas Delmarva Poultry Industry-Derived Infectious bronchitis virus vaccines. Avian Dis. 2014; 58: 102-10.
- Niewiesk, S. Maternal antibodies: clinical significance, mechanisms of interference with immune responses, and possible vaccination strategies. Front Immunol. 2014; 446(5): 1-15.
- Okino CH, Alessi AC, Montassier MFS, Rosa AJM, Wang X, Montassier HJ. Humoral and cell-mediated immune responses to different doses of attenuated vaccine against avian infectious bronchitis. Viral Immunol. 2013; 26(4): 259-67.
- Orr-Burks N, Gulley SL, Gallardo RA, Toro H, van Ginkel FW. Immunoglobulin A as an early humoral responder after mucosal avian coronavirus vaccination. Avian Dis. 2014; 58: 279-86.
- Padilha de Fraga A, Gräf T, Schneider-Pereira C, Ikuta N, Fonseca ASK, Lunge VR. Phylodynamic analysis and molecular diversity of the avian infectious bronchitis virus of chickens un Brazil. Infect Genet Evol. 2018; 61: 77-83.
- Promkuntod N, Wickramasinghe IN, de Vrieze G, Gröne A, Verheije MH. Contributions of the S2 spike ectodomain to attachment host range. Virus Res. 2013; 177: 127-37.
- Pérez-Lozada M, Arenas M, Galán JC, Palero F, González-Candelas F. Recombination in viruses: Mechanisms, methods of study, and evolutionary consequences. Infect Genet Evol. 2015; 30: 296-307.
- Saiada F, Eldemery F, Zegpi RA, Gulley SL, Mishra A, van Santen VL, Toro H. Early vaccination of chickens induces suboptimal immunity against infectious bronchitis virus. Avian Dis. 2019; 63: 38-47.
- Sanjuán R, Domingo-Calap P. Mechanisms of viral mutation. Cell Mol Life Sci. 2016; 73: 4433-48.
- Santos RMD, Fernando FS, Montassier MFS, Silva KR, Lopes PD, Pavani C, Borzi MM, Okino CH, Montassier HJ. Memory immune responses and protection of chickens against a nephropathogenic infectious bronchitis strain by combining live heterologous and inactivated homologous vaccines. J Vet Med Sci. 2019; 81(4): 612-19.
- Shan D, Fang S, Han Z, Ai H, Zhao W, Chen Y, Jiang L, Liu S. Effects of hypervariable regions in Spike protein on pathogenicity, tropism, and serotypes of infectious bronchitis virus. Virus Res. 2018; 250: 104-13.
- Sjaak de Wit JJ, Cook JKA, van der Heijden MJF. Infectious bronchitis virus variants: a review of the history, current situation and control measures. Avian Pathol. 2011; 40(3): 223-35.
- Sjaak de Wit JJ. Malo A Cook JKA. Induction of IBV strain-specific neutralizing antibodies and broad spectrum protection in layer pullets primed with IBV Mass and 793B vaccines prior to injection of inactivated vaccine containing Mass antigen. Avian Pathol. 2019; 48(2): 135-47.
- Toro H, Pennington D, Gallardo RA, van Santen VL, van Ginkel FW, Zhang J, Joiner KS. Infectious bronchitis virus subpopulations in vaccinated chickens after challenge. Avian Dis. 2012a; 56: 501-508
- Toro H, van Santen VL, Jackwood MW. Genetic diversity and selection regulates evolution of infectious bronchitis virus. Avian Dis. 2012b; 56: 449-55.
- Valastro V, Holmes EC, Britton P, Fusaro A, Jackwood MW, Cattoli G, Monne I. S1 gene-based phylogeny of infectious bronchitis virus: an attempt to harmonize virus classification. Infect Genet Evol. 2016; 39: 349-364.
- Van Ginkel FW, Padgett J, Martínez-Romero G, Miller MS. Age dependent immune responses and immune protection after coronavirus vaccination. Vaccine. 2015; 33: 2655-61.
- Van Santen VL, Toro H. Rapid selection in chickens of subpopulations within ArkDPI-derived infectious bronchitis virus vaccines. Avian Pathol. 2008; 37(3): 293-306.
- Wickramasinghe INA. The avian coronavirus Spike protein. Virus Res. 2014; 194: 37-48.
- Zegpi RA, Gulley SL, van Santen VL, Joiner KS, Toro H. Infectious bronchitis virus vaccination at day 1 of age further limits cross protection. Avian Dis. 2019; 63: 302-09
Temas relacionados:
Preguntas Relacionadas
El VBIA se puede clasificar en serotipos empleando inhibición de la hemaglutinación (IH) y la técnica de seroneutralización, identificándose los serotipos: Massachusetts (Mass) y Connecticut (Conn). Por otro lado, el virus se puede genotipificar mediante la caracterización del genoma viral, particularmente de la sub-unidad S1, por biología molecular (RT-PCR y secuenciación). Las secuencias de las RHV de la sub-unidad S1 generalmente pueden correlacionarse con el serotipo.
El Virus de Bronquitis Infecciosa Aviar (VBIA) pertenece al orden Nidovirales, familia Coronaviridae, subfamilia Coronavirinae y género Gammacoronavirus. Su virión es envuelto, pleomórfico y de aproximadamente 120 nm de diámetro. Su genoma es ácido ribonucleico (ARN) de cadena sencilla, en sentido positivo y de 27.6 kb, que codifica para diferentes proteínas, entre ellas 4 proteínas estructurales: nucleocápside (N), glicoproteína de membrana (M), proteína de envoltura (E) y proteína Spike (S).
La acumulación de mutaciones y la recombinación genera diversidad en las poblaciones del VBIA. Mutaciones. Son las sustituciones, deleciones e inserciones que se producen debido a los errores cometidos por la ARN polimerasa-ARN dependiente viral durante la replicación, pues posee una baja fidelidad (capacidad de incorporar la base correcta durante la síntesis de ácidos nucléicos) y por la menor capacidad de los virus con genoma de ARN para corregir dichos errores, dando lugar a una tasa alta de mutaciones (Sanjuán, 2016). Cabe mencionar que, a diferencia del resto de los virus ARN, la ARN polimerasa de los coronavirus presenta un dominio exonucleasa 3’ que posee una función correctora de errores y se ha propuesto que ayuda a alcanzar un balance entre fidelidad y diversidad facilitando la adaptación viral a la presión de selección ambiental (Mandary, 2017). Las mutaciones en las RHV de la subunidad S1 son las más importantes, pues el cambio de un pequeño porcentaje de aminoácidos puede
A nivel de campo se realiza la combinación de serotipos vacunales para ampliar el rango de protección. Por ejemplo, la combinación del serotipo Mass al día de edad y el serotipo 793/B catorce días después ha mostrado buenos resultados (Karimi, 2018). Sin embargo, en varios países sólo se permite la vacunación con el serotipo Mass, y a su vez, la combinación de serotipos aunado a la rápida evolución, pueden dar lugar a virus más virulentos y a la introducción de nuevos patógenos virales (Jordan, 2017).
La glándula de Harder se considera el principal proveedor de IgA a las lágrimas, sin embargo, éste órgano linfoide madura completamente semanas después de la eclosión, por ello, la vacunación temprana genera retraso y/o disminución en la respuesta inmune humoral local por IgA. También se ha reportado una baja avidez de IgG, mayor daño traqueal y signos clínicos después del desafío en comparación con aves vacunadas al día 7 y 14 de edad (Eldemery 2019). La re-vacunación para potencializar la pobre respuesta inmune inicial podría no compensar e incluso enmascarar la prematura vacunación al primer día de edad (van Ginkel, 2015).
Autores:

Recomendar
Comentar
Compartir

¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.
Usuarios destacados en Avicultura

Lorena Ramos
Cargill
Nutricionista Senior en Cargill Protein, América Latina
Estados Unidos de América
Estados Unidos de América





