La coccidiosis es una enfermedad parasitaria protozoaria causada por varias especies de Eimeria sp. entre las más importantes se encuentran E. acervulina E. maxima E. tenella, las cuales afectan particularmente a las aves de corral (Davis y Gookin, 2018). La coccidiosis está extendida mundialmente y es una de las enfermedades más costosas en términos de prevención y pérdida productivas para la industria avícola. Durante más de 50 años, la principal medida fue la utilización de alimentación profiláctica con anticoccidiales, considerados aditivos obligatorios en las dietas de pollos parrilleros criados en sistemas intensivos o superintensivos (Markiewicz et al., 2014). La monensina (MON), fue el primer ionóforos utilizado en la industria avícola, para el control de la coccidiosis en aves. La monensina es un ionóforo carboxílico selectivo de Na+ que forma complejos catiónicos solubles en lípidos que pueden atravesar las membranas celulares rápidamente (EFSA, 2008). En la década de los 80 se realizaron varios estudios demostrando su toxicidad en bovinos, aves de corral, ovejas, caballos y perros. Los órganos diana de la intoxicación por monensina son los músculos esqueléticos y cardíacos. La toxicidad de la monensina se debe principalmente a su capacidad para aumentar la concentración intracelular de sodio (Markiewicz et al., 2014).
Otro de los problemas causantes de pérdidas económicas importantes en la producción avícola es la contaminación con micotoxinas de los alimentos (Magnoli et al., 2019). Se han propuesto numerosos métodos físicos, químicos y biológicos para desintoxicar, degradar o inactivar a las micotoxinas en los alimentos contaminados. Entre ellos, los métodos biológicos, utilizando microorganismos y sus metabolitos, serían un enfoque prometedor debido a su desintoxicación específica, eficiente y ambientalmente racional (Roto et al ., 2015; Magnoli et al., 2017, 2018; Martinez et al., 2017). Otros estudios han indicado que las paredes celulares de Saccharomyces cerevisiae se pueden agregar a los alimentos contaminados para unir selectivamente las micotoxinas (Yiannikouris et al., 2006). Para reducir las pérdidas económicas del sector, continuamente se están estudiando alternativas nutricionales como la utilización de bacterias y levaduras como probióticos y prebióticos los cuales han demostrado ser efectivos en favorecer el crecimiento de la biota intestinal benéfica y algunos como absorbentes de micotoxinas (Sarangi et al., 2016; Magnoli et al., 2016, 2017,2018; Martinez et al., 2017; Anadón et al., 2019; Poloni et al., 2020). Sin embargo, estos productos alternativos solos no han proporcionado una solución efectiva. Es por ello que en la actualidad se está estudiando los efectos de la adición conjunta de bacterias, levaduras, enzimas, coccidiostaticos y fitobioticos entre otros (Mehdi et al., 2018; Anadón et al., 2019; Poloni et al., 2020).
En estudios previos Magnoli et al. (2011a,b) han demostrado que monensina puede reducir la efectividad de la bentonita de sodio (NaB) para adsorber aflatoxina B1 (AFB1). Más tarde y en contraste, De Mil et al. (2017) mostraron que los aglutinantes de micotoxinas no influyeron en la biodisponibilidad oral de los coccidiostáticos en pollos de engorde. Aunque diferentes trabajos han demostrado la influencia de los absorbentes no biológicos (NaB) en la adsorción de AFB1 en presencia de monensina, no hay estudios en la literatura que demuestren la po-sible interacción o los efectos entre los absorbentes biológicos como la levadura y la monensina.
Por lo expuesto anteriormente, el objetivo de este estudio fue evaluar el impacto de Pichia kudriavzevii en la histopatología de los órganos inmunes e intestino delgado de pollos parrilleros alimentados con monensina.
MATERIALES Y MÉTODOS
El protocolo de trabajo y las técnicas utilizadas cum-plen con las regulaciones del Subcomité de Bioética Animal bajo el Comité de Ética de Investigación Científica, según lo establecido en la Resolución 253/10 del Consejo Superior de la Universidad Nacional de Río Cuarto.
Aditivos utilizados
Monensina: se adiciono una fuente comercial de monensina sódica (MON) C36H62O11 (20% de MON granular, Ensol, Buenos Aires, Argentina) a la dieta basal y se homogeneizó para proporcionar una concentración de 50 mg de MON/kg de alimento.
Levadura:Pichia kudriavzevii (estado teleomórfico de Candida krusei) se obtuvo del Centro de Recolección de la Universidad Nacional de Río Cuarto, Argentina. Anteriormente se aisló de los alimentos de pollos parrilleros y se caracterizó por la secuenciación de 26S D1/D2 rRNA dominio genético. Las secuencias de genes parciales de 26S-ARNr (dominios D1 / D2) se amplificaron usando cebadores NL-1 (5’-GCATATCAATAAGCGGAGGAAAAG-3 ‘) y NL-4 (5’-GGTCCGTGTTTCAAGACGG-3’) de acuerdo con Kurtzman y Robnett (2003).
La selección de la cepa se basó en su capacidad para unir AFB1in vitro (Magnoli et al., 2016). P. kudriavzevii se produjo en 150 ml de caldo de levadura peptona dextrosa (YPD) en Erlenmeyer inoculados con 1 ml de un cultivo puro de 24 h. Los Erlenmeyer se incubaron en un agitador orbital (150 rpm) a 37 °C durante 24 h. Luego, las células se recogieron por centrifugación (6.000 rpm, 5 min) y los pellets se liofilizaron y homogeneizaron para incorporarlos a la dieta basal con el fin de proporcionar una concentración de 1 g de levadura/kg de alimento (0,1%).
Diseño experimental: se utilizaron pollitos machos de un día de edad (Ross) vacunados contra la enfermedad de Mareks obtenidos de un criadero comercial y se mantuvieron bajo iluminación fluorescente continua con alimento y agua ad libitumdurante todo el experimento. El día 1 del experimento, se pesaron individualmente y se seleccionaron al azar un total de 60 aves (4 tratamientos/3 réplicas, 5 pollos parrilleros/réplica). Durante el período experimental (28 días), los pollos parrilleros recibieron la dieta correspondiente a cada tratamiento. Para formular las diferentes dietas experimentales, se utilizó una dieta iniciadora basada en harina de maíz y soja (dieta basal) que cumplía con los requisitos de las Di-rectrices Ross 308 (Aviagen, Ross 308 Broiler, 2014). Las diferentes dietas se prepararon mezclando pre-viamente la levadura liofilizada y luego mezclándolas con la dieta basal en un mezclador industrial. El diseño experimental consistió en 4 tratamientos, cada tratamiento se formuló de la siguiente manera: tratamiento (T) T1: dieta basal (DB); T2: DB + MON (50 mg/kg); T3: DB + P. kudriavzevii (1 g de levadura /kg de alimento); T4: DB + MON + P. kudriavzevii. Los pollos parrilleros se pesaron al inicio, semanalmente y al final del estudio y se monitorearon diariamente para detectar signos de morbilidad y mortalidad. Al final del periodo experimental, se extrajo bazo, timo, bolsa de Fabricio e intestino delgado para evaluar los cambios histopatológicos. Además, los órganos inmunes fueron pesados para determinar el peso relativo y absoluto de los mismos.
Determinación de la histopatología de órganos in-munes e intestino delgado: cuando los pollos parrilleros alcanzaron la edad de 33 días, el ensayo terminó, se seleccionaron al azar 3 pollos de cada réplica de cada tratamiento y se sacrificaron por dislocación cervical. Luego se realizó una necropsia detallada. Después del examen patológico, se extrajo bazo, timo y bolsa de Fabricio para la observación histológica y se pesaron, (n = 9) de cada tratamiento (3 de cada réplica de cada órgano) se seleccionaron y fijaron en formalina tamponada neutra al 10%. Los tejidos fijados se recortaron, se embebieron en parafina y se tiñeron con hematoxilinaeosina para su examen histopatológico por microscopía óptica (MO). Microscópicamente, la extensión del daño de los órganos inmunológicos se evaluó según Peng et al. (2015). En el ensayo experimental se evaluaron otros parámetros, cuyos resultados fueron publicados previamente (Magnoli et al., 2018; 2019). El peso relativo se calculó mediante la siguiente fórmula: peso relativo = peso del órgano (g) / peso corporal (g).
Se tomaron muestras de intestino delgado (duodeno) de aproximadamente 6 mm2 se fijaron en formaldehído salino tamponado al 4% (v/v) pH 7,2-7,4 a 4 °C, deshidratado en una serie graduada de etanol (30%, 50%, 70%, 80%, 90%, 95% y 100%) y soluciones de xileno, embebidas en parafina y cortadas en cortes seriados histológicos de ± 4 μm. Las secciones histológicas se tiñeron con hematoxilina/ eosina (H&E) para análisis microscópico.
Las imágenes digitales se capturaron con un microscopio Axiophot (Carl Zeiss, Thornwood, NY) equipado con una cámara digital Power Shot G6 de 7.1 megapíxeles de alta resolución (Canon INC, Japón). El análisis de imagen digital y las mediciones morfométricas se realizaron con Axio visión AxioVs40 V4.6.3.0. software (Carl Zeiss, Gotinga, Alemania).
Microscópicamente, la extensión del daño intestinal y la inflamación se evaluó de acuerdo con Del Carmen et al. (2013), utilizando un sistema de clasificación histopatológico estándar: hallazgos histológicos idénticos a los normales (grado 0); infiltrado inflamatorio leve de la mucosa y/o submucosa (mezcla de neutrófilos) y edema, erosiones puntuales de la mucosa a menudo asociadas con la proliferación capilar, muscular de la mucosa intacta (grado 1); cambios de grado 1 que involucran el 50% de la muestra (grado 2); infiltrado inflamatorio prominente y edema (predominantemente neutrófilos) frecuentemente con áreas más profundas de ulceración que se extienden a través de la muscular de la mucosa hacia la submucosa; células inflamatorias raras que invaden la muscular de la lámina propia pero sin necrosis muscular (grado 3); cambios de grado 3 que involucran el 50% de la muestra (grado 4); ulceración extensa con necrosis coagulativa bordeada inferiormente por numerosos neutrófilos y un menor número de células mononucleares; la necrosis se extiende profundamente en la muscular propia (grado 5); cambios de grado 5 que involucran el 50% de la muestra (grado 6). Los análisis a ciegas fueron realizados por dos científicos diferentes.
Análisis estadístico de los datos: Los datos fueron analizados por un modelo general y lineal mixto (GLMM) (versión 2.03 para Windows 2012; Universidad de Córdoba, Argentina) software 2008 (Di Rienzo et al., 2008). Los datos fueron analizados por análisis de varianza (ANOVA). Las medias y el error estándar (SEM) se compararon utilizando la prueba menos significativa protegida de Fisher (LSD) (p < 0,05).
RESULTADOS
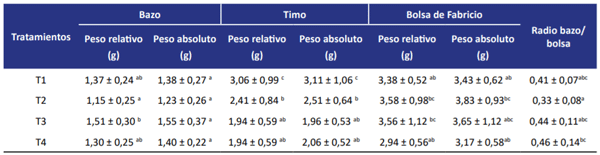
En la Tabla 1 se muestran los pesos relativos y absolutos de bazo, timo y bolsa de Fabricio (BF) y el radio bazo/BF de los pollos parrilleros suplementados con los diferentes tratamientos. Los pesos relativos y absolutos del bazo no mostraron diferencias significativas entre los tratamientos comparados con el tratamiento control (T1) (p< 0,05), sin embargo, los valores muestran una tendencia negativa en ambos parámetros evaluados cuando se adiciono MON (T2). Por otro lado, la adición de levadura (T4) mostro una tendencia positiva de los valores tanto para el peso relativo como absoluto. En cuanto a los pesos relativos y absolutos del timo todos los tratamientos mostraron diferencias significativas comparadas con el tratamiento control (p< 0,05). Los pesos de los diferentes tratamientos fueron menores comparado con los pesos del tratamiento control. La adición de MON (T2) mostro una disminución significativa de los pesos (p< 0,05) comparados con los pesos del tratamiento control (T1), sin embargo, cuando se adiciono en forma conjunta levadura y MON (T4) no mostraron diferencias significativas al compararlas con el tratamiento 2 (MON), si bien no hubo diferencias significativas, los valores de los pesos del timo mostraron una tendencia positiva cuando se adiciono la levadura. Por otro lado, los pesos relativos y absolutos de la BF no mostraron diferencias significativas comparados con el tratamiento control (p< 0,05). Los valores del radio bazo/ bolsa de Fabricio, si bien, no mostraron diferencias significativas entre los tratamientos (p< 0,05), se observa nuevamente una tendencia positiva de los valores con la adición de la levadura al compararlo con el tratamiento con MON (T4).
Tabla 1. Pesos relativos y absolutos de bazo, timo y bolsa de Fabricio y radio bazo/bolsa de Fabricio en pollos parrilleros suplementados con los diferentes tratamientos.
T1: dieta basal (B); T2: B + MON; T3: B + P. kudriavzevii; T4: B + MON + P. kudriavzevii; Monensina (MON 50 mg/kg); P. kudriavzevii (1 g levadura/kg de alimento).
Los datos se expresan como media ± ES. Los superíndices dentro de las filas indican diferencia significativa (p < 0,05), según el test de Fisher; n = 9.
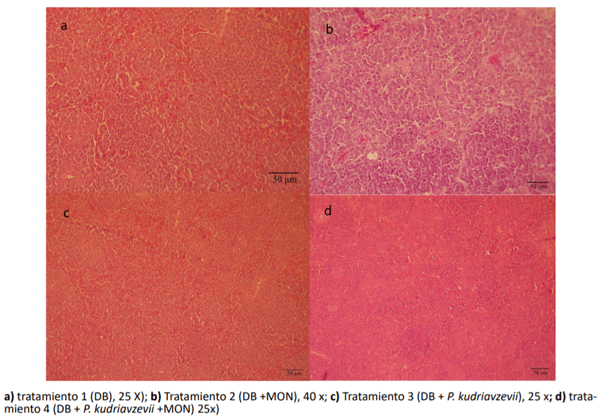
En la Figura 1 se muestran los cambios histopatológicos de timo de pollos parrilleros correspondiente a los diferentes tratamientos. La Figura 1a muestra los cambios histopatológicos en timo de los pollos parrilleros correspondiente al tratamiento control observándose una apariencia normal del mismo. El timo de los pollos parrilleros alimentados con MON (figura 1b) mostraron una alteración evidente en la relación corteza-medular, siendo menor el diámetro de la corteza (menos basofilia) y mayor el diámetro de la médula, lo que sugiere un menor desarrollo de células inmunes maduras, responsables de constituir la corteza del timo. Mientras que, las muestras de timo de los animales alimentados con levadura (T3) no mostraron alteraciones en el parénquima, ni en la relación corteza-médula (Figura 1c). Por otro lado, el timo de los animales alimentados con MON mas el agregado de levadura (T4), presentaron cambios similares a las muestras de los animales alimentados con MON sola (T2), pero con un desarrollo menor de la corteza del timo menos evidente (figura 1d).
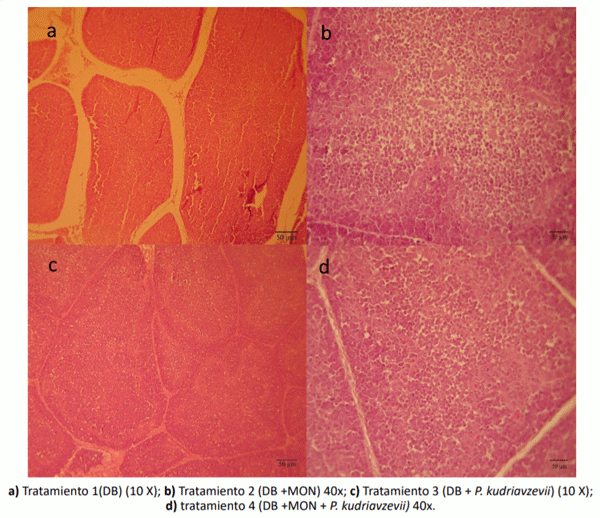
La Figura 2 muestra los cambios histopatológicos en el bazo de los pollos parrilleros suplementados con los diferentes tratamientos. Las muestras de bazo de los pollos parrilleros alimentados con dieta basal (T1) mostraron una apariencia normal (Figura 2a). Las muestras de bazo de los animales correspondiente al tratamiento 2 (MON) mostraron una congestión esplénica y algunas células con núcleos de cariorrexis (Figura 2b). Mientras que, las muestras de bazo de los pollos parrilleros alimentados con levadura sola (T3) mostraron una ligera congestión de la pulpa roja, exhibiendo una gran cantidad de glóbulos rojos en los capilares (Figura 2c). Por otro lado, las muestras de bazo de los animales correspondientes al T4 (DB + MON + P. kudriavzevii) presentaron cambios similares a las muestras de bazo del tratamiento 2 (MON), pero con una congestión menor (Figura 2d).
Figura 1 Cambios histopatológicos en el timo de los pollos parrilleros suplementados con los diferentes tratamientos.
Figura 2. Cambios histopatológicos en el bazo de los pollos parrilleros suplementados con los diferentes tratamientos
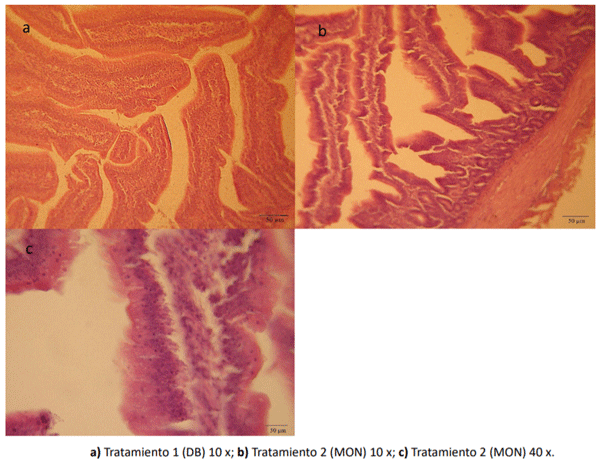
La Figura 3 muestra los cambios histopatológicos de intestino delgado de los pollos parrilleros suplemen-tados con los diferentes tratamientos. En la Figura 3a se observó una longitud normal de las vellosidades, con la presencia de células caliciformes en el epitelio el intestino delgado de los pollos parrilleros alimentados con dieta basal (T1). En la Figura 3b y 3c correspondiente al tratamiento 2 (MON) se observó una disminución en la altura de las vellosidades y un menor número de células caliciformes, con un número de linfocitos intraepiteliales normales (No se observaron lesiones en el intestino delgado de los pollos parrilleros correspondientes al T4 (DB + MON + P. kudriavzevii). Por otro lado, en ningún tratamiento se observó la presencia de células inflamatorias (mononucleares y polimorfonucleares) en el tejido conectivo de la lámina de la mucosa y submucosa de las vellosidades. Además, no hubo alteraciones en los vasos sanguíneos indicando hiperemia.
Figura 3. cambios histopatológicos de intestino delgado de los pollos parrilleros suplementados con los diferentes tratamientos.
DISCUSIÓN
Los anticoccidiostaticos son usados ampliamente en la industria avícola, siendo la monensina sódica un ionóforo autorizado para su uso en pollos de engorde (autorización hasta el 30 de julio de 2014) (Reglamento de la Comisión 2004) para controlar la enteritis necrótica (Del Cacho y Bosch, 2014). Los efectos tóxicos de los ionóforos en las aves sobre los órganos inmunes e intestino son inexistentes, se sabe que su principal efecto tóxico es sobre el tejido muscular produciendo parálisis parcial o completa, pudiendo presentar signos respiratorios ya que afecta también a los músculos de la tráquea (Dowling, 1992). Sin embargo, en estudios previos llevados a cabo por Magnoli et al., 2011a,b donde se utilizaron pollos parrilleros alimentados con diferentes dietas experimentales conteniendo absorbentes no biológicos (bentonita sódica), monensina (MON) (50 mg/ kg) y aflatoxina B1 (AFB1) (100µg/Kg) solos y en forma conjunta, se observaron cambios macroscópicos e histopatológicos en los hígados de los pollos parrilleros alimentados con MON sola. Por otro lado, los hígados de los pollos parrilleros alimentados con la dieta en forma conjunta de MON y AFB1 mostraron lesiones más severas, demostrando un potencial efecto toxico de la MON sobre el hígado, y un efecto aditivo cuando la toxina estaba presente. Además, se demostró que MON disminuyo la capacidad de adsorción de la toxina por parte del absorbente no biológico utilizado.
En la actualidad hay una preocupación creciente sobre los patógenos alimenticios que se transmiten desde los animales de granja a la población humana. Debido a la ausencia de estrategias alternativas, la mayoría de los intentos para controlar la biota intestinal en pollos se ha hecho hasta ahora con el uso de antibióticos. Sin embargo, la reciente y creciente preocupación por la resistencia a los antibióticos a conducido a la prohibición del uso profiláctico de algunos de ellos. Por lo expuesto anteriormente se plantea el objetivo del presente estudio el cual fue evaluar el impacto de P. kudriavzevii sobre los cambios histopatológicos en órganos inmunes e intestino delgado de pollos parrilleros expuestos a monensina.
En el presente estudio, la administración de MON a la dieta de los pollos parrilleros mostró una tendencia negativa en los pesos relativos y absolutos de los órganos inmunes. El peso relativo de los órganos linfoides es un parámetro utilizado para predecir el estatus inmunitario del animal (Chichlowski et al., 2007; Ashayerizadeh et al., 2009). Por ejemplo, la disminución del peso del timo depende de muchos factores entre ellos la edad del ave (involucionando con la edad), la hipoplasia, aplasia y menor diferenciación de linfocitos maduros. En cuanto a la disminución del peso del bazo podría deberse a dos causas, la primera a una falta de parénquima y la segunda a una disminución de la circulación sanguínea en el órgano. Así, la tendencia negativa de los pesos del bazo y timo encontrados con el nivel de inclusión de 50mg/kg de monensina, podrían indicar mayor susceptibilidad de los animales a algún patógeno. Sin embargo, como el peso de los órganos linfoides es un parámetro inmunitario secundario, este debe ser correlacionado con las demás medidas de inmunidad.
Los cambios histopatológicos de los órganos linfoides son una herramienta diagnóstica en los cuadros de inmunosupresión de las aves (Solano et al., 1986). En la presente investigación se evaluaron las lesiones de los órganos inmunes como timo y bazo. La alteración en la relación corteza-medular, encontrados en el timo de los pollos parrilleros alimentados con MON podría sugerir un menor desarrollo de células inmunes maduras, responsables de constituir la corteza del timo. Por otro lado, la congestión esplénica y algunas células con núcleos de cariorrexis en presencia de monensina en las muestras de bazo podrían indicar un efecto negativo sobre la producción de células correspondiente a la línea blanca.
El tracto gastrointestinal es el primer órgano que entra en contacto con componentes de origen dietético y se espera que se vea afectado por la MON con mayor efecto negativo en comparación con otros órganos. Además, la integridad de las vellosidades intestinales juega un papel crucial en la absorción de nutrientes y en el crecimiento del animal. Los cambios histopatológicos encontrados en el intestino delgado de los pollos parrilleros alimentados con MON mostraron una disminución en la altura de las vellosidades y un menor número de células caliciformes, con un número de linfocitos intraepiteliales normales. Estas alteraciones podrían estar afectando la óptima adsorción de los nutrientes como así también la adhesión de los microorganismos patógenas a la superficie de la vellosidad. Los resultados obtenidos en este estudio indicaron una tendencia negativa de los parámetros evaluados cuando está presente la MON mientras que la adición de levadura mostro una tendencia positiva. Estos resultados están parcialmente de acuerdo con otros estudios, donde el consumo de una sustancia tóxica conocida como las micotoxinas afecto los pesos de los órganos inmunes como así también la histología de los órganos inmunes e intestino (Peng et al., 2015; Lakkawar et al., 2017; Hu et al., 2018).
CONCLUSIÓN
En conclusión, la adición de 50 mg/kg de MON afectó negativamente a los órganos inmunes e intestino delgado. Estos cambios fueron atenuados con la adición de la levadura. En futuros trabajos los efectos negativos del coccidiostático podrían ser contrarrestados totalmente con una concentración mayor de levadura.
Alejandra Magnoli1,2, Valeria Poloni2,3, Lorenzo Rosales3, Andrea Cristofolini2,4, Matías Caverzan5, Valeria Coniglio1, María Eugenia Ortiz1, Fátima Candelaria de la Torre1 y Lilia Cavaglieri 2,3*
1- Departamento de Producción Animal, Facultad de Agronomía y Veterinaria, Universidad Nacional de Río Cuarto, Córdoba, Argentina.
2- Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET), Argentina.
3- Departamento de Microbiología e Inmunología Facultad de Ciencias Exactas Físico Químicas y Naturales Universidad Nacional de Río Cuarto, Córdoba, Argentina.
4- Área de Microscopía Electrónica, Departamento de Patología Animal, Facultad de Agronomía y Veterinaria, Universidad Nacional de Río Cuarto, Córdoba, Argentina
5- Departamento de Patología Animal, Facutad de Agronomía y Veterinaria, Universidad Nacional de Río Cuarto. Córdoba, Argentina.
Artículo extraido de: Impacto de Pichia kudriavzevii en la histopatología de los órganos inmunes e intestino delgado de pollos parrilleros alimentados con monensina. Magnoli, A., Poloni, V., Rosales, L., Cristofolini, A., Caverzan, M., Coniglio V., Ortiz M., De la Torre, F. y Cavaglieri, L. (2020). Revista Científica FAV-UNRC Ab Intus 5(3) 51-61. ISSN 2618-2734. Publicado en engormix.com por gentileza de los autores









.jpg&w=3840&q=75)