NUTRICIÓN MATERNA Y DESEMPEÑO REPRODUCTIVO
La nutrición de reproductoras pesadas ha sido enfocada sobre su desempeño, asociada al menor costo de producción. Cuando hablamos del desempeño de reproductoras, está tradicionalmente vinculado con la producción de huevos y fertilidad, dejando como segundo plano la calidad de su descendencia. Así, el perfil nutricional utilizado para obtener un mejor desempeño de las reproductoras pesadas fue seleccionado para garantizar el mayor número de pollos por ave. Sin embargo, el objetivo principal de los incubatorios es garantizar el mayor número de pollitos vendibles, dejando atrás que este está estrechamente correlacionado con el desempeño y rendimiento de canal del pollo de engorde. Por lo tanto hay una diferencia entre los objetivos de la reproducción, incubación y manejo dentro de la cadena avícola.
Investigaciones recientes han demostrado que reproductoras pesadas jóvenes son menos eficientes en sus parámetros zootécnicos que aquellas más viejas, demostrando que tienen necesidades nutricionales diferentes. Este factor, es reflejo de los elementos nutricionales que compone el huevo, donde los provenientes de reproductoras más viejas presentan mayor cantidad de nutrientes por huevo. Otro factor importante y fácilmente evidente a nivel de campo, es que reproductoras más viejas después de la estabilización del pico de postura, generan pollos más pesados al nacimiento, condición que beneficia el desarrollo en las primeras semanas de edad. De esta forma, es importante considerar que los parámetros zootécnicos, y por consiguiente los resultados de los cortes comerciales podrían ser afectados.
El depósito de grasa en los animales ocurre cuando la energía consumida excede la requerida para su mantenimiento y crecimiento. Sin embargo, esto puede ser alterado por diferentes factores, por ejemplo; el depósito de lípidos en las aves en general aumenta con la edad (Deaton & Lott, 1985; Legrand et. al., 1987), siendo mayor en las hembras que en los machos (Mateos & Méndez, 1991), variando por el tipo de linaje (Leclerq & Escartin, 1987) y relación energía:proteína de la dieta. Este último factor es importante, ya que un aumento de esta proporción, sea por aun aumento en la concentración energética o por una reducción de la proteína, provoca un aumento en la deposición de grasa corporal en las aves (Deaton & Lott, 1985; Aletor et. al., 2000).
Cuando la reproductora pesada consume una ración, la prioridad en la utilización de los nutrientes es la manutención de los órganos vitales, seguidos del metabolismo óseo, el crecimiento muscular y por último la reproducción (Araujo. et al. 2009a). Esto resalta en la importancia del adecuado suministro de nutrientes a través de la dieta para garantizar las necesidades de mantenimiento y producción. La ganancia de peso en la reproductora pesada y la producción de huevos deben ser monitoreadas constantemente, para que la alimentación pueda ser ajustada de modo tal que las necesidades y requerimientos nutricionales puedan ser suplidos. No se debe olvidar, que la súper alimentación puede resultar en la acumulación excesiva de grasa, lo que afectará la producción de folículos y consecuentemente el desempeño reproductivo del ave (Baião; Lucio, 2005).
Todos los nutrientes necesarios para la formación y el desarrollo embrionario están contenidos en el huevo, provenientes de la reproductora pesada. El éxito del resultado final de la descendencia estávinculado a estimular al ave a producir huevos con mayor concentración de nutrientes disponibles para el embrión. La nutrición de reproductoras pesadas debe cubrir las exigencias del ave, alcanzando un buen desempeño productivo y supliendo las necesidades de los embriones y los pollos neonatales, originados en sus huevos. El desarrollo y la vitalidad del embrión dependen completamente de los nutrientes contenidos en el huevo (Baião; Lucio, 2005). El huevo es un sistema cerrado, así todos los nutrientes necesarios para el desarrollo del embrión deben ser suministrados por la reproductora cuando el huevo se está formando. Igualmente, el estatus fisiológico del pollo en la eclosión es altamente influenciado por la nutrición de sus madres.
El huevo es un constituyente rico en nutrientes, posee excelente balance de grasas, carbohidratos, minerales, vitaminas y proteínas. Se sabe que sufre de varias reacciones enzimáticas durante su almacenamiento, entre la cuales; la oxidación lipidica es una de las principales contribuyentes en la pérdida de la calidad. Los huevos de gallinas poseen aproximadamente 11 % de lípidos, localizados principalmente en la yema (33 a 35% de lípidos).
Durante la incubación, el contenido del huevo es usado por el embrión para la formación de su cuerpo y la energía para este proceso es proveniente de la yema. Al final de la incubación, la yema restante es internalizada para la cavidad abdominal, que será absorbida posteriormente, desarrollando diferentes funciones en el organismo de las aves. Un importante factor a ser considerado en la calidad de los pollitos es el peso al nacer, pues el bajo peso de los pollos de un día de edad es un factor relevante. Esta situación es más acentuada en pollos provenientes de reproductoras jóvenes, pues ellas producen huevos de menor tamaño que aquellas más viejas, posteriormente pollos menores pueden tener dificultades en la eclosión y limitaciones en el desempeño. Zakariaet al. (1983) demostró que a medida que la reproductora envejece, disminuye el número y aumenta el tamaño de los folículos pre ovulatorios, por lo tanto la cantidad de yema disponible permanece igual, pues esta misma cantidad de yema proveniente de la síntesis hepática es depositada en un menor número de folículos. Con esto, habrá mayor cantidad de nutrientes disponibles para el embrión y el pollo después de eclosión, posibilitándolos a un mejor desarrollo.
La edad de la reproductora también interfiere en la maduración del tracto gastrointestinal (Maiorka, 2002), siendo que embriones de reproductoras pesadas con 30 semanas poseen menor maduración en relación con aquellas de 60 semanas, dificultando a los pollos estar aptos para la adsorción de nutrientes a temprana edad. En relación con la nutrición del embrión, ocurre la participación de las membranas extra-embrionarias;amnios, corion,alantoides y saco de la yema. Moreng y Avens (1990) describieron al saco de la yema como una membrana vascularizada en contacto directo con la membrana vitelinica de la yema. La cama endodérmica se diferencia en las células glandulares que, secretan enzimas para digerir los nutrientes de la yema y en otras células los absorben y transportan para el sistema sanguíneo. El sistema vascular del saco de la yema es continuo llevando los nutrientes de la yema para el embrión en crecimiento. Al séptimo día de incubación, el alantoides se une al corion formando una membrana única fusionada llamada corioalantoide, que se une a la membrana interna de la cáscara, involucrando la gema y la clara. Este contacto con la albumina y la cáscara es importante para el desempeño de sus funciones digestivas, respiratorias y de excreción. El amnio es llenado por liquido claro e incoloro donde el embrión queda inmerso y protegido de fuerzas externas y deshidratación (Gonzales, 1994), siendo absorbido todo prácticamente en el 18° día de incubación. Debe ser considerado, que todavía las fases pre y pos eclosión son críticas para la supervivencia de los pollos.
Uni&Ferket(2004) afirman que varios factores pueden limitar el desarrollo y la viabilidad de los embriones en la fase pre-eclosión y los pollos recién eclosionados siendo: 1) El contenido de nutrientes para el desarrollo de los tejidos y reservas del embrión; 2)La habilidad del tracto gastrointestinal para digerir los nutrientes de las dietas exógenas ricas en proteínas y carbohidratos y 3) La habilidad de los pollos en substituir los nutrientes del saco de la yema por los de la dietas en el periodo pos-eclosión.
La posibilidad de mejorar la eficiencia productiva de los pollos de engorde a partir de la manipulación de la dieta de las reproductoras pesadas ha sido tema de estudio, con la intuición de encontrar alternativas que mejoren el desempeño de las aves de una manera más económica y productiva. Tradicionalmente, muchas investigaciones han sido direccionadas para identificar los nutrientes y los limites que maximizan la producción y la eclosión de los huevos de las reproductoras, investigando sus efectos sobre la producción y la inmunidad de la descendencia. Es sabido que el crecimiento y el desarrollo embrionario adecuado son dependientes de un completo suministro de los nutrientes depositados en el huevo. Consecuentemente, el estatus fisiológico del pollo en la eclosión es influenciado por la nutrición de las reproductoras.
NUTRICIÓN MATERNA Y DESEMPEÑO DE LA DESCENDENCIA
a) Proteína (PB), Energía Metabolizable (EM) y aminoácidos (aa)
La transferencia de nutrientes ocurre de forma activa del ave para el huevo, y es influenciada directamente por los nutrientes que están presentes en su alimentación, siendo que cualquier mudanza en el perfil nutricional en la dieta de las reproductoras pesadas, principalmente en la fase de producción, pueden acarrear efectos sobre el desarrollo de la descendencia. Generalmente, la energía y la proteína son considerados críticos para las reproductoras pesadas. No obstante, todos los nutrientes de una dieta pueden considerarse críticos cuando están dentro del límite, siempre que en la mayoría de las situaciones de la alimentación, estos nutrientes anteriormente mencionados, pueden aproximarse a un límite en su suministro.
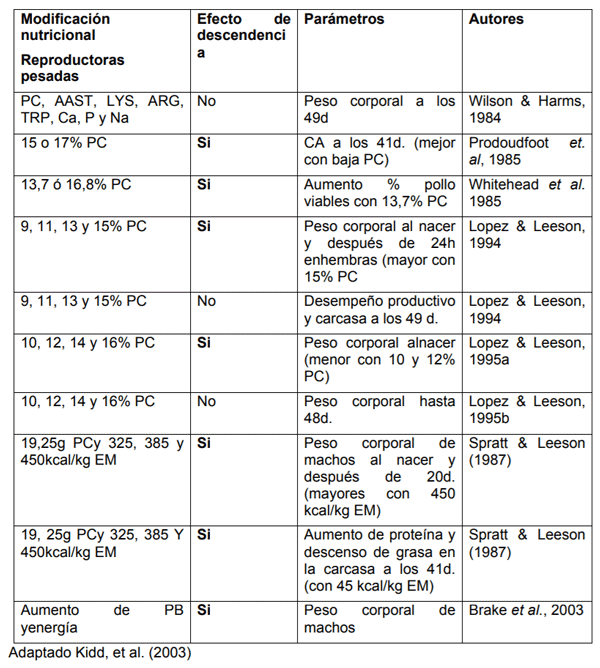
SprattyLeeson (1987) observaron que la proteína y la energía pueden alterar la deposición de grasa y proteína en la descendencia al momento del beneficio. Fue suministrado a las reproductoras pesadas, 150 g de ración por día, con 19 ó 25 g de proteína bruta y 325, 385 y 450 kcal/kg en la ración, a partir de la 19° semana. El desempeño de las descendencias provenientes de las semanas 29, 32, 36 y 40 fue evaluado. Machos provenientes de aves que fueron alimentadas con dietas conteniendo 450 kcal de energía por kg de dieta tuvieron mejor desempeño, así como también un aumento en la deposición de proteína en la carcasa del pollo de engorde y una reducción en la deposición de grasa en comparación con el grupo proveniente de las aves alimentadas con 325 kcal de energía por kg de dieta.
Peebles et al. (2002) notaron un mejor rendimiento de carcasa de pollos provenientes de reproductoras pesadas con dietas formuladas con aceite de maíz, cuando comparados con las aves provenientes de reproductoras alimentadas con el tratamiento control, formuladas con grasa de origen animal.
En la Tabla 1, están presentados algunos trabajos que consideran niveles proteicos y energéticos para reproductoras pesadas y sus efectos sobre la descendencia.
Tabla 1. Efecto de los nutrientes de las dietas de reproductoras pesadas sobre el desempeño de la descendencia.
Da Silva (2010) evaluó 5 niveles de Arginina (Arg) en reproductoras pesadas y sus efectos sobre la descendencia. A partir de la 23° semana de edad, las hembras recibieron las dietas experimentales constituidasa partir de la dieta basal y suplementadas con cinco niveles de L-Arginina variando de 0 a 600 mg/kg en la dieta, lo que corresponde a los niveles de 0,943%; 1,093%; 1,243%; 1,393% y 1,543% de Arg digestible. En la descendencia, la autora verificó el efecto cuadrático de la nutrición de las reproductoras en la conversión de alimento, siendo que 1,359% de Arg digestible proporcionó el mejor índice. Ya el consumo de alimento y la ganancia de peso no fueron afectadas por la suplementación en la dieta de la reproductora.
b) Minerales y vitaminas
La suplementación de microorganismos en la dieta de reproductoras pesadas han sido consideradas una práctica habitual y obligatoria cuando el objeto es optimizar el desempeño de las aves, ya que un aporte inadecuado de microminerales puede comprometer el desempeño de las aves, calidad de la cáscara de los huevos y el desempeño de la descendencia.
Algunas investigaciones han sido desarrolladas recientemente, donde la mayoría se enfoca en el uso de minerales orgánicosen substitución total o parcial a los minerales inorgánicos. Los estudios con minerales orgánicos poseen diversos resultados. Esto es atribuido, muchas veces, a los diferentes procesos de quelatización que son utilizados en la industria y también de la carga iónica de estos minerales.
SegúnPappaset al. (2006) los minerales complejos, por presentar mejor biodisponibilidad cuando son incluidos en las dietas, atienden mejor; los sistemas bioquímicos de las células del animal, mejoran la respuesta inmune, gerencia el estrés oxidativa, desarrollo de los tejidos y huesos. De esta forma, los micro minerales tales como Zn, Mn y S, cuando enlazados a aminoácidos, permiten mejorarla viabilidad y calidad de los pollos. No obstante, dependiendo del estado sanitario, no influencian en el desempeño, cuando son comparados de forma inorgánica (Surai, 2000).
Evaluando la suplementación vitamínica y mineral de reproductoras pesadas durante el periodo de 22 a 45 semana de edad, Araújoet al. (2009) observaron que la descendencia de reproductoras alimentadas con dieta suplementada con glicinato de manganeso, presentó mayor peso corporal y conversión de alimento a los 14 días que los demás tratamientos. Entretanto, a los 41 días, el peso corporal fue semejante para las aves del tratamiento control y dietas suplementadas.
De acuerdo con Whiteheadet al. (1985), al contrario de lo que aconteció con la energía y la proteína, el contenido vitamínico y mineral de un huevo es dependiente del suministro en la dieta de las reproductoras pesadas, y la deficiencia o excesos pueden afectar la calidad y posterior desempeño de la progenie. Además de eso, existen evidencias de que una nutrición adecuada en las reproductoras puede afectar positivamente el desempeño y la respuesta inmunológica de la descendencia.
Según Wolanskiet al. (2006), el peso al nacer del pollito puede no ser un adecuado parámetro de evaluación sobre la calidad del mismo o de su subsecuente desempeño, ya que en este peso se incluye una desconocida cantidad de yema residual. El largo del pollo al nacer ha demostrado estar correlacionado con el peso corporal del ave de edad más avanzada. Araújo et al. (2009) evaluaron la largura de los pollos provenientes de reproductoras pesadas alimentadas con dietas suplementadas con zinc en la dieta. Observaron mayor largura en la eclosión y consecuentemente, mayor ganancia de peso y rendimiento de canal para pollos de engorde provenientes de las reproductoras suplementadas con glicinato de zinc en la dieta, cuando comparadas con el tratamiento control que no poseía suplementación del mineral. En un experimento realizado por Araújo et al. (2009b) la suplementación de glicinato de manganeso en la dieta de reproductoras pesadas resulto en un mejor rendimiento de pecho a los 42 días, cuando comparado a los demás tratamientos.Pedro (2010) y Guimarães et al. (2013) en estudios con suplementación de micromineralesorgánicos en reproductoras pesadas, no encontraron interferencia en los parámetros reproductivos y en las descendencias, siendo los resultados obtenidos semejantes al uso de microminerales inorgánicos.
Estudios de Kiddet al. (2003) demostraron algunas mejoras sobre el desempeño de la descendencia de reproductoras pesadas alimentadas con suplementación de vitaminas y/o sus precursores. Otros estudios, involucrando vitaminas, describieron algunos efectos sobre la descendencia. Surai (2000) evaluó el efecto de cuatro niveles de suplementación de la vitamina E en la ración siendo; 0, 40, 100, 200 mg/kg para reproductoras Cobb y estudió la transferencia para la yema de huevo, tejidos embrionarios y desarrollo del sistema antioxidante del pollo hasta los diez días de edad. La ración basal contenía 10,05 mg/kg de alfa-tocoferol. La cantidad de vitamina presente en el saco vitelineo e hígado de los pollos con un, cinco y diez días de edad fue proporcional a la concentración de esta en la yema de huevo. El mayor nivel de vitamina E, 200 mg/kg presentó efecto positivo sobre la concentración hepática comparado al grupo control. El autor concluyó que la eficiencia de la transferencia de vitamina E de la yema para el hígado del embrión depende de su concentración en el huevo y que el efecto benéfico de esta adicción está en la protección antioxidante del pollo recién eclosionado y durante los primeros días de vida.
La interferencia de la suplementación de vitamina A en la dieta de reproductoras pesadas sobre la reducción de la absorción entérica de la vitamina E fue relatada por Combs (1976). Este autor, observó que este efecto perjudica a la descendencia, pues reproductoras alimentadas con altos niveles de vitamina A, presenta bajos niveles plasmáticos de vitamina E y, por lo tanto, reduce las concentraciones de esta ultima en la yema de los huevos.
La vitamina D3 ha sido tema de diversos estudios sobre su efecto en la descendencia de reproductoras pesadas alimentadas con suplementación de vitamina D3. Algunos de estos estudios demostraron mejor desempeño en pollos después de eclosionado, menor incidencia de problemas locomotores de la descendencia (Driveret al., 2006) y mayor peso de tibia al final del ciclo de producción (Frostet al., 1990), comprobando la eficacia de la estructuración ósea con la suplementación de la vitamina D3.
La nutrición de la reproductora pesada afecta tambien el desempeño de los pollos. Muchos desafios de agentes patogénicos y vacunas acontecen en los primeros días de vida. Por lo tanto, la exigencia de la reproductora pesada en nutrientes específicos con función inmonomoduladora asume un papel importante en la transferencia de inmunida materna y en la respuesta inmune de los pollos. La suplementación en la ración de los pollos con vitamina E también interfiere en la respuesta inmunitaria de las aves (Erf et al., 1998; Leshchinskyy Klasing, 2001).
c) Antioxidantes
Las investigaciones actuales sugieren que el embrión de las aves tiene acceso a un sistema antioxidante integrado por los compuestos derivados de la yema (vitamina E, carotenoides y selenio) y de los compuestos sintetizados por el embrión (ácido ascórbico y glutatión), resultando en varios componentes y actuando en sinergia (Surai, 2002). Los sistemas antioxidativos de los embriones se basan en la interacción de varios antioxidantes.
Dietas de reproductoras pesadas conteniendo niveles altos de vitamina E (100 a 200 ppm) propician un aumento en la concentración del glutatión en el hígado del recién nacido. El glutatión es considerado uno de los antioxidantes hidrosolubles más importantes para lascélulas (Bains y Shaw, 2000) y su concentración elevada puede ser considerada como un indicativo del aumento de la protección antioxidante a los tejidos.
Numerosas funciones biológica pueden ser acreditadas a los carotenoides como; pro vitamina A, inmunidad, protección del epitelio, endocrinología, quimiorreceptores, reproducción, balancehídrico, estabilización de las membranas y metabolismo del calcio. Otro efecto benéfico que puede ser atribuido a los carotenoides es la mejora en los aspectos reproductivos. El efecto antioxidante de los carotenos sobre la reducción de la oxidación lipidica en embriones y espermatozoide mejora la fertilidad de las aves. Los carotenoides presentan funciones antioxidantes, pigmentantes, de pro-vitamina e inmunomoduladores (Williamset al., 1998). SegúnBendich y Olson (1989), los carotenóides no son sintetizados por las aves, entonces, deben ser ingeridos a través de la dieta y su concentración está relacionada directamente por su concentración en los tejidos, asociándose principalmente a los lípidos de los tejidos y las células de origen animal. En las aves de postura, es notable que la pigmentación de la yema de los huevos esté relacionada con la composición de la dieta de estos animales. Entre características químicas y biológicas de los carotenoides, se encuentra un sistema de doble ligaciones conjugadas, responsables por el poder pigmentante y acción antioxidante.
Los carotenoides pueden aportar una grande contribución a esta acción, una vez que ellos son eficaces en la captura de radicales libres, especialmente en la baja tensión de oxigeno que prevalece en los tejidos embrionarios. Entre los carotenoies, la cantaxantina se caracteriza por su actividad antioxidante relativamente alta. Es fácilmente transferida para la yema y distribuida para los tejidos del embrión (Surai, 2003). La cantaxantina viene siendo utilizada en la avicultura buscando aumentar la coloración de la carcasa de los pollos de engorde y yema de huevos de consumo.
La yema de huevo es una fuente rica de carotenoides. Por esto, su coloración depende de la cantidad de xantofilas absorbidas por el ave (Garcia et al., 2002). Según Surai & Speake (1998), el perfil de carotenoides presentes en la yema del huevo es altamente dependiente del tipo de carotenoides presentes en la dieta que fue consumida por la reproductora. Durante el desarrollo de los óvulos, las xantofilas son depositadas en la yema de huevo (Hinton et al., 1974).Algunos estudios sugieren que los carotenoides son capaces de funcionar eficazmente como antioxidantes durante la incubación, mismo en la presencia del oxigeno atmosférico. En experimentos realizados con reproductoras de corte alimentadas con dietas ricas en vitamina E, fue posible concluir que los efectos antioxidantes pueden ser alcanzados a través de interacciones entre carotenoides y vitamina E (Edgeet al., 1997). El nivel de la vitamina E en el hígado de los pollos de un día fue también significativamente elevado cuando las reproductoras recibieron alta cantidad de carotenoides en la dieta. Esto es reflejo de las propiedades antioxidantes de los carotenoides que impiden la depresión de niveles de vitamina E durante periodos de estrés oxidativa, como el proceso de incubación (Suraiet al., 1999). El hígado, por lo tanto, funciona como un local de acumulación de carotenoides durante la vida embrionaria, después como centro de su redistribución y después de la eclosión. Fue demostrado, que para los primeros 9 días de desarrollo pos natal, la concentración de carotenoides en el hígado de la gallina, pavo, pato y ganso disminuyo aproximadamente 3 veces, indicando la importancia de las reservas de carotenoides que fueron acumuladas en el hígado durante el desarrollo embrionario (Surai et al., 2001).
Cuando las reproductoras pesadas fueron alimentadas con la dieta suplementada con luteína, la concentración de carotenoides presentes en el plasma de pollos de engorde fue elevada y de esa diferencia en relación a los pollos que consumieron el tratamiento control fue mantenida hasta por 5 semanas después de la eclosión. Por lo tanto, la dieta materna determina la concentración de carotenoides en el plasma de los pollos durante su desarrollo post natal.
Varios aspectos de acción del carotenoides pueden ser considerados benéficos para el desarrollo del embrión. Los carotenoides pueden aumentar la capacidad antioxidante total disponible para el embrión, protegiendo así los tejidos en desarrollo de los efectos perjudícales de especies reactivas de oxigeno y radicales libres. Esta protección es importante porque varios tejidos del embrión de las aves son ricas en lípidospoliinsaturadosque son mucho más susceptibles a la peroxidación (Speakeet al., 1998).
Trabajando con pollos provenientes de huevos incubados y enriquecidos con carotenoides Surai & Speake (1998), observaron una mayor resistencia a la peroxidaciónlipidica en los tejidos de esas aves. También en el inicio de vida de las aves, los carotenoides tienen un papel importante en la función inmune. En animales adultos, los carotenoides ayudan a prevenir la infección por reforzar respuestas mediadas por células humorales. En el desarrollo inicial de las aves, ocurre mejora en el desarrollo y sistema inmune cuando existe alta concentración de carotenoides en la Bolsa después de la eclosión. Según Koutsos et al. (2003), la capacidad de incorporar los carotenóides dietéticos en el timo, plasma e hígado fue severamente dañado en pollos que fueron privados de carotenoides durante su vida embrionaria.
Es importante recalcar, que niveles lipidicos elevados son fundamentales para el desarrollo embrionario, sirviendo como fuente de energía, ácidos grasos y vitaminas liposolubles. Estos lípidos sufren instauraciones adicionales en el hígado del embrión, para formar ácidos grasos poliinsaturados de cadena larga (PUFAs). Altas concentraciones de PUFAs en las membranas celulares aumentan la susceptibilidad a la degradación por peróxidos (Ferreira, 2010). Varios trabajos demostraron correlación entre niveles de peróxidos lipidicos y sus efectos negativos en el aspecto reproductivo de las aves. De acuerdo con Speake et al. (1998), el desarrollo embrionario está asociado con la acumulación de ácidos grasos poliinsaturados en tejidos adiposos y debido a esto, existe mayor susceptibilidad a la peroxidacción lipidica (Surai, 1999).
Actualmente, se utiliza ampliamente el método denominado TBARS, para evaluar la peroxidaciónlipidica, basado en la reacción de una molécula de MDA, uno de los productos finales de la peroxidaciónlipidica, con dos moléculas de TBA en medio ácido y sobre altas temperaturas, formando un complejo rojo, que puede ser determinado por espectrofotometría. Scher et al. (2009) observaron que la cantaxantina redujo significativamente los niveles de TBARS de los huevos con diferentes tiempos de almacenamientos. Laforet (2009), en un estudio con reproductoras pesadas, verificó que los huevos provenientes de reproductoras pesadas suplementadas con cantaxantina también tuvieron disminución significativa en los índices de peroxidación determinados a través de TBARS.
La asociación de cantaxantina (60 ppm) con 25-(OH)D3 (69 µg/kg) en dietas para gallos Plymouth Rock White de la 40 hasta la 59 semana de edad, mejoró la motilidad de los espermatozoides, aumentó la concentración de las células espermáticas y disminuyó el número de alteraciones morfológica de espermatozoides (Ferreira, 2010).
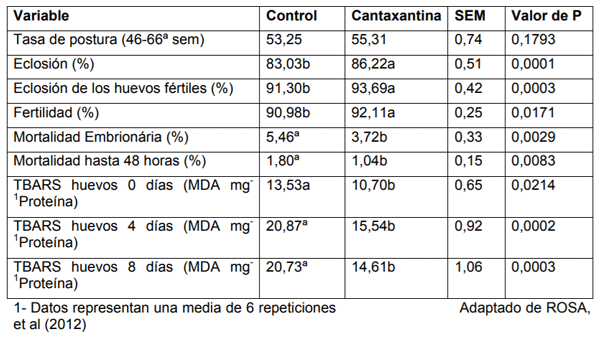
En nuestro grupo de investigación se publicó un estudio (Rosa et al., 2012) sobre la suplementación de cantaxantina (CTX) sobre los aspectos productivos y reproductivos de reproductoras pesadas. Fueron utilizadas 360reproductoras pesadas y 36 gallos evaluados desde la 46° hasta la 66° semanas de edad, distribuidas en dos tratamientos (dieta basal sin suplementación y otro con similar dieta suplementada con 6 ppm de CTX). Fueran realizadas 21 incubaciones, una cada semana, con todos los huevos que poseían las condiciones de incubabilidad. Los huevos estuvieron almacenados por máximo 7 días, para luego ser incubados. Los resultados obtenidos demostraron que los parámetros de peso corporal, tasa de postura y mortalidad de las reproductoras no fueron influenciados por los diferentes tratamientos, bien como el peso de los huevos, la clara y yema (P>0,05). No obstante, la coloración de la yema de los huevos fue altamente influenciada por la utilización de la CTX, en el 14° día después del inicio del experimento hasta el final del periodo experimental (P<0,0001). En la Tabla 2, quedó en evidencia que la suplementación de cantaxantina mejoró la mayoría de los índices reproductivos y redujo significativamente la mortalidad embrionaria (P=0,0029), principalmente hasta las 48 horas de incubación (P=0,0083). Se evaluaron también los índices de TBARS de los huevos provenientes de los tratamientos que fueron almacenados durante 0, 4, 8, y 12 días. La adicción de 6 ppm de CTX en la dieta de las reproductoras redujo los niveles de peroxidaciónlipidica en los huevos de todos los diferentes periodos de almacenaje.
Tabla 2. Parametros reproductivos evaluados durante el período experimental1.
Otro trabajo realizado en LAVIC – UFSM por Santos (2012) evaluó un producto comercial que contenía 69 mcg de 25-(OH)D3 /kg en la dieta y 6 ppm de cantaxantina. Fueran utilizadas 264 reproductoras de corte y 24 machos, Cobb, entre la 25° y 52° semana de edad evaluando sus parámetros reproductivose incubación. La metodología y los parámetros evaluados fueron idénticos al trabajo anteriormente descrito. Las aves sometidas a una dieta conteniendo este producto produciránhuevos con elevados niveles de carotenoides en la yema y resultarían en mejoras significativas en la eclosión (P=0,0075) de 87,15 a 89,67%, eclosión de huevos fértiles (P=0,0237) de 91,63 a 92,60% y redujo la mortalidad embrionaria de 48 horas (P=0,0178) de 1,42 a 1,04%, durante todo el periodo evaluado. En conclusión, el autor afirma que la adición del producto en la dieta de las reproductoras mejoró significativamente la mayoría de los parámetros evaluados.
Los carotenoides son antioxidantes naturales, como la vitamina E y su disminución en los huevos dejaría a los embriones susceptibles al estrés oxidativo, frecuenteen la incubación. Siendo así, la adicción de antioxidantes en reproductoras viejas necesario para mejorar esta condición.
Surai y Sparks (2001) compararon huevos, embriones y pollos producidos por reproductoras pesadas alimentadas con dos dietas: a base de maíz, rica en carotenoides, especialmente luteína y zeaxantina – 11,8 mg de carotenoides/kg, y a base de trigo – 5,6 mg de carotenoides/kg. Los huevos provenientes de gallinas alimentadas con la dieta a base de maíz presentó mayores concentraciones de beta+ganma+tocoferol, carotenoides totales, luteína y zeaxantina, así como, los tejidos de los pollos nacidos de esos huevos. Los autores concluyeron que la dieta de la reproductora tiene una importante función en la formación del sistema antioxidante durante el desarrollo embrionario y que la dieta a base de maíz aumenta el potencial antioxidante de la yema de huevo y de los tejidos embrionarios cuando es comparada a la dieta a base de trigo.
Koutsos et al. (2003) verificaron que la dieta materna rica en carotenoides influenció en la concentración de estos en los tejidos de los pollos de engorde hasta los 28 días. Según Surai et al. (2003) y Karadaset al. (2005) la dieta de la reproductora enriquecida con carotenoides es el principal factor que influencia la concentración de carotenoides en el hígado de los pollos en la primera semana de vida y, que a partir de esta edad la alimentación del pollo pasa a influenciar estos niveles. Basados en el importante papel de los carotenoides como antioxidante inmediatamente después de la eclosión, estos autores concluyeron que los carotenoides en la reproductora, además de influenciar en la incorporación de estos en los tejidos de la descendencia, puede ser necesario para aumentar la viabilidad de la misma. Queda en evidencia que la nutrición materna con carotenoides posee un aspecto fundamental en la mejora significativa de los parámetros reproductivos de reproductoras pesadas. Además de eso, contribuye con la fase embrionaria, afectando positivamente la vida pos eclosión.
d) Micotoxinas
Otra constante preocupante en la cadena productiva es sobre las posibles causas de las micotoxinas en la producción avícola. Extremadamente discutida y documentada en pollos de engorde, pero poco difundida en reproductoras pesadas. Algunos estudios serán citados con la finalidad de observar los posibles efectos que las aflatoxinas tienen sobre la reproductora pesada y sus consecuencias sobre la descendencia.
Además de reducir la producción de huevos, las AFLs también son responsables por la reducción del tamaño del huevo y yema, como resultado de la interferencia entre la síntesis de proteínas y lípidos (Vieira, 1995). La reducción de la yema se debe a los daños al hígado demostrando en un estudio realizado por Hamilton & Garlich (1971), donde ponedoras comerciales alimentadas con raciones conteniendo 10 ppm AFL durante tres semanas tuvo 48% de grasa en el hígado, en cuanto que las alimentadas con una dieta de AFL-libre tuvo 28%. Como consecuencia, hay un decrecimiento en la deposición de grasa en otras estructuras, como en la yema.
De acuerdo con Howarth & Wyatt (1976) la transmisión de toxinas para los huevos fértiles es la principal explicación para las perdidas relacionas con la baja eclosión. Usaron dietas con 0, 5 y 10 µg AFL/g durante 4 semanas para reproductoras pesadas y verificaron que la fertilidad no fue afectada por los diferentes niveles de ALF. Sin embargo, la eclosión disminuyó drásticamente (P>0,05) en la primera semana, donde se observaron índices de 95,1; 68,9 y 48,5% en huevos de aves sometidas a 0, 5 y 10 ppm AFLs, respectivamente.
Varias pérdidas económicas están asociadas con la ingestión de AFL en la alimentación, afectando parámetros de producción como disminución de producción (Hamilton & Garlich, 1971; Uttpatel et al, 2011), perdida de peso, disminución del consumo de la ración y los parametros reproductivos con baja eclobilidad (Trucksses etal., 1983), disminución del peso del huevo y volumen de esperma (Leeson et al., 1995).
Trabajando con reproductoras pesadas con dietas conteniendo 0, 5 y 10 ppm AFL durante cuatro semanas, Howart & Wyatt (1976) constataron que la producción de huevos es reducida significativamente después de 3 y 4 semanas. En un estudio con reproductoras pesadas, Rosa et al. (2001) demostró que hubo una disminución en la tasa de postura después de dos semanas de consumo de la dieta conteniendo 5 ppm AFLs. Un interesante efecto fue observado pues, en la tercera semana de consumo de AFL-libre, las reproductoras pesadas retornaron a la producción de huevos a los niveles normales. No hubo alteración en el consumo de ración y ni peso corporal de las mismas.
Trucksses et al. (1983) encontraran AFB1, aflatoxina M1 y aflatoxicol en huevos de 24 horas despues del consumo de un alimento contaminado. Entretanto, debe saberse que, a pesar que la tasa de postura es reducida apenas siete días mas tarde, los efectos negativos sobre la eclosión son inmediatos, cerca de 24 horas despues del consumo de alimentos contaminados. Jacobson y Wiseman (1974) verificaron que AFB1 puede ser transmitida para los huevos de reproductoras pesadas y depositados en ambos, clara y yema.
Las aflatoxinas pueden entrar en el huevo en cualquier fase de su desarrollo, llevando de 7 a 8 días para un ovocito madurar y mas de 24 horas para convertirse en un huevo. Como el embrión absorve la yema durante la tercera semana de incubación, los niveles elevados de muertes embrionarias son esperadas durante esta fase. Qureshi et al. (1998) relataron altas tasas de mortalidad embrionaria tardia en aves que ingirieron 5 y 10 ppm AFL, y concluyeron que los efectos fueron mas marcantes con un mayor tiempo de exposición a la toxina. Este efecto es debido a la transferencia de metabolitos de AFL o a la propia toxina para el huevo, causando alteraciones inmunitarias en el embrión.
De acuerdo con Santurio (2000), la mejor explicación para las perdidas de la eclosión de los huevos fertiles producidos por gallinas que consumieron aflatoxinas es la transmisión de esta micotixinas para los huevos. La aflatoxina B1 (AFB1) puede ser transmitida para la yema y albumina.
Varios estudios han sido realizados en el Laboratorio de Avicultura – LAVIC (UFSM) para determinar el efecto de las aflatoxinas sobre los parametros reproductivos de las reproductoras pesadas y evaluar los efectos residuales en la descendencia. En uno de estos trabajos, Fernandes (2004) concluyó que niveles de 250 y 500 ppb de AFL en la dieta de reproductoras pesadas durante 4 semanas consecutivas, afectó negativamente la calidad de su descendencia. Resultado semejante fue encontrado por Scher (2010) que conluyó que la ganancia de peso de 1 a 21 días fue perjudicado, cuando las reproductoras de 32 y 48 semanas fueran intoxicadas con 1 mg de AFL/kg de dieta.
El estudio de Fernandes (2004) utilizó 500 hembras y 60 machos Cobb 500 hasta las 48 semanas de edad. Todas las aves fueron alimentadas con dietas AFL-libres y de la 49° hasta la 52° semana de edad, las reproductoras pesadas fueron sometidas a dietas que contenian 0, 250, 500 y 750 ppb de AFLs. Despues del nacimiento, las aves fueron alimentadas con una dieta excente de AFL. Un efecto residual marcante de la alimentación de las reproductoras fue encontrada en la descendencia (P<0,05). Pollos provenientes de reproductoras pesadas alimentadas con dietas conteniendo AFL tuvieron un menor peso corporal y ganancia díaria de peso que aquellas reproductoras que consumieron dieta excenta de AFL. A los 21 días de edad, no obstante el desempeño de las aves no fue mas afectado por la dieta. Sin embargo, los niveles de AFl de las dietas de las reproductoras (0, 250, 500 y 750 ppb de AFl) tuvieron un efecto significativo sobre la mortalidad de pollos de engorde hasta los 21 días de edad, siendo 1,4; 7,9; 11,7 y 15,8% respectivamente (P<0,05). Se observó un efecto linear de 1-7 días de edad y 1-21 días de edad, de acuerdo con las ecuaciones de regresión: yij=1,418996+18,534323*AFL y Yij=2,229214+18,573166*AFL, respectivamente (Rosa et al, 2005; Fernandes et al, 2005).Estos datos demostraron una relación marcada entre la calidad de la alimentación en las reproductoras pesadas y el desempeño de su descenencia.
CONSIDERACIONES FINALES
La nutrición de las reproductoras pesadas tiene un papel importante en el desarrollo, eclosión y desempeño de la descendencia.
El suministro balanceado de nutrientes para las reproductoras garantizará el mejor desarrollo de la descendencia, lo que podrá ser expresado en su calidad y su desempeño a lo largo de su vida productiva.
Nuevos desafíos deben ser lanzados con la intuición de comprender mejor como aprovechar el potencial genético de las reproductoras, que a su vez será traducido en la producción de pollos de alta calidad y que atienen los objetivos de producción esperados.
No obstante, la cantidad de estudios son reducidos, si llevamos en consideración al número de nutrientes que requieren de estudios más profundizados.
Otra área en franco crecimiento y referente es la nutrición in ovo, que puede venir a suplir esas deficiencias del futuro. Por esto, se trata de una innovación que todavía requiere profundizar en estudios y mejoras.
Problemas en las primeras semanas de vida del pollo de engorde, muchas veces son causas desconocidas pudiendo estar fuertemente asociados a la nutrición de las reproductoras pesadas.









.jpg&w=3840&q=75)