Compatibilidad entre una vacuna vectorizada contra la influenza aviar (IA) h7n3 de alta patogenicidad (rhvt-h7) con otra vacuna vectorizada contra enfermedad de Newcastle (rhvt-f) en ponedoras comerciales
Dos pruebas de desafío experimental fueron llevadas a cabo en ponedoras comerciales con anticuerpos maternos (AcM) contra la IA H7N3 y contra la Enfermedad de Newcastle (EN). En experimento 1 las aves fueron vacunadas al día 1 de vida (SC) solamente con una vacuna vectorizada contra Marek y IA que contiene un herpes virus de pavo recombinado con el gen de la hemaglutinina H7 (rHVT-H7) del virus de la IA H7N3 de alta patogenicidad. Las aves fueron entonces desafiadas (inoculación óculo-nasal) a los 70 días de edad con una cepa oficial de desafío del H7N3 aislada en 2015 o con la cepa aislada en 2018. En experimento 2, las aves fueron vacunadas al día 1 de vida (SC) con la vacuna vectorizada rHVT-H7 mezclada con una vacuna vectorizada contra Marek y Newcastle (grupo 2) que contiene un herpes virus de pavo recombinado con el gen de la proteína F del virus de la Enfermedad de Newcastle (rHVT-F). A los 70 días de edad las aves fueron desafiadas con la cepa oficial aislada en 2015 o con la cepa oficial del virus de la Enfermedad de Newcastle. Para cada grupo vacunado en ambos experimentos se tuvo un grupo control no vacunado y desafiado (total de 4 grupos controles). Después del desafío todos los grupos fueron observados clínicamente por 2 semanas y muestreados (hisopados coanales y cloacales) a los 2, 6 y 9 días post desafío para mediciones de excreción del virus de desafío. Todos los grupos experimentales contenían 10 ponedoras comerciales. La tasa de viabilidad en experimento 1 fue 0 y 50% en los grupos control no vacunados y 100% en ambos grupos vacunados cuando las aves fueron desafiadas con las cepas del H7N3 de 2015 y 2018, respectivamente. En experimento 2, todas las aves de los grupos control se murieron hasta 9 días post desafío. Las aves vacunadas presentaron un 100% de protección clínica contra el desafío por el virus H7N3 de 2015 y de 90% contra el desafío por el virus de la Enfermedad de Newcastle.
En conclusión, la vacuna vectorizada rHVT-H7 cuando aplicada sola indujo el 100% de protección contra el desafío por dos diferente aislados del H7N3 de la IAAP. Las tasas de viabilidad post desafío por un H7N3 2015 y por el virus de la Enfermedad de Newcastle a las 10 semanas de edad demuestran la compatibilidad de las dos vacunas vectorizadas cuando mezcladas y aplicadas al primer día de vida en ponedoras comerciales desafiadas a los 70 días de edad.
Aunque los datos iniciales de campo indicaban que la vacuna era protectiva y datos de desafíos experimentales igualmente lo confirmaban (Kapczynski et al., 2013), luego, al largo del año 2013, numerosos reportes de campo empezaron a circular indicando que la cepa vacunal oficial estaba fallando en inducir efectiva inmunidad clínica en contra el H7N3 en las empresas avícolas.
Este artículo reporta los resultados de una reciente prueba de desafío controlado por dos diferentes aislados del H7N3 en ponedoras comerciales vacunadas solamente con una vacuna vectorizada con rHVT-H7 (contra la Enfermedad de Marek y la IAAP por H7N3) o con la asociación de la vacuna vectorizada rHVT-H7 con otra vacuna vectorizada (rHVT-F) contra la Enfermedad de Marek y la Enfermedad de Newcastle.
El experimento fue llevado a cabo en las instalaciones de nivel de bioseguridad 3 (BSL-3) de la Unidad Integral de Servicios Diagnósticos y Constatación (UISDC) del Centro Nacional de Servicios de Diagnóstico en Salud Animal (CENASA) del gobierno de México en Tecámac, estado de México (https://www.gob.mx/senasica/acciones-y-programas/el-centronacional-de-servicios-de-diagnostico-en-salud-animal).
- rHVT-H7 = vacuna recombinante vectorizada contra la Enfermedad de Marek y contra la IAP H7N3 (rHVT-H7). El virus vector replicante de la vacuna es la cepa vacunal HVT (herpesvirus de pavo) recombinada con el gen de la hemaglutinina H7 del virus de la IAAP H7N3 (Vectormune H7 – Ceva Salud Animal).
- rHVT-F = vacuna recombinante vectorizada contra la Enfermedad de Marek y contra la Enfermedad de Newcastle (rHVT-F). El virus vector replicante de la vacuna es la cepa vacunal HVT (herpesvirus de pavos) recombinada con el gen de la proteína de fusión (F) del virus de la Enfermedad de Newcastle (Vectormune ND – Ceva Salud Animal; Palya et al., 2014).
Se usaron ponedoras comerciales Bovans las cuales tenían altos títulos de anticuerpos maternos circulantes contra el H7N3 y contra la Enfermedad de Newcastle (…… promedio HI de ….. de AcM contra el H7N3 y de … contra la Enfermedad de Newcastle) al nacimiento.
- Grupo 1 rHVT-H7/H7N3 2015 (10 ponedoras) Vacunados con la vacuna rHVT-H7 al día 1 de edad vía subcutánea (región dorsal del cuello). Desafío por el H7N3 de la IAAP de 2015.
- Grupo 2 rHVT-H7/H7N3 2018 (10 ponedoras) Vacunados con la vacuna rHVT-H7 al día 1 de edad vía subcutánea (región dorsal del cuello). Desafío por el H7N3 de la IAAP de 2018.
- Grupo 3 control (10 ponedoras) Grupo control del Grupo rHVT-H7/H7N3 2015 No vacunados.
- Grupo 4 control (10 ponedoras) Grupo control del Grupo rHVT-H7/H7N3 2018 No vacunados.
- Grupo 1 rHVT-H7+rHVT-F H7N3 2015 (10 ponedoras) Vacunados con la vacuna rHVT-H7 y con la vacuna rHVT-F mezcladas al día 1 de edad vía subcutánea (región dorsal del cuello). Desafío por el H7N3 de la IAAP de 2015.
- Grupo 2 rHVT-H7+rHVT-F NDV (10 ponedoras) Vacunados con la vacuna rHVT-H7 y con la vacuna rHVT-F al día 1 de edad vía subcutánea (región dorsal del cuello). Desafío por la cepa oficial del velogénica del NDV.
- Grupo 3 control (10 ponedoras) Grupo control del grupo rHVT-H7+rHVT-F H7N3 2015 No vacunados.
- Grupo 4 control (10 ponedoras) Grupo control del grupo rHVT-H7+rHVT-F NDV No vacunados.
Los grupos 1 y 3 fueron desafiados (vía óculo-nasal) a los 70 días de edad con la cepa oficial del virus H7N3 de la IAAP aislado en 2015 en el estado de Guanajuato (A/chicken/Guanajuato/07437-15/2015 - H7N3 - GenBank accession number AKL91078.1). Los grupos 2 y 4 fueron desafiados (vía óculo-nasal) a los 70 días de edad con la cepa oficial velogénica de la Enfermedad de Newcastle (Chimalhuacán – genotipo V – GeneBank accession number KJ577136.1; Absalon et al., 2014). Para ambos los virus de desafío, la solución viral (200 µl) de desafío inoculada en cada ave contenía el título viral 106 DIE50% (Dosis Infectante de Embrión50%).
Todos los grupos en ambos experimentos fueron monitoreados para mortalidad post desafío por 14 días. Muestreos de sangre (todas las aves en cada grupo) para serología HI (inhibición de la hemaglutinación para NDV y IA H7) fueron hechos al 1er día de vida, a las 2,3 y 4 sem de edad y a las 2 semanas post desafío (6 semanas de edad
Todas las pruebas de laboratorios fueron llevadas a cabo en el laboratorio clínico del CENASA.
Los títulos de Ac circulantes fueron medidos por HI (inhibición de la hemaglutinación) en acuerdo con el protocolo estándar de la Organización Mundial de Sanidad Animal (OMSA/OIE, 2019ab / 4 unidades hemaglutinantes y títulos considerados positivos cuando iguales o mayores que 4 log2 o dilución 1:16). Se usó como antígeno para el HI de la IA una cepa oficial estandarizada del gobierno del virus H7N3 de la IAAP aislado en 2012. Para el HI Newcastle el antígeno usado fue la cepa vacunal LaSota.
Diferencias entre los títulos de virus excretados por cada grupo experimental fueron analizadas con la prueba “one-way” ANOVA y la prueba de Tukey para determinación de significancia estadística. Si se detectaba no normalidad en la distribución de los datos se usó la prueba Kruskal-Wallis “one-way” ANOVA en “ranks” y la prueba de Dunn para múltiples comparaciones (GraphPad Prism 8.3.0/InStat, San Diego-CA, USA). Se eligió un valor de P≤0,05 para considerar diferencias como estadísticamente significativas.
Resultados
La tasa de viabilidad post desafío en los 2 grupos en el experimento 1 está reportada en las Figuras 1 y 2. El plan vacunal con la vacuna rHVT-H7 sola al día 1 de edad indujo el 100% de protección clínica contra los desafíos a las 10 semanas de edad con las cepas de campo del H7N3 de la IAAP del año de 2015 (Figura 1) y con la del año de 2018 (Figura 2).
Las aves no vacunadas del grupo control se habían muerto todas ya a los 3 días post desafío post desafío con el H7N3 de 2015 (Figura 1). Sin embargo, el H7N3 de campo aislado en 2018 indujo una mortalidad de solamente 50% en el grupo control no vacunado (Figura 2) indicando una menor patogenicidad de este específico aislado del año 2018.
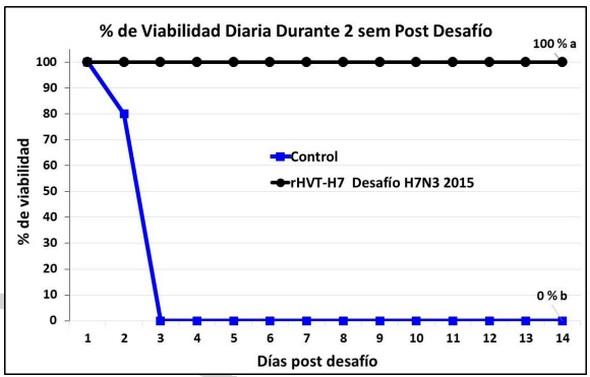
Figura 1. Porcentaje de viabilidad de ponedoras comerciales vacunadas con la vacuna vectorizada rHVT-H7 a 1 día de edad y desafiadas con la cepa de campo del H7N3 de 2015 y observadas clínicamente durante 14 días. La línea color azul representa el promedio del porcentaje de viabilidad de los dos grupos control de aves no vacunadas y desafiadas. Porcentaje final de viabilidad a los 14 días de observación clínica seguidas de letras diferentes difieren estadísticamente (P<0.05).
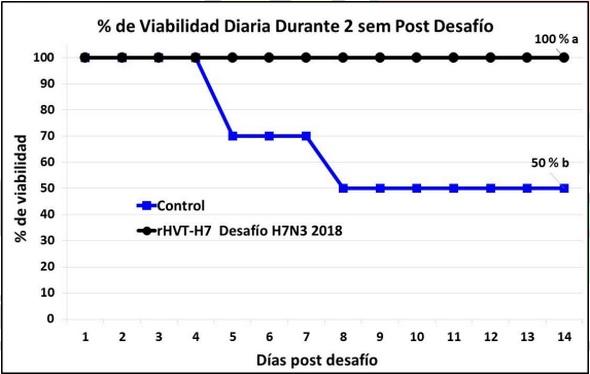
Figura 2. Porcentaje de viabilidad de ponedoras comerciales vacunadas con la vacuna vectorizada rHVT-H7 a 1 día de edad y desafiadas con la cepa de campo del H7N3 de 2018 y observadas clínicamente durante 14 días. La línea color azul representa el promedio del porcentaje de viabilidad de los dos grupos control de aves no vacunadas y desafiadas. Porcentaje final de viabilidad a los 14 días de observación clínica seguidas de letras diferentes difieren estadísticamente (P<0.05).
La tasa de viabilidad post desafío en los 2 grupos en el experimento 2 está reportada en las Figuras 3 y 4. El plan vacunal con la vacuna rHVT-H7 combinada con la vacuna rHVT-F al día 1 de edad indujo el 100% de protección clínica contra el desafío a las 10 semanas de edad con la cepa de campo del H7N3 de la IAAP del año de 2015 (Figura 3). Un 90% de protección fue observado tras el desafío con la cepa de campo oficial (Chimalhuacán) del virus de la Enfermedad de Newcastle (VEN; Figura 4).
Las aves no vacunadas del grupo control se habían muerto todas a los 5 y 9 días post desafío post desafío tras el desafío con la con el H7N3 de 2015 (Figura 3) y la cepa Chimalhuacán del VEN (Figura 4), respectivamente.
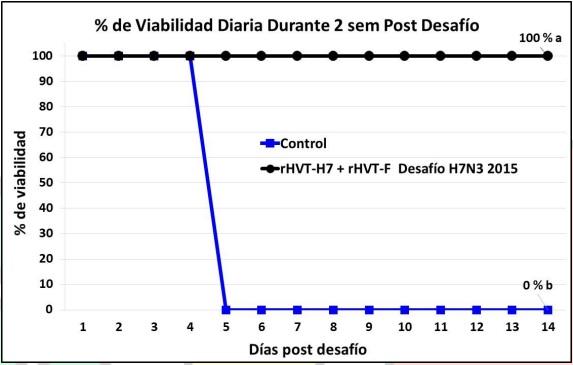
Figura 3. Porcentaje de viabilidad de ponedoras comerciales vacunadas con la vacuna vectorizada rHVT-H7 asociada a la vacuna vectorizada rHVT-F a 1 día de edad y desafiadas con la cepa de campo del H7N3 de 2015 y observadas clínicamente durante 14 días. La línea color azul el porcentaje de viabilidad del grupo control de aves no vacunadas y desafiadas. Porcentaje final de viabilidad a los 14 días de observación clínica seguidas de letras diferentes difieren estadísticamente (P<0.05).
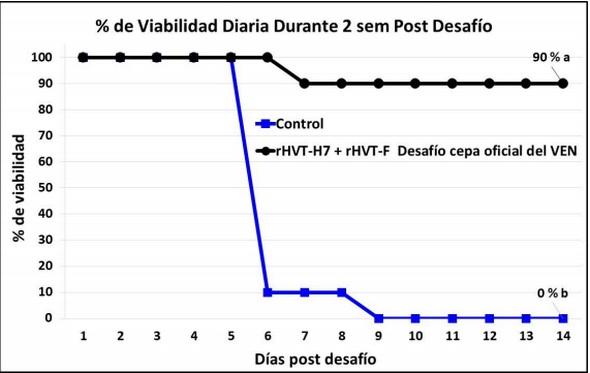
Figura 4. Porcentaje de viabilidad de ponedoras comerciales vacunadas con la vacuna vectorizada rHVT-H7 asociada a la vacuna vectorizada rHVT-F a 1 día de edad y desafiadas con la cepa Chimalhuacán del virus de la Enfermedad de Newcastle (VEN) y observadas clínicamente durante 14 días. La línea color azul representa el porcentaje de viabilidad del dos grupo control de aves no vacunadas y desafiadas. Porcentaje final de viabilidad a los 14 días de observación clínica seguidas de letras diferentes difieren estadísticamente (P<0.05).
1. Absalon, AE et al. (2014) Complete genome analysis of velogenic Newcastle disease virus reference strain 'Chimalhuacan': evolution of viral lineages in Mexico. Virus Genes 49 (2), 233-236 (2014).
2. Cardenas-Garcia, S et al. (2019) Maternally-Derived Antibodies Protect against Challenge with Highly Pathogenic Avian Influenza Virus of the H7N3 Subtype. Vaccines 2019, 7, 163.
3. FAO (2012) Highly pathogenic avian influenza in Mexico (H7N3) - a significant threat to poultry production not to be underestimated. EMPRES WATCH 2012, 26. http://www.fao.org/docrep/016/an395e/an395e.pdf
4. Kapczynski, DR et al. (2013) Characterization of the 2012 highly pathogenic avian influenza H7N3 virus isolated from poultry in an outbreak in Mexico: pathobiology and vaccine protection. J. Virol. 87:9086–9096. 2013.
5. OIE (2012) Highly pathogenic avian influenza, Mexico. Follow-up report No. 1. Information received on 26/06/2012 from Dr Hugo fragoso sánchez, director general de salud animal, SENASICA, SAGARPA, Mexico. .
6. OMSA/OIE – consultado 18 diciembre 2019 –
7. https://www.oie.int/fileadmin/Home/esp/Health_standards/tahm/3.03.04_AI.pdf
8. Palya et al. (2014) Onset and long-term duration of immunity provided by a single vaccination with a turkey herpesvirus vector ND vaccine in commercial layers. Veterinary Immunology and Immunopathology 158 (2014) 105–115
9. Salem, M (2017) Situación actual de los problemas de Influenza Aviar y medidas para prevenir y controlar. Memorias del Congreso Pecuario de Costa Rica, 21-22 de junio de 2017. Accedido en 24 de diciembre de 2019.
10. Spackman, E et al. (2002) Development of a Real-Time Reverse Transcriptase PCR Assay for Type A Influenza Virus and the Avian H5 and H7 Hemagglutinin Subtypes. Journal of Clinical Microbiology Sep 2002, 40 (9) 3256-3260; DOI: 10.1128/JCM.40.9.3256-3260.2002







