INTRODUCCION
Los suelos de la región de Puerto Wilches, Santander Colombia, son suelos destinados en un alto porcentaje al cultivo de palma aceitera (Elaeis guineensis Jacq), se caracterizan por ser ácidos, con alto contenido de aluminio y de baja fertilidad.
De Igual manera en Oxisoles, ultisoles y aún en inceptisoles óxicos, se presenta un alto contenido de aluminio(Al) en la solución del suelo, cuando su pH está por debajo de 5,3 y generalmente su Capacidad de Intercambio Catiónico (CIC) está saturada en un alto porcentaje por Al intercambiable [1].
Se ha señalado que cuando el pH en el suelo disminuye por debajo de 5,0, el Al es parcialmente solubilizado a Al+3 ; condición que lo vuelve más fitotóxico, y la concentración de éste elemento muestra un marcado incremento con la disminución del pH [2]. La presencia del ión aluminio en los suelos ácidos, es uno de los principales factores que limitan la productividad y el crecimiento de las plantas, pues afecta el tamaño de la raíz y provoca un cambio profundo en toda la arquitectura de la misma [3], debido al establecimiento de complejos que forma el aluminio y el fosforo (Al-Pi), se afecta seriamente la absorción no solo del fosforo sino también el ingreso de otros minerales como Calcio, Magnesio, Cobre y Zinc a las plantas. El banco de análisis de suelos de Cenipalma-Colombia ha mostrado que en la Zona Oriental más del 40% de las muestras de suelo analizadas registran saturación de Al mayor del 50% y en la Zona Central, correspondiente a la región de Puerto Wilches, el 30% de las muestras presentan de igual forma los mismos niveles de saturación [4]. Sin embargo especies vegetales hiperacumuladoras soportan altas concentraciones de aluminio y son capaces de desarrollarse y crecer en suelos ácidos debido a diferentes mecanismos tales como la capacidad que tienen de ligar el Al intracelularmente, haciéndolo menos tóxico.
Se han reportado algunas sustancias que actúan como quelantes para la detoxificación del aluminio entre ellas se destacan el citrato, oxalacetato y catequina. [5,6], en general los mecanismos que están implicados en la capacidad que tienen algunas plantas para tolerar aluminio son diversos tales como incremento del pH en la zona próxima a las raíces, modificaciones en la morfología radicular, reducción del paso del aluminio desde las raíces a los brotes, acumulación de aluminio en los brotes sin que se vea afectado el metabolismo de la planta y mecanismos para impedir la inhibición de la asimilación de nutrientes (Ca, Mg, P). Otros autores consideran que los mecanismos de las plantas para tolerar niveles de aluminio del suelo pueden ser clasificados como externos, cuando la raíz es capaz de mantener el aluminio fuera de ella o poseer mecanismos internos cuando la planta es capaz de tolerar la presencia de aluminio en su interior [7,8]. Brachiaria decumbens (Stapf) y Manihot esculenta Crantz, se han reportado como especies vegetales que tienen la capacidad para hiperacumular metales [9,10], los mecanismos específicos que utilizan para la acumulación de metales no han sido muy estudiados. Estas especies vegetales al igual que la gran mayoría de cultivos tropicales y subtropicales de interés agronómico realizan simbiosis con hongos micorrizicos arbusculares [11] que favorecen la adquisición de nutrientes presentes en el suelo de una forma más eficiente , como el fósforo, nitrógeno, calcio, potasio, magnesio, azufre, cobre, molibdeno, hierro y manganeso, debido a que el hongo funciona como una extensión del sistema radical de la planta, facilitando a través de su red de hifas una mayor absorción de éstos en el suelo [12], de otro lado el microsimbionte toma carbohidratos almacenados en las células mesodérmicas y de los exudados radicales de las plantas. Ciertos factores del suelo podrían no ser adecuados para el establecimiento de la simbiosis micorrizica tales como: altos niveles de aluminio, inadecuado contenido de nutrientes del suelo y pH no favorable. Sin embargo varios estudios han demostrado que los hongos micorrizicos tienen la capacidad de adaptarse a tales condiciones y ejercen un papel protector a las plantas frente a la toxicidad del aluminio [13,14,15,16,17].Recientemente se ha demostrado que los hongos micorrizicos arbusculares (HMA), almacenan grandes cantidades de aluminio en sus paredes celulares y núcleos [18].M. esculenta posee elevada susceptibilidad a la colonización micorrizica con esporas procedentes de diferentes cultivos [19], B. decumbens es una especie vegetal con una dependencia micorrizica de aproximadamente 80% [20], características particulares que permitieron seleccionar estas especies vegetales con el fin de propagar bajo condiciones de invernadero hongos micorrizicos nativos de cuatro suelos ácidos, con diferentes contenidos de aluminio y evaluar el comportamiento de la simbiosis asi como la capacidad de retención del ion aluminio .
MÉTODO
Zona de muestreo. Se tomaron muestras de suelo rizosférico de cultivos establecidos de palma aceitera (Elaeis guineensis Jacq) de la región del municipio de Puerto Wilches (Santander), ubicado sobre la margen derecha del rio Magdalena 07°20'88''N y 73°54'22''W a una altura de 80 msnm, con precipitación acumulada anual de 2600 mm, temperaturas promedia mínima de 27,5°C y máxima de 39°C y un brillo solar acumulado de 2400 h sol/año. Se colectaron cuatro tipos de suelos de diferentes cultivos de palma aceitera de tres a cinco años de edad, las muestras se tomaron al azar durante dos periodos del año que coincidieron con época seca y de lluvias. Para cada tipo de suelo se muestrearon 15 plantas, tomando tres submuestras por planta, utilizando un tubo de PVC de 3,8 cm de diámetro y 25 cm de longitud, a una profundidad entre 0-20 cm, y en el área de crecimiento radical (proyección de la copa sobre el suelo) y en la parte media tomada desde el tronco de la planta hasta una distancia de 30 cm. Las submuestras de cada suelo se mezclaron y se obtuvieron muestras compuestas de 5 kg aproximadamente, que fueron utilizadas para los estudios físico-químicos y estudio de HMA nativos. La investigación se llevó a cabo en las instalaciones del laboratorio de tejidos vegetales e invernadero de experimentación del grupo de investigación en Biotecnología agroambiental Microbiota de la Universidad de Santander.
Análisis Fisicoquímico del suelo y determinación de la densidad de esporas de Hongos micorrizicos arbusculares (HMA). Para la caracterización físicoquímica se tomaron 500 g de cada suelo. El análisis físico de la clase textural se realizo por el método de Bouyocous, el contenido de Nitrógeno por el método de Kjeldalh, la determinación de aluminio intercambiable mediante análisis volumétrico utilizando KCl 1N, según NTC 52633 y espectrofotometría de absorción atómica, (Espectrofotómetro, AA, Unicom 969), los demás análisis fisicoquímicos se realizaron en el laboratorio de suelos y consultas industriales de la Universidad Industrial de Santander. La densidad de esporas se realizó para cada tipo de suelo por triplicado, al inicio del experimento y durante los tres periodos de observación: treinta, sesenta y noventa días, mediante el método de tamizaje húmedo y centrifugación en solución saturada de azúcar [21]. El número de esporas para cada muestra de suelo, se determinó por triplicado en 100 g de suelo seco, bajo un microscopio estereoscópico, marca Nikon modelo SMZ445. El criterio para cuantificar la densidad de esporas nativas de HMA de cada suelo se realizó así, bajos: < 1 espora / g de suelo seco, medios: 1-10 esporas/g de suelo seco y altos > 10 esporas/g de suelo seco [22].
Caracterización de morfotipos de esporas de HMA. La identificación de las esporas hasta género se realizó al final del experimento donde se pudo evidenciar la mayoría de esporas en diferentes estadios, en un microscopio óptico Nikon 80 i (400 a 1000x,mediante descripciones consultadas en [23] y [24]. Los parámetros para la identificación de las esporas fueron: forma, color, número de paredes, tamaño, y conexión hifal de la espora en preparaciones permanentes con polivinil-lactoglicerol (PVLG) y la mezcla del reactivo de Melzer en PVLG 1:1. Las esporas, láminas y fotografías correspondientes se registraron en la colección de hongos micorrizicos arbusculares de la región del Magdalena medio Santandereano que se lleva a cabo en el Laboratorio de Biotecnología Agroambiental de la Universidad de Santander(LIIBAAM_UDES),Colombia.
Plantas hospedantes y análisis de la simbiosis. Semillas pregerminadas de B.decumbens y estacas de M. esculenta de aproximadamente 20 cm de longitud, se sembraron directamente en los cuatro sustratos de suelos nativos mas arena (2:1) en bolsas de capacidad 5 kg, paralelamente se montó un ensayo similar, utilizando la mezcla de suelo y arena totalmente estéril que sirvió como el control de los tratamientos sin micorrizar. Todos los tratamientos se regaron periódicamente con agua destilada para mantenerlos cerca del 100 % de capacidad de campo. La fertilización se realizó solo cuando se observaron deficiencias nutricionales en las plantas con una solución mínima de nutrientes, compuesta por: NO3 (1,0 mM), NH4 (0,2mM), K (0,60 mM), Ca (0,50 mM), Mg (0,20 mM), SO4 (0,15 mM), H2PO4 (15 mM), Fe (20 mM), B (20 mM), Mn (4,5 mM), Zn (0,35mM), Cu (0,16 mM), y Mo (0,06 mM). Cada vez que se adiciono la solución nutritiva, se ajustó previamente el PH con solución de HCL 0,1 N y la concentración de Al, con Al2 (SO4)3.18H2O, de acuerdo a las características particulares de cada suelo (cuadro 1), se llevó a cabo un monitoreo regular del pH de cada suelo ensayado. La acumulación de aluminio se midió en raíces y hojas al final del experimento, para las plántulas micorrizadas y sin micorrizar utilizando la técnica de absorción atómica [25]. El porcentaje de colonización de HMA, se determinó por triplicado para cada muestra de raíces, utilizando la coloración de azul tripano [26], tanto para B.decumbens como M. esculenta y se halló el porcentaje de colonización micorrizica por observación directa al microscopio de luz en aumento de 40X.Al final del experimento se midió la longitud radicular en tejidos frescos de las plántulas micorrizadas comparadas con las que no fueron micorrizadas, el tamaño se expresó en centímetros. La biomasa seca de raíces y hojas se determinó después de un secado en horno a 60°C por 48 h y se expresó en gramos.
Diseño del experimento y análisis estadístico. El experimento se organizó en bloques al azar y un diseño factorial, 10 unidades experimentales y tres replicas por tratamiento. Los factores fueron dos plantas hospederas (B.decumbens , M esculenta); dos niveles de micorrización: suelo con micorrizas nativas: (MA+), suelo nativo sin micorrizas (MA-), esterilizado por el método fraccionado en autoclave a 120 °C durante una hora por 2 días consecutivos, cuatro concentraciones de aluminio en la solución del suelo y tres observaciones . Las variables medidas fueron densidad de esporas, porcentaje de colonización micorrizica, biomasa seca de la raíz, longitud radicular, concentración de aluminio detectado en hojas y raíz. Los datos fueron descritos como media ± desviación estándar (DS). Posteriormente, para analizar los efectos de los factores se realizó un análisis de varianza (ANOVA) de dos vías tipo modelo lineal general (MLG), verificando previamente los supuestos de normalidad (prueba de Kolmogorov) y homogeneidad de varianzas (prueba de Levene). Los datos expresados como (%) fueron transformados a la raíz del arco-seno. Se utilizó la prueba de Tukey para comparar las medias entre los diferentes tratamientos, como prueba a posteriori luego de establecer diferencias significativas. El criterio de significancia fue p<0,05. Los análisis estadísticos fueron realizados usando el programa SPSS 13.0.
RESULTADOS
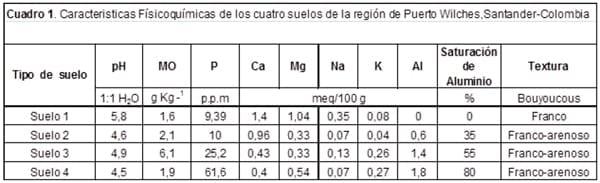
Análisis Fisicoquímico de suelos. Los análisis físico-químicos de los suelos de la región de Puerto Wilches, dedicados al monocultivo de palma aceitera y utilizados para este estudio, se muestran en el cuadro 1, indicando en general que son suelos ácidos y con niveles de saturación medio y alto de aluminio a excepción del suelo uno, donde no se encontraron trazas de aluminio intercambiable. El contenido de nutrientes no fue homogéneo , como dato común para todos los suelos se resalta el bajo contenido de calcio ,de igual forma el contenido de materia orgánica en general , fue bajo a excepción del suelo tres. El contenido de magnesio presentó niveles altos en los cuatro suelos, en el rango desde 0,33 a 1,04 (meq/100g), mientras que el contenido de fósforo disponible en estos suelos fue variable: muy bajo para el suelo uno, bajo para el suelo dos, moderado para el suelo tres y alto para el suelo cuatro.
El análisis físico de la clase textural por el método de Bouyoucos se clasifico en general como Franco arenoso, a excepción del suelo uno que se clasifico como franco.
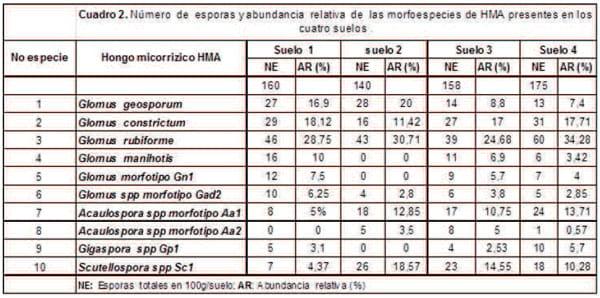
Densidad de esporas de HMA y caracterización de morfotipos. Al inicio del experimento, todos los suelos se tamizaron y se les determinó la densidad esporas por triplicado, obteniendo valores de densidades bajos entre 140 y 170 esporas/100 g de suelo (cuadro 2), estas densidades podrían estar asociadas a diversos factores, entre ellos las alteraciones que ocasiona el monocultivo en la distribución y composición de las comunidades microbianas de la micorrizosfera [27].
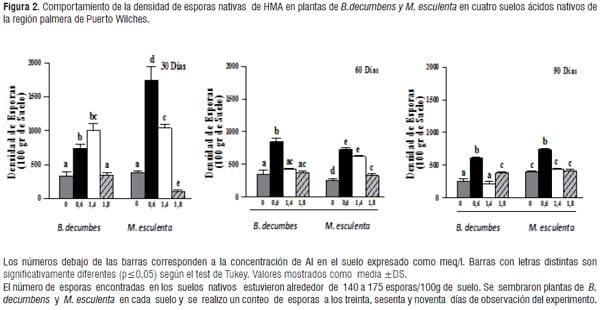
Se ha señalado que la reducción de la diversidad vegetal del ecosistema, afecta concomitantemente la distribución y composición de la comunidad de hongos micorrízicos arbusculares. Otro factor que podría influenciar la baja densidad de esporas de HMA nativos de los suelos palmeros estaría referida a la clase textural franco-arenosa predominante en la región geográfica de este estudio, esto coincide con otros investigadores[11], quienes han expresado que los suelos franco-arenosos no favorecen la simbiosis micorrizica que pueda establecerse con diversos hospederos, mientras que suelos arcillosos incrementan favorablemente la simbiosis y la densidad de los hongos micorrizicos. En la fase final del experimento, se identificaron cuatro especies y seis morfotipos de esporas de HMA (cuadro 2). La especie de HMA, más abundante en los cuatro tipos de suelo fue G.rubiforme (figura 1), las esporas de esta especie se presentaron de color marrón-rojizo brillante y se encontraron en el suelo formando esporocarpos, la forma más predominante de las esporas fue ovoide de 110-180x 190-300 μm, [28], aunque también se encontraron algunas formas globosas de 200-250 μm, con hifas subtendidas amarillo pálido a marrón brillante rectas y algunas se presentaron curvadas, los esporocarpos que se observaron estaban formados por cuatro a diez esporas ovoides de 50x70 μm de color amarillo pálido a marrón intenso. Se conoce que el género Glomus en particular se encuentra con frecuencia en suelos ácidos y específicamente en Colombia se reporta éste género micorrízico como predominante en suelos, seguido por Acaulospora y Gigaspora en suelos de loma y terraza [29].El incremento de las esporas de HMA nativas de los suelos dedicados al cultivo de palma se muestra en la figura 2, en todos los suelos utilizados como sustratos y en las dos plantas que sirvieron como hospedantes. Se aprecia que en M.esculenta se dio una mejor respuesta en el incremento de esporas en los suelos dos y tres. Contrariamente en la segunda y última observación del experimento hubo en general un descenso en el incremento de esporas de HMA, con relación a los primeros treinta días, resultados que podrían estar relacionados con algún tipo de estrés fisiológico por parte de las plantas ensayadas. En general se alcanzó un incremento en el número total de esporas de HMA, en más de 200%, en todos los tipos de suelo y en las dos plantas hospederas con relación a las densidades de esporas encontradas al inicio del experimento (cuadro 2), estos resultados sugieren que las esporas de los HMA, se adaptan a las condiciones particulares de cada suelo y los resultados concuerdan con lo expresado por otros investigadores quienes corroboraron en sus trabajos la buena respuesta a la micorrización de los hospederos cuando son llevados a suelos de baja fertilidad [30,31].
Determinación de los porcentajes de colonización. Los valores encontrados de la colonización micorrizica en las dos plantas hospederas a través de todo el período de observación se aprecian en la figura 3. Las dos especies de plantas utilizadas como plantas hospederas son reconocidas por su alta micotrofia y crecen normalmente en suelos ácidos de baja fertilidad. Sin embargo la colonización micorrizica, se vio disminuida a los 60 días en los dos plantas hospederas siendo más notorio para M. esculenta y alcanzando un descenso del 50% en la colonización. Esto podría explicarse de alguna manera por las condiciones del experimento manipulación de las plantas, las cuales pudieron presentar estrés que pudo influir en las poblaciones de HMA y su interacción simbiótica con cada una de las plantas hospederas. Sin embargo las muestras de raíces micorrizadas de B.decumbens, procesadas en el laboratorio a los 90 días, mostraron valores promedios de colonización del 70% y 80% (figura 4), en los suelos dos y tres respectivamente, los cuales corresponden a los suelos que presentaron niveles de fósforo disponible medio con contenidos de aluminio en el rango de saturación de 35% a 55%, mientras en M. esculenta se hallaron niveles de colonización superiores del 50% en todos los tipos de suelo ensayados.
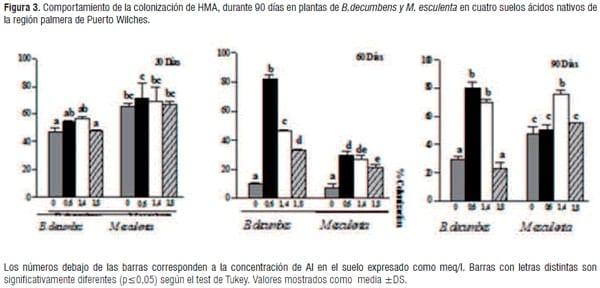
Las diferencias encontradas frente a la micorrización de M. esculenta y B. decumbens coinciden con los argumentos emitidos en otros estudios , donde se indican que tanto la micorrización , la captación de nutrientes y la productividad vegetal varían en función del tipo de planta y de los hongos que interaccionan [32,33].
Evaluación de la biomasa seca y longitud radicular de las plantas huésped. En el cuadro 3, se muestran los valores promedios obtenidos al final del experimento. La biomasa seca se expresó en g % y la longitud radicular en cm, tanto para las plantas micorrizadas y no micorrizadas de B.decumbens y M.esculenta. Los resultados mostraron en general incrementos de estas dos variables en las plantas micorrizadas y especialmente en los suelos con concentraciones de aluminio de 0,6 y 1,4 mEq/100g de suelo, correspondientes a las muestras dos y tres respectivamente. Estos resultados estarían demostrando los benéficos que ofrece la simbiosis, en la captación de nutrientes minerales del suelo, la transferencia de carbono a través de las hifas extraradicales como lo han expresado otros investigadores [34]. El incremento de biomasa encontrado en plantas expuestas a los propágulos micorrizicos es significativa como se ha reportado en otros trabajos [35,36], aunque en este trabajo no se midió la concentración de P en los tejidos y área foliar de las plantas, se conoce que el ión Al limita la captación del P y otros elementos como el calcio y el magnesio, lo cual podría explicar de alguna manera los bajos valores de biomasa encontrados en las raíces de las plantas hospedantes que no se micorrizaron en este experimento. Por el contrario se pudo apreciar el efecto sobre el incremento de la biomasa, que ejerció la presencia de los propágulos micorrizicos en las dos plantas hospedantes , resultados que podrían estar relacionados a su vez con los cambios e incremento del pH que se suceden en la rizósfera , disminuyendo los efecto toxico del ión Aluminio en la adquisición y traslocación suficiente de fosforo, Calcio y Magnesio en las plantas ,como lo han reportado otros investigadores [37], Sin embargo no es bien conocido aun el mecanismo por el cual las plantas micorrizadas tienen mejor respuesta en el incremento de la biomasa, con relación a las plantas no micorrizadas.
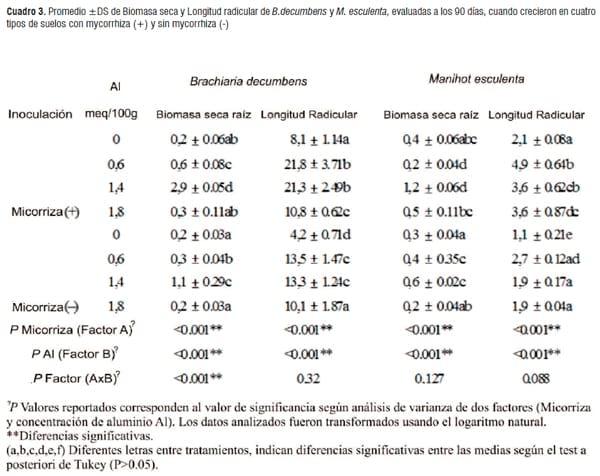
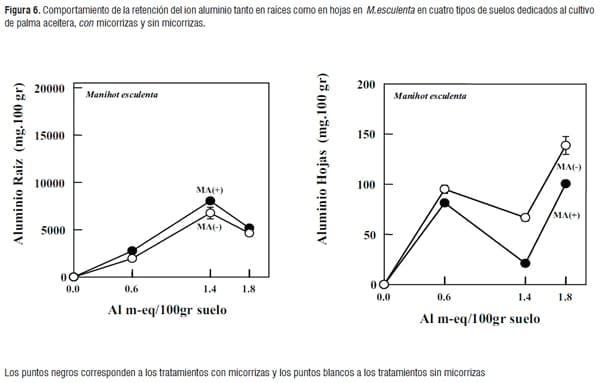
Evaluación del contenido de aluminio en raíz y hojas en las plantas huésped al final del experimento. En la Figura 5 y 6 se aprecia el comportamiento de la retención del ion aluminio en hojas y raíces en las plantas ensayadas, la cantidad de retención del aluminio en los tejidos radiculares no mostró una relación directa con las concentraciones de Al, presentes en cada tipo de suelo. En general en el área foliar se presentaron menores niveles de aluminio en las plántulas micorrizadas con relación a las plántulas que crecieron sin micorrizas y las raíces de las plantas micorrizadas, en general almacenaron más aluminio que las plantas no micorrizadas. Estos resultados sugieren de alguna manera que además de la raíz, los hongos micorrizicos tendrían la capacidad de capturar el ión Al del suelo, disminuyendo su translocación desde la raíz a la parte aérea de la planta y aliviando la toxicidad por aluminio presente en estos suelos. Sin embargo, se presentó un comportamiento diferente en las dos plantas hospedantes cuando crecieron en el suelo 3 (figuras 5 y 6), se observó una disminución de acumulación de aluminio en las hojas y un aumento en la zona radicular; este comportamiento se evidenció tanto en las plántulas micorrizadas y no micorrizadas, sugiriendo que podrían existir otros factores que estarían influyendo en la dinámica y acumulación de aluminio tanto en el área radicular y foliar de las plantas.
CONCLUSIONES
En este trabajo se demostró que las densidades iniciales de esporas de hongos micorrizicos nativos de suelos dedicados al monocultivo de palma se incrementaron en más de 200%, utilizando B.decumbens y M.esculenta, como plantas hospederas, la dinámica de la colonización micorrizica vario a través del tiempo para las dos plantas en cada uno de los suelos ensayados, sin embargo se demostró que la simbiosis micorrizica en B.decumbens es superior al 70 % en suelos con concentraciones de 0,6 y 1,4 meq/100 g de Aluminio y M. esculenta alcanzó interacción simbiótica del 50% en todos los suelos, demostrando que la simbiosis podría estar relacionada con el tipo de hospedero. Todas las plantas micorrizadas mostraron incremento en el desarrollo radicular y biomasa seca, mayor capacidad de retención de aluminio en raíces, con disminución de aluminio en la parte foliar. Los mecanismos que utilizan estas especies vegetales para acumular aluminio en simbiosis con micorriza arbuscular deben seguir siendo estudiados.
AGRADECIMIENTOS
A la Universidad de Santander UDES por los recursos de financiación para este proyecto, a Manuel Gutiérrez por su valiosa contribución en la recolección de las muestras de suelos de la región palmera de Puerto Wilches, a Amelia González, Andrea Gallo, Mayerly Cano en el proceso de tamizaje de los suelos, a Sergio Villamizar por su valiosa labor en el invernadero, a Yolandé Dalpé por su valiosa contribución en la identificación de las esporas de hongos micorrizicos, y a Patrice Dión por sus comentarios.
REFERENCIAS
[1] MUNEVAR,F. Problemática de los Suelos Cultivados con Palma de Aceite en Colombia. Palmas.19, 1998, p.218-228.
[2] KINRAIDE,T.B. Identity of the rhizotoxic aluminum species. Plant soil.134, 1991, p.167-178
[3] CLARKSON, D. T. Metabolic aspects of aluminum toxicity and some possible mechanisms for resistance. 1969, p. 38– 397. In: Rorison IH, ed. Ecological Aspects of the Mineral Nutrition in Plants. Oxford: Blackwell.
[4] CUELLAR, M., MUNÉVAR, F. Control de calidad de los resultados analíticos en el Laboratorio de Análisis Foliares y de Suelos de Cenipalma. Palmas 21, 2000, p. 92-98.
[5] MA, J.F. Role of organic acids in detoxification of aluminum in higher plants. Plant and Cell Physiology, 41, 2000, p. 383-390.
[6] BARCELO, J., C,POSCHENRIEDER. Fast root growth responses, root exudates, and internal detoxification as clues to the mechanisms of aluminum toxicity and resistance: A review. Environ. Exp. Bot. 48, 2002, p.75–92.
[7] KOCHIAN, L. Cellular mechanisms of aluminum toxicity and resistance in plants. Annual Review of plant Physiology (EEUU) 46, 1995, p. 237-260.
[8] TAYLOR, G., MC DONALD-Stephens, J., HUNTER, D., BERTSCH, P., ELMORE, D., RENGEL, Z. Direct measurement of aluminum uptake and distribution in single cells of Chara corallina. Plant Physiol 123, 2000, p. 987-996.
[9] BROOKS,R.Plants that hyperaccumulate heavy metals. New York (EEUU): Cabi, 1998.
[10] REEVES, R.D. Hyper accumulation of trace elements by plants, 2006. p. 25–52: In Morel JL, Echevarria G, Goncharova N (eds.) Phytoremediation of metal contaminates soils. Nato Science Series: IV: Earth and environmental sciences. Springer, Heidelberg.
[11] SIEVERDING, E. Vesicular-arbuscular mycorrhizal management in tropical agroecosystems .Deutsche Gesellschaft fur Technische Zusammenarbeit, Eschborn, Alemania.1991.
[12] READ, D.J. Mycorrhiza. The state of the art. En: Mycorrhiza 2nd. (A. Varma y B. Hock,eds). Springer-Verlag,Berlin,Heidelberg 1999, p. 3-34.
[13] ELLIS, J.R., LARSEN, H.J., M.G. Boosalis. Drought resistance of wheat plants inoculated with vesicular arbuscular mycorrhizae. Plant Soil: 86, 1985, p. 369-378.
[14] MARSCHNER, H. Mineral nutrition of higher plants. Academic .San Diego. 2 Ed. USA Mc Graw Hill Book Company, 1995.
[15] RUFYIKIRI, G., S. DECLERCK., J.E DUFEY., and DELVAUX. Arbuscular mycorrhizal fungi might alleviate aluminum toxicity in banana plants. New Phytol.148, 2000, p.343-352.
[16] CUENCA, G., Z. DE ANDRADE., and E. MENESES. The presence of aluminum in arbuscular mycorrhizas of Clusia multiflora exposed to increased acidity. Plant Soil. 231, 2001, p.233-241.
[17] CUMMING, R.J and J. NING. Arbuscular mycorrhizal fungi enhance aluminum resistance of broomsedge (Andropogon virginicus L). J. Exp. Bot. 54, 2003, p. 1447- 1459.
[18] GUERRA, B., DION, P, dato no publicado.
[19] POTTY, V.P. Cassava as an alternate host for multiplication of VAM fungi. Plant and Soil. 88, 1985, 135-137.
[20] HOWELER, R.H., C.J. ASHER., and D.G. Edwards. Establishment of an effective endomycorrhizal association on cassava in flowing solution culture and its effect on phosphorus nutrition. New Phytol. 90, 1982, p.229-238
[21] GERDEMAN, J.W and T. NICOLSON. Spores of mycorrhizal Endogone species extracted from soil by wet sieving and decanting. Transactions British Mycological Soc. 46, 1963, p.235-244.
[22] SIEVERDING, E. Manual de métodos para la investigación de la micorriza vesículo arbuscular en el laboratorio. Palmira, Valle, Centro Internacional de Agricultura Tropical, CIAT. 1983.
[23] SCHENCK, N.C., Y. PÉREZ. Manual for the identification of VA mycorrhizal fungi. 3th Edition.1990. Synergistic Publications. Gainsville.
[24] INVAM.International culture collection of vesicular arbuscular mycorrhizal fungi. [Online]. Available: http://invam.caf.wvu.edu [citado12 de agosto de 2011]
[25] KENNETH HELRICH. AOAC Official Method 980.03 Metals in Plants. Virginia, EEUU. 2006.
[26] PHILLIPS, J.M and D.S. HAYMAN. Improved procedures for clearing roots and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection. Trans.Br. Mycol. Soc. 55, 1970, p.158-161.
[27] JOHNSON, NC., D, TILMAN and D WEDIN. Plant and soil controls on mycorrhizal fungi. Ecology 73, 1992, p. 2034.
[28] DALPÉ ,Y (comunicación personal)
[29] HABTE, M. Dependency of cassava (Manihot esculenta Crantz) on vesicular-arbuscular mycorrhizal fungi. Mycorrhiza 4, 1994, p.241-245.
[30] POTTY, V.P. Cassava as an alternate host for multiplication of VAM fungi. Plant and Soil. 88, 1985, p.135-137.
[31] ARCOS, A.L.. Distribución de la asociación micorrizica arbuscular en ecosistemas naturales e intervenidos. En: Aspectos ambientales para el ordenamiento territorial del Trapecio Amazónico. Instituto Geográfico Agustín Codazzi (IGAC), 2003.
[32] HELGASON, T., MERRY WEATHER, J. W., DENISON, J., WILSON, P., YOUNG, J.P.W ,and FITTER, A.H. Selectivity and functional diversity in arbuscular mycorrhizas of co-ocurring fungi and plants from a temperate deciduous woodland., J. Ecol. 90, 2002, p.371-384.
[33] MOORA, M., OPIK, M., CEN, R and Zobel, M. Native influence the seedling performance of rare and common Pulsatilla species fuctional ecology, 18, 2004, p.574-562.
[34] SIMARD, S., DURALL, D. Mycorrhizal networks: a review of their extent, function and importance. Can J Bot. 82,2004, 1140- 65.
[35] PLENCHETTE, C., J.A. FORTIN. and V. FURLAN. Growth response of several plant species to mycorrhizae in a soil of moderate P-fer tility. Mycorrhizal dependency under field conditions. Plant and Soil.70, 1983, p.199- 209.
[36] CABELLO, M.N. Efecto de la contaminación con hidrocarburos sobre hongos formadores de micorrizas vesículo-arbusculares (MVA). Boletín micológico, 10, 1995, p.77-83.
[37] LUX,H.B., R.J. CUMMING. Mycorrhizae confer aluminum resistance to tulip poplar seedlings. Can. J. For. Res. 31, 2001, p.694–702.
















