INTRODUCCIÓN
Tanto en la evolución como en la productividad de los suelos agrícolas influyen notablemente los innumerables macro y microorganismos animales y vegetales, que contribuyen a mantener el nivel de materia orgánica e influyendo notoriamente sobre la aireación, drenaje y estructura. La calidad del suelo, considera a la actividad microbiana del suelo importante, ya que conduce a la liberación de nutrientes aprovechados por las plantas pero también a la mineralización y movilización de contaminantes. Así la actividad microbiana es crucial en los ciclos bioquímicos (13). Dada la intensificación agrícola, las regulaciones de las funciones a través de la biodiversidad del suelo son reemplazadas progresivamente por la regulación a través de entradas químicas y mecánicas(7). El proyecto multidisciplinario denominado BIOSYS (Universidad de Goettingen de Alemania) tiene por objetivo la determinación y evaluación de la diversidad biológica, en diferentes ámbitos. La presente investigación planteó el estudio de la biodiversidad microbiológica en los sistemas de uso del suelo más relevantes en la región biogeográfica “Choco- Manabí”, enfocado a la comparación de alternativas de uso de la tierra desde un punto de vista ecológico y económico. Dentro de estos sistemas el suelo es un factor importante a ser considerado por los servicios ambientales que este puede prestar, como una fuente de fijación de carbono, donde los microorganismos y su biodiversidad tienen un rol principal en la conservación y calidad del suelo. Como un aporte al objetivo general del proyecto BIOSYS se planteó la presente investigación que tiene como objetivo principal el estudio del efecto de los diferentes usos (café, pasto y arroz), en dos tipos de suelo: Aluviales y Vertic, en la zona sur de Manabí, en la población y diversidad microbiana. La diversidad microbiana se planteó en términos de grupos funcionales: fijadores de nitrógeno, celulolíticos, solubilizadores de fósforo, así como el estudio de poblaciones totales de hongos, bacterias, actinomicetos y micorrizas.
MATERIALES Y MÉTODOS
El ensayo se ubicó en los cantones: Paján, 24 de Mayo y Jipijapa, en la provincia de Manabí, a una altitud que va desde los 120 a los 500 msnm, con una precipitación promedio anual de 1224mm y una temperatura promedio anual de 25.2 ºC
[1]. Los suelos fueron seleccionados de acuerdo al paisaje y características, definiéndolos como Vertic (terrenos de pendiente) y Aluvial (terrenos planos). Los cultivos representativos de la zona, según el comportamiento del agricultor, fueron café (en sistema agroforestal), arroz y pastizales. Los factores en estudio fueron
tres sistemas de uso: agroforestal de café (u
1), pastizales (u
2) y cultivo de arroz (u
3), interaccionados con dos tipos de suelo: aluvial (s
1) y vertic (s
2); realizando seis observaciones por tratamiento. El área de estudio abarcó una extensión aproximada de 500 km
2. Cada parcela tuvo una superficie aproximada de una hectárea, mientras que el área de la parcela neta fue de 2500 m
2 (50m x 50m).
De cada parcela se tomaron nueve submuestras de suelo a una profundidad de 0 a 10 cm, con la ayuda de un barreno limpio, de 4 cm de diámetro. Para el caso de micorrizas igualmente se tomó nueve submuestras de la rizósfera y a una profundidad de 0 a 20 cm., utilizando para ello una pala de desfonde. Este procedimiento se repitió en 36 parcelas, de las cuales, según el tipo de suelo 18 correspondieron a un suelo Vertic y 18 a un suelo Aluvial. De acuerdo al uso del suelo, 12 parcelas fueron de arroz, 12 de café y 12 de pastos, obteniéndose seis observaciones por parcela de la interacción uso del suelo por tipo de suelo. Las submuestras se depositaron, independientemente, en un recipiente plástico limpio, las cuales fueron homogenizadas para formar una muestra compuesta, de la que se tomó aproximadamente 1 kg y se colocó en una funda debidamente identificada para su posterior análisis en el Departamento de Protección Vegetal de la Estación Experimental Santa Catalina (INIAP-EESC). Las muestras se conservaron en refrigeración a 5ºC hasta su análisis. Para la determinación de micorrizas las muestras se secaron bajo sombra a temperatura ambiente durante 15 días, para evitar que las esporas germinen y/o mueran.
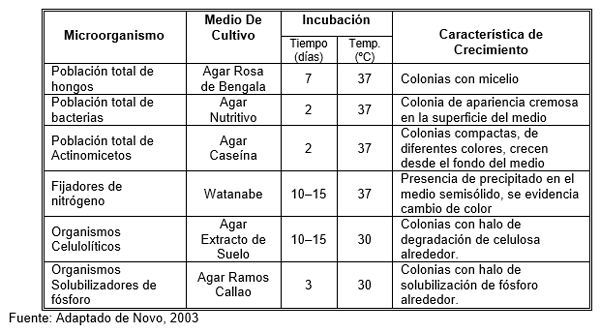
Para la determinación de microorganismos se utilizó el método de diluciones sucesivas, para lo cual se pesaron 10 gramos de la muestra de suelo y dentro de la cámara de flujo laminar se mezcló con 90 ml de agua destilada estéril (dilución 10-1). Se repitió el procedimiento llegando a la dilución de 10-7. De las diluciones 10-3 a 10-7 se tomó 1ml y se colocó en una caja petri, para posteriormente dispensar aproximadamente 20 ml del respectivo medio de cultivo selectivo (siembra profunda), homogenizando con movimientos circulares. Previamente se prepararon los siguientes medios de cultivo selectivos para los diferentes grupos funcionales en estudio: agar nutriente (bacterias totales), agar rosa de bengala (hongos totales), agar caseína (actinomicetos totales), agar Ramos Callao (solubilizadores de fósforo), el medio semisólido “Watanabe” (fijadores de nitrógeno), agar extracto de suelo (celulolíticos totales). Para el caso del medio semisólido se inoculó 0,2 ml en cada tubo, trabajando con las diluciones de 10-1 a 10-10 (Cuadro 1)..
La determinación de la diversidad microbiana se basó en las características del crecimiento de los microorganismos en el medio del cultivo selectivo (Cuadro 1).
La población microbiana se determinó mediante el conteo directo de las colonias en las cajas petri, reportándose en términos de unidades formadoras de colonias por gramo de suelo seco (UFC/gss). Para ello pequeñas cantidades de cada muestra fueron secadas en la estufa a 105ºC durante 48 horas para extraer su humedad (10).
En el caso de las micorrizas, cada muestra de suelo, mezclada homogéneamente, se maceró tratando de disgregar grandes terrones y las raicillas mayores a 2 mm de grosor, porque la micorriza no penetra en éstas (9), tomando las precauciones necesarias para no contaminar la muestra. Para el conteo se hizo una extracción de esporas; para lo cual se pesó 20 gramos de cada muestra tamizada a 2 mm y se las suspendió en 2000 ml de agua, agitando durante 3 minutos y medio. Se dejó reposar la solución para luego el sobrenadante hacerlo pasar a través de dos tamices: de 200 y de 40
um. La dilución fue recogida bajo el último tamiz para hacerla pasar nuevamente 3 veces más por los tamices; luego se lavó el material retenido en los tamices con agua sin mucha presión colocando el material en placas petri cuadriculadas para observar en el estéreo microscopio (6). Para el reconocimiento de géneros se atrapó las esporas con una pipeta pasteur o tubo capilar y se colocó en una placa portaobjetos. Con la ayuda del microscopio compuesto y en base a un laminario
* y características de las esporas se estableció la presencia de diferentes géneros en las muestras. Los datos de población se reportaron en número de esporas por gramo de suelo.
Para el análisis estadístico se utilizó un Diseño Completo al Azar (D.C.A.), con un arreglo factorial 3 x 2 (3 usos de suelo x 2 tipos de suelo), con seis observaciones, que dan un total de 36 unidades experimentales. Además se utilizó la transformación logarítmica de base diez.. Se realizó la prueba DMS al 5% para el factor suelo y para calificar las comparaciones ortogonales. Para el factor usos del suelo y para la interacción uso por tipo de suelo se realizó la prueba Tukey al 5%
Cuadro 1. Resumen de los parámetros de manejo para los diferentes grupos de microorganismos analizados. Cutuglahua-Pichincha.2004
RESULTADOS Y DISCUSIÓN
Diversidad microbiana:
Establecida cualitativamente, en términos de presencia o ausencia de poblaciones de bacterias, hongos, actinomicetos y micorrizas, así como grupos funcionales: fijadores de nitrógeno, solubilizadores de fósforo y degradadores de celulosa (celulolíticos), no se ve afectada, en esta investigación, por los sistemas de uso de tierra ni por los dos tipos de suelo, al no presentar ausencia de los grupos microbianos detallados para el estudio. En cambio, la población microbiana, cuantitativamente establecida, en términos de UFC/gss y esporas/gss, presenta diferentes comportamientos para los grupos en estudio, bajo los diferentes sistemas de uso de la tierra y tipo de suelo.
Población microbiana:
Población de bacterias totales:
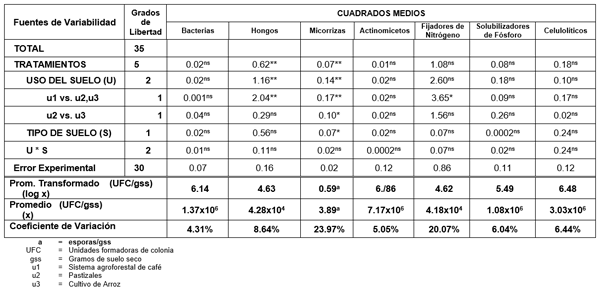
En el Análisis de Variancia, Cuadro 2, se detecta que para la población total de bacterias se obtuvo un promedio de 1.37x106 UFC/gss (Unidades Formadoras de Colonia por gramo de suelo seco) mientras que el coeficiente de variación fue de 4.31%. Además se observa que no existe diferencia significativa entre los factores en estudio. Con respecto a esta población, Alexander (1), explica que es el grupo de microorganismos que se encuentra en mayor cantidad y variedad en el suelo, por lo que dada esta mayor densidad de bacterias, los cambios de uso de tierra, así como los tipos de suelo, no hacen que se manifiesten cambios en la población total sino más bien se estaría influyendo en los diversos e innumerables géneros y especies de bacterias, cambios que no se reflejan dada la naturaleza general de este estudio, pues no se llego a determinar género, ni especie.
Población de hongos totales:
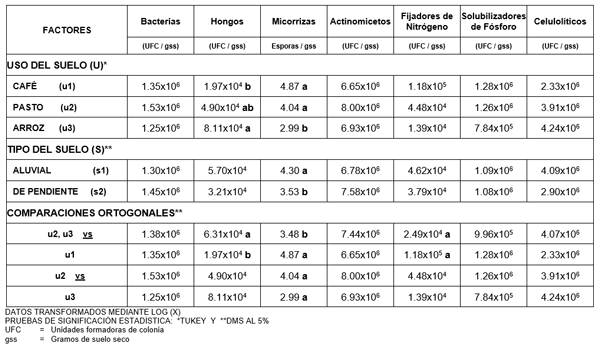
En el ADEVA, Cuadro 2, se observa que el promedio obtenido fue de 4.28x104 UFC/gss; con un coeficiente de variación de 8.64%. Se detecta también significación estadística para el factor uso de suelo y para la comparación ortogonal de los usos pastizales y arrozales frente a cafetales. Al aplicar la prueba Tukey al 5% para el factor uso del suelo, Cuadro 3, se observa que el cultivo de arroz ocupa el primer rango con una población promedio de 8.11x104 UFC/gss, el cultivo de pasto ocupa los rangos “a” y “b” con 5.70x104 UFC/gss, mientras que el cultivo de café ocupa el segundo y último rango con un promedio de 1.97x104 UFC/gss. Para la comparación ortogonal pastizales-arrozales versus cafetales de la población total de hongos, se aplicó la prueba DMS al 5%, observándose que la comparación pastizales-arrozales ocupa el primer rango con 6.31x104 UFC/gss, mientras que el segundo rango es para los cafetales con una población promedio de 1.97x104 UFC/gss. Como se observa, la mayor población se obtuvo en suelos de arrozales, los cuales estaban listos para la siembra y previamente se había realizado la labor de quema. Esto puede deberse a que los géneros de hongos identificados en el laboratorio corresponden a: Paecelomyces sp., Aspergillus spp., Mucor sp., Penicillium sp. y Trichoderma sp., que son hongos saprófitos, con características termófilas, los que según Sarles (12), pueden soportar temperaturas altas y de corta duración (como en la labor de quema), mediante sus estructuras especializadas de reproducción (esporas) que permiten resistir condiciones adversas de alta temperatura.Estas esporas de hongos latentes en el suelo de arrozales fueron estimuladas para su reproducción y crecimiento con el aparecimiento de las primeras lluvias, debido a que la humedad del suelo es un factor muy importante en el ciclo metabólico de los hongos, como lo explica Alexander (2). Por otra parte, Harris (8), detalla que un gran grupo de hongos, tiene la capacidad de producir todas las enzimas necesarias y los constituyentes celulares, a partir de nutrientes simples, a diferencia de organismos como bacterias y protozoos que necesitan mayores cantidades de aminoácidos y vitaminas para su crecimiento. Por otra parte, menciona que el tratamiento con fertilizantes que contengan sales de amonio, como en el caso de los arrozales, hace que el número de hongos puede aumentar debido a la oxidación microbiana del nitrógeno. Los cafetales y pastizales en estudio, que en promedio tienen 20 y 23 años de establecimiento respectivamente, probablemente fueron menos afectados por factores ambientales en su población de hongos que cultivos recientes (arrozales), al haber logrado un equilibrio ecológico. Al respecto, Alexander (2) explica que la edad de la planta influye en el grado de respuesta de los microorganismos, jugando un importante papel en la población microbiológica del suelo al establecerse un equilibrio en el sistema implantado. Y que en los sistemas forestales de varios años de vida, donde los restos vegetales se acumulan sobre la superficie y se van degradando de acuerdo a los requerimientos de los microorganismos se llega a un equilibrio en la dinámica microorganismo - sustrato.
Población de esporas micorrizas:
En el Cuadro 2, del análisis de varianza, se detecta una población promedio de 3.89 esporas/gss y un coeficiente de variación de 23.97%. Existe significación estadística para micorrizas en el factor uso de suelo, tipo de suelo y las comparaciones ortogonales. Al aplicar Tukey 5%, para el factor uso de suelo, Cuadro 3, se observa que el primer rango corresponde a los cultivos de café con 4.87 esporas/gss y a los pastizales con 4.04 esporas/gss, mientras que el cultivo de arroz ocupa el segundo rango con un promedio de 2.99 esporas/gss. En la comparación: pastizales-arrozales versus cafetales, mediante DMS al 5%, cuadro 3, se detectan dos rangos, ubicándose en el primer rango los cafetales con un promedio de 4.87 esporas/gss, y en el segundo, con una población de 3.48 esporas/gss, los pastizales-arrozales. Mientras que en la comparación: pastizales versus arrozales los dos comparten el mismo rango con una población promedio de 4.04 esporas/gss y 2.99 esporas/gss, respectivamente. Para el factor suelo se obtuvo el mayor promedio y el primer rango para suelos de origen Aluvial con 4.30 esporas/gss, mientras que los suelos Vertic con 3.53 esporas/gss ocupan el segundo rango. La población de esporas micorrizantes fue mayor en los sistemas agroforestales de café, frente a los cultivos de pastos y arrozales, debido a las ventajas ecológicas que los sistemas forestales presentan. Al respecto, Farrel y Altieri (4), mencionan que las ventajas se deben al establecimiento de microclimas estables, al control del contenido de humedad, al sistema rizosférico que mejora la aireación y filtración del agua, haciendo propicio el desarrollo de la simbiosis hongo–raíz, dado por las diversas formas vegetales arbóreas. Además, el poder fotosintético de las especies vegetales en los sistemas agroforestales, permite la disponibilidad del sustrato necesario para la micorriza a nivel del suelo. Los pastizales, estadísticamente presentaron un mismo rango de significación con los cafetales. Seguramente la influencia del sistema radicular influyó significativamente en el establecimiento de las micorrizas, aunque las condiciones ecológicas pudieron haber sido menos favorables que en los cafetales, con una ligera compactación del suelo que mostró una densidad aparente de 1.2 g/cc versus 1.00 g/cc
1. Los arrozales seguramente no mantuvieron la simbiosis microorganismo – raíz, porque durante el muestreo el arroz no se encontraba aún establecido. En la presente investigación se observó una mayor presencia de esporas de los géneros
Glomus sp., Acaulospora sp y
Gigaspora sp., lo cual corrobora con el reporte de Duicela et al. (3), quienes encontraron mayor población del género
Glomus sp., en la misma zona de estudio. Játiva, citado por Duicela et al. (3), explica que el género
Glomus sp., produce mayor esporulación intraradical, requiriendo la presencia de raíces en el suelo para el incremento de la población. Estas condiciones fueron adversas en el muestreo de los arrozales. El número de esporas obtenidas en esta investigación fue comparable a los datos reportados por DNPV-EESC (2003)
2, para las muestras de suelo de cafetales ubicados en la misma zona.
Población de actinomicetes totales:
En el análisis de varianza, Cuadro 2, se observa una población promedio de 7.17x106 UFC/gss, trabajando con un coeficiente de variación de 5.05%. No existe diferencia significativa en los tratamientos. A esto se explica que los actinomicetos presentan características de hongos y de bacterias, desarrollando estructuras de resistencia, esto es observado en los arrozales, donde presentaron termotolerancia, evidenciándose mediante su número poblacional, a lo que Alexander (2), explica que con la ayuda de estructuras, como las conidias, que forman parte de un grupo dominante de actinomicetos, pueden resistir la desecación o diferentes condiciones desfavorables hasta cuando nuevos sustratos orgánicos se hagan aprovechables, asegurando la sobrevivencia de su población. Harris (8), explica también que los actinomicetos son nutricionalmente un grupo muy adaptable, heterotróficos sin excepción, y pueden usar un amplio rango de componentes de carbono y nitrógeno, tales como polisacáridos, lípidos, fenoles, proteína, quitina, entre otros. Esto podría ser causa de los resultados obtenidos en el estudio, presentaron cambios o diferencias significativas en el comportamiento poblacional de los actinomicetos.
Población de organismos fijadores de nitrógeno:
Del análisis de varianza, Cuadro 2, para esta población, se obtuvo un promedio de 4.18x104 UFC/gss; y un coeficiente de variación de 20.07%. Se observa solamente significación estadística para la comparación ortogonal de los usos pastizales-arrozales frente a cafetales, u2u3 vs u1. A pesar de que existe diferencia estadística, al aplicar la prueba DMS al 5%, Cuadro 3, se detecta que tanto los cafetales como la combinación pastizales-arrozales ocupan el rango “a” con una población promedio de 1.18x105 y 2.49x104 UFC/gss, respectivamente. La población de organismos fijadores de nitrógeno en el sistema agroforestal de café, es mayor a la encontrada en los pastizales y arrozales, esto podría deberse a que en este sistema el manejo cultural no involucra la utilización de fertilizantes químicos, como en el cultivo de arroz, que como explica Giller et al. (7), las fuentes nitrogenadas por ejemplo, inhiben la actividad metabólica de fijación, asimbiótica principalmente; causando que la población final de organismos fijadores de nitrógeno disminuya en un 88% a diferencia de los cafetales. La mayor población de microorganismos fijadores de nitrógeno en pasto comparado con arrozales pudo haberse debido a la presencia de leguminosas en los pastizales (Desmodium sp., Macroptilium lathyroides, Rhynchosia minima, entre otras1), y también árboles de guaba (leguminosa), que seguramente afectaron el incremento poblacional de estos microorganismos.
Población de organismos solubilizadores de fósforo:
De acuerdo al análisis estadístico, Cuadro 2, la población promedio de organismos solubilizadores de fósforo fue de 1.08x106 UFC/gss y el coeficiente de variación fue de 6.04%. Los organismos solubilizadores de fósforo no presentaron diferencias significativas entre tratamientos. Los sustratos del suelo, principalmente a partir de exudados radiculares, estimulan con gran intensidad la actividad microbiana. A esto Fernández y Novo (5) mencionan, que los exudados radiculares sirven como fuente de nutrientes y energía, además de inhibir o estimular la actividad bioquímica de los microorganismos, influyendo así indirectamente en las diferentes interrelaciones entre los microorganismos colonizadores a través de la acción selectiva que ejercen sobre especie o grupos particulares de microorganismos, afectando el metabolismo que realizan en el suelo: solubilización de fósforo, degradación de celulosa, etc.
Población de organismos celulolíticos:
En el ADEVA, Cuadro 2, se detecta que la población promedio fue de 3.03x106 UFC/gss y el coeficiente de variación obtenido fue de 6.44%. Se observa también que los organismos celulolíticos no presentaron diferencias significativas entre tratamientos. Al observar las tendencias poblacionales, Cuadro 3, se puede considerar el criterio de Harris (8), que menciona que la celulosa no está fácilmente disponible cuando se encuentra formando parte de la madera y de la hojarasca que cae al suelo, como en el caso de los sistemas agroforestales de café, mientras que en los pastizales, las gramíneas (ricas en celulosa), son una fuente fácilmente disponible por los microorganismos del suelo, mientras que el grado de descomposición de los restos vegetales en arrozales, luego de la quema, fue avanzado lo que podría haber influenciado en el incremento del metabolismo y de la población de los organismos celulolíticos.
CONCLUSIONES
- En suelos tropicales, bajo época seca, los hongos, las micorrizas arbusculares y los organismos fijadores de nitrógeno reaccionaron con cambios significativos en su población, especialmente por el cambio del uso de la tierra.
- Los tipos de suelos vertic y aluvial no tuvieron, en general, una influencia significativa en la población de los diferentes grupos microbianos.
- Las micorrizas reflejaron mayor adaptación a suelos de buenas características nutricionales y ambientales; dando a los sistemas agroforestales un nivel superior desde el punto de vista ecológico, con relación a los pastizales y cultivos de arroz.
RECOMENDACIONES
- Utilizar el sistema agroforestal de café como el sistema de uso más favorable para la diversidad microbiana, debido a sus condiciones ambientales que favorecen el desarrollo de micorrizas arbusculares y organismos fijadores de nitrógeno, sirviendo como un referente de la calidad y salud del suelo.
- Introducir en los pastizales especies forestales de la zona, creando ambiente apropiados para la conservación del suelo y la preservación de todo cuanto habita en el suelo.
- Utilizar en el cultivo de arroz de secano otro sistema de cultivo, como el de callejones, para lograr que las condiciones biológicas del suelo, se desarrollen con mayor intensidad.
- Realizar el mismo estudio en época lluviosa, para identificar el comportamiento microbiano, por factores principalmente de humedad y temperatura.
- Correlacionar los datos de población microbiana con factores físicos y químicos del suelo (contenido de elementos minerales, temperatura, etc.), para establecer criterios en el comportamiento de los microorganismos y estimarlos al momento del muestreo y análisis.
Cuadro 2. Análisis de Varianza para el estudio de diversidad microbiana en sistemas agroforestales de café (Coffea arabiga), y cultivos de pastos y arroz (Oriza sativa) en dos tipos de suelo al Sur de Manabí. 2004
Cuadro 3. Promedios de población en el estudio de la diversidad microbiana en sistemas agroforestales de café (Coffea arabiga), y cultivos de pastos y arroz (Oriza sativa) en dos tipos de suelo al sur de Manabí. 2004






.jpg&w=3840&q=75)