Alimentacion de los pollos
Estrategias de Alimentación para Optimizar Integridad Intestinal
Publicado: 25 de enero de 2011
Por: Pim Langhout (Nutriad International NV, Belgium) y Carlos Martínez Amezcua (Nutriad México)
Resumen: Las aves tienen un alto requerimiento de aminoácidos para alcanzar sus altos índices de productividad. El alto nivel de requerimientos de aminoácidos frecuentemente se satisface con altos niveles de proteína. Con estos altos niveles de proteína, también se presentan altos niveles de proteína no digerida en la dieta. La proteína no digerida da lugar a un mayor flujo de aminoácidos y una fermentación indeseable en la parte baja del tracto intestinal favoreciendo el crecimiento de flora patógena, induciendo un desequilibrio en la relación de flora benéfica: bacterias proteolíticas (Clostridium), lo que conduce a una deficiente integridad intestinal. Estos efectos detrimentales se aumentan por la reducción en el uso de los niveles de antibióticos promotores de crecimiento en la dieta. Optimizando el tamaño de la particular en la dieta se mejora la tasa de paso de la dieta resultando en una mejor digestión de la proteína que reduce la fermentación de la proteína a nivel del íleon y ciegos. Para estimular el desarrollo de la integridad óptima del intestino el uso de una dieta pre-iniciadora es también importante. La composición de dicha dieta es muy importante y el ácido butírico puede jugar un papel esencial en la dieta. El ácido butírico induce péptidos que estimulan el desarrollo del tracto gastrointestinal, de llegar a la parte distal del intestino el ácido butírico estimula el sistema inmune y mejora la motilidad intestinal, así como reduce la colonización de bacterias patógenas. Consecuentemente, el ácido butírico en la dieta suministrado como butirato, ha mostrado mejores resultados si se administra en forma parcialmente recubierto para logar una liberación dirigida en la parte baja del tracto intestinal.
Introducción
El desempeño de los pollos de engorda se ha aumentado enormemente en las últimas décadas. Havenstein y colaboradores (1994ab) demostraron que el mejoramiento genético ha sido responsable en gran medida de este incremento. Desde que la investigación del grupo de Havenstein se publicó, las compañías de genética han logrado un progreso continuo en sus líneas genéticas, resultando en un aumento continuo en la tasa de crecimiento y un mejoramiento en la eficiencia alimenticia (ver los manuales de las reproductoras de las compañías de genética).
En condiciones prácticas el desempeño es con frecuencia significativamente menor que el potencial genético de las aves. Esto con frecuencia se relaciona con las limitantes en el manejo y la nutrición. Los conceptos nutricionales generales no coinciden completamente con los desafíos que vienen con la alta velocidad de crecimiento. Además, las aves con frecuencia crecen bajo condiciones que causan desafíos adicionales inducidos por las regulaciones políticas como la prohibición de los antibióticos promotores de crecimiento en la UE desde el 2006. Esto ha resultado en una situación muy desafiante para balancear la integridad intestinal que es necesaria para el desempeño óptimo del pollo de engorda.
Mucha investigación se ha llevado a cabo en los últimos años para estudiar los factores nutricionales que tienen un efecto positivo en la integridad intestinal. En este artículo algunos de estos factores se describen desde un punto de vista práctico. Para los fines de esta revisión, solamente se discutirán los factores nutricionales que parecen ser los más relevantes para el mercado de Centro América.
Proteína indigestible
Las aves modernas pueden utilizar altos niveles de aminoácidos en la dieta para lograr producciones altas de carne en pechuga (Langhout y Wijtten, 2004). Esta investigación mostró que el aumento en el nivel de proteína en la fase de iniciación del período de crecimiento resulta en un mejor desempeño de las aves al final del período de crecimiento, siempre y cuando se satisfagan los requerimientos de aminoácidos y se presente un equilibrio entre ellos. Esta habilidad para utilizar altos niveles de aminoácidos ha resultado en un aumento gradual en los niveles de proteína en las dietas de los pollos de engorda, particularmente en las primeras semanas de vida. Dependiendo de las fuentes de proteína utilizadas, aproximadamente 15 - 20% de la proteína en la dieta es indigestible en los ingredientes convencionales. Varios estudios han demostrado que un aumento en la proteína indigestible tiene un efecto negativo en el desempeño del pollo de engorda como se puede observar en el Cuadro 1 (De Lange et al., 2003).
Cuadro 1. Efecto de niveles crecientes de proteína cruda indigestible en la dieta sobre el desempeño del crecimiento de los pollos entre 11 y 28 días de edad.
Dieta | I | II | III | IV |
Proteína no digerida (g/kg) | 29.1 | 32.4 | 34.2 | 36.3 |
Ganancia de peso (g/d) | 67.7a | 67.1ab | 65.5bc | 63.7c |
EA | 1.630a | 1.674b | 1.693bc | 1.724c |
abc Las medias en una misma columna que no comparten un superíndice común difieren significativamente (P<0.05).
Fuente; De lange et al. (2003)
El efecto negativo de niveles altos de proteína en la dieta se ha asociado con un mayor flujo de proteína a secciones posteriores del tracto gastrointestinal y un mayor crecimiento de bacterias proteolíticas, como lo demostró Drew y col. (2004), quien observó un incremento significativo en la población de Clostridium perfringens tanto en íleon como en Ciegos de pollos alimentados con niveles altos de proteína, considerando dos fuentes diferentes, comparados con una dieta con un nivel de proteína utilizado en la práctica (Cuadro 2).
Cuadro 2. Efecto del nivel y tipo de proteína en los parámetros productivos y población de Clostridium Perfringens en Ileon y Ciego de pollos a los 28 días de edad. (Drew y col. 2004)
Fuente de Proteína | PC (g/kg) | Peso Corporal (g) | Clostridum Ileon, ufc/g | Clostridium Ciegos, ufc/g |
Harina de Pescado | 230 | 1,064 | 3,93 | 4,57 |
Harina de Pescado | 400 | 1,125 | 6.98 | 7.55 |
Concentrado de Soya | 230 | 794 | 1.69 | 3.25 |
Concentrado de Soya | 400 | 689 | 5.28 | 6.36 |
Efectos Principales | ||||
Fuente de Proteína | <0.01 | <0.01 | <0.01 | |
Nivel de Proteína | <0.37 | <0.01 | <0.01 |
Este efecto negativo de proteína indigestible se redujo cuando un antibiótico promotor de crecimiento se incluyó en la dieta (Smulders et al., 1999). El exceso de proteína indigestible se asocia con un incremento en la fermentación proteolítica que resulta en un aumento en el riesgo de un desbalance en la población microbiana, lo anterior es debido a que una mayor cantidad de proteína puede llegar a secciones posteriores del tracto gastrointestinal, en donde bacterias proteolíticas encuentran condiciones y un mayor aporte de sustrato para incrementar su población (Elwinger, 1994), del mismo modo, Crevieu-Gabriel y Naciri (2001) concluyen que dietas altas en proteína se han asociado con un incremento en la severidad y presentación de coccidia en pollo de engorda. La fermentación proteolítica también resulta en la producción de componentes tóxicos como las aminas biogénicas, amoníaco, fenoles tóxicos que negativamente afectan el desempeño de los animales y su salud (Anderson, 2000).
Para mejorar la integridad intestinal suena obvio disminuir la proteína indigestible. Sin embargo, eso tiene algunas implicaciones económicas. Formular las dietas con los menores niveles de la proteína indigestible implican la utilización de ingredientes de mayor digestibilidad y mejor balance de aminoácidos, en muchas ocasiones estos ingredientes son más costosos y/o poco disponibles, lo que ocasiona un incremento en el costo de la dieta, otra estrategia común ha sido reducir el nivel de proteína, sin tener en cuenta el aporte, relación y digestibilidad de aminoácidos, especialmente de los aminoácidos esenciales, esta estrategia tendrá un impacto negativo significativo en el desempeño del pollo de engorda. Otra posibilidad es seleccionar fuentes de proteína altamente digestible combinadas con el uso de aminoácidos sintéticos (esenciales), disponibles comercialmente, como lo son la DL-Metionina, la L-Lisina HCl y la Treonina, respetando en lo posible un perfil ideal de aminoácidos y permitiendo que la dieta satisfaga cada uno de los aminoácidos tanto esenciales como los no esenciales (Baker y Parsons, 1994). Este método permite el desempeño óptimo, sin embargo, en ocasiones los costos de alimento suben significativamente. Si bien la información con la que contamos actualmente es alentadora también , es necesaria mayor investigación que cuantifique el impacto de manipulaciones en el nivel de proteína indigestible en la fermentación de la proteína y el impacto del balance de esta fermentación con la fermentación de los carbohidratos antes de hacer recomendaciones prácticas. Si bien, podemos esperar que otros aminoácidos esenciales estén disponibles a precios más accesibles; el método más práctico es tratar de balancear la microflora intestinal por la vía de otras medidas nutricionales.
Tamaño de partícula
La mayoría de los pollos de engorda se alimenta con una dieta tipo migaja en el iniciador seguido de pellets en las etapas de crecimiento y finalización. La calidad de los pellets es importante para optimizar el consumo de alimento. Por lo tanto, la mayoría de los productores de alimento ponen mucho esfuerzo en alcanzar la máxima calidad del pellet. Un factor de importancia para lograr la calidad del pellet es la fineza de los ingredientes de la dieta. Al moler finamente los ingredientes (tamaño de criba < 2 mm) se apoyará una buena calidad de pellet y se estimula el máximo consumo de alimento y varios resultados confirman una mejora en la eficiencia alimenticia al permitir al ave consumir su alimento en menos tiempo.
El tamaño de la particular también es importante con respecto a la tasa de paso del alimento a través del tracto intestinal. La molleja juega un papel importante en el control de la tasa de paso. La molleja es el órgano del ave que sirve para moler partículas gruesas hasta que son lo suficientemente finas para pasar al el duodeno. Esto significa que cuando una dieta se compone solamente de partículas finas la dieta permanece relativamente poco en la molleja y se mueve rápidamente al duodeno (Lott, 1989). La consecuencia es que la pre-digestión de los nutrientes, como la proteína, en la molleja es limitada. Más aún, la función de la barrera del pH de la molleja que elimina bacterias dañinas que entran al ave por el pico también es menos efectiva. Además, más alimento entra al duodeno al mismo tiempo, sobrecargando al duodeno lo que impacta negativamente la capacidad buffer (amortiguador) del quimo, que tendrá un pH menos apropiado para maximizar la eficiencia de las enzimas pancreáticas. En conclusión, las dietas finamente molidas afectan la molleja y la función del intestino y consecuentemente aumentan el riesgo de una integridad intestinal reducida en la parte más baja del tracto intestinal.
La investigación ha demostrado que al proveer una dieta con partículas más gruesas aumenta la función de la molleja (Langhout et al., 2002, Svihus et al., 2005).
Cuadro 3. Efecto del tamaño de particular en los pesos y los valores de pH en diferentes partes del tracto gastrointestinal.
Partículas finas1 | Partículas gruesas2 | |
Peso de la molleja, g | 20.4a | 32.8b |
Peso del contenido de la molleja, g | 13.4a | 49.8b |
Peso del duodeno + yeyuno, g | 52.2b | 47.8a |
Peso del ileón, g | 23.7 | 21.2 |
Peso de los ciegos, g | 10.0 | 11.4 |
PH de la molleja | 3.4b | 2.8a |
PH duodeno + yeyuno | 5.8 | 6.2 |
PH ileón | 6.3a | 7.0b |
1 Partículas finas: ingredientes molidos en una criba de 3 mm.
2 Partículas gruesas: ingredientes molidos en una criba de 8 mm.
ab Las medias en la misma columna que no comparten un superíndice difieren significativamente (P<0.05).
Fuente: Langhout et al. (2002)
En el Cuadro 3 se muestran los datos del estudio de Langhout y colaboradores (2002). Esta prueba muestra que las dietas con partículas gruesas resultan en un aumento de peso de la molleja, un pH menor y un vaciamiento más gradual de la molleja hacia el duodeno. El impacto positivo de un tamaño de partícula grueso también se ha observado en la mejor digestión y absorción de otros nutrientes como el fósforo (Charbeneau y Roberson, 2004; Martinez-Amezcua y Parsons, 2007;), muy probablemente debido a un mayor tiempo de retención del alimento, lo que permite una mayor solubilización de los minerales, mayor tiempo de acción de las enzimas (que son sustrato-tiempo dependiente) y un efecto positivo sobre el control de bacterias patógenas como Clostridium y Salmonela, tanto en aves como en cerdos, incluso algunos trabajos han observado efectos positivos sobre Coccidia spp. Los efectos descritos anteriormente probablemente se deban a un mejor control del flujo del alimento, evitando el paso de porciones importantes de alimento sin digerir (principalmente proteína) a secciones posteriores del tracto gastrointestinal y/o promover una mejor digestión y fermentación de carbohidratos, lo que se ha relacionado con un mejor balance en la flora microbiana, promoviendo el crecimiento de bacterias como los lactobacilos y bifidobacterias que promueven la producción de ácido láctico y ácidos grasos volátiles (citado por Guillou y Landeau, 2000; Carré, 2000; Amerah et al, 2007). Estas observaciones coinciden con Langhout et al. (2002) quienes mostraron que un tamaño de partícula grueso en el alimento resultó en un mayor pH en el íleon, indicando una menor fermentación microbiana.
Dieta pre-iniciadora
Durante los primeros días después del nacimiento muchos cambios ocurren en el pollito, como consecuencia son muy sensible a los disturbios del tracto intestinal en este período. Directamente después del nacimiento el pollo está libre de gérmenes (Langhout, 1998). Esto significa que el pollito tendrá que desarrollar su propia microflora y balancearla muy rápidamente después del nacimiento para evitar que unas bacterias individualmente crezcan más que otras. En los pollos de un día de edad, aproximadamente el 20% de su peso es la yema. La yema contiene mucha proteína, misma que será fuente de aminoácidos esenciales y de alta digestibilidad como nutrientes y fuente de anticuerpos, el sistema inmune materno para el pollito joven (Dibner et al., 1998). Después de unos días esos anticuerpos se usan totalmente, lo cual significa que el ave tiene la necesidad de desarrollar su propio sistema inmune en la primera semana. Más aún, durante la primera semana de su vida principalmente los órganos digestivos y el hígado se desarrollan y se observan los cambios significativos en la morfología de la pared intestinal (Jin et al., 1998). Como resultado, el peso relativo de los diferentes órganos y el hígado aumenta en comparación con el crecimiento del esqueleto y los músculos (carne), por ejemplo. Después de la primera semana de vida estos cambios y el crecimiento, sobre todo, del tejido esquelético y muscular aumentan. Del mismo modo, la capacidad digestiva de un ave de primer semana de edad todavía no está plenamente desarrollada, la secreción y actividad enzimática y producción de sales biliares se incrementará gradualmente hasta alcanzar su máximo entre los 7 y 14 días de edad, dependiendo esto de las enzimas, siendo los sistemas de digestión de lípidos y los sistemas de digestión de carbohidratos diferentes al almidón aquellos que toman más tiempo para alcanzar su máximo de eficiencia (Mateos y col. 207). Estos desarrollos mencionados anteriormente en los primeros días de la vida de los pollitos hacen que este período sea muy importante para el posterior desempeño de los animales. Muchos estudios han demostrado que al proveer dietas especiales pre-iniciadoras a las aves en los primeros 5-7 días de edad mejora el estado de salud del ave y su desempeño al final del período de crecimiento (e.g. Leeson, 2008). La efectividad de dichas dietas pre-iniciadoras depende fuertemente de los componentes incluidos en la dieta. La opción de los ingredientes altamente digestible, como el aceite de coco y el hypro soya, apoyan la respuesta de la dieta pre-iniciadora. Un papel muy importante en la efectividad de la dieta pre-iniciadora es la elección de los aditivos del alimento. El ácido butírico aparece en este aspecto como uno de los aditivos en el alimento más prometedores.
Modo de acción del ácido butírico
En los últimos años muchas moléculas diferentes y aditivos han sido probados en su habilidad para mejorar la integridad intestinal. Una molécula interesante en este aspecto es el ácido butírico. El ácido butírico tiene algunas propiedades específicas. Estas propiedades también son muy interesantes para la salud humana; por lo tanto, muchos datos referentes al modo de acción vienen de la investigación en humanos. El ácido butírico en humanos se usa en la nutrición parenteral que se administra con otros nutrientes por vía intravenosa después de una cirugía intestinal para estimular la recuperación del intestino (Tappende et al., 2003). El ácido butírico, cuando está presente en el tracto intestinal induce a la producción de péptidos (Guillodeau et al., 2009). Estos péptidos estimulan el desarrollo y la reparación del tracto intestinal a través de un aumento en la proliferación celular (Bartholome et al., 2004). Recientemente, se ha demostrado que el butirato cuando se presenta en la sangre estimula al péptido que aumenta la absorción de la glucosa del intestino. Fue demostrado por Hu y Gou (2007) que todo indica que también en las aves hay un modo similar de acción. Ellos demostraron un aumento en el desarrollo de las vellosidades cuando el butirato de sodio se agrega en la dieta.
También se ha demostrado que el ácido butírico estimula varias funciones en la parte baja del tracto intestinal. Los estudios han identificado receptores específicos para la proteína-G, específicamente GPR 41 y GPR 43, en los enterocitos en el epitelio de particularmente el ileón, el ciego y el colon (Le Poul et al., 2003). Cuando el butirato se une a estos receptores la producción de varios péptidos diferentes se estimula (Cox et al., 2009, Tazoe et al., 2008). Algunos de estos péptidos tienen un efecto positivo sobre el desarrollo del sistema inmune y mejora la función del sistema inmune en el caso de un desafío de enfermedad (Cox et al., 2009). Se ha demostrado que otros péptidos optimizan la motilidad del intestino, a través de hacer más lento el paso del alimento (Tazoe et al., 2009). El vaciamiento del alimento de la molleja hacia el intestino delgado se hace más lento. Por ende, parece que el butirato está induciendo un efecto similar en la tasa de paso como partículas gruesas. Leeson, et.al. (2005) obtuvieron indicaciones de que el ácido butírico también estimula el sistema inmune en las aves, así como Antongiovanni et al. (2005), que mostró que las aves alimentadas con dietas que contenían butirato tienen una mejor habilidad para soportar el desafío coccidiano a los 21 días de edad.
Recientemente, una nueva actividad del ácido butírico fue reportada por Van Immerseel et al.(2003) y del mismo grupo, por Gantois et al. (2006). En los estudios de Van Immerseel y colaboradores se demostró que el ácido butírico cuando se presenta en el tracto intestinal fue capaz de disminuir la colonización de la Salmonella en pollo de engorda. El modo de acción de esta actividad del ácido butírico es a través de la expresión de genes. El butirato conecta con la Salmonella. Esto subregula la expresión del gen HilA resultando en un bloqueo de la liberación de la enzima SPI-1 y es responsable para la toma de la Salmonella por el ave (Gantois et al., 2006). Una demostración de este efecto del ácido butírico se muestra en la Figura 1, tomada de una prueba llevada a cabo por Van Immerseel et al. (2005). En esta prueba las aves se desafiaron con varias Salmonella spp. Cuando las aves se alimentaron con dietas que contenían ya sea ácido propiónico o butírico producidos para liberación dirigida protegida, una reducción significativa en el nivel de Salmonella se observó en los pollos. El efecto del ácido butírico tendió a ser más pronunciado que el del ácido propiónico. La adición de ácido acético en la dieta resulta en un nivel significativamente mayor de Salmonella en los pollos de engorda en comparación con las aves control.
Los efectos sobre el desarrollo inmune, la motilidad del intestino, así como el efecto de la Salmonella por la vía de la expresión del gen son solamente posibles cuando el butirato llega a las partes más bajas del tracto intestinal. Generalmente, se acepta que el ácido butírico libre desaparece rápidamente ya en la parte proximal del tracto intestinal. Por lo tanto, para obtener butirato en los niveles significativos disponibles en la parte baja del intestino el butirato necesita estar protegido para lograr una liberación dirigida.
Figura 1. Efecto de varios ácidos grasos de cadena corta en la colonización de las aves infectadas con Salmonella.
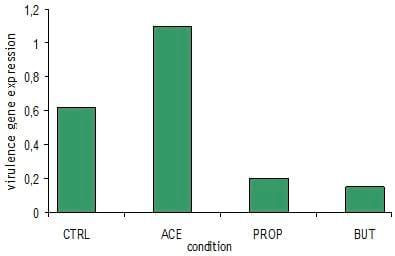
Fuente: Van Immerseel et al. (2004b)
El ácido butírico en el desempeño del pollo de engorda
La investigación reciente ha indicado respuestas benéficas de ácido butírico, suministrado en forma de butirato, sobre el desempeño del pollo de engorda (Panda et al., 2009). En otra prueba reciente, llevada a cabo en el 2009 en Canadá, el efecto del ácido butírico sobre el desempeño del pollo de engorda se probó en aves desafiadas con clostridios. El ácido butírico (Adimix 30 Protegido) era un Na-butirato y estaba protegido para que el butirato se liberara en la parte más baja del tracto intestinal. Las aves se desafiaron al proporcionarles cama infectada con clostridios antes de su llegada. Adimix (niveles de dosis; 1.0, 0.75 y 0.5 kg/ton en el iniciador, crecimiento y finalización respectivamente) se probó contra un control negativo y un control positivo (BMD; 55 ppm). La prueba duró hasta los 42 días de edad. Los datos de la prueba se presentan en el Cuadro 4. La adición de Adimix a la dieta redujo significativamente la mortalidad y aumentó los pesos corporales en comparación con el control. El efecto positivo de Adimix sobre el desempeño del pollo de engorda fue similar al de aquellas aves que en su dieta tenían el antibiótico BMD.
Cuadro 4. Efecto del Na-butirato con liberación dirigida (Adimix 30 Protegido) en el desempeño del pollo de engorda en aves desafiadas con clostridios.
Control negativo | Dieta con BMB | Dieta con Adimix | |
Mortalidad (%) | 6b | 4a | 3a |
Pesos corporales (g) | 2788a | 2863b | 2899b |
CA | 1.97 | 1.91 | 1.95 |
ab Medias en la misma columna sin compartir un superíndice común difieren significativamente (P<0.05).
Conclusión
Los altos requerimientos nutricionales de las aves modernas aumentan el riesgo de afectar la integridad intestinal. Varias medidas nutricionales como la optimización del tamaño de la partícula y el uso de una dieta especial pre-iniciadora puede reducir el riesgo de los problemas de salud intestinal. El ácido butírico, suministrado como butirato con liberación dirigida, ha demostrado que mejora la integridad intestinal y puede jugar un papel importante en la nutrición del pollo de engorda moderno para obtener la salud y el desempeño óptimo del pollo de engorda.
Referencias
- Amerah, A.M., V. Ravindran, R.G. Lentle and D.G. Thomas. (2007). Feed particle size: Implications on the digestion and performance of poultry. World's Poultry Science Journal. 63: 439-455
- Antongiovanni, M., A. Buccioni, F. Petacchi, A. Martini and S. Minieri (2005) Effect of glycerides and free short chain fatty acids replacing avilamycin in the diet of broiler chickens. Proc. 15th Eur. Symp. Poultry Nutrition, Hungary
- Anderson, D.B., V.J. McCracken, R.I. Aminov, J.M. Simpson, R.I. Mackie, M.W.A. Verstegen and H.R. Gaskins (2000) Gut microbiology and growth-promoting antibiotics in swine. Nutrition Abstracts and Reviews 70: 101-108.
- Bartholome, A.L., Albin, D.M., Baker, D.H., Holst, J.J., and K.A. Tappenden (2004) Supplementation of total parental nutrition with butyrate increases structural aspects of intestinal adaptation after an 80% jejunoileal resection in neonatal piglets. Journal of Parental and Enteral Nutrition 28(4), 210-222.
- Carré B. 2000. Effets de la taille des particules alimentaires sur le processus digestifs chez les oiseaux d'elevage. INRA. Prod. Anim. 13 (2), 131-136
- Cox, M.A., Jackson, J., Stanton, M., Rojas-Triana, A., Bober, L., Laverty, M., Yang, X., Zhu, F., Liu, J., Wang, S., Monsma, F., Vassileva, G., Maguire, M., Gustafson, E., Bayne, M., Chou, C., Lundell, D., and C. Jenh (2009) Short-chain fatty acids act as antiinflammatory mediators by regulating prostaglandin E2 and cytokines. World J Gastroenterol 15(44): 5549-5557.
- Crevieu-Gabriel. I; M. Naciri. (2001). Effet de l'alimentation sur les coccidioses chez le poulet. INRA Prod. Anim. 14(4): 231-246.
- Charbeneau, R.A., and K.D. Roberson. 2004. Effects of corn and soybean meal particle size on phosphorus use in turkey poults. J. Appl. Poult. Res. 13:302-310
- Drew M.D., N.A. Syed, B.G. Goldade, B. Laarveld, and A.G. Van Kessel. (2004). Effects of dietary protein source and level on intestinal populations of Clostridium perfringens in broiler chickens. Poultry Science, 83: 414-420
- Elwinger, K., B. Engstrom, E. Berndston, O. Fossum and B. Teglof (1994) Effect of protein level and feed enzyme addition on the caecal growth of C. perfringens in broiler chickens. Proceedings WP 9th European Poultry Conference, Glascow: 423-424.
- De Lange, L., C. Rombouts and G. Oude Elferink (2003) Practical application and advantages of using total digestible amino acids and undigestible crude protein to formulate broiler diets. Worlds Poultry Science Journal 59: 447-454.
- Dibner, J.J., C.D. Knight, M.L. Kitchell, C.A. Atwell, A.C. Downs and F.J. Ivey (1998) Early feeding and development of the immune system in neonatal poultry. Journal of Applied Poultry Research 7:425-436.
- Gantois, I., R. Ducatelle, F. Pasmonas, F. Haesebrouck, I. Hautefort, A. Thompson, J.C. Hinton and F. van Immerseel (2006) Butyrate specifically down-regulates Salmonella Pathogenicity island 1 gene expression. Applied and Environmental Microbiology 72:946-949.
- Guillou D., y E. Landeau. (2000). Granulométrie et nutrition porcine. INRA. Prod. Anim. 13 (2), 137-145
- Guilloteau, P., Zabielski, R., David, J.C., Blum, J.W. Morisset, J.A., Biernat, M., Wolinski, J., Laubitz, D., and Y. Hamon (2009) Sodium-butyrate as a growth promoter in milk replacer formula for young calves. J. Dairy Science 92: 1038-1049.
- Havenstein, G.B., P.R. Ferkel, S.E. Scheideler and B.T. Larson (1994a) Growth, livability, and feed conversion of 1957 vs 1991 broilers when fed "typical" 1957 and 1991 broiler diets. Poultry Science 73: 1785-1794.
- Havenstein, G.B., P.R. Ferkel, S.E. Scheideler and D.V. Rives (1994b) Carcass composition, and yield of 1991 vs 1957 broilers when fed "typical" 1957 and 1991 broiler diets. Poultry Science 73:1795-1804.
- Hu, Z. and Y. Guo (2007) Effects of dietary sodium butyrate supplementation on the intestinal morphological structure, absorptive function and gut flora in chickens Animal FeedScience and Technology, Volume 132, Issue 3, Pages 240-249
- Jin, S.H., A. Corless and J.L. Sell (1998) Digestive system development in post hatch poultry. World Poultry Science Journal 54:335-345.
- Langhout, D.J. (1998) The role of the intestinal flora as affected by non-starch polysaccharides in broiler chicks. Ph.D. thesis, Agricultural University Wageningen, the Netherlands.
- Langhout D.J. and P.J.A. Wijtten (2004) Increasing dietary amino acid improve performance, what is the best practical and economical approach. XVIII Latin American Poultry Congress
- Langhout, D.J., P.J.A. Wijtten and H.B. Perdok (2002). Optimising the physical form of broiler diets in different stages of the fattening period to maximise performance and health status of the bird. XVII Latin American Poultry Congress
- Le Poul, E., Loison, C., Struyf, S., Springael, J.Y., Lannoy, V., Decobecq, M., Brezillon, S., Dupriez, V., Vassart, G., Van Damme, J., Parmentier, M, and M. Detheux (2003) Functional characterization of human receptors for short chain fatty acids and their role in polymorphonuclear cell activation. The Journal of Biological Chemistry 278(28), 25481-25489.
- Leeson, S. (2008) Predictions for commercial poultry nutrition. Journal of Applied Poultry Research 17:315-322.
- Leeson, S., H. Namkung, M.Antongiovanni and E.H. Lee (2005) Effect of butyric acid on the performance and carcass yield of broiler chickens. Poultry Science 84: 1418-1422.
- Lott, B.D. (1989) The effect of corn particle size on water consumption and broiler performance. Ph.D. dissertation, Mississippi State University, Mississippi State, MS.
- Mateos G.G., Jiménez-Moreno E., J.M. González Alvarado, D.G. Valencia. 2007. Estrategias de alimentación en la primer semana de vida del pollito.XIII Curso de Especialización FEDNA. Madrid 25 y 26 de Octubre: p: 65-92
- Panda A. K., Rama Rao S.V.,Raju M.V.L. and G. Shyam Sunder G. (2009) Effect of Butyric Acid on Performance, Gastrointestinal Tract Health and Carcass Characteristics in Broiler Chickens. Asian-australasian journal of animal sciences , 22 (7) 1026-1031
- Smulders, A.C.J.M., A. Veldman and H. Enting (1999) Effect of anti-microbial growth promoter in feeds with different levels of undigestible protein on broiler performance. Proceedings 12th European Symposium on Poultry Nutrition: 177-182.
- Svihus, B., O. Zimonja and K.H. Klovstad (2005) Grinding size and grinding method and interaction with pelleting for wheat-based broiler chicken diets. Proceedings WP 15th European Poultry Conference, Hungary:565-567.
- Tappenden, K.A., Albin, D.M., Bartholome, A.L., and H.F. Mangian (2003) Glucagon-like peptide-2 and short-chain-fatty acids: An new twist to an old story. Journal of nutrition 133: 3717-3720.
- Tazoe, H., Otomo Y., Kaji I., Tanaka R., Karaki S.I. and A. Kuwahara (2008) Roles of short-chain fatty acids receptors, GPR41 and GPR43 on colonic functions. J. Physiol Pharmacol. 59, 251-262.
- Van Immerseel, F. J. de Buck, F. Boyen, L. Bohez, F. Pasmans, J. Volf, M. Sevcik, I. Rychlik, F. Haesebrouck and R. Ducatelle (2004a) Madium chain fatty acids decrease colonization and invasion through hilA suppression shortly after infection of chickens with Salmonella enterica serovar Enteritidis. Applied and Environmental Microbiology 70:3582-3587.
- Van Immerseel, F.,V. Fievez, J. de Buck, F. Pasmans, A. Martel, F. Haesebrouck and R. Ducatelle (2004b) Microencapsulated short-chain fatty acids in feed modify colonization and invasion early after infection with Salmonella Enteritidis in Young chickens. Poultry Science 83:69-74.
- Van Immerseel, F. F. Boyen, I. Gantois, L. Timbermont, L. Bohez, F. Pasmans, F. Haesebrouck and R. Ducatelle (2005) Supplementation of coated butyric acid in the feed reduces colonization and shedding of Salmonella in poultry. Poultry Science 84:1851-1856.
- Wijtten, P.J.A., R. Prak, A. Lemme and D.J. Langhout (2003) Effect of different dietary ideal protein levels on broiler performance. British Poultry Science
- Wijtten, P.J.A., A. Lemme and D.J. Langhout (2004) Effects of Different Dietary Ideal Protein Levels on Male and Female Broiler Performance During Different Phases of Life: Single Phase Effects, Carry-Over-Effects, and Interactions Between Phases. Poultry Science
Temas relacionados:
Recomendar
Comentar
Compartir

¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.




.jpg&w=3840&q=75)